鲁教版五四制九年级化学3.3海水制碱习题(含解析)
文档属性
| 名称 | 鲁教版五四制九年级化学3.3海水制碱习题(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 80.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-14 14:38:17 | ||
图片预览



文档简介
海水制碱
一、单选题
对某的溶液成分进行分析、检测,下列结果合理的是
A.
B. KC1 NaCl
C. NaCl KOH
D. HCl
下列物质不能用复分解反应制取的是
A. Fe B. C. D.
有溶液、溶液、溶液、溶液四种物质,两物质间能发生的化学反应共有
A. 3个 B. 4个 C. 5个 D. 6个
下列说法正确的是
A. 盐溶液一定显中性
B. 含同种元素的物质一定是纯净物
C. 酸、碱的组成中一定含有氢元素
D. 有盐和水生成的反应一定是复分解反应
“84消毒液”是宾馆、医院、学校等一些公共场所常备的消毒剂,适用于环境和物体表面消毒,其有效成分主要是次氯酸钠化学式为。次氯酸钠属于
A. 酸 B. 碱 C. 盐 D. 氧化物
下列物质间不能发生复分解反应的是
A. 碳酸钠溶液和氯化钙溶液 B. 氢氧化钠溶液和氯化钾溶液
C. 碳酸钾溶液和盐酸 D. 硫酸铜溶液和氯化钡溶液
下列各组离子在的溶液中能大量共存的是
A. 、、、 B. 、、、
C. 、、、 D. 、、、
在的无色溶液中,下列离子可以大量共存的是
A. 、、、 B. 、、、
C. 、、、 D. 、、、
下列物质能在的无色溶液中大量共存的是
A. 、NaCl、、
B. KOH、、KCl、
C. KCl、、、
D. 、 、、Na
我国制碱工业的先驱---侯德榜发明的联合制碱法中的“碱”是指
A. NaCl B. NaOH C. D.
如图是和溶液恰好完全反应的微观示意图,由此得出结论错误的是
A. 该反应属于复分解反应
B. 反应后溶液中存在的粒子只有和
C. 该反应的实质是和结合生成
D. 和反应的实质与该反应相同
推理是化学学习的重要方法,下列推理正确的是
A. 单质是由同种元素组成,所以同种元素组成的纯净物都是单质
B. 某物质在氧气中燃烧生成二氧化碳和水,所以该物质中一定含有氧元素
C. 将某无色溶液滴在pH试纸上,测得,所以该溶液是碱溶液
D. 复分解反应有沉淀、气体或水生成,所以有沉淀、气体或水生成的反应都是复分解反应
以下是四位同学对生活中的现象进行探究后的结果的表述,其中不正确的是
A. 纯碱其实不是碱,属盐类
B. 可用纯碱替代洗洁精洗涤餐具表面的油污
C. 用纯碱可除去面团发酵产生的酸
D. 用加水溶解的方法检验纯碱中是否混入了食盐
二、流程题
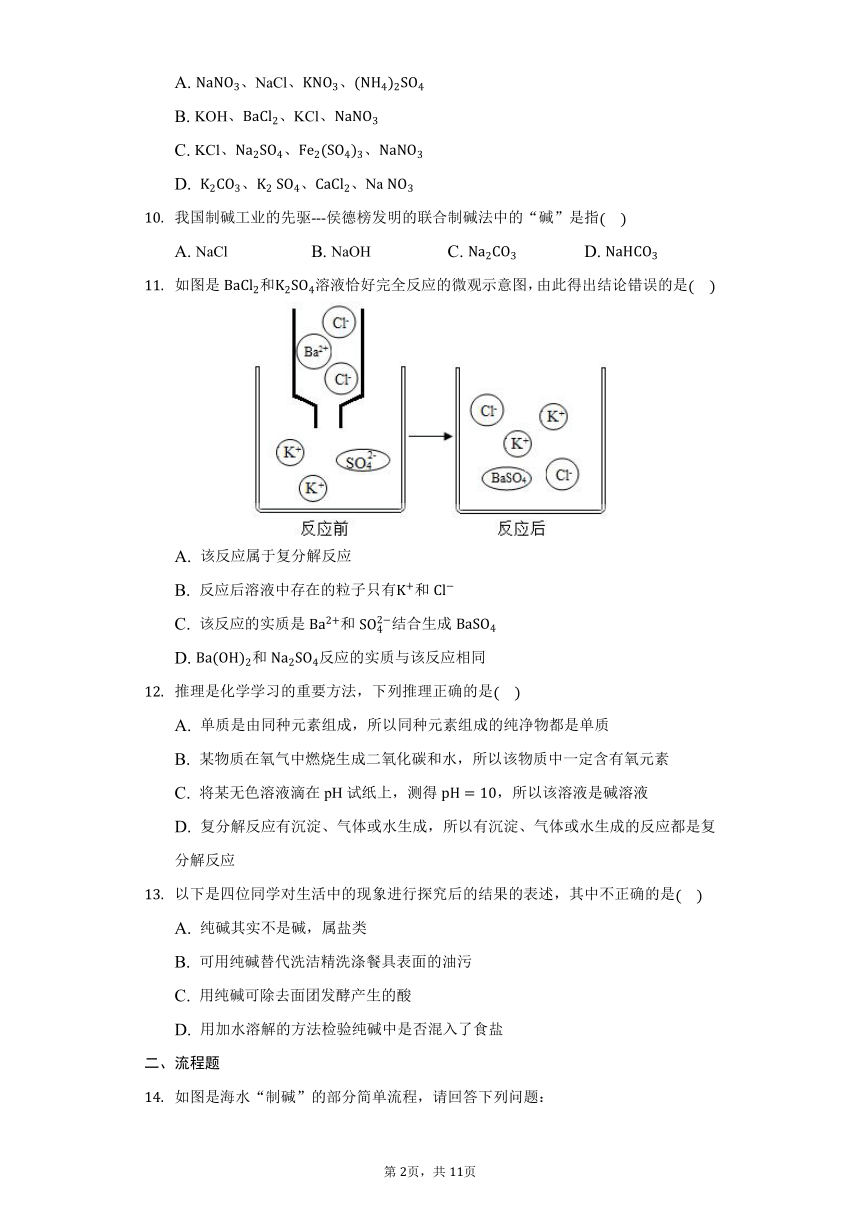
如图是海水“制碱”的部分简单流程,请回答下列问题:
步骤Ⅳ反应的化学方程式为________________________________。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低,这是因为_______________。
氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,首先析出的物质是_________,原因是______________________________。
三、实验题
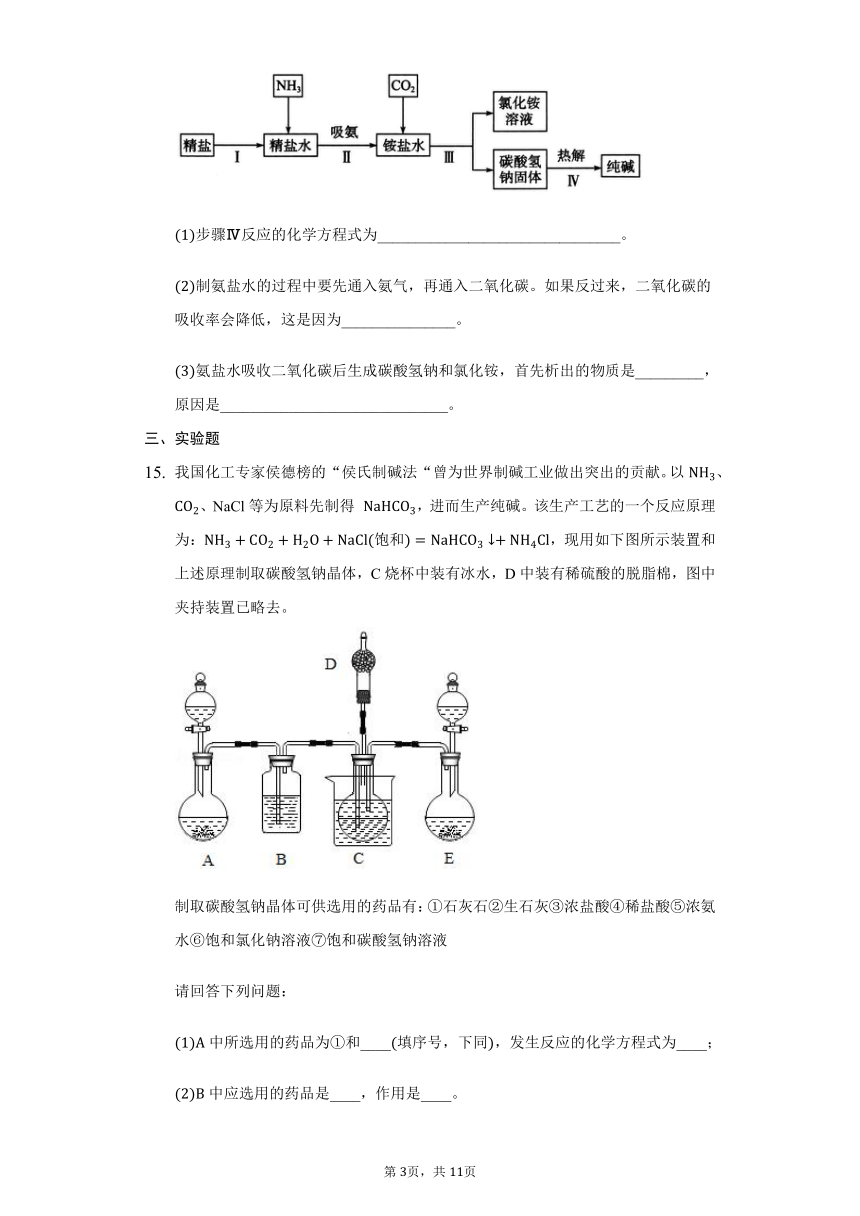
我国化工专家侯德榜的“侯氏制碱法“曾为世界制碱工业做出突出的贡献。以、、NaCl等为原料先制得 ,进而生产纯碱。该生产工艺的一个反应原理为:饱和,现用如下图所示装置和上述原理制取碳酸氢钠晶体,C烧杯中装有冰水,D中装有稀硫酸的脱脂棉,图中夹持装置已略去。
制取碳酸氢钠晶体可供选用的药品有:石灰石生石灰浓盐酸稀盐酸浓氨水饱和氯化钠溶液饱和碳酸氢钠溶液
请回答下列问题:
中所选用的药品为和____填序号,下同,发生反应的化学方程式为____;
中应选用的药品是____,作用是____。
中产生气体,所选用的药品为____,产生氨气的原因是____。
在实验过程中,应先向C中通入的气体的化学式是____,其原因是____。
由E向C装置通气的导管不能插入液面以下的原因是____。
“侯氏制碱法”最后一步用制备纯碱的化学方程式为____。
答案和解析
1.【答案】D
【解析】解:pH为2的水溶液显酸性,水溶液中含有大量的;
A、与中的碳酸根离子能结合成水和二氧化碳气体,不能大量共存,故选项错误。
B、与中的碳酸氢根离子能结合成水和二氧化碳气体,不能大量共存,故选项错误。
C、与KOH中的氢氧根离子能结合成水,不能大量共存,故选项错误。
D、四种离子间不能结合成沉淀、气体或水,且能在酸性溶液大量共存,故选项正确。
故选:D。
pH为2的水溶液显酸性,水溶液中含有大量的;根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存。
本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;解题时要注意酸性溶液中中含有大量的。
2.【答案】A
【解析】解:A中铁为单质,而复分解反应是化合物与化合物反应生成化合物与化合物,则不可能用复分解反应制取,故A正确。
B中可用硫酸与氢氧化钙反应,酸碱中和反应属于复分解反应,故B错误。
C中可用硝酸银与盐酸反应生成,属于复分解反应,故C错误。
D中可用硫酸钙和氢氧化钡反应得到,属于复分解反应,故D错误。
故选:A。
本题考查对复分解反应的理解及利用复分解反应来制取物质,若有气体或水或沉淀生成时才发生复分解反应.
正确把握复分解反应在溶液中相互交换成分,离子之间重新结合的实质.学会利用反应来制初中化学中常见的物质.
3.【答案】C
【解析】
【分析】
本题难度不大,掌握复分解反应发生的条件有沉淀、气体或水生成并能灵活运用是正确解答本题的关键。
【解答】
溶液能与溶液、溶液发生复分解反应,分别生成碳酸钡沉淀和氢氧化钠、硫酸钡沉淀和水。
溶液能与溶液、溶液发生复分解反应,分别生成碳酸钡沉淀和氯化钠、硫酸钡沉淀和盐酸。
溶液、溶液反应生成硫酸钠、水和二氧化碳。
两物质间能发生的化学反应共有5个。
故选:C。
4.【答案】C
【解析】解:A、盐溶液不一定显中性,也可能是酸性或碱性,如碳酸钠溶液显碱性,故A错误;
B、纯净物是指由一种物质组成,含同种元素的物质不一定是纯净物,例如氧气和臭氧属于混合物,故B错误;
C、酸是指在电离时产生的阳离子全部是氢离子的化合物;碱是指在电离时产生的阴离子全部是氢氧根离子的化合物,酸、碱的组成中一定含有氢元素,故C正确;
D、有盐和水生成的反应不一定是复分解反应,如:,故D错误。
故选:C。
A、根据盐的化学性质进行分析;
B、根据纯净物的定义进行分析;
C、根据酸和碱的特征进行分析;
D、根据复分解反应是两种化合物相互交换成分生成两种新的化合物的反应进行分析。
本题难度不大,掌握盐的化学性质、复分解反应的特征、酸和碱的特征、燃烧的条件等是正确解答本题的关键。
5.【答案】C
【解析】解:次氯酸钠是由金属元素和酸根组成的,属于盐,
故选:C。
根据的物质的成分和类别进行分析解答即可。
本题难度不大,考查物质类别的判别,抓住酸、碱、盐的特征、熟悉常见的物质的组成是正确解答本题的关键。
6.【答案】B
【解析】解:A、碳酸钠溶液和氯化钙溶液相互交换成分生成碳酸钙沉淀和氯化钠,能发生复分解反应,故选项错误。
B、氢氧化钠溶液和氯化钾溶液相互交换成分没有沉淀、气体或水生成,不能发生复分解反应,故选项正确。
C、碳酸钾溶液和盐酸相互交换成分生成氯化钾、水和二氧化碳,能发生复分解反应,故选项错误。
D、硫酸铜溶液和氯化钡溶液相互交换成分生成硫酸钡淀和氯化铜,能发生复分解反应,故选项错误。
故选:B。
根据复分解反应发生的条件,若两种物质相互交换成分有沉淀、气体或水生成,则能发生化学反应,据此进行分析判断.
本题难度不大,掌握复分解反应发生的条件有沉淀、气体或水生成并能灵活运用是正确解答本题的关键.
7.【答案】B
【解析】
【分析】
本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意是在酸性溶液中共存。
【解答】
pH为2的水溶液显酸性,水溶液中含有大量的;则
A.、、、中的与结合可以生成水,故本组离子在的溶液中不能大量共存,故A不符合题意;
B.、、、中各离子和之间相互结合不能生成沉淀、气体或水,则本组离子在的溶液中能大量共存,故B符合题意;
C.、、、中的和结合生成既不溶于水也不溶于酸的白色沉淀,则本组离子在的溶液中不能大量共存,故C不符合题意;
D.、、、中的和结合可以生成水和二氧化碳,故本组离子在的溶液中不能大量共存,故D不符合题意。
故选B。
8.【答案】D
【解析】解:A、、两种离子能结合成氨气和水,的水溶液呈紫红色,故选项错误。
B、、两种离子能结合成硫酸钡沉淀,不能大量共存,故选项错误。
C、、能结合成水和二氧化碳,不能大量共存,故选项错误。
D、四种离子间不能结合成沉淀、气体或水,能大量共存,且不存在有色离子,故选项正确。
故选:D。
的溶液显中性;根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能大量共存,据此进行分析判断即可。本题还要注意溶液呈无色,不能含有明显有颜色的铜离子、铁离子和亚铁离子等。
本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意特定离子的颜色。
9.【答案】A
【解析】解:pH为1的水溶液显酸性,水溶液中含有大量的.
A、四者之间不反应,能在酸性溶液中共存,且不存在有色离子,故选项正确.
B、KOH中的氢氧根离子和在溶液中能结合生成水,不能大量共存,故选项错误.
C、四者之间不反应,且能在酸性溶液中共存,但溶于水呈黄色,故选项错误.
D、中的碳酸根离子和在溶液中能结合生成水和二氧化碳,不能大量共存,故选项错误.
故选:A.
pH为1的水溶液显酸性,水溶液中含有大量的根据复分解反应发生的条件可知,若物质之间相互交换成分不能生成水、气体、沉淀,则能够在溶液中大量共存.本题还要注意能得到无色溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.
本题考查物质的共存问题,判断离子在溶液中能否共存,主要看溶液中溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意在酸性溶液中共存及特定离子的颜色.
10.【答案】C
【解析】解:A、侯德榜发明的联合制碱法中的“碱”指的是纯碱,其化学式为,而不是NaCl,故选项错误。
B、侯德榜发明的联合制碱法中的“碱”指的是纯碱,其化学式为,而不是NaOH,故选项错误。
C、侯德榜发明的联合制碱法中的“碱”指的是纯碱,其化学式为,故选项正确。
D、侯德榜发明的联合制碱法中的“碱”指的是纯碱,其化学式为,而不是,故选项错误。
故选:C。
根据侯德榜发明的联合制碱法中的“碱”指的是纯碱,进行分析判断。
本题难度不大,掌握侯德榜发明的联合制碱法中的“碱”指的是纯碱是正确解答本题的关键。
11.【答案】B
【解析】解:A、和溶液恰好完全反应生成硫酸钡沉淀和氯化钾,该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应,故选项说法正确。
B、反应后溶液中存在的粒子除了和,还有水分子,故选项说法错误。
C、该反应的实质是和结合生成,故选项说法正确。
D、和反应生成硫酸钡沉淀和氢氧化钠,该反应的实质是和结合生成,反应的实质与该反应相同,故选项说法正确。
故选:B。
根据和溶液恰好完全反应的微观示意图可知,反应的实质是钡离子和硫酸根离子结合生成硫酸钡沉淀,进行分析判断。
本题难度不大,掌握复分解反应的实质离子之间结合生成沉淀或水或气体是正确吴俊达本题的关键。
12.【答案】A
【解析】解:A、单质是由同种元素组成,所以同种元素组成的纯净物都是单质,故A正确;
B、某物质在氧气中燃烧后生成二氧化碳和水,根据质量守恒定律可知,该物质一定含有碳、氢元素,可能含有氧元素,故B错误;
C、将某无色溶液滴在pH试纸上,测得,该溶液显碱性,但不一定是碱溶液,如碳酸钠是一种盐,其水溶液显碱性,故C错误;
D、复分解反应有沉淀、气体或水生成,但有沉淀、气体或水生成的反应不一定都是复分解反应,如水的通电分解产生气体,但不属于复分解反应,故D正确。
故选:A。
A、根据单质的概念来分析;
B、根据质量守恒定律来分析;
C、根据溶液的酸碱性来分析;
D、根据复分解反应的判断方法来分析。
本题难度不大,解答此类题时要根据不同知识的特点类推,不能盲目类推,并要注意知识点与方法的有机结合,做到具体问题能具体分析。
13.【答案】D
【解析】略
14.【答案】
氨气在水中的溶解度比大,氨盐水显碱性,更易吸收二氧化碳
碳酸氢钠;相同条件下,碳酸氢钠的溶解度较小
【解析】略
15.【答案】;
;除去二氧化碳中混有的氯化氢气体
;氧化钙与水反应放出大量热,而氨水受热会挥发出大量的氨气
;氨气极易溶于水,溶液显碱性,能吸收更多的二氧化碳气体
防止发生倒吸
【解析】
【分析】
本题考查纯碱的制备原理,掌握实验室中制取二氧化碳的原理、气体除杂的方法、制取氨气的原理、装置的特点以及气体的溶解性是解答本题的关键,注意基础知识的积累与应用。
【解答】
装置用于制取二氧化碳气体,所以试剂是石灰石与稀盐酸;石灰石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为。
制取的二氧化碳中混有少量的氯化氢气体,所以装置B中的试剂是碳酸氢钠溶液,碳酸氢钠与氯化氢反应生成氯化钠、水和二氧化碳。
氧化钙与水反应生成氢氧化钙,并放出热量;而氨水受热会挥发出大量的氨气。
氨气极易溶于水,所以在实验过程中,应先向C中通入氨气,此溶液显碱性,能吸收更多的二氧化碳气体。
氨气极易溶于水,为了防止发生倒吸,所以由E向C装置通气的导管不能插入液面以下。
碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为。
第2页,共2页
第1页,共1页
一、单选题
对某的溶液成分进行分析、检测,下列结果合理的是
A.
B. KC1 NaCl
C. NaCl KOH
D. HCl
下列物质不能用复分解反应制取的是
A. Fe B. C. D.
有溶液、溶液、溶液、溶液四种物质,两物质间能发生的化学反应共有
A. 3个 B. 4个 C. 5个 D. 6个
下列说法正确的是
A. 盐溶液一定显中性
B. 含同种元素的物质一定是纯净物
C. 酸、碱的组成中一定含有氢元素
D. 有盐和水生成的反应一定是复分解反应
“84消毒液”是宾馆、医院、学校等一些公共场所常备的消毒剂,适用于环境和物体表面消毒,其有效成分主要是次氯酸钠化学式为。次氯酸钠属于
A. 酸 B. 碱 C. 盐 D. 氧化物
下列物质间不能发生复分解反应的是
A. 碳酸钠溶液和氯化钙溶液 B. 氢氧化钠溶液和氯化钾溶液
C. 碳酸钾溶液和盐酸 D. 硫酸铜溶液和氯化钡溶液
下列各组离子在的溶液中能大量共存的是
A. 、、、 B. 、、、
C. 、、、 D. 、、、
在的无色溶液中,下列离子可以大量共存的是
A. 、、、 B. 、、、
C. 、、、 D. 、、、
下列物质能在的无色溶液中大量共存的是
A. 、NaCl、、
B. KOH、、KCl、
C. KCl、、、
D. 、 、、Na
我国制碱工业的先驱---侯德榜发明的联合制碱法中的“碱”是指
A. NaCl B. NaOH C. D.
如图是和溶液恰好完全反应的微观示意图,由此得出结论错误的是
A. 该反应属于复分解反应
B. 反应后溶液中存在的粒子只有和
C. 该反应的实质是和结合生成
D. 和反应的实质与该反应相同
推理是化学学习的重要方法,下列推理正确的是
A. 单质是由同种元素组成,所以同种元素组成的纯净物都是单质
B. 某物质在氧气中燃烧生成二氧化碳和水,所以该物质中一定含有氧元素
C. 将某无色溶液滴在pH试纸上,测得,所以该溶液是碱溶液
D. 复分解反应有沉淀、气体或水生成,所以有沉淀、气体或水生成的反应都是复分解反应
以下是四位同学对生活中的现象进行探究后的结果的表述,其中不正确的是
A. 纯碱其实不是碱,属盐类
B. 可用纯碱替代洗洁精洗涤餐具表面的油污
C. 用纯碱可除去面团发酵产生的酸
D. 用加水溶解的方法检验纯碱中是否混入了食盐
二、流程题
如图是海水“制碱”的部分简单流程,请回答下列问题:
步骤Ⅳ反应的化学方程式为________________________________。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低,这是因为_______________。
氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,首先析出的物质是_________,原因是______________________________。
三、实验题
我国化工专家侯德榜的“侯氏制碱法“曾为世界制碱工业做出突出的贡献。以、、NaCl等为原料先制得 ,进而生产纯碱。该生产工艺的一个反应原理为:饱和,现用如下图所示装置和上述原理制取碳酸氢钠晶体,C烧杯中装有冰水,D中装有稀硫酸的脱脂棉,图中夹持装置已略去。
制取碳酸氢钠晶体可供选用的药品有:石灰石生石灰浓盐酸稀盐酸浓氨水饱和氯化钠溶液饱和碳酸氢钠溶液
请回答下列问题:
中所选用的药品为和____填序号,下同,发生反应的化学方程式为____;
中应选用的药品是____,作用是____。
中产生气体,所选用的药品为____,产生氨气的原因是____。
在实验过程中,应先向C中通入的气体的化学式是____,其原因是____。
由E向C装置通气的导管不能插入液面以下的原因是____。
“侯氏制碱法”最后一步用制备纯碱的化学方程式为____。
答案和解析
1.【答案】D
【解析】解:pH为2的水溶液显酸性,水溶液中含有大量的;
A、与中的碳酸根离子能结合成水和二氧化碳气体,不能大量共存,故选项错误。
B、与中的碳酸氢根离子能结合成水和二氧化碳气体,不能大量共存,故选项错误。
C、与KOH中的氢氧根离子能结合成水,不能大量共存,故选项错误。
D、四种离子间不能结合成沉淀、气体或水,且能在酸性溶液大量共存,故选项正确。
故选:D。
pH为2的水溶液显酸性,水溶液中含有大量的;根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存。
本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;解题时要注意酸性溶液中中含有大量的。
2.【答案】A
【解析】解:A中铁为单质,而复分解反应是化合物与化合物反应生成化合物与化合物,则不可能用复分解反应制取,故A正确。
B中可用硫酸与氢氧化钙反应,酸碱中和反应属于复分解反应,故B错误。
C中可用硝酸银与盐酸反应生成,属于复分解反应,故C错误。
D中可用硫酸钙和氢氧化钡反应得到,属于复分解反应,故D错误。
故选:A。
本题考查对复分解反应的理解及利用复分解反应来制取物质,若有气体或水或沉淀生成时才发生复分解反应.
正确把握复分解反应在溶液中相互交换成分,离子之间重新结合的实质.学会利用反应来制初中化学中常见的物质.
3.【答案】C
【解析】
【分析】
本题难度不大,掌握复分解反应发生的条件有沉淀、气体或水生成并能灵活运用是正确解答本题的关键。
【解答】
溶液能与溶液、溶液发生复分解反应,分别生成碳酸钡沉淀和氢氧化钠、硫酸钡沉淀和水。
溶液能与溶液、溶液发生复分解反应,分别生成碳酸钡沉淀和氯化钠、硫酸钡沉淀和盐酸。
溶液、溶液反应生成硫酸钠、水和二氧化碳。
两物质间能发生的化学反应共有5个。
故选:C。
4.【答案】C
【解析】解:A、盐溶液不一定显中性,也可能是酸性或碱性,如碳酸钠溶液显碱性,故A错误;
B、纯净物是指由一种物质组成,含同种元素的物质不一定是纯净物,例如氧气和臭氧属于混合物,故B错误;
C、酸是指在电离时产生的阳离子全部是氢离子的化合物;碱是指在电离时产生的阴离子全部是氢氧根离子的化合物,酸、碱的组成中一定含有氢元素,故C正确;
D、有盐和水生成的反应不一定是复分解反应,如:,故D错误。
故选:C。
A、根据盐的化学性质进行分析;
B、根据纯净物的定义进行分析;
C、根据酸和碱的特征进行分析;
D、根据复分解反应是两种化合物相互交换成分生成两种新的化合物的反应进行分析。
本题难度不大,掌握盐的化学性质、复分解反应的特征、酸和碱的特征、燃烧的条件等是正确解答本题的关键。
5.【答案】C
【解析】解:次氯酸钠是由金属元素和酸根组成的,属于盐,
故选:C。
根据的物质的成分和类别进行分析解答即可。
本题难度不大,考查物质类别的判别,抓住酸、碱、盐的特征、熟悉常见的物质的组成是正确解答本题的关键。
6.【答案】B
【解析】解:A、碳酸钠溶液和氯化钙溶液相互交换成分生成碳酸钙沉淀和氯化钠,能发生复分解反应,故选项错误。
B、氢氧化钠溶液和氯化钾溶液相互交换成分没有沉淀、气体或水生成,不能发生复分解反应,故选项正确。
C、碳酸钾溶液和盐酸相互交换成分生成氯化钾、水和二氧化碳,能发生复分解反应,故选项错误。
D、硫酸铜溶液和氯化钡溶液相互交换成分生成硫酸钡淀和氯化铜,能发生复分解反应,故选项错误。
故选:B。
根据复分解反应发生的条件,若两种物质相互交换成分有沉淀、气体或水生成,则能发生化学反应,据此进行分析判断.
本题难度不大,掌握复分解反应发生的条件有沉淀、气体或水生成并能灵活运用是正确解答本题的关键.
7.【答案】B
【解析】
【分析】
本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意是在酸性溶液中共存。
【解答】
pH为2的水溶液显酸性,水溶液中含有大量的;则
A.、、、中的与结合可以生成水,故本组离子在的溶液中不能大量共存,故A不符合题意;
B.、、、中各离子和之间相互结合不能生成沉淀、气体或水,则本组离子在的溶液中能大量共存,故B符合题意;
C.、、、中的和结合生成既不溶于水也不溶于酸的白色沉淀,则本组离子在的溶液中不能大量共存,故C不符合题意;
D.、、、中的和结合可以生成水和二氧化碳,故本组离子在的溶液中不能大量共存,故D不符合题意。
故选B。
8.【答案】D
【解析】解:A、、两种离子能结合成氨气和水,的水溶液呈紫红色,故选项错误。
B、、两种离子能结合成硫酸钡沉淀,不能大量共存,故选项错误。
C、、能结合成水和二氧化碳,不能大量共存,故选项错误。
D、四种离子间不能结合成沉淀、气体或水,能大量共存,且不存在有色离子,故选项正确。
故选:D。
的溶液显中性;根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能大量共存,据此进行分析判断即可。本题还要注意溶液呈无色,不能含有明显有颜色的铜离子、铁离子和亚铁离子等。
本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意特定离子的颜色。
9.【答案】A
【解析】解:pH为1的水溶液显酸性,水溶液中含有大量的.
A、四者之间不反应,能在酸性溶液中共存,且不存在有色离子,故选项正确.
B、KOH中的氢氧根离子和在溶液中能结合生成水,不能大量共存,故选项错误.
C、四者之间不反应,且能在酸性溶液中共存,但溶于水呈黄色,故选项错误.
D、中的碳酸根离子和在溶液中能结合生成水和二氧化碳,不能大量共存,故选项错误.
故选:A.
pH为1的水溶液显酸性,水溶液中含有大量的根据复分解反应发生的条件可知,若物质之间相互交换成分不能生成水、气体、沉淀,则能够在溶液中大量共存.本题还要注意能得到无色溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.
本题考查物质的共存问题,判断离子在溶液中能否共存,主要看溶液中溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意在酸性溶液中共存及特定离子的颜色.
10.【答案】C
【解析】解:A、侯德榜发明的联合制碱法中的“碱”指的是纯碱,其化学式为,而不是NaCl,故选项错误。
B、侯德榜发明的联合制碱法中的“碱”指的是纯碱,其化学式为,而不是NaOH,故选项错误。
C、侯德榜发明的联合制碱法中的“碱”指的是纯碱,其化学式为,故选项正确。
D、侯德榜发明的联合制碱法中的“碱”指的是纯碱,其化学式为,而不是,故选项错误。
故选:C。
根据侯德榜发明的联合制碱法中的“碱”指的是纯碱,进行分析判断。
本题难度不大,掌握侯德榜发明的联合制碱法中的“碱”指的是纯碱是正确解答本题的关键。
11.【答案】B
【解析】解:A、和溶液恰好完全反应生成硫酸钡沉淀和氯化钾,该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应,故选项说法正确。
B、反应后溶液中存在的粒子除了和,还有水分子,故选项说法错误。
C、该反应的实质是和结合生成,故选项说法正确。
D、和反应生成硫酸钡沉淀和氢氧化钠,该反应的实质是和结合生成,反应的实质与该反应相同,故选项说法正确。
故选:B。
根据和溶液恰好完全反应的微观示意图可知,反应的实质是钡离子和硫酸根离子结合生成硫酸钡沉淀,进行分析判断。
本题难度不大,掌握复分解反应的实质离子之间结合生成沉淀或水或气体是正确吴俊达本题的关键。
12.【答案】A
【解析】解:A、单质是由同种元素组成,所以同种元素组成的纯净物都是单质,故A正确;
B、某物质在氧气中燃烧后生成二氧化碳和水,根据质量守恒定律可知,该物质一定含有碳、氢元素,可能含有氧元素,故B错误;
C、将某无色溶液滴在pH试纸上,测得,该溶液显碱性,但不一定是碱溶液,如碳酸钠是一种盐,其水溶液显碱性,故C错误;
D、复分解反应有沉淀、气体或水生成,但有沉淀、气体或水生成的反应不一定都是复分解反应,如水的通电分解产生气体,但不属于复分解反应,故D正确。
故选:A。
A、根据单质的概念来分析;
B、根据质量守恒定律来分析;
C、根据溶液的酸碱性来分析;
D、根据复分解反应的判断方法来分析。
本题难度不大,解答此类题时要根据不同知识的特点类推,不能盲目类推,并要注意知识点与方法的有机结合,做到具体问题能具体分析。
13.【答案】D
【解析】略
14.【答案】
氨气在水中的溶解度比大,氨盐水显碱性,更易吸收二氧化碳
碳酸氢钠;相同条件下,碳酸氢钠的溶解度较小
【解析】略
15.【答案】;
;除去二氧化碳中混有的氯化氢气体
;氧化钙与水反应放出大量热,而氨水受热会挥发出大量的氨气
;氨气极易溶于水,溶液显碱性,能吸收更多的二氧化碳气体
防止发生倒吸
【解析】
【分析】
本题考查纯碱的制备原理,掌握实验室中制取二氧化碳的原理、气体除杂的方法、制取氨气的原理、装置的特点以及气体的溶解性是解答本题的关键,注意基础知识的积累与应用。
【解答】
装置用于制取二氧化碳气体,所以试剂是石灰石与稀盐酸;石灰石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为。
制取的二氧化碳中混有少量的氯化氢气体,所以装置B中的试剂是碳酸氢钠溶液,碳酸氢钠与氯化氢反应生成氯化钠、水和二氧化碳。
氧化钙与水反应生成氢氧化钙,并放出热量;而氨水受热会挥发出大量的氨气。
氨气极易溶于水,所以在实验过程中,应先向C中通入氨气,此溶液显碱性,能吸收更多的二氧化碳气体。
氨气极易溶于水,为了防止发生倒吸,所以由E向C装置通气的导管不能插入液面以下。
碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为。
第2页,共2页
第1页,共1页
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
