浙江高考化学试题与高中苏教版化学教材的关系
文档属性
| 名称 | 浙江高考化学试题与高中苏教版化学教材的关系 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-16 08:59:06 | ||
图片预览








文档简介
(共73张PPT)
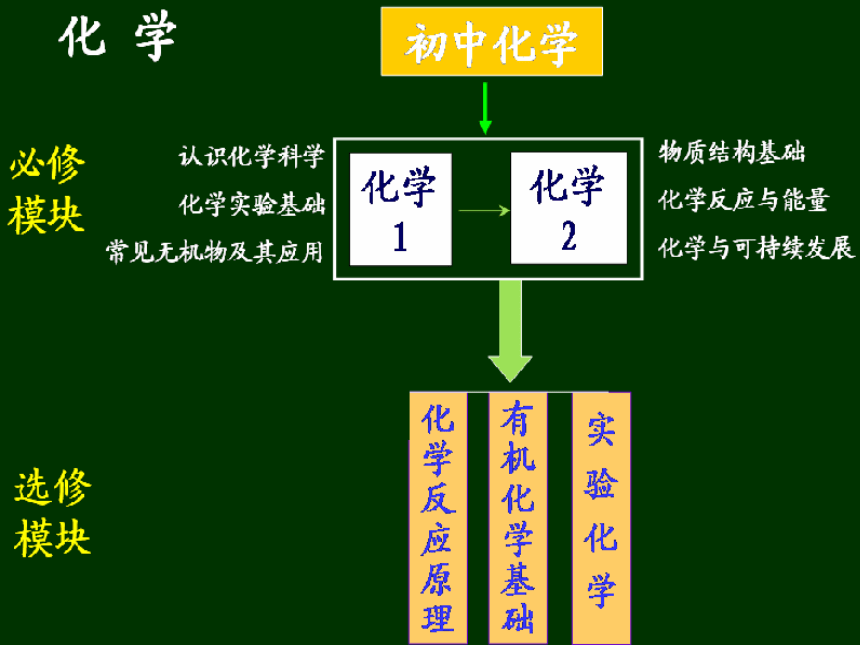
高考试题七加四, 涉及内容有五块;
《化学1》,是基础, 夯实基础最重要;
《化学2》,仅结构, 其它内容后加强;
《有机化学》占两成, 学好狠抓官能团;
《实验化学》四十多, 怎么强调不为过;
余下主要是《原理》, 居高临下理解透。
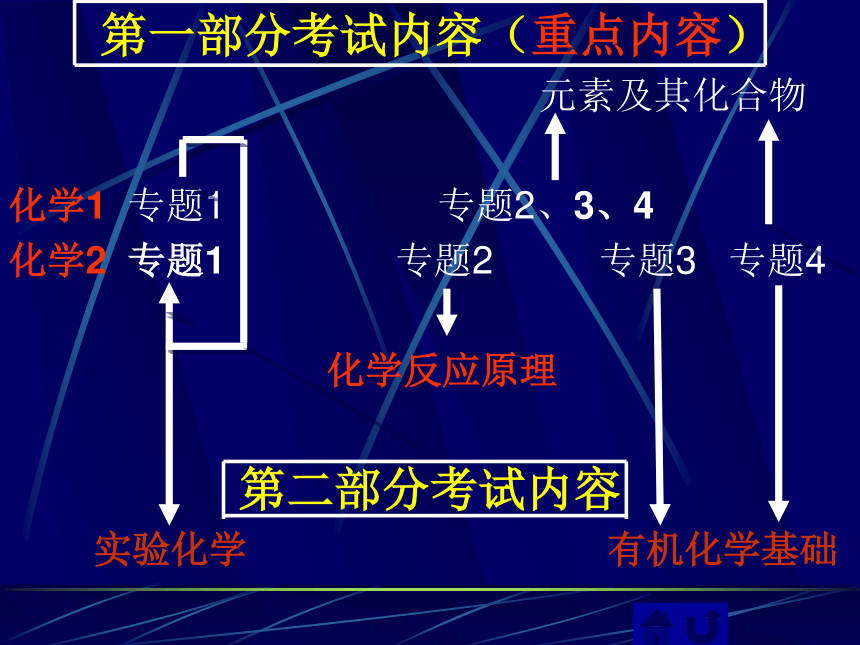
第一部分考试内容(重点内容)
元素及其化合物
化学1 专题1 专题2、3、4
化学2 专题1 专题2 专题3 专题4
化学反应原理
第二部分考试内容
实验化学 有机化学基础
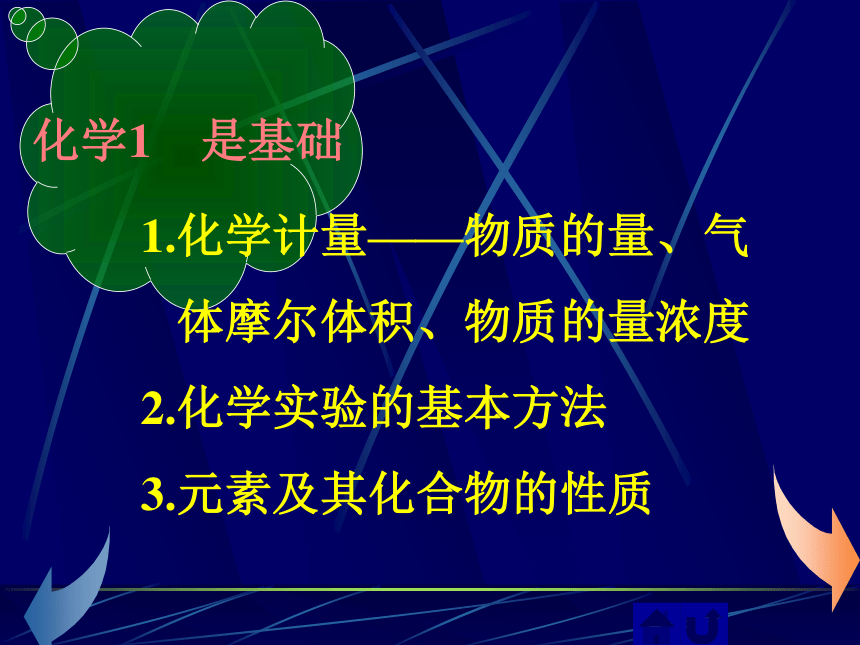
化学1 是基础
1.化学计量——物质的量、气
体摩尔体积、物质的量浓度
2.化学实验的基本方法
3.元素及其化合物的性质
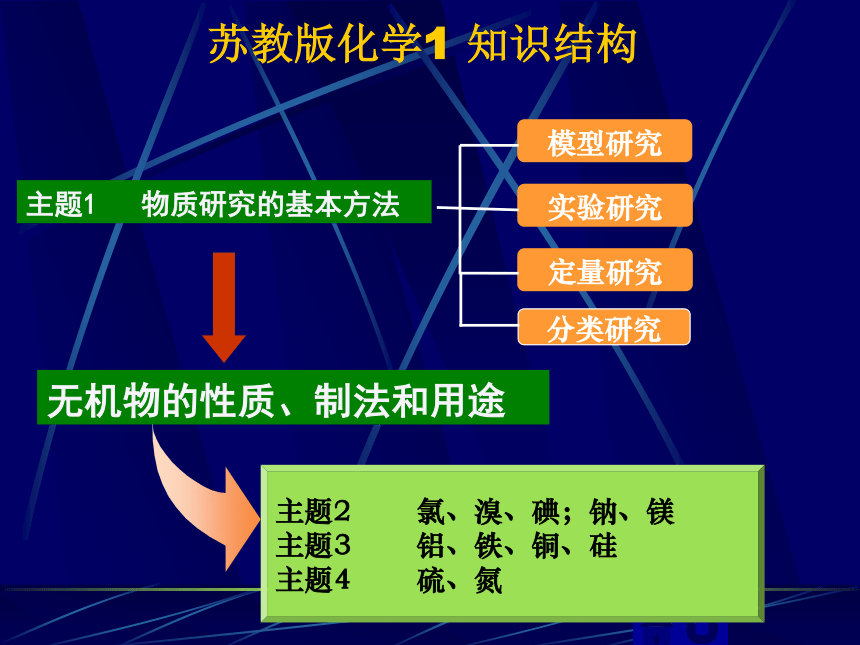
苏教版化学1 知识结构
主题1 物质研究的基本方法
模型研究
实验研究
定量研究
主题2 氯、溴、碘;钠、镁
主题3 铝、铁、铜、硅
主题4 硫、氮
无机物的性质、制法和用途
分类研究
专题一
化学家
眼中的
物质世界
第一单元
丰富多彩
的物质世界
第二单元
研究物质
的实验方法
第三单元
人类对原子
结构的认识
①物质分类及其转化
②物质的量
③物质聚集状态
④物质的分散系
①物质的分离和提纯
②常见物质的检验
③溶液的配制及其分析
①原子结构模型的演变
②原子的构成
专题一的主要内容
1-3 人类对原子结构的认识:
原子结构,元素性质与最外层电子关系
1-1 丰富多彩的化学物质:
物质的不同种类 不同类型物质间的转化及规律(四种反应,氧化还原反应;反应的定量关系:物质的量) 从聚集状态分类(1mol不同状态物质的体积、气体摩尔体积) 物质的分散系(胶体、电解质、电离方程式)
1-2 研究物质的实验方法:
物质的分离提纯(过滤、结晶、萃取、蒸馏、层析) 物质的检验 溶液的配制及分析 (物质的量浓度,配制,滴定分析)
对宏观物质的基本认识
化学研究的
基本方法
对物质微观结构的认识
物质组成分析
专题1 化学家眼中的物质世界
第三单元涉及各部分知识点的联系
原子结构模型的演变
学习有关原子结构的基础知识
原子结构
示 意 图
核素、同位素的概念
质子数、中子数、质量数之间的关系
化学反应中电子得失与原子最外层电子数 的关系
第一单元:丰富多彩的物质世界 —物质的分类及其转化
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
纯净物、混合物、单质、化合物……化学反应基本类型
氧化还原
反 应
一些常见的单质、氧化物、酸、碱、盐之间的反应关系
有机物的概念,无机物和有机物之间的 转 化
第一单元:丰富多彩的物质世界 ——物质的量
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
物质的量、
摩尔质量
根据物质的量的简单计算
第一单元:丰富多彩的物质世界 ——物质的聚集状态
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
不同状态物质的结构与性质、晶体、气体摩尔体积
根据气体摩尔体积的简单计算
第一单元:丰富多彩的物质世界 ——物质的分散系
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
分散系、溶液、胶体、电解质、非电解质、电解质的电离
第二单元:研究物质的实验方法
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
物质的分离及提纯、常见物质的检验、溶液的配制及分析、中和滴定法测定溶液浓度
第三单元:人类对原子结构的认识
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
原子结构模型、核素、同位素
初中
化学1-1
化学1-2
选修课程
从得失氧的角度判断氧化还原反应从具体的物质氧气来认识氧化性;氢气和一氧化碳来认识还原性
根据化合价的变化判断氧化还原反应
根据实验事实了解氧化还原反应的本质是电子的转移,氧化剂、还原剂、氧化性、还原性概念等
电解、原电池学习进一步理解氧化还原反应
具体应用:铝、铁、铜的获取,硫和含硫化合物的相互转化,生产生活中的含氮化合物
后续专题
初中课程
必修课程
选修课程
化学1—专题1:分子、原子、离子化学2—专题1:原子核的结构、原子中各微粒的关系、核外电子排布
原子由原子核和核外电子构成
《物质结构与性质》
原子结构——原子的量子力学模型、核外电子排布、元素周期律(表)
分子结构——共价键、分子间作用力(氢键)
晶体结构——微粒间的作用力、晶体类型
物质
能量
方向、速率、限度
类型
化学反应
原子的
重新组合
感受到反应有快慢
感受到反应中有
吸热、放热现象
基本反应类型
初中
反应历程
基元反应
理性分析化学反应的
方向、快慢和限度
化学能
热能(定量计算 )
电能(理性分析)
更加本质的认识
氧化还原反应、离子反应
选修
必修
旧键的断裂
新键的生成
感性认识化学反应
的快慢和限度
氧化还原反应的实质
感性认识离子反应
化学能
热能(定性认识)
电能(感性认识)
结合学生已有经验
交流研讨实验探究
模型、图片形象化
运用概念形成观念
形成概念
酸、碱、盐溶液有导电性
电离
激活、猜想、讨论
图片形象化
离子的检验
运用
离子反应
第二专题
运用
形成观念
完成从宏观到微观、现象到本质的转变。
化学反应是某一层次微粒的相互作用
后续学习相关内容
实验化学-专题一
物质的分离与提纯
课题1:海带中碘元素的分离及检验;
课题2:用纸层析法分离铁离子和铜离子;课题3:硝酸钾晶体的制备
No1、生活中的事例
泥浆水的净化
海水晒盐
蒸馏法制酒
No2、归纳过滤、蒸馏两种基本分离方法
过滤:分离液体和难溶物
蒸馏:分离沸点不同的物质
No3、交流与讨论1:
请根据要求设计分离和提纯下列物质的实验方案,并将你的方案与同学交流讨论。
已知氢氧化镁难溶于水,硫酸钡既难溶于水又难溶于酸,碳酸钡难溶于水,但可溶于酸。现有含硫酸钠、氯化镁和泥沙等杂质的粗食盐,请设计实验方案,由粗食盐提纯氯化钠。
①将粗食盐溶于水得悬浊液A
②向A中加入足量氯化钡溶液直到不再产生沉淀
③向②所得溶液中加入足量氢氧化钠溶液直到不再产生沉淀
④向③所得溶液中加入足量碳酸钠溶液直到不再产生沉淀
⑤过滤,得溶液B
⑥向B溶液中加入盐酸至呈中性
⑦蒸发溶液,得较纯的氯化钠
No4、归纳水溶液中物质提纯的要点
除杂务尽
不引入新的杂质
No5、交流与讨论2:现有氯化钾和硝酸钾的固体
混合物50 g,其中氯化钾的质量分数为
10%,请设计实验方案提纯硝酸钾
No6、归纳结晶法提纯物质的原理及方法:
原理:利用物质溶解度的差异进行物质分离
操作方法:饱和溶液降温结晶,溶解度受温
度影响较大的首先大量析出,然后过滤。
No7、演示P17“观察与思考”:用CCl4萃取溴水中的溴
No8、提问:用酒精可以萃取溴水中的溴吗?
No9、简介萃取要求
溶质在萃取剂中的溶解度比在原溶剂中大
萃取剂与原溶剂互不相溶
萃取剂与原溶剂和溶质互不相溶
No10、简单介绍层析法
化学实验专题
高考试题化学实验共有42分(2道选择题+2道非选择题)
浙江三年来高考实验试题涉及到
《实验化学》模块的内容有:
萃取分液、纸层析、减压过滤、结晶及晶粒的形成条件、滴定、硝基苯的制备、干燥剂(含CoCl2)电化学实验、牙膏及火柴头中某些成分的检验、亚硝酸根的检验、硫酸亚铁铵的制备、有机化合物的制备、实验室安全守则
考试大纲
(1)了解化学实验是科学探究过程中的一种方法
(2)了解化学实验室常用实验仪器的主要用途和使用方法
(3)掌握化学实验的基本操作,能识别化学药品安全使用标识,了解实验室一般事故的预防和处理。
(4)掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
(5)能对常见的物质进行检验、分离和提纯,能根据要求配制溶液。
(6)能根据实验试题要求,做到:
a.设计、评价或改进实验方案;
b.了解控制实验条件的方法;
c.分析或处理实验数据,得出合理结论;
d.绘制和识别典型的实验仪器装置图。
(7)以上各部分知识与技能的综合应用。
实验原理
反应原理
——制备(气体制备、有机化合物制备等);除杂净化(洗气、提纯等)、吸收(尾气处理等)
装置原理
——装置中各仪器的名称、作用;装置的工作原理
操作原理
——操作步骤、操作步骤的原因
实验设计与评价
(1)物质制备
(2)物质性质
(3)物质(离子)的检验(鉴别与鉴定)
(4)物质的提纯(除杂、分离)
2012年 8(6分).下列说法正确的是
A.在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全
B.在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在
C.在“硫酸亚铁铵的制备”实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
D.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理
2011年8( 6分).
下列说法不正确的是
A.变色硅胶干燥剂含有CoCl2,干燥剂呈蓝色时,表示不具有吸水干燥功能
B.“硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触
C.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经干燥或润洗后方可使用
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
2012年10(6分).以铬酸钾为原料,
电化学法制备重铬酸钾的实验装置示
意图如右:下列说法不正确的是
A.在阴极室,发生的电极反应
为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐
由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2 +2H+ +H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量。若K与Cr的物质的
量之比为d,则此时铬酸钾的转化率为1—
2011年10(6分). 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要是液滴之下氧气含量比边缘处少。下列说法正确的是
A.液滴中的Cl—由a区向b区迁移
B.液滴边缘是正极区,发生的电极
反应为:O2+2H2O+4e—==4OH—
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH—形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu—2e—==Cu2+
2012年26.[15分]已知:
I2+2S2O42— == S4O62—+2I-。相关物质的溶度积常数见下表:
物质 Cu(OH)2 Fe(OH)3 CuCl CuI
Ksp 2.2×10-20 2.6×10-39 1.7×10-7 1.3×10-12
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2 2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________。
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2 2H2O晶体。
(2)在空气中直接加热CuCl2 2H2O晶体得不到纯的无水CuCl2,原因是___________(用化学方程式表示)。由CuCl2 2H2O晶体得到纯的无水CuCl2的合理方法是___________。
(3)某学习小组用“间接碘量法”测定含有CuCl2 2H2O晶体的试样(不含能与I―发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
①可选用___________作滴定指示剂,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______。
③该试样中CuCl2 2H2O的质量百分数为_____。
(1)某学习小组对加碘进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是_______(用化学式表示);CCl4中紫红色的物质是______(用电子式表示)。
2011年26(15分).食盐中含有一定量的镁、铁等杂质,加碘盐中的损失主要是由于杂质、水份、空气中的氧气以及光照、受热而引起的。已知:
氧化性: IO3—>Fe3+>I2;还原性:S2O32—>I—
3I2+6OH—==5I—+IO3—+3H2O KI+I2 KI3
②第二份试液中加入足量KI固体后,反应的离子方程式为__________、______________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式:____________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?_____(填“是”或“否”),并说明理由:________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是______。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO3
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:______________________________________。
2012年28.[14分]实验室制备苯乙酮的化学方程式为:
制备过程中还有
主要实验装置和步骤如下:
(I)合成:在三颈瓶
中加入20 g无水AlCl3
和30 mL无水苯。为避
免反应液升温过快,
边搅拌边慢慢滴加6 mL
乙酸酐和10 mL无水苯的
混合液,控制滴加速率,
使反应液缓缓回流。滴加完毕后加热回流1小时。
等副反应。
(Ⅱ)分离与提纯:
①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层
②水层用苯萃取,分液
③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品
④蒸馏粗产品得到苯乙酮。回答下列问题:
(1)仪器a的名称:____;装置b的作用:___。
(2)合成过程中要求无水操作,理由是____。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致_________________。
A.反应太剧烈 B.液体太多搅不动
C.反应变缓慢 D.副产物增多
(4)分离和提纯操作②的目的是________________________________________________。该操作中是否可改用乙醇萃取?_____(填“是”或“否”),原因是_________________。
(4)分离和提纯操作②的目的是___________。该操作中是否可改用乙醇萃取?_____(填“是”或“否”),原因是_________________。
(5)分液漏斗使用前须___________________并洗净备用。萃取时,先后加入待萃取液和萃取剂,经振摇并_________后,将分液漏斗置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先__________,然后打开活塞放出下层液体,上层液体从上口倒出。
(6)粗产品蒸馏提纯时,下面装置中温度计位置正确的是________________,可能会导致收集到的产品中混有低沸点杂质的装置是_______。
2011年28.(15分)二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下:
在反应装置中,加入原料和溶剂,
搅拌下加热回流。反应结束后加水
煮沸,冷却后即有二苯基乙二酮粗
产品析出,用70%乙醇水溶液重结晶提纯。
重结晶过程:
加热溶解 活性炭脱色 趁热过滤 冷却结晶
抽滤 洗涤 干燥
请回答以下问题:
写出装置图中玻璃仪器的名称:a_______________,b________________。
趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:________。
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可采用_________、___________等方法促进晶体析出。
抽滤所用的滤纸应略___________(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上
往往还粘有少量晶体,需选用液体将杯壁上的晶
体冲洗下来后转入布氏漏斗,下列液体最合适的是______________。
A.无水乙醇 B.饱和氯化钠溶液
C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:_____________。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15 min、30 min、45 min和60 min时,用毛细管取样、点样,薄层色谱展开后的斑点如下图所示。该实验条件下比较合适的回流时间是___。
A.15 min B.30 min
C.45 min D.60 min
反应开始 15 min 30 min 45 min 60 min
三年来浙江高考化学试题
《有机化学基础》20分
(1道选择题+1道非选择题)
(2012年高考题)
2011年高考题
2010年高考题
祝——
高考成功
恭祝大家——
身体健康,
师业辉煌!
再见
高考试题七加四, 涉及内容有五块;
《化学1》,是基础, 夯实基础最重要;
《化学2》,仅结构, 其它内容后加强;
《有机化学》占两成, 学好狠抓官能团;
《实验化学》四十多, 怎么强调不为过;
余下主要是《原理》, 居高临下理解透。
第一部分考试内容(重点内容)
元素及其化合物
化学1 专题1 专题2、3、4
化学2 专题1 专题2 专题3 专题4
化学反应原理
第二部分考试内容
实验化学 有机化学基础
化学1 是基础
1.化学计量——物质的量、气
体摩尔体积、物质的量浓度
2.化学实验的基本方法
3.元素及其化合物的性质
苏教版化学1 知识结构
主题1 物质研究的基本方法
模型研究
实验研究
定量研究
主题2 氯、溴、碘;钠、镁
主题3 铝、铁、铜、硅
主题4 硫、氮
无机物的性质、制法和用途
分类研究
专题一
化学家
眼中的
物质世界
第一单元
丰富多彩
的物质世界
第二单元
研究物质
的实验方法
第三单元
人类对原子
结构的认识
①物质分类及其转化
②物质的量
③物质聚集状态
④物质的分散系
①物质的分离和提纯
②常见物质的检验
③溶液的配制及其分析
①原子结构模型的演变
②原子的构成
专题一的主要内容
1-3 人类对原子结构的认识:
原子结构,元素性质与最外层电子关系
1-1 丰富多彩的化学物质:
物质的不同种类 不同类型物质间的转化及规律(四种反应,氧化还原反应;反应的定量关系:物质的量) 从聚集状态分类(1mol不同状态物质的体积、气体摩尔体积) 物质的分散系(胶体、电解质、电离方程式)
1-2 研究物质的实验方法:
物质的分离提纯(过滤、结晶、萃取、蒸馏、层析) 物质的检验 溶液的配制及分析 (物质的量浓度,配制,滴定分析)
对宏观物质的基本认识
化学研究的
基本方法
对物质微观结构的认识
物质组成分析
专题1 化学家眼中的物质世界
第三单元涉及各部分知识点的联系
原子结构模型的演变
学习有关原子结构的基础知识
原子结构
示 意 图
核素、同位素的概念
质子数、中子数、质量数之间的关系
化学反应中电子得失与原子最外层电子数 的关系
第一单元:丰富多彩的物质世界 —物质的分类及其转化
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
纯净物、混合物、单质、化合物……化学反应基本类型
氧化还原
反 应
一些常见的单质、氧化物、酸、碱、盐之间的反应关系
有机物的概念,无机物和有机物之间的 转 化
第一单元:丰富多彩的物质世界 ——物质的量
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
物质的量、
摩尔质量
根据物质的量的简单计算
第一单元:丰富多彩的物质世界 ——物质的聚集状态
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
不同状态物质的结构与性质、晶体、气体摩尔体积
根据气体摩尔体积的简单计算
第一单元:丰富多彩的物质世界 ——物质的分散系
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
分散系、溶液、胶体、电解质、非电解质、电解质的电离
第二单元:研究物质的实验方法
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
物质的分离及提纯、常见物质的检验、溶液的配制及分析、中和滴定法测定溶液浓度
第三单元:人类对原子结构的认识
基本概念
基本理论
基本实验
基本计算
元素化学
有机化学
原子结构模型、核素、同位素
初中
化学1-1
化学1-2
选修课程
从得失氧的角度判断氧化还原反应从具体的物质氧气来认识氧化性;氢气和一氧化碳来认识还原性
根据化合价的变化判断氧化还原反应
根据实验事实了解氧化还原反应的本质是电子的转移,氧化剂、还原剂、氧化性、还原性概念等
电解、原电池学习进一步理解氧化还原反应
具体应用:铝、铁、铜的获取,硫和含硫化合物的相互转化,生产生活中的含氮化合物
后续专题
初中课程
必修课程
选修课程
化学1—专题1:分子、原子、离子化学2—专题1:原子核的结构、原子中各微粒的关系、核外电子排布
原子由原子核和核外电子构成
《物质结构与性质》
原子结构——原子的量子力学模型、核外电子排布、元素周期律(表)
分子结构——共价键、分子间作用力(氢键)
晶体结构——微粒间的作用力、晶体类型
物质
能量
方向、速率、限度
类型
化学反应
原子的
重新组合
感受到反应有快慢
感受到反应中有
吸热、放热现象
基本反应类型
初中
反应历程
基元反应
理性分析化学反应的
方向、快慢和限度
化学能
热能(定量计算 )
电能(理性分析)
更加本质的认识
氧化还原反应、离子反应
选修
必修
旧键的断裂
新键的生成
感性认识化学反应
的快慢和限度
氧化还原反应的实质
感性认识离子反应
化学能
热能(定性认识)
电能(感性认识)
结合学生已有经验
交流研讨实验探究
模型、图片形象化
运用概念形成观念
形成概念
酸、碱、盐溶液有导电性
电离
激活、猜想、讨论
图片形象化
离子的检验
运用
离子反应
第二专题
运用
形成观念
完成从宏观到微观、现象到本质的转变。
化学反应是某一层次微粒的相互作用
后续学习相关内容
实验化学-专题一
物质的分离与提纯
课题1:海带中碘元素的分离及检验;
课题2:用纸层析法分离铁离子和铜离子;课题3:硝酸钾晶体的制备
No1、生活中的事例
泥浆水的净化
海水晒盐
蒸馏法制酒
No2、归纳过滤、蒸馏两种基本分离方法
过滤:分离液体和难溶物
蒸馏:分离沸点不同的物质
No3、交流与讨论1:
请根据要求设计分离和提纯下列物质的实验方案,并将你的方案与同学交流讨论。
已知氢氧化镁难溶于水,硫酸钡既难溶于水又难溶于酸,碳酸钡难溶于水,但可溶于酸。现有含硫酸钠、氯化镁和泥沙等杂质的粗食盐,请设计实验方案,由粗食盐提纯氯化钠。
①将粗食盐溶于水得悬浊液A
②向A中加入足量氯化钡溶液直到不再产生沉淀
③向②所得溶液中加入足量氢氧化钠溶液直到不再产生沉淀
④向③所得溶液中加入足量碳酸钠溶液直到不再产生沉淀
⑤过滤,得溶液B
⑥向B溶液中加入盐酸至呈中性
⑦蒸发溶液,得较纯的氯化钠
No4、归纳水溶液中物质提纯的要点
除杂务尽
不引入新的杂质
No5、交流与讨论2:现有氯化钾和硝酸钾的固体
混合物50 g,其中氯化钾的质量分数为
10%,请设计实验方案提纯硝酸钾
No6、归纳结晶法提纯物质的原理及方法:
原理:利用物质溶解度的差异进行物质分离
操作方法:饱和溶液降温结晶,溶解度受温
度影响较大的首先大量析出,然后过滤。
No7、演示P17“观察与思考”:用CCl4萃取溴水中的溴
No8、提问:用酒精可以萃取溴水中的溴吗?
No9、简介萃取要求
溶质在萃取剂中的溶解度比在原溶剂中大
萃取剂与原溶剂互不相溶
萃取剂与原溶剂和溶质互不相溶
No10、简单介绍层析法
化学实验专题
高考试题化学实验共有42分(2道选择题+2道非选择题)
浙江三年来高考实验试题涉及到
《实验化学》模块的内容有:
萃取分液、纸层析、减压过滤、结晶及晶粒的形成条件、滴定、硝基苯的制备、干燥剂(含CoCl2)电化学实验、牙膏及火柴头中某些成分的检验、亚硝酸根的检验、硫酸亚铁铵的制备、有机化合物的制备、实验室安全守则
考试大纲
(1)了解化学实验是科学探究过程中的一种方法
(2)了解化学实验室常用实验仪器的主要用途和使用方法
(3)掌握化学实验的基本操作,能识别化学药品安全使用标识,了解实验室一般事故的预防和处理。
(4)掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
(5)能对常见的物质进行检验、分离和提纯,能根据要求配制溶液。
(6)能根据实验试题要求,做到:
a.设计、评价或改进实验方案;
b.了解控制实验条件的方法;
c.分析或处理实验数据,得出合理结论;
d.绘制和识别典型的实验仪器装置图。
(7)以上各部分知识与技能的综合应用。
实验原理
反应原理
——制备(气体制备、有机化合物制备等);除杂净化(洗气、提纯等)、吸收(尾气处理等)
装置原理
——装置中各仪器的名称、作用;装置的工作原理
操作原理
——操作步骤、操作步骤的原因
实验设计与评价
(1)物质制备
(2)物质性质
(3)物质(离子)的检验(鉴别与鉴定)
(4)物质的提纯(除杂、分离)
2012年 8(6分).下列说法正确的是
A.在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全
B.在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在
C.在“硫酸亚铁铵的制备”实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
D.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理
2011年8( 6分).
下列说法不正确的是
A.变色硅胶干燥剂含有CoCl2,干燥剂呈蓝色时,表示不具有吸水干燥功能
B.“硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触
C.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经干燥或润洗后方可使用
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
2012年10(6分).以铬酸钾为原料,
电化学法制备重铬酸钾的实验装置示
意图如右:下列说法不正确的是
A.在阴极室,发生的电极反应
为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐
由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2 +2H+ +H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量。若K与Cr的物质的
量之比为d,则此时铬酸钾的转化率为1—
2011年10(6分). 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要是液滴之下氧气含量比边缘处少。下列说法正确的是
A.液滴中的Cl—由a区向b区迁移
B.液滴边缘是正极区,发生的电极
反应为:O2+2H2O+4e—==4OH—
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH—形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu—2e—==Cu2+
2012年26.[15分]已知:
I2+2S2O42— == S4O62—+2I-。相关物质的溶度积常数见下表:
物质 Cu(OH)2 Fe(OH)3 CuCl CuI
Ksp 2.2×10-20 2.6×10-39 1.7×10-7 1.3×10-12
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2 2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________。
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2 2H2O晶体。
(2)在空气中直接加热CuCl2 2H2O晶体得不到纯的无水CuCl2,原因是___________(用化学方程式表示)。由CuCl2 2H2O晶体得到纯的无水CuCl2的合理方法是___________。
(3)某学习小组用“间接碘量法”测定含有CuCl2 2H2O晶体的试样(不含能与I―发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
①可选用___________作滴定指示剂,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______。
③该试样中CuCl2 2H2O的质量百分数为_____。
(1)某学习小组对加碘进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是_______(用化学式表示);CCl4中紫红色的物质是______(用电子式表示)。
2011年26(15分).食盐中含有一定量的镁、铁等杂质,加碘盐中的损失主要是由于杂质、水份、空气中的氧气以及光照、受热而引起的。已知:
氧化性: IO3—>Fe3+>I2;还原性:S2O32—>I—
3I2+6OH—==5I—+IO3—+3H2O KI+I2 KI3
②第二份试液中加入足量KI固体后,反应的离子方程式为__________、______________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式:____________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?_____(填“是”或“否”),并说明理由:________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是______。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO3
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:______________________________________。
2012年28.[14分]实验室制备苯乙酮的化学方程式为:
制备过程中还有
主要实验装置和步骤如下:
(I)合成:在三颈瓶
中加入20 g无水AlCl3
和30 mL无水苯。为避
免反应液升温过快,
边搅拌边慢慢滴加6 mL
乙酸酐和10 mL无水苯的
混合液,控制滴加速率,
使反应液缓缓回流。滴加完毕后加热回流1小时。
等副反应。
(Ⅱ)分离与提纯:
①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层
②水层用苯萃取,分液
③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品
④蒸馏粗产品得到苯乙酮。回答下列问题:
(1)仪器a的名称:____;装置b的作用:___。
(2)合成过程中要求无水操作,理由是____。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致_________________。
A.反应太剧烈 B.液体太多搅不动
C.反应变缓慢 D.副产物增多
(4)分离和提纯操作②的目的是________________________________________________。该操作中是否可改用乙醇萃取?_____(填“是”或“否”),原因是_________________。
(4)分离和提纯操作②的目的是___________。该操作中是否可改用乙醇萃取?_____(填“是”或“否”),原因是_________________。
(5)分液漏斗使用前须___________________并洗净备用。萃取时,先后加入待萃取液和萃取剂,经振摇并_________后,将分液漏斗置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先__________,然后打开活塞放出下层液体,上层液体从上口倒出。
(6)粗产品蒸馏提纯时,下面装置中温度计位置正确的是________________,可能会导致收集到的产品中混有低沸点杂质的装置是_______。
2011年28.(15分)二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下:
在反应装置中,加入原料和溶剂,
搅拌下加热回流。反应结束后加水
煮沸,冷却后即有二苯基乙二酮粗
产品析出,用70%乙醇水溶液重结晶提纯。
重结晶过程:
加热溶解 活性炭脱色 趁热过滤 冷却结晶
抽滤 洗涤 干燥
请回答以下问题:
写出装置图中玻璃仪器的名称:a_______________,b________________。
趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:________。
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可采用_________、___________等方法促进晶体析出。
抽滤所用的滤纸应略___________(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上
往往还粘有少量晶体,需选用液体将杯壁上的晶
体冲洗下来后转入布氏漏斗,下列液体最合适的是______________。
A.无水乙醇 B.饱和氯化钠溶液
C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:_____________。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15 min、30 min、45 min和60 min时,用毛细管取样、点样,薄层色谱展开后的斑点如下图所示。该实验条件下比较合适的回流时间是___。
A.15 min B.30 min
C.45 min D.60 min
反应开始 15 min 30 min 45 min 60 min
三年来浙江高考化学试题
《有机化学基础》20分
(1道选择题+1道非选择题)
(2012年高考题)
2011年高考题
2010年高考题
祝——
高考成功
恭祝大家——
身体健康,
师业辉煌!
再见
同课章节目录
