第1章 化学反应 最热同步卷 单元测试(含答案)
文档属性
| 名称 | 第1章 化学反应 最热同步卷 单元测试(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 265.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-18 09:07:03 | ||
图片预览



文档简介
华东师大版九年级上学期《第一章 化学反应》最热同步卷
一.选择题(共15小题)
1.小强同学在用氯酸钾制取氧气时,误把高锰酸钾当作二氧化锰加入了。下列对该实验的分析不正确的是( )
A.生成氧气的速度加快了
B.产生的氧气质量增加了
C.反应中高锰酸钾起催化作用
D.反应过程中,试管中的固体种类最多5种,最少3种
2.某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如图所示,下列关于该过程的说法错误的是( )
A.t1时刻,O2开始产生
B.b曲线表示KMnO4分解
C.KMnO4在该反应中起催化作用
D.c曲线代表氯化钾
3.某同学误将少量高锰酸钾当成二氧化锰加入氯酸钾中进行加热制取氧气,部分物质质量随时间变化的关系如图所示(已知物质发生化学反应时,反应物质量会减少,生成物质量会增加),下列关于该过程的说法正确的是( )
A.t2时刻,氯酸钾开始分解
B.t2时刻,氧气开始产生
C.c代表生成的所有氧气的质量
D.二氧化锰的质量一直保持不变
4.下列四个化学反应中属于化合反应的是( )
A.碳酸→二氧化碳+水
B.铁+氧气四氧化三铁
C.酒精+氧气二氧化碳+水
D.碳酸钙+盐酸→二氧化碳+水+氯化钙
5.下列物质在氧气中燃烧,其反应基本类型不是化合反应的是( )
A.铁丝 B.硫磺 C.镁条 D.蜡烛
6.下列反应中属于化合反应的是( )
A.氧化汞汞+氧气
B.水氢气+氧气
C.酒精+氧气二氧化碳+水
D.汞+氧气氧化汞
7.下列反应既不属于分解反应,也不属于化合反应的是( )
A.氢气+氧气水
B.氢气+氧化铁铁+水
C.碳酸→水+二氧化碳
D.双氧水→水+氧气
8.下列反应既不属于分解反应,也不属于化合反应的是( )
A.镁+氧气氧化镁
B.氧化汞汞+氧气
C.水氢气+氧气
D.蜡烛+氧气二氧化碳+水
9.下列化学反应属于分解反应的是( )
A.氢气+氧气水
B.蜡烛+氧气二氧化碳+水
C.硫+氧气二氧化硫
D.氯酸钾氯化钾+氧气
10.在化学反应前后,下列各项中肯定没有变化的是( )
①原子数目②分子数目③元素种类④物质种类⑤原子种类⑥元素的化合价
A.①④⑥ B.①②③⑤⑥ C.①②⑥ D.①③⑤
11.甲、乙、丙、丁四种物质,它们在密闭容器中反应前后质量的变化关系如下表所示。则下列说法错误的( )
物质名称 甲 乙 丙 丁
反应前质量/g 50 10 8 0
反应后质量/g 16 m 26 16
A.甲是化合物
B.m=38
C.乙可能是这个反应的催化剂
D.此反应基本类型为分解反应
12.某化合物在4.8g氧气中完全燃烧,生成了4.4g二氧化碳和2.7g水。关于该物质的推断中不正确的是( )
A.该化合物的质量为2.3g
B.该化合物中一定含碳、氢、氧三种元素
C.该化合物中碳、氧元素质量比为3:2
D.分子中C、H原子个数比为1:2
13.从化学方程式“N2+O2 2NO”中不能获得的信息是( )
A.反应物有两种
B.反应速率很快
C.反应条件是放电
D.反应中反应物的分子个数比是1:1
14.关于化学方程式4P+5O22P2O5的理解,正确的是( )
A.反应前后分子总数保持不变
B.该反应的反应物是五氧化二磷
C.每31份质量的磷与32份质量的氧气完全反应,生成142份质量的五氧化二磷
D.在点燃的条件下,磷和氧气反应生成五氧化二磷
15.关于化学方程式CO2+C2CO的叙述中,正确的是( )
A.二氧化碳和碳等于一氧化碳
B.1个二氧化碳分子和1个碳原子生成2个一氧化碳
C.二氧化碳和碳在高温的条件下生成一氧化碳
D.每44份质量的二氧化碳和12份质量的碳在高温条件下生成86份质量的一氧化碳
二.填空题(共10小题)
16.实验室常用 和 混合的方法制取氧气,或用加热 和二氧化锰的混合物制取氧气,或用加热 的方法制取氧气。
请写出这三个反应的文字表达式:
(1) ;
(2) ;
(3) 。
17.复学防疫,化学助力。
(1)测量体温是防控的重要环节。家庭常备体温计中的液态物质是汞。汞是由 (选填“分子”“原子”“离子”)直接构成,用符号表示构成金属汞的微粒 。测体温时水银体温计中汞柱会上升的微观原因是 。
(2)到校后,勤消毒。过氧乙酸用于教室消毒,其化学性质不稳定,分解的化学方程式为:2C2H4O3═2C2H4O2+X↑,则X的化学式为 。用于手部消毒的酒精溶液要远离火源,说明酒精具有 性(写出其相应的化学性质)。
(3)用餐时,讲营养。学校给同学们定制了高钙牛奶,这里的“钙“指 (填序号)。
A、钙离子
B、钙原子
C、钙元素
D、钙单质
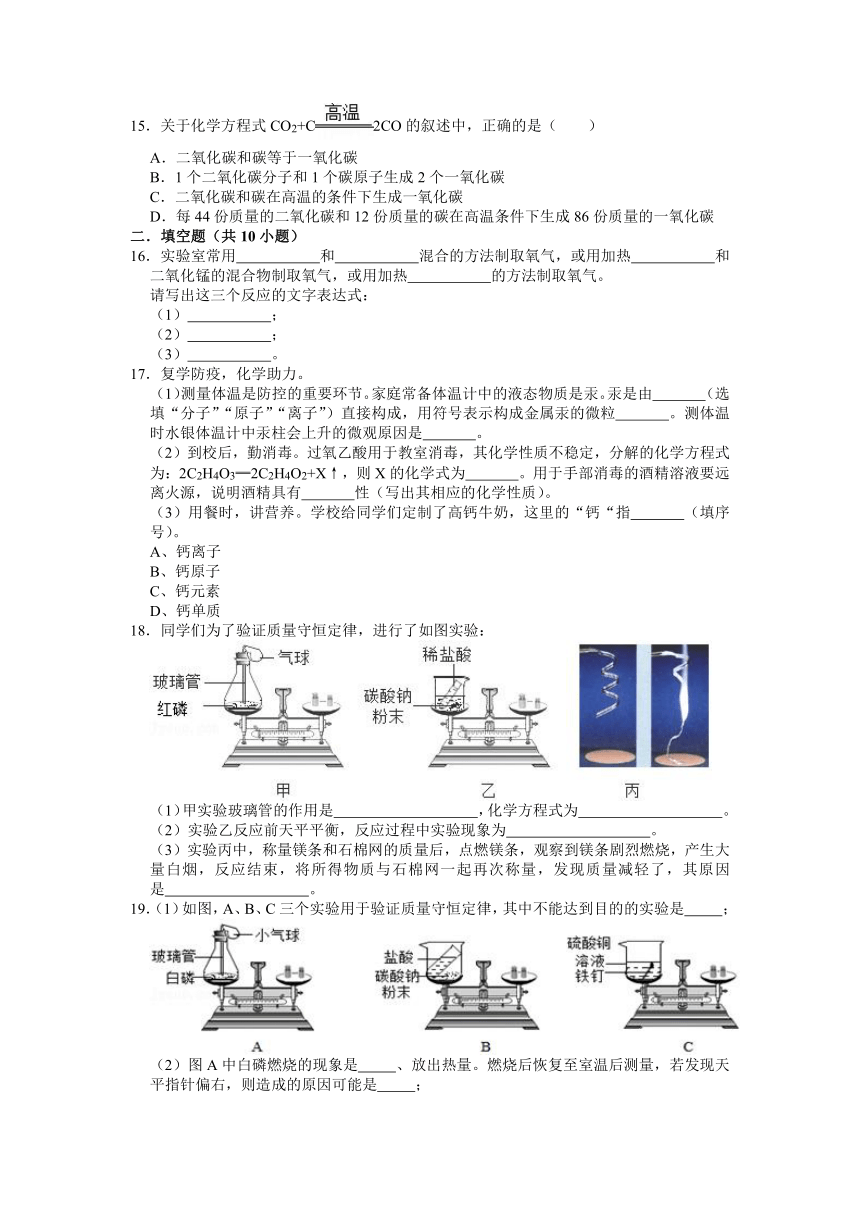
18.同学们为了验证质量守恒定律,进行了如图实验:
(1)甲实验玻璃管的作用是 ,化学方程式为 。
(2)实验乙反应前天平平衡,反应过程中实验现象为 。
(3)实验丙中,称量镁条和石棉网的质量后,点燃镁条,观察到镁条剧烈燃烧,产生大量白烟,反应结束,将所得物质与石棉网一起再次称量,发现质量减轻了,其原因是 。
19.(1)如图,A、B、C三个实验用于验证质量守恒定律,其中不能达到目的的实验是 ;
(2)图A中白磷燃烧的现象是 、放出热量。燃烧后恢复至室温后测量,若发现天平指针偏右,则造成的原因可能是 ;
(3)图C中反应的化学方程式为 ;
(4)由上述实验可知,在化学反应前后,一定不变的是 (填数字序号)。
①原子种类
②原子数目
③分子种类
④分子数目
⑤物质总质量
20.某物质在9.6g氧气中恰好完全燃烧,生成8.8g CO2和5.4g H2O,则该物质中一定含有 元素。
21.(1)水通直流电电解一会儿后,在负极上产生的气体是 (填化学式)。
(2)氧化物是由两种元素组成,其中一种是氧元素的化合物,相对分子质量最小的氧化物是 。
(3)甲烷在空气中完全燃烧,反应的化学方程式为CH4+2O2X+2H2O,则X的化学式为 。
22.写出下列反应的反应方程式。
(1)镁带燃烧: ;
(2)铁丝在氧气中燃烧: ;
(3)天然气燃烧: 。
23.请写出下列化学反应方程式。
(1)红磷在空气中燃烧 ;
(2)镁条在氧气中燃烧 ;
(3)实验室加热黑白固体混合物制氧气 ;
(4)碳和氧化铜在高温条件下反应生成铜和二氧化碳 。
24.按要求写出下列反应的符号表达式:(任举一例)
(1)有H2O生成的分解反应 ;
(2)有H2O生成的化合反应 ;
(3)H2O的分解反应 。
25.4g氢气可与 g氧气完全反应生成水。
三.解答题(共5小题)
26.质量守恒定律的发现是化学发展史上的一个重要里程碑,请用相关知识回答问题。
(1)纸在空中燃烧后化为灰烬,灰烬的质量比纸的质量 ;
(2)植物的光合作用可表示为:二氧化碳+水淀粉+氧气。根据以上信息可确定淀粉中一定含有的元素是 (填写元素符号),依据是在化学反应前后 不变;
(3)15.8g高锰酸钾中含有氧元素的质量为6.4g,则加热15.8g高锰酸钾至完全分解,理论上可以得到氧气的质量 (选填“大于”、“等于”或“小于”)6.4g。
27.在验证质量守恒定律时,某同学设计了如图所示的两个实验,请根据质量守恒定律回答下列问题。
(1)实验Ⅰ中气球的主要作用是什么? ,写出红磷燃烧的化学方程式 。
(2)实验Ⅱ中,反应前天平平衡,将稀盐酸倒入烧杯中和碳酸钠充分反应后,观察到天平指针向右偏转。该反应 (选填“遵守”或“不遵守”)质量守恒定律。请解释反应后天平向右偏转的原因 。
28.写出下列反应的文字表达式。
(1)电解水制取氧气和氢气 。
(2)镁在空气中燃烧 。
29.按要求回答问题。
(1)铁丝在氧气中燃烧符号表达式 。
(2)镁在空气中燃烧符号表达式 ,查阅资料,发现镁条也可以在氮气中燃烧,生成氮化镁(其中氮元素化合价为﹣3),请写出反应符号表达式 ;实验室用燃烧红磷来测定空气中氧气的体积分数,请写出反应符号表达式 ,若用镁条替代红磷燃烧测定空气中氧气的体积分数,会导致进入的水体积 (选填“>”、“=”、“<”)五分之一。
(3)古代宝剑“淬火”,将烧的红热的宝剑迅速伸入水中,可以听到“呲呲”声,观察到宝剑表面变暗,涉及原理:铁在高温下和水发生反应,表面生成四氧化三铁和一种可燃性气体。请写出宝剑“淬火”主要的反应符号表达式 。
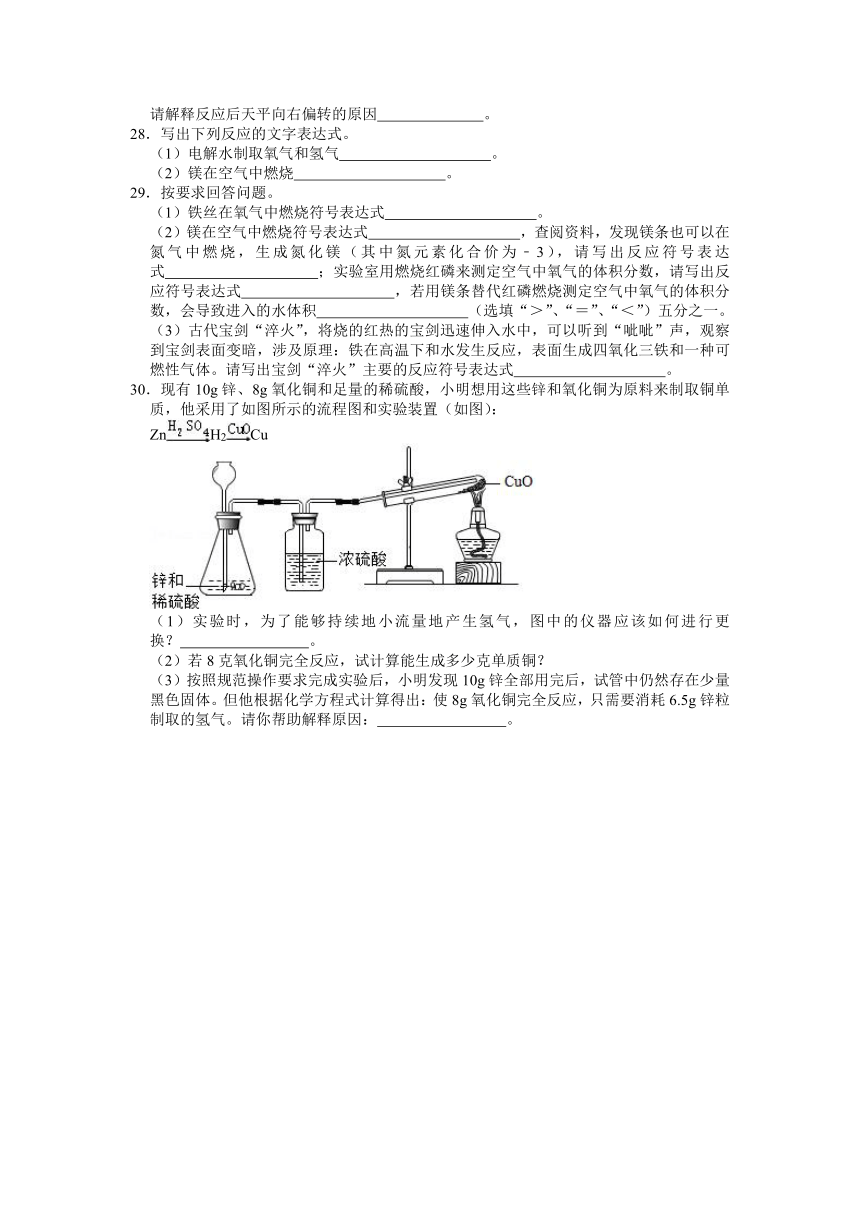
30.现有10g锌、8g氧化铜和足量的稀硫酸,小明想用这些锌和氧化铜为原料来制取铜单质,他采用了如图所示的流程图和实验装置(如图):
ZnH2Cu
(1)实验时,为了能够持续地小流量地产生氢气,图中的仪器应该如何进行更换? 。
(2)若8克氧化铜完全反应,试计算能生成多少克单质铜?
(3)按照规范操作要求完成实验后,小明发现10g锌全部用完后,试管中仍然存在少量黑色固体。但他根据化学方程式计算得出:使8g氧化铜完全反应,只需要消耗6.5g锌粒制取的氢气。请你帮助解释原因: 。
华东师大版九年级上学期《第一章 化学反应》最热同步卷
参考答案与试题解析
一.选择题(共15小题)
1.【解答】解:高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰和氧气,生成的二氧化锰作为氯酸钾反应的催化剂,加快了化学反应速率;生成氧气的质量与单纯加热氯酸钾相比,质量增加;在反应过程中,当氯酸钾和高锰酸钾都是部分反应时,试管中的固体种类最多,有高锰酸钾、锰酸钾、二氧化锰、氯酸钾和氯化钾五种物质,当反应物都全部反应时,试管中的固体种类最少,有锰酸钾、二氧化锰和氯化钾三种物质。观察选项,可知答案C不正确。
故选:C。
2.【解答】解:根据题干所给信息可知,b物质的质量先减少,所以b是高锰酸钾,a的质量后减少,所以a是氯酸钾,在t1时刻高锰酸钾开始分解,有氧气生成,随着高锰酸钾的分解,二氧化锰的质量也在不断的增加,氯酸钾在二氧化锰的催化作用下分解产生氧气和氯化钾。
A.t1时刻,高锰酸钾分解,O2开始产生,选项说法正确;
B.高锰酸钾首先受热分解产生氧气,所以b曲线表示KMnO4分解,选项说法正确;
C.高锰酸钾分解产生的二氧化锰是氯酸钾分解的催化剂,而不是高锰酸钾充当催化剂,选项说法错误;
D.氯酸钾在二氧化锰的催化作用下,受热分解产生氯化钾和氧气,所以c曲线表示氯化钾,选项说法正确。
故选:C。
故选:C。
3.【解答】解:高锰酸钾加热到较低温度时就可以分解产生氧气、锰酸钾和二氧化锰;氯酸钾在二氧化锰的催化作用下、加热到一定温度时分解产生氧气和氯化钾。
A.某同学误将少量高锰酸钾当成二氧化锰加入氯酸钾中进行加热制取氧气,由b的质量较少,则b是高锰酸钾,a是氯酸钾,t2时刻,氯酸钾开始分解,选项说法正确;
B.高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,t1时刻,氧气开始产生,选项说法错误;
C.c代表氯酸钾分解产生的氧气,而不包括高锰酸钾分解产生的氧气,选项说法错误;
D.该反应中的二氧化锰是高锰酸钾分解的产物,在高锰酸钾反应前,二氧化锰的质量为零,随着高锰酸钾的分解,二氧化锰的质量增加,当高锰酸钾完全分解后,二氧化锰的质量不再改变,选项说法错误。
故选:A。
4.【解答】解:A、该反应符合“一变多”的特征,属于分解反应,故选项错误;
B、该反应符合“多变一”的特征,属于化合反应,故选项正确;
C、不符合“多变一”的特征,不属于化合反应;故选项错误;
D、不符合“多变一”的特征,不属于化合反应;故选项错误;
故选:B。
5.【解答】解:A、铁丝在氧气中剧烈燃烧,火星四射;该反应生成四氧化三铁,但该反应符合“多变一”的特征,属于化合反应,故选项说法错误;
B、硫磺在氧气中燃烧,该反应生成二氧化硫,但该反应符合“多变一”的特征,属于化合反应,故选项说法错误;
C、镁在氧气中燃烧,该反应生成氧化镁,但该反应符合“多变一”的特征,属于化合反应,故选项说法错误;
D、蜡烛在氧气中燃烧,发出白光;该反应生成二氧化碳和水,该反应的生成物是两种,不符合“多变一”的特征,不属于化合反应,故选项说法正确;
故选:D。
6.【解答】解:A、该反应符合“一变多”的特征,属于分解反应,故选项错误;
B、该反应符合“一变多”的特征,属于分解反应,故选项错误;
C、该反应的生成物是两种,不符合“多变一”的特征,不属于化合反应,故选项错误;
D、该反应符合“多变一”的特征,属于化合反应,故选项正确;
故选:D。
7.【解答】解:A、氢气+氧气水,该反应符合“多变一”的特征,属于化合反应,故选项错误。
B、氢气+氧化铁铁+水,该反应物和生成物均是两种,不符合“多变一”的特征,也不符合“一变多”的特征,既不属于化合反应也不属于分解反应,故选项正确。
C、碳酸→水+二氧化碳,该反应符合“一变多”的特征,属于分解反应,故选项错误。
D、双氧水→水+氧气,该反应符合“一变多”的特征,属于分解反应,故选项错误。
故选:B。
8.【解答】解:A、镁+氧气氧化镁该反应符合“多变一”的形式,符合化合反应的特征,属于化合反应,故选项错误;
B、氧化汞汞+氧气该反应符合“一变多”的形式,符合分解反应的特征,属于分解反应,故选项错误;
C、水氢气+氧气该反应符合“一变多”的形式,符合分解反应的特征,属于分解反应,故选项错误;
D、蜡烛+氧气二氧化碳+水该反应的反应物和生成物均是两种,不符合“一变多”、“多变一”的形式,不属于分解反应、化合反应,故选项正确。
故选:D。
9.【解答】解:A、该反应符合“多变一”的特征,属于化合反应,故选项错误;
B、反应物、生成物都为两种,不符合“一变多”的分解反应特点,错误;
C、该反应符合“多变一”的特征,属于化合反应,故选项错误;
D、该反应符合“一变多”的分解反应特点,正确;
故选:D。
10.【解答】解:①反应前后原子数目不变;
②反应前后分子数目可能改变,也可能不变;
③反应前后元素种类不变;
④反应前后物质种类改变;
⑤反应前后原子种类不变;
⑥反应前后元素的化合价可能改变,也可能不变。
故选:D。
11.【解答】解:由表中数据分析可知,反应前后甲的质量减少了50g﹣16g=34g,故是反应物,参加反应的质量为34g;同理可以确定丙是生成物,生成的质量为26g﹣8g=18g;丁是生成物,生成的质量为16g﹣0g=16g;由质量守恒定律,乙的质量不变,可能作该反应的催化剂,也可能没有参加反应;故m的数值为10.
A、该反应的反应物为甲,生成物是丙和丁,符合“一变多”的形式,属于分解反应,甲是分解反应的反应物,一定是化合物,故选项说法正确.
B、m的数值为10,故选项说法错误。
C、乙的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法正确。
D、该反应的反应物为甲,生成物是丙和丁,符合“一变多”的形式,属于分解反应,故选项说法正确.
故选:B。
12.【解答】解:A、参加反应的化合物的质量为4.4g+2.7g﹣4.8g=2.3g,故选项说法正确.
B、4.4gCO2中含有碳元素的质量为:4.4g××100%=1.2g,2.7g水中含有氢元素的质量为:2.7g××100%=0.3g,生成物4.4g二氧化碳和2.7g水中所含碳、氢元素的质量和=1.2g+0.3g=1.5g,1.5g<2.3g,该物质中含氧元素的质量为:2.3g﹣1.5g=0.8g,则该物质中一定含有碳、氢、氧三种元素,故选项说法正确.
C、该化合物中碳、氧元素质量比为1.2g:0.8g=3:2,故选项说法正确.
D、根据化合物原子的个数比=元素的质量与相对原子质量之比,则该物质分子中碳原子和氢原子的个数比为:=1:3,故选项说法错误.
故选:D。
13.【解答】解:A、从化学方程式“N2+O22NO”可知,反应物有氮气和氧气两种,故选项错误。
B、从化学方程式“N2+O22NO”,无法确定反应速率,故选项正确。
C、从化学方程式“N2+O22NO”可知,反应条件是放电,故选项错误。
D、从化学方程式“N2+O22NO”可知,从微观上,放电条件下,每1个氮分子和1个氧分子反应生成2个一氧化氮分子,反应中反应物的分子个数比是1:1,故选项错误。
故选:B。
14.【解答】解:A、从微观上,点燃条件下,每4个磷原子和5个氧分子反应生成2个五氧化二磷分子,反应前后分子总数减少,故选项说法错误。
B、该反应的反应物是磷和氧气,故选项说法错误。
C、该反应可读作:每124份质量的磷和160份质量的氧气在点燃条件下恰好反应生成284份质量的五氧化二磷,故选项说法错误.
D、该反应可读作:在点燃的条件下,磷和氧气反应生成五氧化二磷,故选项说法正确。
故选:D。
15.【解答】解:A、在反应中“+”读作“和”,“═”读应作“生成”,故选项读法错误.
B、微观上可读作1个二氧化碳分子和1个碳原子生成2个一氧化碳分子,故选项读法错误。
C、二氧化碳和碳在高温的条件下生成一氧化碳,故选项读法正确。
D、每44份质量的二氧化碳和12份质量的碳在高温条件下生成56份质量的一氧化碳,故选项读法错误。
故选:C。
二.填空题(共10小题)
16.【解答】解:实验室采用过氧化氢溶液和二氧化锰的混合物制取氧气,不需要加热,也可以利用氯酸钾和二氧化锰的混合物加热制取氧气,也可单独加热高锰酸钾制取氧气;
故答案为:过氧化氢溶液;二氧化锰;氯酸钾;高锰酸钾。
(1)过氧化氢在二氧化锰催化作用下反应生成水和氧气,书写文字表达式不需要配平和气体符号,所以为过氧化氢水+氧气;
故答案为:过氧化氢水+氧气。
(2)氯酸钾在二氧化锰催化作用下加热反应生成氯化钾和氧气,书写文字表达式不需要配平和气体符号,所以为氯酸钾氯化钾+氧气;
故答案为:氯酸钾氯化钾+氧气。
(3)高锰酸钾在加热条件下反应生成锰酸钾、二氧化锰和氧气,书写文字表达式不需要配平和气体符号,所以为高锰酸钾锰酸钾+二氧化锰+氧气;
故答案为:高锰酸钾锰酸钾+二氧化锰+氧气。
17.【解答】解:(1)汞是由原子直接构成,构成金属汞的微粒可以表示为Hg,测体温时水银体温计中汞柱会上升的微观原因是汞原子之间的间隔变大。
故填:原子;Hg;汞原子之间的间隔变大。
(2)反应前后碳原子都是4个,氢原子都是8个,反应前氧原子是6个,反应后应该是6个,其中2个包含在X中,则X的化学式为O2;
用于手部消毒的酒精溶液要远离火源,说明酒精具有可燃性。
故填:O2;可燃。
(3)学校给同学们定制了高钙牛奶,这里的“钙“指钙元素。
故填:C。
18.【解答】解:(1)玻璃管的作用是导热来让红磷在密闭体系中点燃,达到着火点,减少误差;化学方程式是:4P+5O22P2O5;
(2)稀盐酸与碳酸钠粉末反应生成氯化钠、水、二氧化碳,而烧杯是敞开的,所以生成的二氧化碳逸散到空气中使质量减小,故反应过程中实验现象为天平指针向右偏转;
(3)镁条在空气中剧烈燃烧,产生大量白烟,其实是生成的氧化镁部分散失到空气中,而镁的相对原子质量是24,氧的相对原子质量是16,故反应结束,将所得物质与石棉网一起再次称量,镁条的质量减少。
故答案为:(1)导热来让红磷在密闭体系中点燃;4P+5O22P2O5;
(2)天平指针向右偏转;
(3)镁条在燃烧时产生大量的白烟,其实是生成的氧化镁部分散失到空气中。
19.【解答】解:(1)其中不能达到目的的实验是B,是因为反应生成的二氧化碳逸出装置。
故填:B。
(2)图A中白磷燃烧的现象是白磷燃烧,产生白烟、放出热量,燃烧后恢复至室温后测量,若发现天平指针偏右,则造成的原因可能是装置漏气等。
故填:白磷燃烧,产生白烟;装置漏气等。
(3)图C中铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=Cu+FeSO4。
故填:Fe+CuSO4=Cu+FeSO4。
(4)由上述实验可知,在化学反应前后,一定不变的是原子种类、原子数目、物质总质量。
故填:①②⑤。
20.【解答】解:由质量守恒定律,反应前后元素种类不变,该物质中一定含有碳元素和氢元素。
8.8gCO2中含有氧元素的质量为:8.8g×=6.4g,5.4gH2O中含有氧元素的质量为:5.4g×=4.8g,生成物8.8g二氧化碳和5.4g水中所含氧元素的质量和=6.4g+4.8g=11.2g,11.2g>9.6g;该物质中含氧元素的质量为:11.2g﹣9.6g=1.6g,则该物质中一定含有碳、氢、氧三种元素。
故填:碳、氢、氧三种。
21.【解答】解:(1)水通直流电电解一会儿后,在负极上产生的气体是H2。
故填:H2。
(2)相对分子质量最小的氧化物是H2O。
故填:H2O。
(3)反应前碳原子是1个,反应后应该是1个,包含在X中,反应前后氢原子都是4个,反应前氧原子是4个,反应后应该是4个,其中2个包含在X中,则X的化学式为CO2。
故填:CO2。
22.【解答】解:(1)镁带燃烧生成氧化镁,反应的化学方程式为:2Mg+O22MgO。
(2)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为3Fe+2O2Fe3O4。
(3)天然气的主要成分是甲烷,甲烷在点燃条件下燃烧生成二氧化碳和水,反应的化学方程式为CH4+2O2CO2+2H2O.
故答案为:
(1)2Mg+O22MgO;
(2)3Fe+2O2Fe3O4;
(3)CH4+2O2CO2+2H2O。
23.【解答】解:(1)红磷在空气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O22P2O5。
(2)镁条在氧气中燃烧生成氧化镁,反应的化学方程式为:2Mg+O22MgO.
(3)实验室加热黑白固体混合物制氧气,采用的是加热氯酸钾和二氧化锰混合物的方法,反应的化学方程式为:2KClO32KCl+3O2↑。
(4)碳和氧化铜在高温条件下反应生成铜和二氧化碳,反应的化学方程式为:C+2CuO2Cu+CO2↑。
故答案为:
(1)4P+5O22P2O5;
(2)2Mg+O22MgO;
(3)2KClO32KCl+3O2↑;
(4)C+2CuO2Cu+CO2↑。
24.【解答】解:(1)过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的符号表达式为:H2O2H2O+O2.
(2)氢气在氧气中燃烧生成水,是有H2O生成的化合反应,反应的符号表达式为:H2+O2H2O。
(3)水通电分解生成氢气和氧气,反应的符号表达式为:H2OH2+O2。
故答案为:
(1)H2O2H2O+O2;
(2)H2+O2H2O;
(3)H2OH2+O2。
25.【解答】解:设氧气的质量为x。
2H2+O22H2O
4 32
4g x
=
解得:x=32g.
故答案为:32。
三.解答题(共5小题)
26.【解答】解:(1)纸在空中燃烧后化为灰烬,灰烬的质量比纸的质量小,是因为纸张燃烧生成的水和二氧化碳扩散到空气中。
故填:小。
(2)植物的光合作用可表示为:二氧化碳+水淀粉+氧气。
根据以上信息可确定,二氧化碳中的碳元素和水中的氢元素转化到淀粉中,因此淀粉中一定含有的元素是氢元素和碳元素,依据是在化学反应前后元素种类不变。
故填:H、C;元素种类。
(3)15.8g高锰酸钾中含有氧元素的质量为6.4g,则加热15.8g高锰酸钾至完全分解,理论上可以得到氧气的质量小于6.4g,是因为高锰酸钾中的氧元素转化到锰酸钾、二氧化锰和氧气中。
故填:小于。
27.【解答】解:(1)实验Ⅰ中气球的主要作用是缓冲,防止瓶塞飞出,红磷燃烧生成五氧化二磷,反应的化学方程式:4P+5O22P2O5。
故填:缓冲,防止瓶塞飞出;4P+5O22P2O5。
(2)该反应遵守质量守恒定律。反应后天平向右偏转的原因:反应产生的气体逸散到了空气中。
故填:遵守;反应产生的气体逸散到了空气中。
28.【解答】解:(1)水在通电条件下分解生成氢气和氧气,反应的文字表达式为:水氢气+氧气。
(2)镁在空气中燃烧生成氧化镁,反应的文字表达式为:镁+氧气氧化镁。
故答案为:
(1)水氢气+氧气;
(2)镁+氧气氧化镁。
29.【解答】解:(1)在点燃的条件下,铁与氧气反应生成四氧化三铁,符号表达式为:Fe+O2Fe3O4;故填:Fe+O2Fe3O4;
(2)在点燃的条件下,镁与氧气反应生成氧化镁,符号表达式为:Mg+O2MgO,查阅资料,发现镁条也可以在氮气中燃烧,生成氮化镁(其中氮元素化合价为﹣3),反应符号表达式为:Mg+N2Mg3N2;实验室用燃烧红磷来测定空气中氧气的体积分数,在点燃的条件下,磷与氧气反应生成五氧化二磷,反应的符号表达式为:P+O2P2O5,由于镁能与空气中氮气反应,所以若用镁条替代红磷燃烧测定空气中氧气的体积分数,会导致进入的水体积多于五分之一;故填:Mg+O2MgO;Mg+N2Mg3N2;P+O2P2O5;>;
(3)由质量守恒定律可知,铁在高温下和水发生反应,表面生成四氧化三铁和一种可燃性气体﹣﹣氢气,符号表达式为:Fe+H2OFe3O4+H2;故填:Fe+H2OFe3O4+H2。
30.【解答】解:(1)分液漏斗能控制加入液体的量,实验时,为了能够持续地小流量地产生氢气,实验时应该小流量连续缓慢把稀硫酸加入锥形瓶,应该更换图中的仪器是:将长颈漏斗更换成分液漏斗。
(2)8克氧化铜完全反应能生成单质铜的质量为:8g×=6.4g
答:8克氧化铜完全反应能生成6.4克单质铜;
(3)根据Zn+H2SO4=ZnSO4+H2↑和CuO+H2H2O+Cu
可得关系式:Zn﹣﹣﹣﹣﹣﹣﹣﹣﹣Cu
65 64
氢气是先通后停且有部分残留在装置内没有参与反应,所以消耗的锌大于6.5g。
故答案为:(1)将长颈漏斗更换成分液漏斗;
(2)6.4g;
(3)氢气是先通后停且有部分残留在装置内没有参与反应,所以消耗的锌大于6.5g。
一.选择题(共15小题)
1.小强同学在用氯酸钾制取氧气时,误把高锰酸钾当作二氧化锰加入了。下列对该实验的分析不正确的是( )
A.生成氧气的速度加快了
B.产生的氧气质量增加了
C.反应中高锰酸钾起催化作用
D.反应过程中,试管中的固体种类最多5种,最少3种
2.某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如图所示,下列关于该过程的说法错误的是( )
A.t1时刻,O2开始产生
B.b曲线表示KMnO4分解
C.KMnO4在该反应中起催化作用
D.c曲线代表氯化钾
3.某同学误将少量高锰酸钾当成二氧化锰加入氯酸钾中进行加热制取氧气,部分物质质量随时间变化的关系如图所示(已知物质发生化学反应时,反应物质量会减少,生成物质量会增加),下列关于该过程的说法正确的是( )
A.t2时刻,氯酸钾开始分解
B.t2时刻,氧气开始产生
C.c代表生成的所有氧气的质量
D.二氧化锰的质量一直保持不变
4.下列四个化学反应中属于化合反应的是( )
A.碳酸→二氧化碳+水
B.铁+氧气四氧化三铁
C.酒精+氧气二氧化碳+水
D.碳酸钙+盐酸→二氧化碳+水+氯化钙
5.下列物质在氧气中燃烧,其反应基本类型不是化合反应的是( )
A.铁丝 B.硫磺 C.镁条 D.蜡烛
6.下列反应中属于化合反应的是( )
A.氧化汞汞+氧气
B.水氢气+氧气
C.酒精+氧气二氧化碳+水
D.汞+氧气氧化汞
7.下列反应既不属于分解反应,也不属于化合反应的是( )
A.氢气+氧气水
B.氢气+氧化铁铁+水
C.碳酸→水+二氧化碳
D.双氧水→水+氧气
8.下列反应既不属于分解反应,也不属于化合反应的是( )
A.镁+氧气氧化镁
B.氧化汞汞+氧气
C.水氢气+氧气
D.蜡烛+氧气二氧化碳+水
9.下列化学反应属于分解反应的是( )
A.氢气+氧气水
B.蜡烛+氧气二氧化碳+水
C.硫+氧气二氧化硫
D.氯酸钾氯化钾+氧气
10.在化学反应前后,下列各项中肯定没有变化的是( )
①原子数目②分子数目③元素种类④物质种类⑤原子种类⑥元素的化合价
A.①④⑥ B.①②③⑤⑥ C.①②⑥ D.①③⑤
11.甲、乙、丙、丁四种物质,它们在密闭容器中反应前后质量的变化关系如下表所示。则下列说法错误的( )
物质名称 甲 乙 丙 丁
反应前质量/g 50 10 8 0
反应后质量/g 16 m 26 16
A.甲是化合物
B.m=38
C.乙可能是这个反应的催化剂
D.此反应基本类型为分解反应
12.某化合物在4.8g氧气中完全燃烧,生成了4.4g二氧化碳和2.7g水。关于该物质的推断中不正确的是( )
A.该化合物的质量为2.3g
B.该化合物中一定含碳、氢、氧三种元素
C.该化合物中碳、氧元素质量比为3:2
D.分子中C、H原子个数比为1:2
13.从化学方程式“N2+O2 2NO”中不能获得的信息是( )
A.反应物有两种
B.反应速率很快
C.反应条件是放电
D.反应中反应物的分子个数比是1:1
14.关于化学方程式4P+5O22P2O5的理解,正确的是( )
A.反应前后分子总数保持不变
B.该反应的反应物是五氧化二磷
C.每31份质量的磷与32份质量的氧气完全反应,生成142份质量的五氧化二磷
D.在点燃的条件下,磷和氧气反应生成五氧化二磷
15.关于化学方程式CO2+C2CO的叙述中,正确的是( )
A.二氧化碳和碳等于一氧化碳
B.1个二氧化碳分子和1个碳原子生成2个一氧化碳
C.二氧化碳和碳在高温的条件下生成一氧化碳
D.每44份质量的二氧化碳和12份质量的碳在高温条件下生成86份质量的一氧化碳
二.填空题(共10小题)
16.实验室常用 和 混合的方法制取氧气,或用加热 和二氧化锰的混合物制取氧气,或用加热 的方法制取氧气。
请写出这三个反应的文字表达式:
(1) ;
(2) ;
(3) 。
17.复学防疫,化学助力。
(1)测量体温是防控的重要环节。家庭常备体温计中的液态物质是汞。汞是由 (选填“分子”“原子”“离子”)直接构成,用符号表示构成金属汞的微粒 。测体温时水银体温计中汞柱会上升的微观原因是 。
(2)到校后,勤消毒。过氧乙酸用于教室消毒,其化学性质不稳定,分解的化学方程式为:2C2H4O3═2C2H4O2+X↑,则X的化学式为 。用于手部消毒的酒精溶液要远离火源,说明酒精具有 性(写出其相应的化学性质)。
(3)用餐时,讲营养。学校给同学们定制了高钙牛奶,这里的“钙“指 (填序号)。
A、钙离子
B、钙原子
C、钙元素
D、钙单质
18.同学们为了验证质量守恒定律,进行了如图实验:
(1)甲实验玻璃管的作用是 ,化学方程式为 。
(2)实验乙反应前天平平衡,反应过程中实验现象为 。
(3)实验丙中,称量镁条和石棉网的质量后,点燃镁条,观察到镁条剧烈燃烧,产生大量白烟,反应结束,将所得物质与石棉网一起再次称量,发现质量减轻了,其原因是 。
19.(1)如图,A、B、C三个实验用于验证质量守恒定律,其中不能达到目的的实验是 ;
(2)图A中白磷燃烧的现象是 、放出热量。燃烧后恢复至室温后测量,若发现天平指针偏右,则造成的原因可能是 ;
(3)图C中反应的化学方程式为 ;
(4)由上述实验可知,在化学反应前后,一定不变的是 (填数字序号)。
①原子种类
②原子数目
③分子种类
④分子数目
⑤物质总质量
20.某物质在9.6g氧气中恰好完全燃烧,生成8.8g CO2和5.4g H2O,则该物质中一定含有 元素。
21.(1)水通直流电电解一会儿后,在负极上产生的气体是 (填化学式)。
(2)氧化物是由两种元素组成,其中一种是氧元素的化合物,相对分子质量最小的氧化物是 。
(3)甲烷在空气中完全燃烧,反应的化学方程式为CH4+2O2X+2H2O,则X的化学式为 。
22.写出下列反应的反应方程式。
(1)镁带燃烧: ;
(2)铁丝在氧气中燃烧: ;
(3)天然气燃烧: 。
23.请写出下列化学反应方程式。
(1)红磷在空气中燃烧 ;
(2)镁条在氧气中燃烧 ;
(3)实验室加热黑白固体混合物制氧气 ;
(4)碳和氧化铜在高温条件下反应生成铜和二氧化碳 。
24.按要求写出下列反应的符号表达式:(任举一例)
(1)有H2O生成的分解反应 ;
(2)有H2O生成的化合反应 ;
(3)H2O的分解反应 。
25.4g氢气可与 g氧气完全反应生成水。
三.解答题(共5小题)
26.质量守恒定律的发现是化学发展史上的一个重要里程碑,请用相关知识回答问题。
(1)纸在空中燃烧后化为灰烬,灰烬的质量比纸的质量 ;
(2)植物的光合作用可表示为:二氧化碳+水淀粉+氧气。根据以上信息可确定淀粉中一定含有的元素是 (填写元素符号),依据是在化学反应前后 不变;
(3)15.8g高锰酸钾中含有氧元素的质量为6.4g,则加热15.8g高锰酸钾至完全分解,理论上可以得到氧气的质量 (选填“大于”、“等于”或“小于”)6.4g。
27.在验证质量守恒定律时,某同学设计了如图所示的两个实验,请根据质量守恒定律回答下列问题。
(1)实验Ⅰ中气球的主要作用是什么? ,写出红磷燃烧的化学方程式 。
(2)实验Ⅱ中,反应前天平平衡,将稀盐酸倒入烧杯中和碳酸钠充分反应后,观察到天平指针向右偏转。该反应 (选填“遵守”或“不遵守”)质量守恒定律。请解释反应后天平向右偏转的原因 。
28.写出下列反应的文字表达式。
(1)电解水制取氧气和氢气 。
(2)镁在空气中燃烧 。
29.按要求回答问题。
(1)铁丝在氧气中燃烧符号表达式 。
(2)镁在空气中燃烧符号表达式 ,查阅资料,发现镁条也可以在氮气中燃烧,生成氮化镁(其中氮元素化合价为﹣3),请写出反应符号表达式 ;实验室用燃烧红磷来测定空气中氧气的体积分数,请写出反应符号表达式 ,若用镁条替代红磷燃烧测定空气中氧气的体积分数,会导致进入的水体积 (选填“>”、“=”、“<”)五分之一。
(3)古代宝剑“淬火”,将烧的红热的宝剑迅速伸入水中,可以听到“呲呲”声,观察到宝剑表面变暗,涉及原理:铁在高温下和水发生反应,表面生成四氧化三铁和一种可燃性气体。请写出宝剑“淬火”主要的反应符号表达式 。
30.现有10g锌、8g氧化铜和足量的稀硫酸,小明想用这些锌和氧化铜为原料来制取铜单质,他采用了如图所示的流程图和实验装置(如图):
ZnH2Cu
(1)实验时,为了能够持续地小流量地产生氢气,图中的仪器应该如何进行更换? 。
(2)若8克氧化铜完全反应,试计算能生成多少克单质铜?
(3)按照规范操作要求完成实验后,小明发现10g锌全部用完后,试管中仍然存在少量黑色固体。但他根据化学方程式计算得出:使8g氧化铜完全反应,只需要消耗6.5g锌粒制取的氢气。请你帮助解释原因: 。
华东师大版九年级上学期《第一章 化学反应》最热同步卷
参考答案与试题解析
一.选择题(共15小题)
1.【解答】解:高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰和氧气,生成的二氧化锰作为氯酸钾反应的催化剂,加快了化学反应速率;生成氧气的质量与单纯加热氯酸钾相比,质量增加;在反应过程中,当氯酸钾和高锰酸钾都是部分反应时,试管中的固体种类最多,有高锰酸钾、锰酸钾、二氧化锰、氯酸钾和氯化钾五种物质,当反应物都全部反应时,试管中的固体种类最少,有锰酸钾、二氧化锰和氯化钾三种物质。观察选项,可知答案C不正确。
故选:C。
2.【解答】解:根据题干所给信息可知,b物质的质量先减少,所以b是高锰酸钾,a的质量后减少,所以a是氯酸钾,在t1时刻高锰酸钾开始分解,有氧气生成,随着高锰酸钾的分解,二氧化锰的质量也在不断的增加,氯酸钾在二氧化锰的催化作用下分解产生氧气和氯化钾。
A.t1时刻,高锰酸钾分解,O2开始产生,选项说法正确;
B.高锰酸钾首先受热分解产生氧气,所以b曲线表示KMnO4分解,选项说法正确;
C.高锰酸钾分解产生的二氧化锰是氯酸钾分解的催化剂,而不是高锰酸钾充当催化剂,选项说法错误;
D.氯酸钾在二氧化锰的催化作用下,受热分解产生氯化钾和氧气,所以c曲线表示氯化钾,选项说法正确。
故选:C。
故选:C。
3.【解答】解:高锰酸钾加热到较低温度时就可以分解产生氧气、锰酸钾和二氧化锰;氯酸钾在二氧化锰的催化作用下、加热到一定温度时分解产生氧气和氯化钾。
A.某同学误将少量高锰酸钾当成二氧化锰加入氯酸钾中进行加热制取氧气,由b的质量较少,则b是高锰酸钾,a是氯酸钾,t2时刻,氯酸钾开始分解,选项说法正确;
B.高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,t1时刻,氧气开始产生,选项说法错误;
C.c代表氯酸钾分解产生的氧气,而不包括高锰酸钾分解产生的氧气,选项说法错误;
D.该反应中的二氧化锰是高锰酸钾分解的产物,在高锰酸钾反应前,二氧化锰的质量为零,随着高锰酸钾的分解,二氧化锰的质量增加,当高锰酸钾完全分解后,二氧化锰的质量不再改变,选项说法错误。
故选:A。
4.【解答】解:A、该反应符合“一变多”的特征,属于分解反应,故选项错误;
B、该反应符合“多变一”的特征,属于化合反应,故选项正确;
C、不符合“多变一”的特征,不属于化合反应;故选项错误;
D、不符合“多变一”的特征,不属于化合反应;故选项错误;
故选:B。
5.【解答】解:A、铁丝在氧气中剧烈燃烧,火星四射;该反应生成四氧化三铁,但该反应符合“多变一”的特征,属于化合反应,故选项说法错误;
B、硫磺在氧气中燃烧,该反应生成二氧化硫,但该反应符合“多变一”的特征,属于化合反应,故选项说法错误;
C、镁在氧气中燃烧,该反应生成氧化镁,但该反应符合“多变一”的特征,属于化合反应,故选项说法错误;
D、蜡烛在氧气中燃烧,发出白光;该反应生成二氧化碳和水,该反应的生成物是两种,不符合“多变一”的特征,不属于化合反应,故选项说法正确;
故选:D。
6.【解答】解:A、该反应符合“一变多”的特征,属于分解反应,故选项错误;
B、该反应符合“一变多”的特征,属于分解反应,故选项错误;
C、该反应的生成物是两种,不符合“多变一”的特征,不属于化合反应,故选项错误;
D、该反应符合“多变一”的特征,属于化合反应,故选项正确;
故选:D。
7.【解答】解:A、氢气+氧气水,该反应符合“多变一”的特征,属于化合反应,故选项错误。
B、氢气+氧化铁铁+水,该反应物和生成物均是两种,不符合“多变一”的特征,也不符合“一变多”的特征,既不属于化合反应也不属于分解反应,故选项正确。
C、碳酸→水+二氧化碳,该反应符合“一变多”的特征,属于分解反应,故选项错误。
D、双氧水→水+氧气,该反应符合“一变多”的特征,属于分解反应,故选项错误。
故选:B。
8.【解答】解:A、镁+氧气氧化镁该反应符合“多变一”的形式,符合化合反应的特征,属于化合反应,故选项错误;
B、氧化汞汞+氧气该反应符合“一变多”的形式,符合分解反应的特征,属于分解反应,故选项错误;
C、水氢气+氧气该反应符合“一变多”的形式,符合分解反应的特征,属于分解反应,故选项错误;
D、蜡烛+氧气二氧化碳+水该反应的反应物和生成物均是两种,不符合“一变多”、“多变一”的形式,不属于分解反应、化合反应,故选项正确。
故选:D。
9.【解答】解:A、该反应符合“多变一”的特征,属于化合反应,故选项错误;
B、反应物、生成物都为两种,不符合“一变多”的分解反应特点,错误;
C、该反应符合“多变一”的特征,属于化合反应,故选项错误;
D、该反应符合“一变多”的分解反应特点,正确;
故选:D。
10.【解答】解:①反应前后原子数目不变;
②反应前后分子数目可能改变,也可能不变;
③反应前后元素种类不变;
④反应前后物质种类改变;
⑤反应前后原子种类不变;
⑥反应前后元素的化合价可能改变,也可能不变。
故选:D。
11.【解答】解:由表中数据分析可知,反应前后甲的质量减少了50g﹣16g=34g,故是反应物,参加反应的质量为34g;同理可以确定丙是生成物,生成的质量为26g﹣8g=18g;丁是生成物,生成的质量为16g﹣0g=16g;由质量守恒定律,乙的质量不变,可能作该反应的催化剂,也可能没有参加反应;故m的数值为10.
A、该反应的反应物为甲,生成物是丙和丁,符合“一变多”的形式,属于分解反应,甲是分解反应的反应物,一定是化合物,故选项说法正确.
B、m的数值为10,故选项说法错误。
C、乙的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法正确。
D、该反应的反应物为甲,生成物是丙和丁,符合“一变多”的形式,属于分解反应,故选项说法正确.
故选:B。
12.【解答】解:A、参加反应的化合物的质量为4.4g+2.7g﹣4.8g=2.3g,故选项说法正确.
B、4.4gCO2中含有碳元素的质量为:4.4g××100%=1.2g,2.7g水中含有氢元素的质量为:2.7g××100%=0.3g,生成物4.4g二氧化碳和2.7g水中所含碳、氢元素的质量和=1.2g+0.3g=1.5g,1.5g<2.3g,该物质中含氧元素的质量为:2.3g﹣1.5g=0.8g,则该物质中一定含有碳、氢、氧三种元素,故选项说法正确.
C、该化合物中碳、氧元素质量比为1.2g:0.8g=3:2,故选项说法正确.
D、根据化合物原子的个数比=元素的质量与相对原子质量之比,则该物质分子中碳原子和氢原子的个数比为:=1:3,故选项说法错误.
故选:D。
13.【解答】解:A、从化学方程式“N2+O22NO”可知,反应物有氮气和氧气两种,故选项错误。
B、从化学方程式“N2+O22NO”,无法确定反应速率,故选项正确。
C、从化学方程式“N2+O22NO”可知,反应条件是放电,故选项错误。
D、从化学方程式“N2+O22NO”可知,从微观上,放电条件下,每1个氮分子和1个氧分子反应生成2个一氧化氮分子,反应中反应物的分子个数比是1:1,故选项错误。
故选:B。
14.【解答】解:A、从微观上,点燃条件下,每4个磷原子和5个氧分子反应生成2个五氧化二磷分子,反应前后分子总数减少,故选项说法错误。
B、该反应的反应物是磷和氧气,故选项说法错误。
C、该反应可读作:每124份质量的磷和160份质量的氧气在点燃条件下恰好反应生成284份质量的五氧化二磷,故选项说法错误.
D、该反应可读作:在点燃的条件下,磷和氧气反应生成五氧化二磷,故选项说法正确。
故选:D。
15.【解答】解:A、在反应中“+”读作“和”,“═”读应作“生成”,故选项读法错误.
B、微观上可读作1个二氧化碳分子和1个碳原子生成2个一氧化碳分子,故选项读法错误。
C、二氧化碳和碳在高温的条件下生成一氧化碳,故选项读法正确。
D、每44份质量的二氧化碳和12份质量的碳在高温条件下生成56份质量的一氧化碳,故选项读法错误。
故选:C。
二.填空题(共10小题)
16.【解答】解:实验室采用过氧化氢溶液和二氧化锰的混合物制取氧气,不需要加热,也可以利用氯酸钾和二氧化锰的混合物加热制取氧气,也可单独加热高锰酸钾制取氧气;
故答案为:过氧化氢溶液;二氧化锰;氯酸钾;高锰酸钾。
(1)过氧化氢在二氧化锰催化作用下反应生成水和氧气,书写文字表达式不需要配平和气体符号,所以为过氧化氢水+氧气;
故答案为:过氧化氢水+氧气。
(2)氯酸钾在二氧化锰催化作用下加热反应生成氯化钾和氧气,书写文字表达式不需要配平和气体符号,所以为氯酸钾氯化钾+氧气;
故答案为:氯酸钾氯化钾+氧气。
(3)高锰酸钾在加热条件下反应生成锰酸钾、二氧化锰和氧气,书写文字表达式不需要配平和气体符号,所以为高锰酸钾锰酸钾+二氧化锰+氧气;
故答案为:高锰酸钾锰酸钾+二氧化锰+氧气。
17.【解答】解:(1)汞是由原子直接构成,构成金属汞的微粒可以表示为Hg,测体温时水银体温计中汞柱会上升的微观原因是汞原子之间的间隔变大。
故填:原子;Hg;汞原子之间的间隔变大。
(2)反应前后碳原子都是4个,氢原子都是8个,反应前氧原子是6个,反应后应该是6个,其中2个包含在X中,则X的化学式为O2;
用于手部消毒的酒精溶液要远离火源,说明酒精具有可燃性。
故填:O2;可燃。
(3)学校给同学们定制了高钙牛奶,这里的“钙“指钙元素。
故填:C。
18.【解答】解:(1)玻璃管的作用是导热来让红磷在密闭体系中点燃,达到着火点,减少误差;化学方程式是:4P+5O22P2O5;
(2)稀盐酸与碳酸钠粉末反应生成氯化钠、水、二氧化碳,而烧杯是敞开的,所以生成的二氧化碳逸散到空气中使质量减小,故反应过程中实验现象为天平指针向右偏转;
(3)镁条在空气中剧烈燃烧,产生大量白烟,其实是生成的氧化镁部分散失到空气中,而镁的相对原子质量是24,氧的相对原子质量是16,故反应结束,将所得物质与石棉网一起再次称量,镁条的质量减少。
故答案为:(1)导热来让红磷在密闭体系中点燃;4P+5O22P2O5;
(2)天平指针向右偏转;
(3)镁条在燃烧时产生大量的白烟,其实是生成的氧化镁部分散失到空气中。
19.【解答】解:(1)其中不能达到目的的实验是B,是因为反应生成的二氧化碳逸出装置。
故填:B。
(2)图A中白磷燃烧的现象是白磷燃烧,产生白烟、放出热量,燃烧后恢复至室温后测量,若发现天平指针偏右,则造成的原因可能是装置漏气等。
故填:白磷燃烧,产生白烟;装置漏气等。
(3)图C中铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=Cu+FeSO4。
故填:Fe+CuSO4=Cu+FeSO4。
(4)由上述实验可知,在化学反应前后,一定不变的是原子种类、原子数目、物质总质量。
故填:①②⑤。
20.【解答】解:由质量守恒定律,反应前后元素种类不变,该物质中一定含有碳元素和氢元素。
8.8gCO2中含有氧元素的质量为:8.8g×=6.4g,5.4gH2O中含有氧元素的质量为:5.4g×=4.8g,生成物8.8g二氧化碳和5.4g水中所含氧元素的质量和=6.4g+4.8g=11.2g,11.2g>9.6g;该物质中含氧元素的质量为:11.2g﹣9.6g=1.6g,则该物质中一定含有碳、氢、氧三种元素。
故填:碳、氢、氧三种。
21.【解答】解:(1)水通直流电电解一会儿后,在负极上产生的气体是H2。
故填:H2。
(2)相对分子质量最小的氧化物是H2O。
故填:H2O。
(3)反应前碳原子是1个,反应后应该是1个,包含在X中,反应前后氢原子都是4个,反应前氧原子是4个,反应后应该是4个,其中2个包含在X中,则X的化学式为CO2。
故填:CO2。
22.【解答】解:(1)镁带燃烧生成氧化镁,反应的化学方程式为:2Mg+O22MgO。
(2)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为3Fe+2O2Fe3O4。
(3)天然气的主要成分是甲烷,甲烷在点燃条件下燃烧生成二氧化碳和水,反应的化学方程式为CH4+2O2CO2+2H2O.
故答案为:
(1)2Mg+O22MgO;
(2)3Fe+2O2Fe3O4;
(3)CH4+2O2CO2+2H2O。
23.【解答】解:(1)红磷在空气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O22P2O5。
(2)镁条在氧气中燃烧生成氧化镁,反应的化学方程式为:2Mg+O22MgO.
(3)实验室加热黑白固体混合物制氧气,采用的是加热氯酸钾和二氧化锰混合物的方法,反应的化学方程式为:2KClO32KCl+3O2↑。
(4)碳和氧化铜在高温条件下反应生成铜和二氧化碳,反应的化学方程式为:C+2CuO2Cu+CO2↑。
故答案为:
(1)4P+5O22P2O5;
(2)2Mg+O22MgO;
(3)2KClO32KCl+3O2↑;
(4)C+2CuO2Cu+CO2↑。
24.【解答】解:(1)过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的符号表达式为:H2O2H2O+O2.
(2)氢气在氧气中燃烧生成水,是有H2O生成的化合反应,反应的符号表达式为:H2+O2H2O。
(3)水通电分解生成氢气和氧气,反应的符号表达式为:H2OH2+O2。
故答案为:
(1)H2O2H2O+O2;
(2)H2+O2H2O;
(3)H2OH2+O2。
25.【解答】解:设氧气的质量为x。
2H2+O22H2O
4 32
4g x
=
解得:x=32g.
故答案为:32。
三.解答题(共5小题)
26.【解答】解:(1)纸在空中燃烧后化为灰烬,灰烬的质量比纸的质量小,是因为纸张燃烧生成的水和二氧化碳扩散到空气中。
故填:小。
(2)植物的光合作用可表示为:二氧化碳+水淀粉+氧气。
根据以上信息可确定,二氧化碳中的碳元素和水中的氢元素转化到淀粉中,因此淀粉中一定含有的元素是氢元素和碳元素,依据是在化学反应前后元素种类不变。
故填:H、C;元素种类。
(3)15.8g高锰酸钾中含有氧元素的质量为6.4g,则加热15.8g高锰酸钾至完全分解,理论上可以得到氧气的质量小于6.4g,是因为高锰酸钾中的氧元素转化到锰酸钾、二氧化锰和氧气中。
故填:小于。
27.【解答】解:(1)实验Ⅰ中气球的主要作用是缓冲,防止瓶塞飞出,红磷燃烧生成五氧化二磷,反应的化学方程式:4P+5O22P2O5。
故填:缓冲,防止瓶塞飞出;4P+5O22P2O5。
(2)该反应遵守质量守恒定律。反应后天平向右偏转的原因:反应产生的气体逸散到了空气中。
故填:遵守;反应产生的气体逸散到了空气中。
28.【解答】解:(1)水在通电条件下分解生成氢气和氧气,反应的文字表达式为:水氢气+氧气。
(2)镁在空气中燃烧生成氧化镁,反应的文字表达式为:镁+氧气氧化镁。
故答案为:
(1)水氢气+氧气;
(2)镁+氧气氧化镁。
29.【解答】解:(1)在点燃的条件下,铁与氧气反应生成四氧化三铁,符号表达式为:Fe+O2Fe3O4;故填:Fe+O2Fe3O4;
(2)在点燃的条件下,镁与氧气反应生成氧化镁,符号表达式为:Mg+O2MgO,查阅资料,发现镁条也可以在氮气中燃烧,生成氮化镁(其中氮元素化合价为﹣3),反应符号表达式为:Mg+N2Mg3N2;实验室用燃烧红磷来测定空气中氧气的体积分数,在点燃的条件下,磷与氧气反应生成五氧化二磷,反应的符号表达式为:P+O2P2O5,由于镁能与空气中氮气反应,所以若用镁条替代红磷燃烧测定空气中氧气的体积分数,会导致进入的水体积多于五分之一;故填:Mg+O2MgO;Mg+N2Mg3N2;P+O2P2O5;>;
(3)由质量守恒定律可知,铁在高温下和水发生反应,表面生成四氧化三铁和一种可燃性气体﹣﹣氢气,符号表达式为:Fe+H2OFe3O4+H2;故填:Fe+H2OFe3O4+H2。
30.【解答】解:(1)分液漏斗能控制加入液体的量,实验时,为了能够持续地小流量地产生氢气,实验时应该小流量连续缓慢把稀硫酸加入锥形瓶,应该更换图中的仪器是:将长颈漏斗更换成分液漏斗。
(2)8克氧化铜完全反应能生成单质铜的质量为:8g×=6.4g
答:8克氧化铜完全反应能生成6.4克单质铜;
(3)根据Zn+H2SO4=ZnSO4+H2↑和CuO+H2H2O+Cu
可得关系式:Zn﹣﹣﹣﹣﹣﹣﹣﹣﹣Cu
65 64
氢气是先通后停且有部分残留在装置内没有参与反应,所以消耗的锌大于6.5g。
故答案为:(1)将长颈漏斗更换成分液漏斗;
(2)6.4g;
(3)氢气是先通后停且有部分残留在装置内没有参与反应,所以消耗的锌大于6.5g。
