第2章 酸与碱 真题同步卷 单元练习(含答案)
文档属性
| 名称 | 第2章 酸与碱 真题同步卷 单元练习(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 150.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-18 09:05:13 | ||
图片预览


文档简介
华东师大版九年级上学期《第二章 酸与碱》真题同步卷
一.选择题(共10小题)
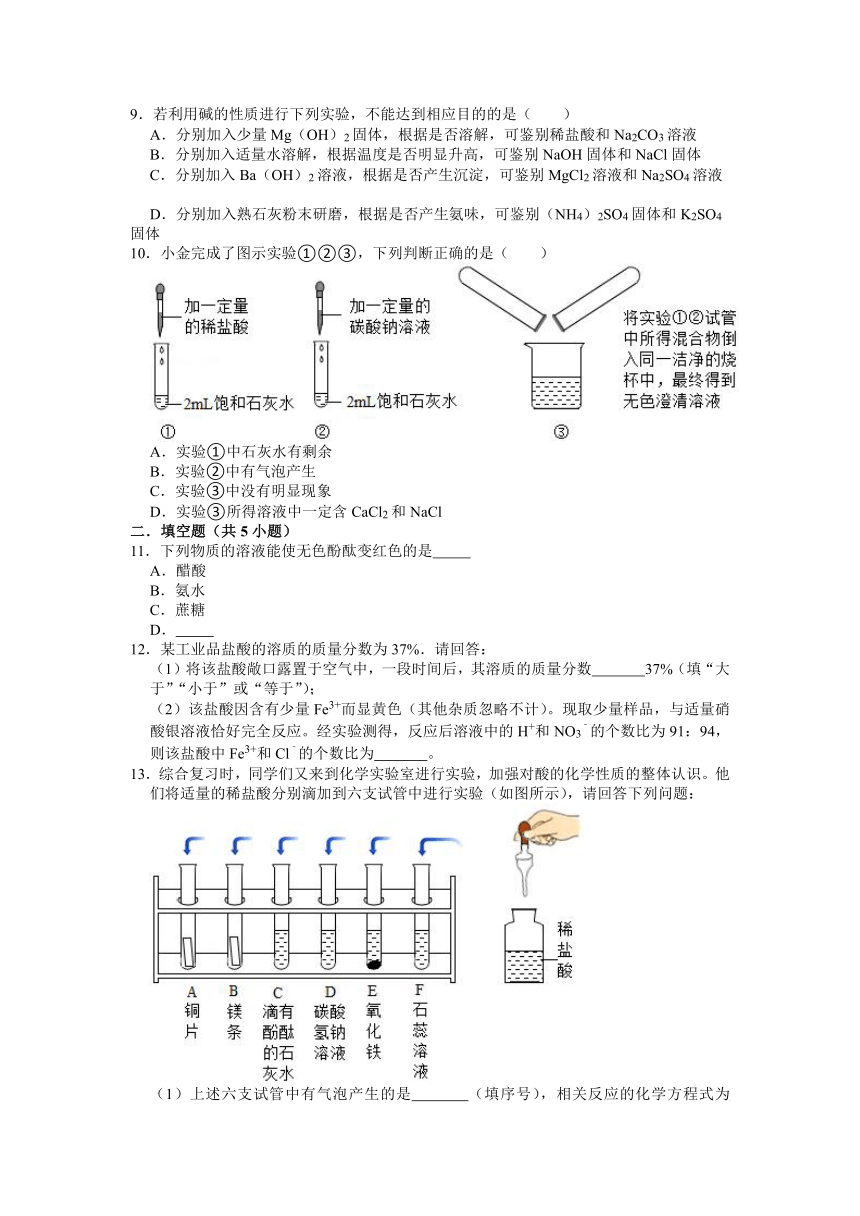
1.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y.先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
2.某物质能使紫色石蕊溶液变为蓝色,关于该物质的下列说法中正确的是( )
A.该物质可能是氢氧化铜
B.该物质一定是纯碱的水溶液
C.可以将pH试纸放入该物质的稀溶液中测其pH
D.向该物质的水溶液中滴加稀盐酸,溶液的pH一定变小
3.下列关于实验现象的描述中,正确的是( )
A.打开盛有浓盐酸的试剂瓶,在瓶口观察到白烟
B.硫在氧气中燃烧,产生蓝紫色的火焰
C.木炭在高温下还原氧化铜,固体由红色逐渐变黑
D.镁条在空气中燃烧会发出耀眼的白光,生成黑色固体
4.下列关于浓硫酸的说法正确的是( )
A.易挥发 B.有腐蚀性 C.无吸水性 D.密度比水小
5.向一定量的稀盐酸中,分别加入足量的水、金属铁、氢氧化钙溶液、硝酸银溶液,下列图示正确的是( )
A. B.
C. D.
6.物质的组成、结构决定物质的性质是化学特有的思维方式。下列说法不正确的是( )
A.金刚石和C60都具有立体网状结构,所以它们有相似的性质
B.稀硫酸和稀盐酸能与锌反应生成氢气,是因为酸溶液中均含有H+
C.木炭、氢气在一定条件下都能与氧化铜反应生成铜,从组成分析CH4也可以
D.不同塑料具有热塑性和热固性的性质差异,是因为小分子连接成高分子时形成的结构不同
7.下列常用来改良酸性土壤的物质是( )
A.熟石灰 B.硫酸 C.烧碱 D.食盐
8.下列不是氢氧化钠的俗名的是( )
A.苛性钠 B.纯碱 C.火碱 D.烧碱
9.若利用碱的性质进行下列实验,不能达到相应目的的是( )
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
10.小金完成了图示实验①②③,下列判断正确的是( )
A.实验①中石灰水有剩余
B.实验②中有气泡产生
C.实验③中没有明显现象
D.实验③所得溶液中一定含CaCl2和NaCl
二.填空题(共5小题)
11.下列物质的溶液能使无色酚酞变红色的是
A.醋酸
B.氨水
C.蔗糖
D.
12.某工业品盐酸的溶质的质量分数为37%.请回答:
(1)将该盐酸敞口露置于空气中,一段时间后,其溶质的质量分数 37%(填“大于”“小于”或“等于”);
(2)该盐酸因含有少量Fe3+而显黄色(其他杂质忽略不计)。现取少量样品,与适量硝酸银溶液恰好完全反应。经实验测得,反应后溶液中的H+和NO3﹣的个数比为91:94,则该盐酸中Fe3+和Cl﹣的个数比为 。
13.综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六支试管中进行实验(如图所示),请回答下列问题:
(1)上述六支试管中有气泡产生的是 (填序号),相关反应的化学方程式为 (只写出一个)。
(2)能证明“C试管中发生了化学反应”的现象是 。
(3)有一支试管中的物质不与稀盐酸反应,原因是 。
14.请用所学的化学知识解释下列现象:
(1)NaOH在生活中可用来除去油污,是因为氢氧化钠能与 反应;
(2)一氧化碳用于炼铁的原理(用化学方程式表示) ;
(3)用天然气作燃料的原理(用化学方程式表示) ;
(4)将一包放置较长时间的食品干燥剂放入烧杯中,放入足量的稀盐酸,可能发生反应的化学方程式是 、 、 .(写三个即可)
15.某实验中学的同学归纳总结了有关酸和碱的化学性质的知识网络如图所示。其中A是一种生活中最常见的金属,B是一种常见的化合物,图中短线表示两种物质在一定条件下可以发生化学反应。请根据图示回答有关问题。
(1)B可能是 (填化学式);
(2)请写出有关反应的化学方程式:
反应①: ;
反应④: ;
(3)请你用文字描述反应⑤的实验现象 ;
(4)图中所标的9个反应中,属于中和反应的是 (填代号,下同),属于置换反应的是 。
三.解答题(共5小题)
16.从玫瑰花瓣中提取的花青素(紫色)可制成酸碱指示剂,滴入到不同溶液中颜色变化如下表,结合表中信息回答:
试剂 NaCl溶液 盐酸 NaHCO3溶液 NH4Cl溶液 NaOH溶液
颜色 紫 红 蓝 红 蓝
(1)NH4Cl溶液呈 (填“酸性”“碱性”或“中性”),用作化肥长期施用的结果是 。
(2)向某无色溶液中滴入花青素,溶液变蓝色,则此溶液中一定不存在Na+、K+、Fe3+、NH4+、NO3﹣、SO42﹣离子中的 (填离子符号)。
(3)胃溃疡患者不用碳酸氢钠片治疗胃酸过多的原因是 (用化学方程式表示)。
17.实验室中有些药品需要密封保存,其原因有多种情况.请你谈谈浓硫酸、氢氧化钠溶液需要密封保存的原因.
18.盐酸是重要的化工原料,也是实验室中最常用的化学试剂之一。
(1)用质量分数为37%的浓盐酸配制1000g质量分数为0.37%(pH约为1)的稀盐酸。
①所配稀盐酸中溶质的质量为 g,所需浓盐酸的质量为 g。
②已知浓盐酸密度为1.19g/cm3,量取上述所需浓盐酸用到的仪器是 (填标号)。
A.10mL量筒
B.50mL量筒
C.试管
D.胶头滴管
③测定所配稀盐酸的酸碱度,应将pH试纸放置在 上。
(2)取少量氢氧化钙粉末于试管中,加入2mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象是 。
(3)取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。
①铁与稀盐酸反应的化学方程式为 。
②如图示意图中,与实验结果相符的是 (填标号)。
19.为绿化环境并改善空气质量,在城市公路两侧种植了树木.园林工人常在树木上涂刷含有硫黄粉等的石灰浆.这样做的目的是什么?(答一点即可)你还知道氢氧化钙的其它用途吗?(答两点即可)
20.某拓展性学习小组在学校科学实验创新比赛中,做了一个有趣的实验,装置如图。
实验设计:三颈烧瓶中充满二氧化碳气体,A颈、B颈分别连接充满氢氧化钠溶液和盐酸的注射器,C颈插有两端开口的玻璃导管(伸入瓶内的一端连有小气球),装置气密性良好。
实验操作:先通过A颈往瓶内注入氢氧化钠溶液,观察到小气球的形状发生了变化;过一段时间后再通过B颈往瓶中注入盐酸,发现小气球的形状又发生了改变。
请描述小气球形状的变化情况,并对此作出合理的解释。
华东师大版九年级上学期《第二章 酸与碱》真题同步卷
参考答案与试题解析
一.选择题(共10小题)
1.【解答】解:A、浓盐酸具有挥发性,但挥发出来的氯化氢气体不能使喷有酚酞溶液的脱脂棉变色,故选项错误。
B、浓氨水具有挥发性,挥发出来的氨气能使喷有酚酞溶液的脱脂棉变红色,故选项正确。
C、浓醋酸具有挥发性,但挥发出来的气体不能使喷有酚酞溶液的脱脂棉变色,故选项错误。
D、浓氢氧化钠溶液不具有挥发性,不能使喷有酚酞溶液的脱脂棉变色,故选项错误。
故选:B。
2.【解答】解:A.氢氧化铜是一种难溶于水的碱,不能使紫色石蕊溶液变为蓝色,选项说法错误;
B.纯碱溶液显碱性,能使紫色石蕊溶液变为蓝色,但该溶液不一定就是纯碱的水溶液,也可能是其他显碱性的溶液,如氢氧化钠溶液等,选项说法错误;
C.测定溶液的pH时,要用干燥洁净的玻璃棒蘸取待测溶液滴在pH试纸上,而不能将pH试纸直接放入待测溶液中,这样会将溶液污染,选项说法错误;
D.稀盐酸显酸性,pH<7,向该物质的水溶液中滴加稀盐酸,稀盐酸能与这种碱性物质反应,溶液的碱性减弱,pH一定变小,选项说法正确。
故选:D。
3.【解答】解:A.打开盛有浓盐酸的试剂瓶时,挥发出的氯化氢能和空气中的水蒸气结合形成酸雾,不是白烟,该选项说法不正确;
B.硫在氧气中燃烧,产生蓝紫色的火焰,该选项说法正确;
C.木炭在高温下还原氧化铜生成铜,固体由黑色逐渐变红,该选项说法不正确;
D.镁条在空气中燃烧会发出耀眼的白光,生成白色固体,该选项说法不正确。
故选:B。
4.【解答】解:浓硫酸没有挥发性,有强烈的腐蚀性、吸水性,密度比水大。
故选:B。
5.【解答】解:A、向一定量的稀盐酸中不断加水稀释,溶液始终显酸性,pH不可能大于或等于7,故选项图象错误。
B、稀盐酸能与铁反应生成氯化亚铁和氢气,一开始就产生氢气,至完全反应不再发生改变,故选项图象错误。
C、稀盐酸与氢氧化钙溶液反应生成氯化钙和水,溶液的质量不断增加,但溶液的质量不可能从0开始,故选项图象错误。
D、稀盐酸与硝酸银溶液反应生成氯化银沉淀和硝酸,沉淀的质量逐渐增加,至完全反应,不再发生改变,故选项图象正确。
故选:D。
6.【解答】解:A、金刚石和C60都具有立体网状结构,但碳原子的排列方式不同,物理性质差异较大,故选项说法错误。
B、稀硫酸和稀盐酸能与锌反应生成氢气,是因为酸溶液中均含有H+,故选项说法正确。
C、木炭、氢气均具有还原性,木炭、氢气在一定条件下都能与氧化铜反应生成铜,从组成分析中CH4的碳、氢也能夺取氧气的氧,CH4也可以,故选项说法正确。
D、不同塑料具有热塑性和热固性的性质差异,是因为小分子连接成高分子时形成的结构不同,故选项说法正确。
故选:A。
7.【解答】解:A.熟石灰是氢氧化钙的俗称,是一种碱。可用于中和酸性土壤改良土壤,符合题意;
B.硫酸是一种常见的酸,不能改良酸性土壤,不合题意;
C.烧碱是氢氧化钠的俗称,是一种常见的碱,能中和酸性物质,但其具有很强烈的腐蚀性,不能改良酸性土壤,不合题意;
D.食盐是氯化钠的俗称,其水溶液呈中性,不能改良酸性土壤,不合题意。
故选:A。
8.【解答】解:氢氧化钠俗称苛性钠、火碱、烧碱,而纯碱是碳酸钠的俗称。
A、苛性钠是氢氧化钠的俗称,故选项不符合题意。
B、纯碱是碳酸钠的俗称,故选项符合题意。
C、火碱是氢氧化钠的俗称,故选项不符合题意。
D、烧碱是氢氧化钠的俗称,故选项不符合题意。
故选:B。
9.【解答】解:A、氢氧化镁难溶于水,不能与Na2CO3溶液反应,能与稀盐酸反应生成氯化镁和水,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液,故选项说法正确。
B、NaOH固体溶于水放热,使温度升高,氯化钠溶于水温度几乎无变化,可以鉴别,故选项说法正确。
C、Ba(OH)2溶液与MgCl2溶液和Na2SO4溶液反应,分别生成氢氧化镁沉淀、硫酸钡沉淀,不能鉴别,故选项说法错误。
D、分别加入熟石灰粉末研磨,根据是否产生氨味,产生氨味的是(NH4)2SO4固体,可以鉴别,故选项说法正确。
故选:C。
10.【解答】解:A、最终得到无色澄清溶液,是因为①中的稀盐酸过量,过量的稀盐酸和②中反应生成的碳酸钙反应生成氯化钙、水和二氧化碳,因此实验①中石灰水没有剩余,该选项说法不正确;
B、实验②中碳酸钠和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钠,不产生气泡,该选项说法不正确;
C、实验③中最终得到无色澄清溶液,说明1号试管中的盐酸过量,和2号试管中的氢氧化钠反应生成氯化钠和水,和碳酸钙反应生成氯化钙、水和二氧化碳,过程中固体溶解,产生气泡,该选项说法不正确;
D、实验③中最终得到无色澄清溶液,说明1号试管中的盐酸过量,和2号试管中的氢氧化钠反应生成氯化钠和水,和碳酸钙反应生成氯化钙、水和二氧化碳,因此实验③所得溶液中一定含CaCl2和NaCl,该选项说法正确。
故选:D。
二.填空题(共5小题)
11.【解答】解:碱性溶液能使无色酚酞变红色。
A.醋酸显酸性,不能使无色酚酞试液变色,不合题意;
B.氨水显碱性,能使无色酚酞试液变红色,符合题意;
C.蔗糖水呈中性,不能使无色酚酞试液变色,不合题意;
D.氢氧化钠溶液、石灰水显碱性,能使无色酚酞试液变红色。
故答案为:B;石灰水(答案合理即可)。
12.【解答】解:(1)将该盐酸敞口露置于空气中,浓盐酸具有挥发性,溶质质量减少,溶剂质量不变,则其溶质的质量分数小于37%。
(2)现取少量样品,与适量硝酸银溶液恰好完全反应,反应后溶液中含有氢离子、铁离子和硝酸根离子,H+和NO3﹣的个数比为91:94,设氢离子的个数是91,NO3﹣的个数是94,设铁离子的个数为x,91+3x=94,x=1。
氯离子和银离子结合生成氯化银沉淀,硝酸中氢离子和硝酸根离子的个数比为1:1,则氯离子的个数与硝酸根离子的个数相同,则该盐酸中Fe3+和Cl﹣的个数比为1:94。
故答案为:
(1)小于;
(2)1:94。
13.【解答】解:(1)酸能与活泼金属反应生成氢气,镁能与稀盐酸反应生成氯化镁和氢气,稀盐酸与碳酸氢钠溶液反应生成氯化钠、水和二氧化碳气体,上述六支试管中有气泡产生的是BD;反应的化学方程式分别是Mg+2HCl═MgCl2+H2↑、NaHCO3+HCl=NaCl+H2O+CO2↑。
(2)滴有酚酞溶液的石灰水显红色,无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,逐滴滴入稀盐酸,至恰好完全反应,溶液显中性,溶液由红色变为无色,证明盐酸和氢氧化钙发生了化学反应。
(3)有一支试管中的物质不与稀盐酸反应,该物质是铜,在金属活动性顺序中,铜位于氢的后面,不与稀盐酸反应。
故答案为:
(1)BD;Mg+2HCl═MgCl2+H2↑或NaHCO3+HCl=NaCl+H2O+CO2↑;
(2)溶液由红色变为无色;
(3)在金属活动性顺序中,铜位于氢的后面,不与稀盐酸反应。
14.【解答】解:(1)氢氧化钠具有碱性,可以与油脂发生反应,而除去油污;
(2)炼铁是将原料(铁矿石、焦炭、石灰石、空气)通入高炉中,在高炉中发生复杂反应,生成铁的单质,例如以赤铁矿为例,氧化铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO2Fe+3CO2.
(3)天然气的主要成分是甲烷,甲烷燃烧生成二氧化碳和水,反应的化学方程式为:CH4+2O2CO2+2H2O
(4)首先生石灰与水反应生成氢氧化钙,方程式为CaO+H2O=Ca(OH)2.
生石灰与盐酸反应生成氯化钙和水,CaO+2HCl═CaCl2+H2O,
氢氧化钙与盐酸反应生成氯化钙和水,Ca(OH)2+2HCl═CaCl2+2H2O,
碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,CaCO3+2HCl═CaCl2+H2O+CO2↑.
故答案为:(1)油脂(2)Fe2O3+3CO2Fe+3CO2(3)CH4+2O2CO2+2H2O
(4)CaO+H2O=Ca(OH)2;CaO+2HCl═CaCl2+H2O;Ca(OH)2+2HCl═CaCl2+2H2O(或CaCO3+2HCl═CaCl2+H2O+CO2↑).
15.【解答】解:(1)B既能与酸反应,还能与碱反应,B应为盐,可能是碳酸钠,其化学式为Na2CO3(合理即可)。
(2)A是一种生活中最常见的金属,是铁与稀硫酸反应生成硫酸亚铁溶液和氢气,反应的化学方程式为Fe+H2SO4═FeSO4+H2↑。
反应④,是二氧化碳与石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O。
(3)反应⑤是氧化铜与稀硫酸反应生成硫酸铜和水,会观察到黑色粉末溶解,溶液变蓝色。
(4)中和反应是酸与碱作用生成盐和水的反应,图中所标的9个反应中,属于中和反应的是⑥⑨;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应的是①。
故答案为:
(1)Na2CO3(合理即可);
(2)Fe+H2SO4═FeSO4+H2↑;CO2+Ca(OH)2═CaCO3↓+H2O;
(3)黑色粉末溶解,溶液变蓝色;
(4)⑥⑨;①。
三.解答题(共5小题)
16.【解答】解:(1)盐酸和NH4Cl溶液滴入到花青素都显红色,说明NH4Cl溶液呈酸性,NH4Cl用作化肥长期施用的结果是会使土壤酸化,又因为氯离子容易使土壤板结;
(2)无色溶液,说明其中不含Fe3+,又滴入花青素,溶液变蓝色,说明溶液显碱性,所以不会有NH4+;
(3)由于这些碳酸氢钠与胃酸反应能产生二氧化碳气体,加重胃溃疡病情,所以患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸氢钠的抗酸药;化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑。
故答案为:(1)酸性;使土壤酸化、板结(2)Fe3+、NH4+ (3)NaHCO3+HCl=NaCl+H2O+CO2↑
17.【解答】解:浓硫酸需要密封保存的原因是有吸水性;氢氧化钠溶液需要密封保存是因为它接触空气中的二氧化碳而变质.
18.【解答】解:(1)①所配稀盐酸中溶质的质量为:1000g×0.37%=3.7g,所需浓盐酸的质量为:3.7g÷37%=10g。
故填:3.7;10。
②已知浓盐酸密度为1.19g/cm3,10g浓盐酸体积:10g÷1.19g/mL=8.4mL,量取上述所需浓盐酸用到的仪器是10mL量筒和胶头滴管。
故填:AD。
③测定所配稀盐酸的酸碱度,应将pH试纸放置在干燥、洁净的表面皿上。
故填:干燥、洁净的表面皿。
(2)取少量氢氧化钙粉末于试管中,加入2mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象:浑浊液变红色,再变澄清,红色消失,是因为氢氧化钙溶液显碱性,能使酚酞试液变红色,氢氧化钙和稀盐酸反应生成氯化钙和水。
故填:浑浊液变红色,再变澄清,红色消失。
(3)取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。
①铁与稀盐酸反应的化学方程式为:Fe+2HCl═FeCl2+H2↑。
故填:Fe+2HCl═FeCl2+H2↑。
②如图示意图中,与实验结果相符的是D,是因为铁质量相等,最终生成氢气质量相等,由于铁粉和稀盐酸接触面积比铁片大,因此反应速率比铁片快,反应需要时间短。
故填:D。
19.【解答】解:石硫合剂能起到防止冻伤或杀死虫卵的作用,氢氧化钙具有碱性,能用于改良酸性土壤,能与二氧化碳反应生成坚硬的碳酸钙,可以用于建筑材料故答案为:
目的:防止冻伤或防止害虫生卵;
用途:改良酸性土壤,用作建筑材料.
20.【解答】解:先通过A颈往瓶内注入氢氧化钠溶液,氢氧化钠与二氧化碳反应导致瓶内的压强减小,气球胀大,过一段时间后再通过B颈往瓶中注入盐酸,则盐酸与碳酸钠反应生成二氧化碳,瓶内压强增大,气球变瘪,故答案为:开始氢氧化钠与二氧化碳反应导致瓶内压强变小,气球变大,后来盐酸与碳酸钠反应生成二氧化碳,导致瓶内的压强增大,气球变瘪。
一.选择题(共10小题)
1.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y.先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
2.某物质能使紫色石蕊溶液变为蓝色,关于该物质的下列说法中正确的是( )
A.该物质可能是氢氧化铜
B.该物质一定是纯碱的水溶液
C.可以将pH试纸放入该物质的稀溶液中测其pH
D.向该物质的水溶液中滴加稀盐酸,溶液的pH一定变小
3.下列关于实验现象的描述中,正确的是( )
A.打开盛有浓盐酸的试剂瓶,在瓶口观察到白烟
B.硫在氧气中燃烧,产生蓝紫色的火焰
C.木炭在高温下还原氧化铜,固体由红色逐渐变黑
D.镁条在空气中燃烧会发出耀眼的白光,生成黑色固体
4.下列关于浓硫酸的说法正确的是( )
A.易挥发 B.有腐蚀性 C.无吸水性 D.密度比水小
5.向一定量的稀盐酸中,分别加入足量的水、金属铁、氢氧化钙溶液、硝酸银溶液,下列图示正确的是( )
A. B.
C. D.
6.物质的组成、结构决定物质的性质是化学特有的思维方式。下列说法不正确的是( )
A.金刚石和C60都具有立体网状结构,所以它们有相似的性质
B.稀硫酸和稀盐酸能与锌反应生成氢气,是因为酸溶液中均含有H+
C.木炭、氢气在一定条件下都能与氧化铜反应生成铜,从组成分析CH4也可以
D.不同塑料具有热塑性和热固性的性质差异,是因为小分子连接成高分子时形成的结构不同
7.下列常用来改良酸性土壤的物质是( )
A.熟石灰 B.硫酸 C.烧碱 D.食盐
8.下列不是氢氧化钠的俗名的是( )
A.苛性钠 B.纯碱 C.火碱 D.烧碱
9.若利用碱的性质进行下列实验,不能达到相应目的的是( )
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
10.小金完成了图示实验①②③,下列判断正确的是( )
A.实验①中石灰水有剩余
B.实验②中有气泡产生
C.实验③中没有明显现象
D.实验③所得溶液中一定含CaCl2和NaCl
二.填空题(共5小题)
11.下列物质的溶液能使无色酚酞变红色的是
A.醋酸
B.氨水
C.蔗糖
D.
12.某工业品盐酸的溶质的质量分数为37%.请回答:
(1)将该盐酸敞口露置于空气中,一段时间后,其溶质的质量分数 37%(填“大于”“小于”或“等于”);
(2)该盐酸因含有少量Fe3+而显黄色(其他杂质忽略不计)。现取少量样品,与适量硝酸银溶液恰好完全反应。经实验测得,反应后溶液中的H+和NO3﹣的个数比为91:94,则该盐酸中Fe3+和Cl﹣的个数比为 。
13.综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六支试管中进行实验(如图所示),请回答下列问题:
(1)上述六支试管中有气泡产生的是 (填序号),相关反应的化学方程式为 (只写出一个)。
(2)能证明“C试管中发生了化学反应”的现象是 。
(3)有一支试管中的物质不与稀盐酸反应,原因是 。
14.请用所学的化学知识解释下列现象:
(1)NaOH在生活中可用来除去油污,是因为氢氧化钠能与 反应;
(2)一氧化碳用于炼铁的原理(用化学方程式表示) ;
(3)用天然气作燃料的原理(用化学方程式表示) ;
(4)将一包放置较长时间的食品干燥剂放入烧杯中,放入足量的稀盐酸,可能发生反应的化学方程式是 、 、 .(写三个即可)
15.某实验中学的同学归纳总结了有关酸和碱的化学性质的知识网络如图所示。其中A是一种生活中最常见的金属,B是一种常见的化合物,图中短线表示两种物质在一定条件下可以发生化学反应。请根据图示回答有关问题。
(1)B可能是 (填化学式);
(2)请写出有关反应的化学方程式:
反应①: ;
反应④: ;
(3)请你用文字描述反应⑤的实验现象 ;
(4)图中所标的9个反应中,属于中和反应的是 (填代号,下同),属于置换反应的是 。
三.解答题(共5小题)
16.从玫瑰花瓣中提取的花青素(紫色)可制成酸碱指示剂,滴入到不同溶液中颜色变化如下表,结合表中信息回答:
试剂 NaCl溶液 盐酸 NaHCO3溶液 NH4Cl溶液 NaOH溶液
颜色 紫 红 蓝 红 蓝
(1)NH4Cl溶液呈 (填“酸性”“碱性”或“中性”),用作化肥长期施用的结果是 。
(2)向某无色溶液中滴入花青素,溶液变蓝色,则此溶液中一定不存在Na+、K+、Fe3+、NH4+、NO3﹣、SO42﹣离子中的 (填离子符号)。
(3)胃溃疡患者不用碳酸氢钠片治疗胃酸过多的原因是 (用化学方程式表示)。
17.实验室中有些药品需要密封保存,其原因有多种情况.请你谈谈浓硫酸、氢氧化钠溶液需要密封保存的原因.
18.盐酸是重要的化工原料,也是实验室中最常用的化学试剂之一。
(1)用质量分数为37%的浓盐酸配制1000g质量分数为0.37%(pH约为1)的稀盐酸。
①所配稀盐酸中溶质的质量为 g,所需浓盐酸的质量为 g。
②已知浓盐酸密度为1.19g/cm3,量取上述所需浓盐酸用到的仪器是 (填标号)。
A.10mL量筒
B.50mL量筒
C.试管
D.胶头滴管
③测定所配稀盐酸的酸碱度,应将pH试纸放置在 上。
(2)取少量氢氧化钙粉末于试管中,加入2mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象是 。
(3)取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。
①铁与稀盐酸反应的化学方程式为 。
②如图示意图中,与实验结果相符的是 (填标号)。
19.为绿化环境并改善空气质量,在城市公路两侧种植了树木.园林工人常在树木上涂刷含有硫黄粉等的石灰浆.这样做的目的是什么?(答一点即可)你还知道氢氧化钙的其它用途吗?(答两点即可)
20.某拓展性学习小组在学校科学实验创新比赛中,做了一个有趣的实验,装置如图。
实验设计:三颈烧瓶中充满二氧化碳气体,A颈、B颈分别连接充满氢氧化钠溶液和盐酸的注射器,C颈插有两端开口的玻璃导管(伸入瓶内的一端连有小气球),装置气密性良好。
实验操作:先通过A颈往瓶内注入氢氧化钠溶液,观察到小气球的形状发生了变化;过一段时间后再通过B颈往瓶中注入盐酸,发现小气球的形状又发生了改变。
请描述小气球形状的变化情况,并对此作出合理的解释。
华东师大版九年级上学期《第二章 酸与碱》真题同步卷
参考答案与试题解析
一.选择题(共10小题)
1.【解答】解:A、浓盐酸具有挥发性,但挥发出来的氯化氢气体不能使喷有酚酞溶液的脱脂棉变色,故选项错误。
B、浓氨水具有挥发性,挥发出来的氨气能使喷有酚酞溶液的脱脂棉变红色,故选项正确。
C、浓醋酸具有挥发性,但挥发出来的气体不能使喷有酚酞溶液的脱脂棉变色,故选项错误。
D、浓氢氧化钠溶液不具有挥发性,不能使喷有酚酞溶液的脱脂棉变色,故选项错误。
故选:B。
2.【解答】解:A.氢氧化铜是一种难溶于水的碱,不能使紫色石蕊溶液变为蓝色,选项说法错误;
B.纯碱溶液显碱性,能使紫色石蕊溶液变为蓝色,但该溶液不一定就是纯碱的水溶液,也可能是其他显碱性的溶液,如氢氧化钠溶液等,选项说法错误;
C.测定溶液的pH时,要用干燥洁净的玻璃棒蘸取待测溶液滴在pH试纸上,而不能将pH试纸直接放入待测溶液中,这样会将溶液污染,选项说法错误;
D.稀盐酸显酸性,pH<7,向该物质的水溶液中滴加稀盐酸,稀盐酸能与这种碱性物质反应,溶液的碱性减弱,pH一定变小,选项说法正确。
故选:D。
3.【解答】解:A.打开盛有浓盐酸的试剂瓶时,挥发出的氯化氢能和空气中的水蒸气结合形成酸雾,不是白烟,该选项说法不正确;
B.硫在氧气中燃烧,产生蓝紫色的火焰,该选项说法正确;
C.木炭在高温下还原氧化铜生成铜,固体由黑色逐渐变红,该选项说法不正确;
D.镁条在空气中燃烧会发出耀眼的白光,生成白色固体,该选项说法不正确。
故选:B。
4.【解答】解:浓硫酸没有挥发性,有强烈的腐蚀性、吸水性,密度比水大。
故选:B。
5.【解答】解:A、向一定量的稀盐酸中不断加水稀释,溶液始终显酸性,pH不可能大于或等于7,故选项图象错误。
B、稀盐酸能与铁反应生成氯化亚铁和氢气,一开始就产生氢气,至完全反应不再发生改变,故选项图象错误。
C、稀盐酸与氢氧化钙溶液反应生成氯化钙和水,溶液的质量不断增加,但溶液的质量不可能从0开始,故选项图象错误。
D、稀盐酸与硝酸银溶液反应生成氯化银沉淀和硝酸,沉淀的质量逐渐增加,至完全反应,不再发生改变,故选项图象正确。
故选:D。
6.【解答】解:A、金刚石和C60都具有立体网状结构,但碳原子的排列方式不同,物理性质差异较大,故选项说法错误。
B、稀硫酸和稀盐酸能与锌反应生成氢气,是因为酸溶液中均含有H+,故选项说法正确。
C、木炭、氢气均具有还原性,木炭、氢气在一定条件下都能与氧化铜反应生成铜,从组成分析中CH4的碳、氢也能夺取氧气的氧,CH4也可以,故选项说法正确。
D、不同塑料具有热塑性和热固性的性质差异,是因为小分子连接成高分子时形成的结构不同,故选项说法正确。
故选:A。
7.【解答】解:A.熟石灰是氢氧化钙的俗称,是一种碱。可用于中和酸性土壤改良土壤,符合题意;
B.硫酸是一种常见的酸,不能改良酸性土壤,不合题意;
C.烧碱是氢氧化钠的俗称,是一种常见的碱,能中和酸性物质,但其具有很强烈的腐蚀性,不能改良酸性土壤,不合题意;
D.食盐是氯化钠的俗称,其水溶液呈中性,不能改良酸性土壤,不合题意。
故选:A。
8.【解答】解:氢氧化钠俗称苛性钠、火碱、烧碱,而纯碱是碳酸钠的俗称。
A、苛性钠是氢氧化钠的俗称,故选项不符合题意。
B、纯碱是碳酸钠的俗称,故选项符合题意。
C、火碱是氢氧化钠的俗称,故选项不符合题意。
D、烧碱是氢氧化钠的俗称,故选项不符合题意。
故选:B。
9.【解答】解:A、氢氧化镁难溶于水,不能与Na2CO3溶液反应,能与稀盐酸反应生成氯化镁和水,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液,故选项说法正确。
B、NaOH固体溶于水放热,使温度升高,氯化钠溶于水温度几乎无变化,可以鉴别,故选项说法正确。
C、Ba(OH)2溶液与MgCl2溶液和Na2SO4溶液反应,分别生成氢氧化镁沉淀、硫酸钡沉淀,不能鉴别,故选项说法错误。
D、分别加入熟石灰粉末研磨,根据是否产生氨味,产生氨味的是(NH4)2SO4固体,可以鉴别,故选项说法正确。
故选:C。
10.【解答】解:A、最终得到无色澄清溶液,是因为①中的稀盐酸过量,过量的稀盐酸和②中反应生成的碳酸钙反应生成氯化钙、水和二氧化碳,因此实验①中石灰水没有剩余,该选项说法不正确;
B、实验②中碳酸钠和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钠,不产生气泡,该选项说法不正确;
C、实验③中最终得到无色澄清溶液,说明1号试管中的盐酸过量,和2号试管中的氢氧化钠反应生成氯化钠和水,和碳酸钙反应生成氯化钙、水和二氧化碳,过程中固体溶解,产生气泡,该选项说法不正确;
D、实验③中最终得到无色澄清溶液,说明1号试管中的盐酸过量,和2号试管中的氢氧化钠反应生成氯化钠和水,和碳酸钙反应生成氯化钙、水和二氧化碳,因此实验③所得溶液中一定含CaCl2和NaCl,该选项说法正确。
故选:D。
二.填空题(共5小题)
11.【解答】解:碱性溶液能使无色酚酞变红色。
A.醋酸显酸性,不能使无色酚酞试液变色,不合题意;
B.氨水显碱性,能使无色酚酞试液变红色,符合题意;
C.蔗糖水呈中性,不能使无色酚酞试液变色,不合题意;
D.氢氧化钠溶液、石灰水显碱性,能使无色酚酞试液变红色。
故答案为:B;石灰水(答案合理即可)。
12.【解答】解:(1)将该盐酸敞口露置于空气中,浓盐酸具有挥发性,溶质质量减少,溶剂质量不变,则其溶质的质量分数小于37%。
(2)现取少量样品,与适量硝酸银溶液恰好完全反应,反应后溶液中含有氢离子、铁离子和硝酸根离子,H+和NO3﹣的个数比为91:94,设氢离子的个数是91,NO3﹣的个数是94,设铁离子的个数为x,91+3x=94,x=1。
氯离子和银离子结合生成氯化银沉淀,硝酸中氢离子和硝酸根离子的个数比为1:1,则氯离子的个数与硝酸根离子的个数相同,则该盐酸中Fe3+和Cl﹣的个数比为1:94。
故答案为:
(1)小于;
(2)1:94。
13.【解答】解:(1)酸能与活泼金属反应生成氢气,镁能与稀盐酸反应生成氯化镁和氢气,稀盐酸与碳酸氢钠溶液反应生成氯化钠、水和二氧化碳气体,上述六支试管中有气泡产生的是BD;反应的化学方程式分别是Mg+2HCl═MgCl2+H2↑、NaHCO3+HCl=NaCl+H2O+CO2↑。
(2)滴有酚酞溶液的石灰水显红色,无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,逐滴滴入稀盐酸,至恰好完全反应,溶液显中性,溶液由红色变为无色,证明盐酸和氢氧化钙发生了化学反应。
(3)有一支试管中的物质不与稀盐酸反应,该物质是铜,在金属活动性顺序中,铜位于氢的后面,不与稀盐酸反应。
故答案为:
(1)BD;Mg+2HCl═MgCl2+H2↑或NaHCO3+HCl=NaCl+H2O+CO2↑;
(2)溶液由红色变为无色;
(3)在金属活动性顺序中,铜位于氢的后面,不与稀盐酸反应。
14.【解答】解:(1)氢氧化钠具有碱性,可以与油脂发生反应,而除去油污;
(2)炼铁是将原料(铁矿石、焦炭、石灰石、空气)通入高炉中,在高炉中发生复杂反应,生成铁的单质,例如以赤铁矿为例,氧化铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO2Fe+3CO2.
(3)天然气的主要成分是甲烷,甲烷燃烧生成二氧化碳和水,反应的化学方程式为:CH4+2O2CO2+2H2O
(4)首先生石灰与水反应生成氢氧化钙,方程式为CaO+H2O=Ca(OH)2.
生石灰与盐酸反应生成氯化钙和水,CaO+2HCl═CaCl2+H2O,
氢氧化钙与盐酸反应生成氯化钙和水,Ca(OH)2+2HCl═CaCl2+2H2O,
碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,CaCO3+2HCl═CaCl2+H2O+CO2↑.
故答案为:(1)油脂(2)Fe2O3+3CO2Fe+3CO2(3)CH4+2O2CO2+2H2O
(4)CaO+H2O=Ca(OH)2;CaO+2HCl═CaCl2+H2O;Ca(OH)2+2HCl═CaCl2+2H2O(或CaCO3+2HCl═CaCl2+H2O+CO2↑).
15.【解答】解:(1)B既能与酸反应,还能与碱反应,B应为盐,可能是碳酸钠,其化学式为Na2CO3(合理即可)。
(2)A是一种生活中最常见的金属,是铁与稀硫酸反应生成硫酸亚铁溶液和氢气,反应的化学方程式为Fe+H2SO4═FeSO4+H2↑。
反应④,是二氧化碳与石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O。
(3)反应⑤是氧化铜与稀硫酸反应生成硫酸铜和水,会观察到黑色粉末溶解,溶液变蓝色。
(4)中和反应是酸与碱作用生成盐和水的反应,图中所标的9个反应中,属于中和反应的是⑥⑨;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应的是①。
故答案为:
(1)Na2CO3(合理即可);
(2)Fe+H2SO4═FeSO4+H2↑;CO2+Ca(OH)2═CaCO3↓+H2O;
(3)黑色粉末溶解,溶液变蓝色;
(4)⑥⑨;①。
三.解答题(共5小题)
16.【解答】解:(1)盐酸和NH4Cl溶液滴入到花青素都显红色,说明NH4Cl溶液呈酸性,NH4Cl用作化肥长期施用的结果是会使土壤酸化,又因为氯离子容易使土壤板结;
(2)无色溶液,说明其中不含Fe3+,又滴入花青素,溶液变蓝色,说明溶液显碱性,所以不会有NH4+;
(3)由于这些碳酸氢钠与胃酸反应能产生二氧化碳气体,加重胃溃疡病情,所以患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸氢钠的抗酸药;化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑。
故答案为:(1)酸性;使土壤酸化、板结(2)Fe3+、NH4+ (3)NaHCO3+HCl=NaCl+H2O+CO2↑
17.【解答】解:浓硫酸需要密封保存的原因是有吸水性;氢氧化钠溶液需要密封保存是因为它接触空气中的二氧化碳而变质.
18.【解答】解:(1)①所配稀盐酸中溶质的质量为:1000g×0.37%=3.7g,所需浓盐酸的质量为:3.7g÷37%=10g。
故填:3.7;10。
②已知浓盐酸密度为1.19g/cm3,10g浓盐酸体积:10g÷1.19g/mL=8.4mL,量取上述所需浓盐酸用到的仪器是10mL量筒和胶头滴管。
故填:AD。
③测定所配稀盐酸的酸碱度,应将pH试纸放置在干燥、洁净的表面皿上。
故填:干燥、洁净的表面皿。
(2)取少量氢氧化钙粉末于试管中,加入2mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象:浑浊液变红色,再变澄清,红色消失,是因为氢氧化钙溶液显碱性,能使酚酞试液变红色,氢氧化钙和稀盐酸反应生成氯化钙和水。
故填:浑浊液变红色,再变澄清,红色消失。
(3)取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。
①铁与稀盐酸反应的化学方程式为:Fe+2HCl═FeCl2+H2↑。
故填:Fe+2HCl═FeCl2+H2↑。
②如图示意图中,与实验结果相符的是D,是因为铁质量相等,最终生成氢气质量相等,由于铁粉和稀盐酸接触面积比铁片大,因此反应速率比铁片快,反应需要时间短。
故填:D。
19.【解答】解:石硫合剂能起到防止冻伤或杀死虫卵的作用,氢氧化钙具有碱性,能用于改良酸性土壤,能与二氧化碳反应生成坚硬的碳酸钙,可以用于建筑材料故答案为:
目的:防止冻伤或防止害虫生卵;
用途:改良酸性土壤,用作建筑材料.
20.【解答】解:先通过A颈往瓶内注入氢氧化钠溶液,氢氧化钠与二氧化碳反应导致瓶内的压强减小,气球胀大,过一段时间后再通过B颈往瓶中注入盐酸,则盐酸与碳酸钠反应生成二氧化碳,瓶内压强增大,气球变瘪,故答案为:开始氢氧化钠与二氧化碳反应导致瓶内压强变小,气球变大,后来盐酸与碳酸钠反应生成二氧化碳,导致瓶内的压强增大,气球变瘪。
