化学必修I人教版3.1金属的化学性质课件3
文档属性
| 名称 | 化学必修I人教版3.1金属的化学性质课件3 |

|
|
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-17 00:00:00 | ||
图片预览










文档简介
(共39张PPT)
第三章 金属及其化合物
第一节 金属的化学性质(第1课时)
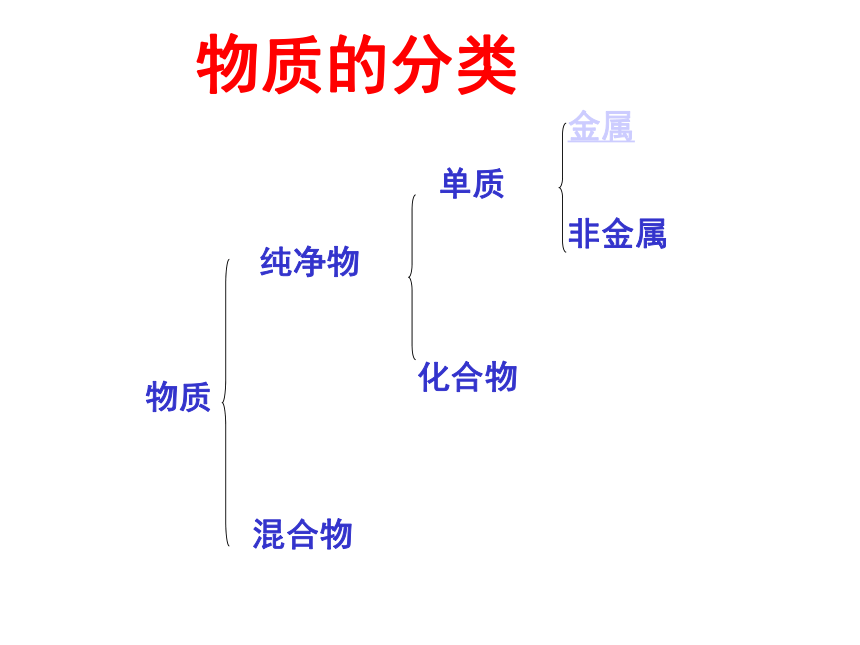
物质
纯净物
混合物
单质
化合物
金属
非金属
物质的分类
青铜器
铁器
铝合金
铁
合金
铜
银
金
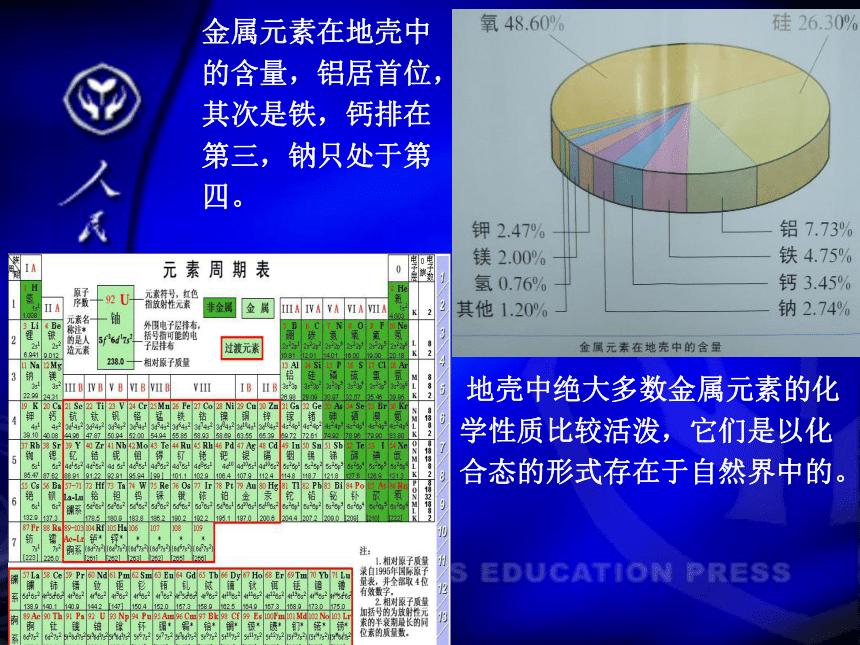
地壳中绝大多数金属元素的化学性质比较活泼,它们是以化合态的形式存在于自然界中的。
金属元素在地壳中的含量,铝居首位,其次是铁,钙排在第三,钠只处于第四。
金属在自然界里的分布
1.人类发现的一百多种元素中,约80%是 金属元素。在元素周期表中,有16种非金属,6种惰性气体元素,87种金属元素。金属大约占五分之四。金属在周期表中的位置:分布在斜线左下方.
见周期表
2、金属在自然界里的存在形式:
①化合态:绝大多数:如Fe2O3、CuS、NaCl、MgSO4等
②游离态(单质):极少数.如:铂、金。
研究物质的性质,常用的步骤是什么?
①物理性质:色态味,溶解性、熔沸点、密度、硬度、导电导热性、延展性等.
②化学性质:化学特性以及与非金属、酸、碱、盐溶液等的反应情况。
启发:是拿过来一一研究,还是选几个代表?
金属那么多,郁闷啊! 怎么学啊?
1、金属的颜色、光泽
绝大多数金属都是银白色,具有金属光泽,
少数金属是特殊颜色如铜是紫红色,金是金
黄色。
3、延展性
延性:拉成细丝的性质。
展性:压成薄片的性质。
黑色金属:铁Fe、铬Cr、锰Mn;
有色金属:除铁、铬、锰外的金属。
一、金属的物理性质--通性
2、良好的导电、导热性
金属的原子结构特点
Na
Mg
Al
结构决定性质.性质反映结构!
启发:为什么大多数金属以化合态形式存在于自然界中?
分析:金属最外层一般是少于4个电子,反应中很容易
失去,表现出较强的还原性。很容易被氧气等活
泼的非金属单质所氧化,其在金属活动顺序表
中越靠左越易发生化学反应.
2.分析下列图片中的反应,写出反应的化学方程式。
①
铝丝与硫酸铜溶液反应
②
镁条燃烧
③
铜丝与硝酸银溶液反应
④
镁条与稀盐酸反应
思考与交流
1.结合初中化学,说明金属能与哪些物质发生化反应?
2Al+3CuSO4=Al2(SO4 )3+3Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
Mg+2HCl=MgCl2+H2
2Mg+O2===2MgO
点燃
④
①
②
③
1、钠与氧气的反应
一、金属与非金属的反应
金属钠的介绍:
钠的密度是0.97g/cm3,质地柔软,化学性质很活泼,容易和氧气、水等物质反应。
保存方法:保存在煤油中。
原理:钠密度大于煤油,沉在底部,
隔绝了与空气的接触。
钠也可以用石蜡(膏状物)封存。
实验3-1:用镊子夹取存放在煤油中的金属钠,用滤纸吸干钠及镊子表面的煤油,用镊子夹紧放在玻璃片上,用小刀切去一端的外皮。观察钠的颜色、光泽、感受钠的硬度。
注意事项:凡是接触钠的用具都必须是干燥的。取用钠后剩余的钠应放回原瓶,残余的钠的碎屑不能随意乱扔。
实验探究3—2:钠在空气中加热
2Na + O2 === Na2O2
加热
常温下
4Na + O2 == 2Na2O
(白色)
加热或点燃
0
0
+1
-1
失去2e-
得到2e-
0
0
+1
-2
失去4e-
得到4e-
注意: 条件不一样,产物不同
不稳定
稳定
点燃
1.钠与氧气反应
2Na +O2 == Na2O2 (淡黄色)
过氧化钠
一、金属与非金属的反应
钠与其他非金属反应
反应剧烈
2Na + S =研磨= Na2S
点燃
2Na + Cl2 == 2NaCl
燃烧
白烟
爆炸
钠与氯气反应
钠与硫反应
一、金属与非金属的反应
科学探究:铝箔在空气中加热
未打磨的铝箔加热
打磨过的铝箔加热
4Al + 3O2 == 2Al2O3
加热
2、铝与氧气的反应
一、金属与非金属的反应
4Al + 3O2 === 2Al2O3
加热
强调:生活中Al2O3很多,如烧水用的铝壶,用一段时间后会发现表面变成灰色,这一层就是Al2O3,它很致密,起到保护内层金属的作用,故在洗刷时,不要将它硬刷掉。
Al2O3:白色固体
许多金属都能与氧气反应,反应的剧烈程度与其活泼性有关。其中越活泼的金属越容易反应,如Na、K等在空气中就能反应;Mg、Fe、Al等在加热或点燃时与氧气反应;不活泼金属反应时条件强一些。
金属与氧气反应的规律:
4、铝与某些氧化物的反应—铝热反应
2Al+Fe2O3===2Fe+Al2O3
4Al+3MnO2===3Mn+2Al2O3
3、镁与其它非金属和氧化物反应(N2、CO2等)
3Mg+N2===Mg3N2
2Mg+CO2===2MgO+C 2Mg+SO2===2MgO+S
应用:用来冶炼高熔点金属。
一、金属与非金属的反应
加热
点燃
加热
点燃
点燃
铝热剂:铝与高熔点金属氧化物
原理:Al为还原剂,放热,生成液态金属。
5、铁与非金属反应
点燃
△
3Fe + 2O2 Fe3O4
结论:根据Fe与O2、Cl2、S反应后的生成物中铁
元素的化合价,比较这三种非金属单质的
氧化性强弱。
2Fe + 3Cl2 2FeCl3
点燃
Fe + S == FeS
1. 钠与盐酸、稀硫酸的反应
2Na+2HCl==2NaCl+H2 ↑
2Na+H2SO4==Na2SO4+H2 ↑
实质: 2Na+2H+==2Na++H2 ↑
二、金属与酸的反应
2. 铝与盐酸、稀硫酸的反应
2Al+6HCl==2AlCl3+3H2 ↑
2Al+3H2SO4==Al2(SO4)3+3H2 ↑
实质: 2Al+6H+==2Al3++3H2 ↑
3. 铁与盐酸、稀硫酸的反应
Fe+2HCl==FeCl2+H2 ↑
Fe+H2SO4==FeSO4+H2 ↑
实质:Fe +2H+==2Fe2++H2 ↑
二、金属与酸的反应
小结:金属与酸的反应的规律:
⑴反应实质都是: M+H+→M++H2 ↑
⑵金属活动性顺序表中,H之前的金属,金属越活泼,
越容易与酸反应生成H2 。
⑶ 金属与HNO3(浓、稀)和浓H2SO4反应不能生成H2,
而是发生了其它的氧化还原反应生成了其它的气体。
4. 铝、铁与强氧化性酸的钝化反应
钝化反应:常温下,Fe、Al可与浓硝酸、浓硫酸发生钝化反应,在铁、铝表面形成一层致密的氧化膜,覆盖在金属表面,阻止了内部金属的进一步反应。
条件:冷(或常温)、浓
物质:金属(铁、铝);酸(浓硫酸、浓硝酸)
原理:发生反应,在金属表面生成致密氧化膜,阻止
反应的继续进行;
注意:发生了反应,只是很弱,反应的量可以忽略;若条件改变,则反应继续进行,但不一定是“金属与酸的置换反应”,还可能是“金属与它们发生氧化还原反应”。
用途:用铁制或铝制容器盛放、运输浓硫酸和浓硝酸。
思考:铝锅中水垢如何除去?
(醋酸、稀强酸、浓盐酸、浓硫酸、浓硝酸)
①.在“钠与氧气的反应”为什么不能用手直接拿金属钠?
②.能否把钠保存在汽油里或四氯化碳(CCl4)中?说明理由。)
(提示:汽油易挥发、易燃;CCl4的密度比钠的大)
③.“钠是一种还原性很强的金属,能把铜从 硫酸铜溶液中置换出来”。这种说法是否正确?为什么?
三、金属与水的反应
1.钠与水反应
浮在水面;
熔为小球;
四处游动;
嘶嘶作响;
逐渐消失,
酚酞变红。
钠的密度比水小
剧烈反应放热
钠的熔点较低
反应放出气体
浮
游
熔
声
红
生成碱性物质
2Na + 2H2O == 2NaOH + H2↑
失去2e-
得到2e-
+1
0
0
+1
实质:2Na+2H2O==2Na++2OH-+H2 ↑
(1)钠对人的皮肤有很强的腐蚀性,取用钠时必须用镊子,切不可用手拿。
(2)在实验室里钠是保存在煤油中的,钠和煤油都易着火,在实验过程中要注重防火。
(3)切下未用的钠应及时放回煤油中。
(4)实验用品中的镊子、小刀和滤纸都必须干 燥无水。
1、取一小试管,向其中加入等体积的水和煤油,然后把一小块金属钠放入到试管中,可以观察到什么现象?并解释。
答:钠在上下跳跃,并逐渐消失。
2、钠久置于空气的变化情况如何?
Na
O2
Na2O
H2O
CO2
NaOH
Na2CO3
2. 钾与水的反应:
2K+2H2O==2KOH+H2↑
比较:钾与水的反应比钠更剧烈,在液面上甚至能看到 燃烧。
三、金属与水的反应
3. 镁与水的反应
Mg+2H2O(热水)==Mg(OH)2+H2 ↑
比较:镁与水的反应很弱,加热时与热水才反应。
4. 铝与水的反应
2Al+6H2O(沸水)==2Al(OH)3+3H2 ↑
比较:铝与水的反应更弱,与沸水才缓慢反应。
思考:家里的铝壶一般能用十来年,你能说说为什么吗?
5、铁与水蒸气的反应
3Fe+4H2O(g) Fe3O4+4H2
高温
三、金属与水的反应
金属与水反应的规律:
⑴反应实质都是:金属与水电离出的H+反应生成H2。只是因为水的电离比酸要弱得多,故金属与水反应 都没有与酸反应那么剧烈。
⑵金属活动性顺序表中,K、Ca、Na等都能和水剧烈反应生成相应的碱和氢气;Mg、Al与水反应很弱,也生成碱和氢气;Fe与水蒸气在高温下反应生成四氧化三铁和氢气;不活泼金属很难与水反应 。
⑶ 金属与溶液反应时,一定要考虑是否与溶液中的水反应。钠与溶液反应一定发生:2Na+2H2O==2NaOH+H2↑。如果是酸溶液,先发生与酸的反应,再发生与水的反应;若是盐、碱溶液,一般先发生与水的反应,再发生NaOH与溶质的反应。
反应实质:
2Al+6H2O=2Al(OH)3+3H2 (很慢)
2Al(OH)3+2NaOH=2NaAlO2+4H2O (促进)
铝是还原剂,水是氧化剂。生成的氢气完全来源于水!
酸、碱、盐等可直接腐蚀铝制品,铝制餐具不宜用来蒸煮或长时间存放具有酸性、碱性或咸味的食物。
1.铝跟碱的反应
思考:如何除去铁粉中的铝粉?
加入NaOH溶液,过滤。
思考:如何除去铝粉中的铁粉?
用吸铁吸附
四、金属与碱的反应
偏铝酸钠
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
1. 在溶液中发生的置换反应
应用:
湿法冶铜:Fe+CuSO4=FeSO4+Cu
回收贵重金属:Fe+2AgNO3=Fe(NO4)2+2Ag
五、金属与盐溶液的反应
金属活动性顺序表中,位于前面的金属A能够把位于它后面的金属B从其盐(金属B的盐)溶液中置换出来:A+B的盐→A的盐+B
2. 钠与盐溶液的反应
+
_________________________________________________________
2Na+2H2O+CuSO4==Na2SO4 +Cu(OH)2 ↓ +H2 ↑
小结:钠与盐溶液反应时,
先与水发生置换反应,生成的NaOH再
考虑与溶液中的溶质是否反应。
但不能置换盐溶液中的任何金属。
2Na+2H2O==2NaOH+H2 ↑
CuSO4+2NaOH==Na2SO4+Cu(OH)2↓
五、金属与盐溶液的反应
思考与交流
1、小明家有一只20世纪50年代的铝锅,至今仍保存完好.
该铝锅未锈蚀的主要原因是( )
A.铝性质稳定,不易发生化学反应
B.铝不易被氧化
C.铝的氧化物容易发生还原反应
D.铝虽易被氧化,但氧化生成的氧化膜具有保护内部铝的作用
D
2、完成下列化学方程式
A. Na + O2 ━━━
B. Na + O2 ━━━
C. Mg+O2━━━
D. Fe+O2━━
E. Cu+O2━━
加热
加热
加热
加热
加热
加热
加热
加热
加热
加热
加热
A.4Na + O2 === 2Na2O
B.2Na + O2 === Na2O2
C.2Mg + O2 === 2MgO
D.3Fe + 2O2 === Fe3O4
E.2Cu + O2 === 2CuO
△
△
△
△
2010.11.
第三章 金属及其化合物
第一节 金属的化学性质(第1课时)
物质
纯净物
混合物
单质
化合物
金属
非金属
物质的分类
青铜器
铁器
铝合金
铁
合金
铜
银
金
地壳中绝大多数金属元素的化学性质比较活泼,它们是以化合态的形式存在于自然界中的。
金属元素在地壳中的含量,铝居首位,其次是铁,钙排在第三,钠只处于第四。
金属在自然界里的分布
1.人类发现的一百多种元素中,约80%是 金属元素。在元素周期表中,有16种非金属,6种惰性气体元素,87种金属元素。金属大约占五分之四。金属在周期表中的位置:分布在斜线左下方.
见周期表
2、金属在自然界里的存在形式:
①化合态:绝大多数:如Fe2O3、CuS、NaCl、MgSO4等
②游离态(单质):极少数.如:铂、金。
研究物质的性质,常用的步骤是什么?
①物理性质:色态味,溶解性、熔沸点、密度、硬度、导电导热性、延展性等.
②化学性质:化学特性以及与非金属、酸、碱、盐溶液等的反应情况。
启发:是拿过来一一研究,还是选几个代表?
金属那么多,郁闷啊! 怎么学啊?
1、金属的颜色、光泽
绝大多数金属都是银白色,具有金属光泽,
少数金属是特殊颜色如铜是紫红色,金是金
黄色。
3、延展性
延性:拉成细丝的性质。
展性:压成薄片的性质。
黑色金属:铁Fe、铬Cr、锰Mn;
有色金属:除铁、铬、锰外的金属。
一、金属的物理性质--通性
2、良好的导电、导热性
金属的原子结构特点
Na
Mg
Al
结构决定性质.性质反映结构!
启发:为什么大多数金属以化合态形式存在于自然界中?
分析:金属最外层一般是少于4个电子,反应中很容易
失去,表现出较强的还原性。很容易被氧气等活
泼的非金属单质所氧化,其在金属活动顺序表
中越靠左越易发生化学反应.
2.分析下列图片中的反应,写出反应的化学方程式。
①
铝丝与硫酸铜溶液反应
②
镁条燃烧
③
铜丝与硝酸银溶液反应
④
镁条与稀盐酸反应
思考与交流
1.结合初中化学,说明金属能与哪些物质发生化反应?
2Al+3CuSO4=Al2(SO4 )3+3Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
Mg+2HCl=MgCl2+H2
2Mg+O2===2MgO
点燃
④
①
②
③
1、钠与氧气的反应
一、金属与非金属的反应
金属钠的介绍:
钠的密度是0.97g/cm3,质地柔软,化学性质很活泼,容易和氧气、水等物质反应。
保存方法:保存在煤油中。
原理:钠密度大于煤油,沉在底部,
隔绝了与空气的接触。
钠也可以用石蜡(膏状物)封存。
实验3-1:用镊子夹取存放在煤油中的金属钠,用滤纸吸干钠及镊子表面的煤油,用镊子夹紧放在玻璃片上,用小刀切去一端的外皮。观察钠的颜色、光泽、感受钠的硬度。
注意事项:凡是接触钠的用具都必须是干燥的。取用钠后剩余的钠应放回原瓶,残余的钠的碎屑不能随意乱扔。
实验探究3—2:钠在空气中加热
2Na + O2 === Na2O2
加热
常温下
4Na + O2 == 2Na2O
(白色)
加热或点燃
0
0
+1
-1
失去2e-
得到2e-
0
0
+1
-2
失去4e-
得到4e-
注意: 条件不一样,产物不同
不稳定
稳定
点燃
1.钠与氧气反应
2Na +O2 == Na2O2 (淡黄色)
过氧化钠
一、金属与非金属的反应
钠与其他非金属反应
反应剧烈
2Na + S =研磨= Na2S
点燃
2Na + Cl2 == 2NaCl
燃烧
白烟
爆炸
钠与氯气反应
钠与硫反应
一、金属与非金属的反应
科学探究:铝箔在空气中加热
未打磨的铝箔加热
打磨过的铝箔加热
4Al + 3O2 == 2Al2O3
加热
2、铝与氧气的反应
一、金属与非金属的反应
4Al + 3O2 === 2Al2O3
加热
强调:生活中Al2O3很多,如烧水用的铝壶,用一段时间后会发现表面变成灰色,这一层就是Al2O3,它很致密,起到保护内层金属的作用,故在洗刷时,不要将它硬刷掉。
Al2O3:白色固体
许多金属都能与氧气反应,反应的剧烈程度与其活泼性有关。其中越活泼的金属越容易反应,如Na、K等在空气中就能反应;Mg、Fe、Al等在加热或点燃时与氧气反应;不活泼金属反应时条件强一些。
金属与氧气反应的规律:
4、铝与某些氧化物的反应—铝热反应
2Al+Fe2O3===2Fe+Al2O3
4Al+3MnO2===3Mn+2Al2O3
3、镁与其它非金属和氧化物反应(N2、CO2等)
3Mg+N2===Mg3N2
2Mg+CO2===2MgO+C 2Mg+SO2===2MgO+S
应用:用来冶炼高熔点金属。
一、金属与非金属的反应
加热
点燃
加热
点燃
点燃
铝热剂:铝与高熔点金属氧化物
原理:Al为还原剂,放热,生成液态金属。
5、铁与非金属反应
点燃
△
3Fe + 2O2 Fe3O4
结论:根据Fe与O2、Cl2、S反应后的生成物中铁
元素的化合价,比较这三种非金属单质的
氧化性强弱。
2Fe + 3Cl2 2FeCl3
点燃
Fe + S == FeS
1. 钠与盐酸、稀硫酸的反应
2Na+2HCl==2NaCl+H2 ↑
2Na+H2SO4==Na2SO4+H2 ↑
实质: 2Na+2H+==2Na++H2 ↑
二、金属与酸的反应
2. 铝与盐酸、稀硫酸的反应
2Al+6HCl==2AlCl3+3H2 ↑
2Al+3H2SO4==Al2(SO4)3+3H2 ↑
实质: 2Al+6H+==2Al3++3H2 ↑
3. 铁与盐酸、稀硫酸的反应
Fe+2HCl==FeCl2+H2 ↑
Fe+H2SO4==FeSO4+H2 ↑
实质:Fe +2H+==2Fe2++H2 ↑
二、金属与酸的反应
小结:金属与酸的反应的规律:
⑴反应实质都是: M+H+→M++H2 ↑
⑵金属活动性顺序表中,H之前的金属,金属越活泼,
越容易与酸反应生成H2 。
⑶ 金属与HNO3(浓、稀)和浓H2SO4反应不能生成H2,
而是发生了其它的氧化还原反应生成了其它的气体。
4. 铝、铁与强氧化性酸的钝化反应
钝化反应:常温下,Fe、Al可与浓硝酸、浓硫酸发生钝化反应,在铁、铝表面形成一层致密的氧化膜,覆盖在金属表面,阻止了内部金属的进一步反应。
条件:冷(或常温)、浓
物质:金属(铁、铝);酸(浓硫酸、浓硝酸)
原理:发生反应,在金属表面生成致密氧化膜,阻止
反应的继续进行;
注意:发生了反应,只是很弱,反应的量可以忽略;若条件改变,则反应继续进行,但不一定是“金属与酸的置换反应”,还可能是“金属与它们发生氧化还原反应”。
用途:用铁制或铝制容器盛放、运输浓硫酸和浓硝酸。
思考:铝锅中水垢如何除去?
(醋酸、稀强酸、浓盐酸、浓硫酸、浓硝酸)
①.在“钠与氧气的反应”为什么不能用手直接拿金属钠?
②.能否把钠保存在汽油里或四氯化碳(CCl4)中?说明理由。)
(提示:汽油易挥发、易燃;CCl4的密度比钠的大)
③.“钠是一种还原性很强的金属,能把铜从 硫酸铜溶液中置换出来”。这种说法是否正确?为什么?
三、金属与水的反应
1.钠与水反应
浮在水面;
熔为小球;
四处游动;
嘶嘶作响;
逐渐消失,
酚酞变红。
钠的密度比水小
剧烈反应放热
钠的熔点较低
反应放出气体
浮
游
熔
声
红
生成碱性物质
2Na + 2H2O == 2NaOH + H2↑
失去2e-
得到2e-
+1
0
0
+1
实质:2Na+2H2O==2Na++2OH-+H2 ↑
(1)钠对人的皮肤有很强的腐蚀性,取用钠时必须用镊子,切不可用手拿。
(2)在实验室里钠是保存在煤油中的,钠和煤油都易着火,在实验过程中要注重防火。
(3)切下未用的钠应及时放回煤油中。
(4)实验用品中的镊子、小刀和滤纸都必须干 燥无水。
1、取一小试管,向其中加入等体积的水和煤油,然后把一小块金属钠放入到试管中,可以观察到什么现象?并解释。
答:钠在上下跳跃,并逐渐消失。
2、钠久置于空气的变化情况如何?
Na
O2
Na2O
H2O
CO2
NaOH
Na2CO3
2. 钾与水的反应:
2K+2H2O==2KOH+H2↑
比较:钾与水的反应比钠更剧烈,在液面上甚至能看到 燃烧。
三、金属与水的反应
3. 镁与水的反应
Mg+2H2O(热水)==Mg(OH)2+H2 ↑
比较:镁与水的反应很弱,加热时与热水才反应。
4. 铝与水的反应
2Al+6H2O(沸水)==2Al(OH)3+3H2 ↑
比较:铝与水的反应更弱,与沸水才缓慢反应。
思考:家里的铝壶一般能用十来年,你能说说为什么吗?
5、铁与水蒸气的反应
3Fe+4H2O(g) Fe3O4+4H2
高温
三、金属与水的反应
金属与水反应的规律:
⑴反应实质都是:金属与水电离出的H+反应生成H2。只是因为水的电离比酸要弱得多,故金属与水反应 都没有与酸反应那么剧烈。
⑵金属活动性顺序表中,K、Ca、Na等都能和水剧烈反应生成相应的碱和氢气;Mg、Al与水反应很弱,也生成碱和氢气;Fe与水蒸气在高温下反应生成四氧化三铁和氢气;不活泼金属很难与水反应 。
⑶ 金属与溶液反应时,一定要考虑是否与溶液中的水反应。钠与溶液反应一定发生:2Na+2H2O==2NaOH+H2↑。如果是酸溶液,先发生与酸的反应,再发生与水的反应;若是盐、碱溶液,一般先发生与水的反应,再发生NaOH与溶质的反应。
反应实质:
2Al+6H2O=2Al(OH)3+3H2 (很慢)
2Al(OH)3+2NaOH=2NaAlO2+4H2O (促进)
铝是还原剂,水是氧化剂。生成的氢气完全来源于水!
酸、碱、盐等可直接腐蚀铝制品,铝制餐具不宜用来蒸煮或长时间存放具有酸性、碱性或咸味的食物。
1.铝跟碱的反应
思考:如何除去铁粉中的铝粉?
加入NaOH溶液,过滤。
思考:如何除去铝粉中的铁粉?
用吸铁吸附
四、金属与碱的反应
偏铝酸钠
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
1. 在溶液中发生的置换反应
应用:
湿法冶铜:Fe+CuSO4=FeSO4+Cu
回收贵重金属:Fe+2AgNO3=Fe(NO4)2+2Ag
五、金属与盐溶液的反应
金属活动性顺序表中,位于前面的金属A能够把位于它后面的金属B从其盐(金属B的盐)溶液中置换出来:A+B的盐→A的盐+B
2. 钠与盐溶液的反应
+
_________________________________________________________
2Na+2H2O+CuSO4==Na2SO4 +Cu(OH)2 ↓ +H2 ↑
小结:钠与盐溶液反应时,
先与水发生置换反应,生成的NaOH再
考虑与溶液中的溶质是否反应。
但不能置换盐溶液中的任何金属。
2Na+2H2O==2NaOH+H2 ↑
CuSO4+2NaOH==Na2SO4+Cu(OH)2↓
五、金属与盐溶液的反应
思考与交流
1、小明家有一只20世纪50年代的铝锅,至今仍保存完好.
该铝锅未锈蚀的主要原因是( )
A.铝性质稳定,不易发生化学反应
B.铝不易被氧化
C.铝的氧化物容易发生还原反应
D.铝虽易被氧化,但氧化生成的氧化膜具有保护内部铝的作用
D
2、完成下列化学方程式
A. Na + O2 ━━━
B. Na + O2 ━━━
C. Mg+O2━━━
D. Fe+O2━━
E. Cu+O2━━
加热
加热
加热
加热
加热
加热
加热
加热
加热
加热
加热
A.4Na + O2 === 2Na2O
B.2Na + O2 === Na2O2
C.2Mg + O2 === 2MgO
D.3Fe + 2O2 === Fe3O4
E.2Cu + O2 === 2CuO
△
△
△
△
2010.11.
