1.4 化学方程式简单计算 精选练习(含答案)
文档属性
| 名称 | 1.4 化学方程式简单计算 精选练习(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 235.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-18 10:29:30 | ||
图片预览



文档简介
2021-2022学年华师大版九年级化学方程式简单计算的精选练习
一.选择题(共7小题)
1.(2021 绵阳)取20.0g KMnO4固体制氧气,加热一段时间后,固体质量减少1.6g。已分解KMnO4的质量占取用KMnO4总质量的百分率为( )
A.8% B.39.5% C.79% D.92%
2.(2021 贺州)将含有CH4和H2的混合气体6g完全燃烧,把产生的气体通入足量的澄清石灰水中,得到20g白色沉淀。则原混合气体中CH4和H2的质量比为( )
A.2:3 B.3:10 C.8:1 D.8:7
3.(2021 盐城)将CO和铁的氧化物FexOy置于密闭容器中,一定条件下充分反应至完全。反应过程中容器内部分物质的质量变化如图所示。下列说法正确的是( )
A.m的值为12.6
B.铁的氧化物中x:y=3:4
C.参加反应的铁的氧化物的质量为16g
D.当CO2质量为4.4g时,容器内CO质量为14g
4.(2021 德阳)碳酸氢钠(NaHCO3)是发酵粉的主要成分,常用于制作糕点、馒头的发泡剂。某同学为探究发酵粉样品中NaHCO3的质量分数,他取样品20.0g,进行如图实验探究:
假设样品中除NaHCO3之外的其他成分加热不发生变化,也不与盐酸反应,直接进入固体B中。下列判断正确的是( )
A.加热产生CO2的质量为3.1g
B.固体A中含有Na2CO3的质量为7.5g
C.蒸发结晶得到的固体B中含有剩余的HCl
D.原发酵粉样品中的NaHCO3的质量分数为84.0%
5.(2021 柳州)将8g CuO粉末加入到100g一定质量分数的稀H2SO4溶液中,微热到CuO完全溶解,再向溶液中加入Wg铁粉,使溶液中的溶质完全反应后过滤,将滤渣在低温下烘干,干燥后固体质量仍然为Wg。下列分析不正确的是( )
A.W可能是5.6 B.W可能是6.4 C.W可能是8 D.W可能是12
6.(2021 河南)现将含有某一种氯化物杂质的MgCl2粉末95g溶于水后,与足量的AgNO3溶液反应,可生成AgCl沉淀290g。则该MgCl2粉末中含有的杂质可能是( )
A.NaCl B.CaCl2 C.AlCl3 D.KCl
7.(2021 哈尔滨)实验室为测定铁和铜的固体混合物中铜的质量分数,取11.2g该混合物,向其中加入足量的硫酸铜溶液,充分反应后过滤、洗涤,将不溶性固体在空气中加热,待其完全变为黑色固体(CuO)后,称量黑色固体为15g。则原固体混合物中铜的质量分数为( )
A.64% B.40% C.56% D.50%
二.计算题(共8小题)
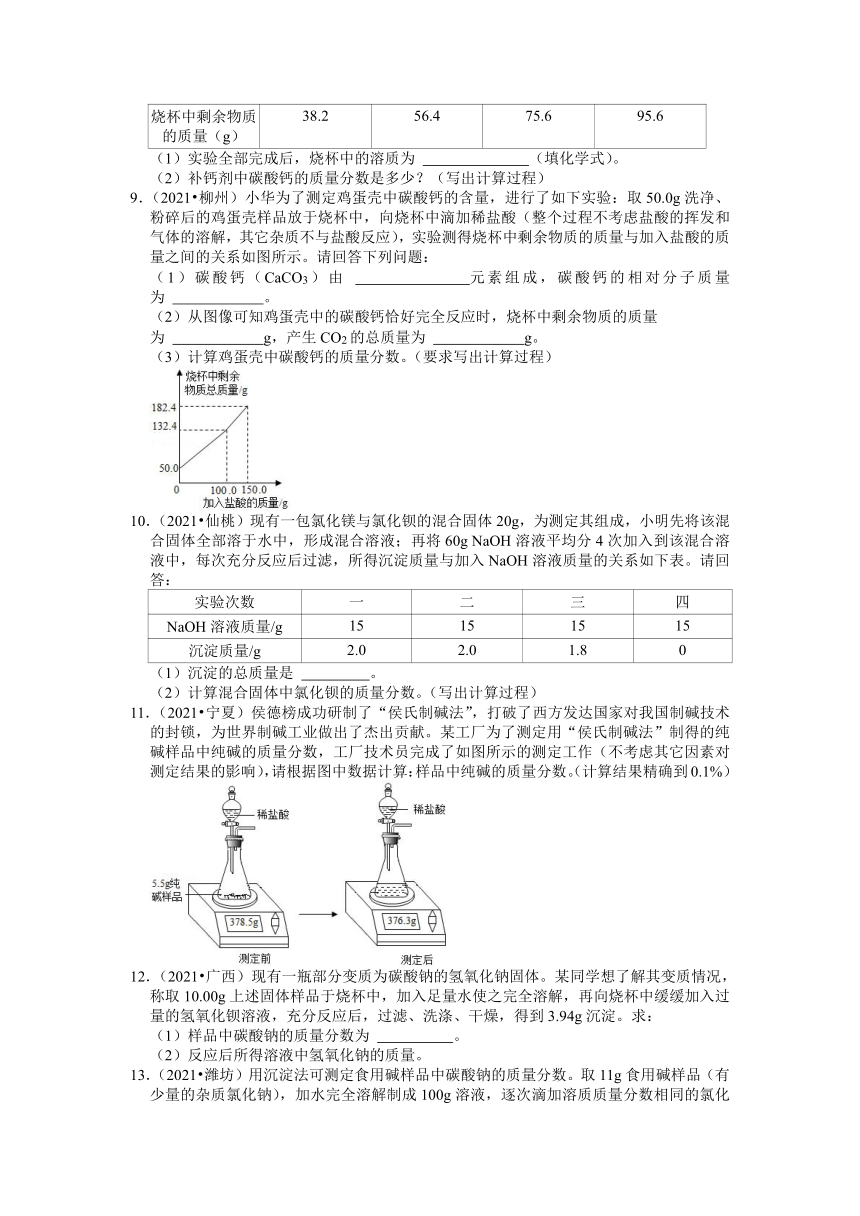
8.(2021 荆门)某补钙剂主要成分为碳酸钙(其他成分不溶于水也不与酸反应)。为了测定补钙剂中碳酸钙的质量分数,小明同学称取20g补钙剂放入烧杯中,再将80g稀盐酸分四次加入,充分反应后,测得的实验数据如表所示:
第1次 第2次 第3次 第4次
加入稀盐酸的质量(g) 20 20 20 20
烧杯中剩余物质的质量(g) 38.2 56.4 75.6 95.6
(1)实验全部完成后,烧杯中的溶质为 (填化学式)。
(2)补钙剂中碳酸钙的质量分数是多少?(写出计算过程)
9.(2021 柳州)小华为了测定鸡蛋壳中碳酸钙的含量,进行了如下实验:取50.0g洗净、粉碎后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸(整个过程不考虑盐酸的挥发和气体的溶解,其它杂质不与盐酸反应),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。请回答下列问题:
(1)碳酸钙(CaCO3)由 元素组成,碳酸钙的相对分子质量为 。
(2)从图像可知鸡蛋壳中的碳酸钙恰好完全反应时,烧杯中剩余物质的质量
为 g,产生CO2的总质量为 g。
(3)计算鸡蛋壳中碳酸钙的质量分数。(要求写出计算过程)
10.(2021 仙桃)现有一包氯化镁与氯化钡的混合固体20g,为测定其组成,小明先将该混合固体全部溶于水中,形成混合溶液;再将60g NaOH溶液平均分4次加入到该混合溶液中,每次充分反应后过滤,所得沉淀质量与加入NaOH溶液质量的关系如下表。请回答:
实验次数 一 二 三 四
NaOH溶液质量/g 15 15 15 15
沉淀质量/g 2.0 2.0 1.8 0
(1)沉淀的总质量是 。
(2)计算混合固体中氯化钡的质量分数。(写出计算过程)
11.(2021 宁夏)侯德榜成功研制了“侯氏制碱法”,打破了西方发达国家对我国制碱技术的封锁,为世界制碱工业做出了杰出贡献。某工厂为了测定用“侯氏制碱法”制得的纯碱样品中纯碱的质量分数,工厂技术员完成了如图所示的测定工作(不考虑其它因素对测定结果的影响),请根据图中数据计算:样品中纯碱的质量分数。(计算结果精确到0.1%)
12.(2021 广西)现有一瓶部分变质为碳酸钠的氢氧化钠固体。某同学想了解其变质情况,称取10.00g上述固体样品于烧杯中,加入足量水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,充分反应后,过滤、洗涤、干燥,得到3.94g沉淀。求:
(1)样品中碳酸钠的质量分数为 。
(2)反应后所得溶液中氢氧化钠的质量。
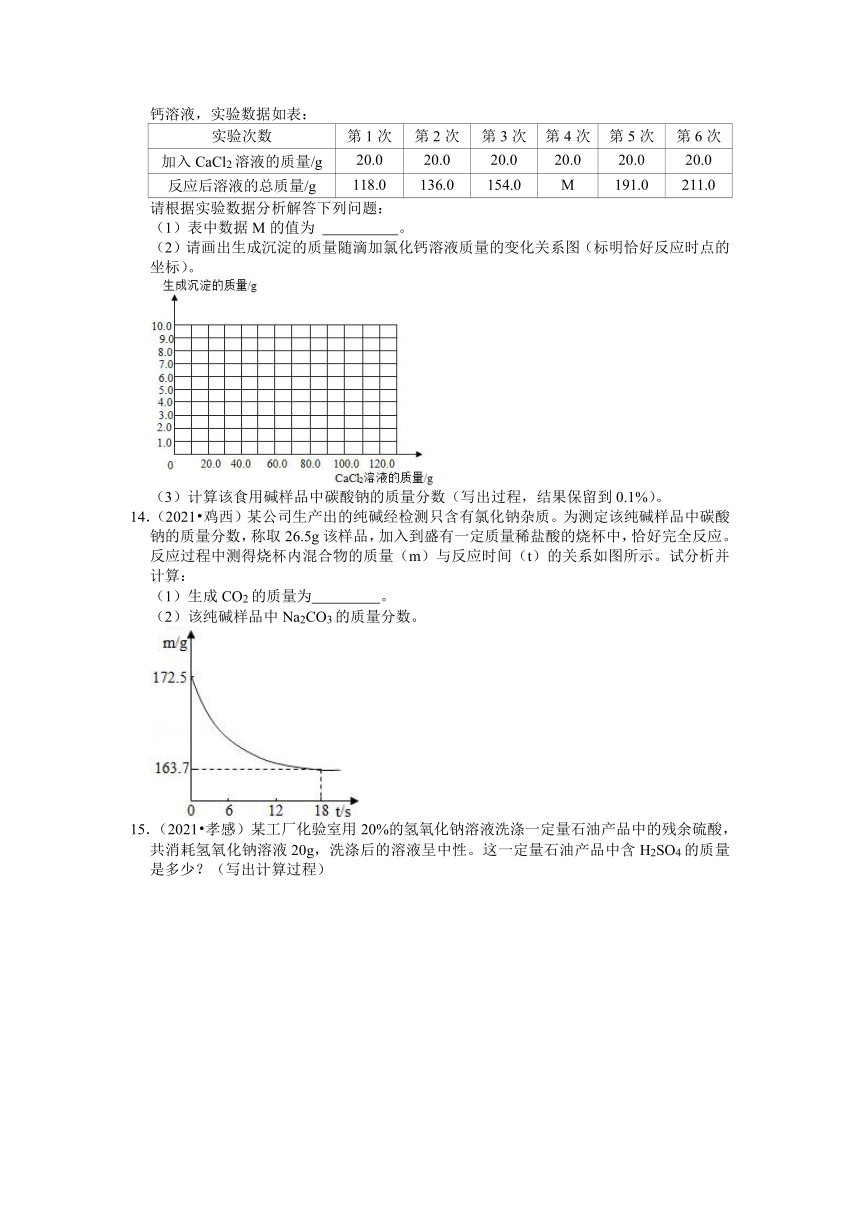
13.(2021 潍坊)用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如表:
实验次数 第1次 第2次 第3次 第4次 第5次 第6次
加入CaCl2溶液的质量/g 20.0 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 M 191.0 211.0
请根据实验数据分析解答下列问题:
(1)表中数据M的值为 。
(2)请画出生成沉淀的质量随滴加氯化钙溶液质量的变化关系图(标明恰好反应时点的坐标)。
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
14.(2021 鸡西)某公司生产出的纯碱经检测只含有氯化钠杂质。为测定该纯碱样品中碳酸钠的质量分数,称取26.5g该样品,加入到盛有一定质量稀盐酸的烧杯中,恰好完全反应。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)的关系如图所示。试分析并计算:
(1)生成CO2的质量为 。
(2)该纯碱样品中Na2CO3的质量分数。
15.(2021 孝感)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液20g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?(写出计算过程)
2021-2022学年华师大版九年级化学方程式简单计算的精选练习
参考答案与试题解析
一.选择题(共7小题)
1.(2021 绵阳)取20.0g KMnO4固体制氧气,加热一段时间后,固体质量减少1.6g。已分解KMnO4的质量占取用KMnO4总质量的百分率为( )
A.8% B.39.5% C.79% D.92%
【解答】解:设生成1.6g氧气需要高锰酸钾的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 1.6g
x=15.8g
已分解KMnO4的质量占取用KMnO4总质量的百分率为:
=79%
故选:C。
2.(2021 贺州)将含有CH4和H2的混合气体6g完全燃烧,把产生的气体通入足量的澄清石灰水中,得到20g白色沉淀。则原混合气体中CH4和H2的质量比为( )
A.2:3 B.3:10 C.8:1 D.8:7
【解答】解:设甲烷质量为x,
由CH4+2O2CO2+2H2O、Ca(OH)2+CO2═CaCO3↓+H2O可知,CH4﹣CaCO3,
CH4﹣CaCO3,
16 100
x 20g
=,
x=3.2g,
则原混合气体中CH4和H2的质量比为:3.2g:(6g﹣3.2g)=8:7.
故选:D。
3.(2021 盐城)将CO和铁的氧化物FexOy置于密闭容器中,一定条件下充分反应至完全。反应过程中容器内部分物质的质量变化如图所示。下列说法正确的是( )
A.m的值为12.6
B.铁的氧化物中x:y=3:4
C.参加反应的铁的氧化物的质量为16g
D.当CO2质量为4.4g时,容器内CO质量为14g
【解答】解:A、由反应的化学方程式:
yCO+FexOyxFe+yCO2,
28y 44y
(m﹣8.4)g 13.2g
m=16.8,故m的值为16.8,故选项说法错误。
B、生成铁的质量为16.8g,参加反应的一氧化碳的质量为16.8g﹣8.4g=8.4g,则铁的氧化物中氧元素的质量为13.2g﹣8.4g=4.8g,则铁的氧化物中x:y=:=1:1,故选项说法错误。
C、参加反应的铁的氧化物的质量为16.8g+4.8g=21.6g,故选项说法错误。
D、当CO2质量为4.4g时,由反应的化学方程式,则参加反应的一氧化碳的质量为2.8g,容器内CO质量为16.8g﹣2.8g=14g,故选项说法正确。
故选:D。
4.(2021 德阳)碳酸氢钠(NaHCO3)是发酵粉的主要成分,常用于制作糕点、馒头的发泡剂。某同学为探究发酵粉样品中NaHCO3的质量分数,他取样品20.0g,进行如图实验探究:
假设样品中除NaHCO3之外的其他成分加热不发生变化,也不与盐酸反应,直接进入固体B中。下列判断正确的是( )
A.加热产生CO2的质量为3.1g
B.固体A中含有Na2CO3的质量为7.5g
C.蒸发结晶得到的固体B中含有剩余的HCl
D.原发酵粉样品中的NaHCO3的质量分数为84.0%
【解答】解:A.碳酸氢钠分解的反应方程式为2NaHCO3Na2CO3+H2O+CO2↑,依据质量守恒定律可知,加热产生H2O和CO2的质量为20.0g﹣16.9g=3.1g;故A错误;
B.设加热生成碳酸钠的质量为x
2NaHCO3Na2CO3+H2O+CO2↑ 固体减少量△N
168 106 62
x 3.1g
=
x=5.3g
则固体A中含有Na2CO3的质量为5.3g,故B错误;
C.HCl为气体,则蒸发结晶得到的固体B中不可能含有剩余的HCl,故C错误;
D.分析2NaHCO3Na2CO3+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,Na2CO3+2HCl=2NaCl+H2O+CO2↑可得如下关系
设原固体中NaHCO3的质量为y
NaHCO3~~NaCl 固体减少量△M
84 58.5 25.5
y 20.0g﹣14.9g
=
y=16.8g
则原发酵粉样品中的NaHCO3的质量分数为×100%=84.0%
故D正确;
故选:D。
5.(2021 柳州)将8g CuO粉末加入到100g一定质量分数的稀H2SO4溶液中,微热到CuO完全溶解,再向溶液中加入Wg铁粉,使溶液中的溶质完全反应后过滤,将滤渣在低温下烘干,干燥后固体质量仍然为Wg。下列分析不正确的是( )
A.W可能是5.6 B.W可能是6.4 C.W可能是8 D.W可能是12
【解答】解:铁与稀硫酸反应生成硫酸亚铁和氢气,铁与硫酸铜反应生成硫酸亚铁和铜。反应中铁、铜质量比为56:64。若加入铁粉后,铁只与硫酸铜反应,则反应后固体质量增加。根据题干信息,反应前所加铁粉质量与最终所得固体质量相等,说明最初加入8g氧化铜完全反应后,稀硫酸有剩余,即Wg铁粉中一部分与硫酸反应了,另一部分与硫酸铜反应。氧化铜与稀硫酸反应生成硫酸铜和水,反应中氧化铜和硫酸铜的质量比为80:160。因此8g氧化铜完全溶解,生成硫酸铜质量为16g。铁与硫酸铜的反应中铁和硫酸铜质量比为56:160,因此16g硫酸铜反应消耗铁的质量为5.6g。若W是5.6生成铜的质量为6.4g,A说法不正确;若W大于5.6,则除5.6g与硫酸铜反应外,其余部分铁与剩余的稀硫酸反应,干燥后固体质量可能不变。所以B、C、D说法正确。
故选:A。
6.(2021 河南)现将含有某一种氯化物杂质的MgCl2粉末95g溶于水后,与足量的AgNO3溶液反应,可生成AgCl沉淀290g。则该MgCl2粉末中含有的杂质可能是( )
A.NaCl B.CaCl2 C.AlCl3 D.KCl
【解答】解:若考虑极限情况,即氯化镁中不含杂质,则95g可生成AgCl287g,现生成AgCl沉淀290g,说明杂质是含氯量大于MgCl2中含氯量的物质,氯化镁中Cl的含量为≈0.75。
A、氯化钠中Cl的含量为:≈0.61,小于氯化镁中Cl的含量,故A错误;
B、氯化钙中Cl的含量为:≈0.64,小于氯化镁中Cl的含量,故B错误;
C、氯化铝中Cl的含量为:≈0.80,大于氯化镁中Cl的含量,故C正确;
D、氯化钾中Cl的含量为:≈0.48,小于氯化镁中Cl的含量,故D错误;
故选:C。
7.(2021 哈尔滨)实验室为测定铁和铜的固体混合物中铜的质量分数,取11.2g该混合物,向其中加入足量的硫酸铜溶液,充分反应后过滤、洗涤,将不溶性固体在空气中加热,待其完全变为黑色固体(CuO)后,称量黑色固体为15g。则原固体混合物中铜的质量分数为( )
A.64% B.40% C.56% D.50%
【解答】解,设固体混合物中铁的质量为x,则其中铜的质量为11.2g﹣x
设x的铁与硫酸铜反应生成的铜的质量为m
Fe+CuSO4=Cu+FeSO4
56 64
x m
=
m=x
2Cu+O2 2CuO
2×64 2×80
(11.2g﹣x)+x 15g
=
x=5.6g
因此原固体混合物中铜的质量分数为×100%=50%
故选:D。
二.计算题(共8小题)
8.(2021 荆门)某补钙剂主要成分为碳酸钙(其他成分不溶于水也不与酸反应)。为了测定补钙剂中碳酸钙的质量分数,小明同学称取20g补钙剂放入烧杯中,再将80g稀盐酸分四次加入,充分反应后,测得的实验数据如表所示:
第1次 第2次 第3次 第4次
加入稀盐酸的质量(g) 20 20 20 20
烧杯中剩余物质的质量(g) 38.2 56.4 75.6 95.6
(1)实验全部完成后,烧杯中的溶质为 HCl、CaCl2 (填化学式)。
(2)补钙剂中碳酸钙的质量分数是多少?(写出计算过程)
【解答】解:(1)第4次加入20g稀盐酸,烧杯中剩余物质质量增加95.6g﹣75.6g=20g,说明碳酸钙已经完全反应,全部完成后,盐酸有剩余,烧杯中的溶质为HCl、CaCl2。
(2)由质量守恒定律,产生二氧化碳气体的质量为20g+80g﹣95.6g=4.4g。
设该补钙剂中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
x=10g
该补钙剂中碳酸钙的质量分数为×100%=50%。
答:该补钙剂中碳酸钙的质量分数为50%。
故答案为:(1)HCl、CaCl2;(2)50%。
9.(2021 柳州)小华为了测定鸡蛋壳中碳酸钙的含量,进行了如下实验:取50.0g洗净、粉碎后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸(整个过程不考虑盐酸的挥发和气体的溶解,其它杂质不与盐酸反应),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。请回答下列问题:
(1)碳酸钙(CaCO3)由 钙、碳、氧三种 元素组成,碳酸钙的相对分子质量为 100 。
(2)从图像可知鸡蛋壳中的碳酸钙恰好完全反应时,烧杯中剩余物质的质量
为 132.4 g,产生CO2的总质量为 17.6 g。
(3)计算鸡蛋壳中碳酸钙的质量分数。(要求写出计算过程)
【解答】解:(1)碳酸钙是由钙、碳、氧三种元素组成的;碳酸钙的相对分子质量为40+12+16×3=100;
(2)由图中信息,可知鸡蛋壳中的碳酸钙恰好完全反应,即加入100g盐酸时,烧杯中剩余物质的质量=132.4g,根据质量守恒定律可知反应前后减少的质量就是生成二氧化碳的质量,产生CO2的总质量为50.0g+100g﹣132.4g=17.6g;
(3)设鸡蛋壳中碳酸钙的质量是x。
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 17.6g
x=40g
鸡蛋壳中碳酸钙的质量分数=80%
答:鸡蛋壳中碳酸钙的质量分数为80%。
故答案为:(1)钙、碳、氧三种;100;(2)132.4;17.6;(3)80%。
10.(2021 仙桃)现有一包氯化镁与氯化钡的混合固体20g,为测定其组成,小明先将该混合固体全部溶于水中,形成混合溶液;再将60g NaOH溶液平均分4次加入到该混合溶液中,每次充分反应后过滤,所得沉淀质量与加入NaOH溶液质量的关系如下表。请回答:
实验次数 一 二 三 四
NaOH溶液质量/g 15 15 15 15
沉淀质量/g 2.0 2.0 1.8 0
(1)沉淀的总质量是 5.8g 。
(2)计算混合固体中氯化钡的质量分数。(写出计算过程)
【解答】解:(1)沉淀的总质量是:2.0g+2.0g+1.8g=5.8g。
故填:5.8g。
(2)设氯化镁质量为x,
MgCl2+2NaOH═Mg(OH)2↓+2NaCl,
95 58
x 5.8g
=,
x=9.5g,
混合固体中氯化钡的质量分数是:100%=52.5%,
答:混合固体中氯化钡的质量分数是52.5%。
11.(2021 宁夏)侯德榜成功研制了“侯氏制碱法”,打破了西方发达国家对我国制碱技术的封锁,为世界制碱工业做出了杰出贡献。某工厂为了测定用“侯氏制碱法”制得的纯碱样品中纯碱的质量分数,工厂技术员完成了如图所示的测定工作(不考虑其它因素对测定结果的影响),请根据图中数据计算:样品中纯碱的质量分数。(计算结果精确到0.1%)
【解答】解:生成二氧化碳的质量为:378.5g﹣376.3g=2.2g;
设参加反应的碳酸钠的质量为x
2HCl+Na2CO3=2NaCl+H2O+CO2↑
106 44
x 2.2g
=
x=5.3g
所以样品中纯碱的质量分数是×100%≈96.4%
答:样品中纯碱的质量分数是96.4%。
12.(2021 广西)现有一瓶部分变质为碳酸钠的氢氧化钠固体。某同学想了解其变质情况,称取10.00g上述固体样品于烧杯中,加入足量水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,充分反应后,过滤、洗涤、干燥,得到3.94g沉淀。求:
(1)样品中碳酸钠的质量分数为 21.2% 。
(2)反应后所得溶液中氢氧化钠的质量。
【解答】解:(1)设参加反应的碳酸钠的质量为x,生成氢氧化钠的质量为y。
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
106 197 80
x 3.94g y
x=2.12g y=1.60g,
样品中碳酸钠的质量分数为:
=21.2%;
(2)反应后所得溶液中氢氧化钠的质量为:
1.60g+(10.00g﹣2.12g)=9.48g
答:反应后所得溶液中氢氧化钠的质量为9.48g。
故答案为:
(1)21.2%;
(2)9.48g。
13.(2021 潍坊)用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如表:
实验次数 第1次 第2次 第3次 第4次 第5次 第6次
加入CaCl2溶液的质量/g 20.0 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 M 191.0 211.0
请根据实验数据分析解答下列问题:
(1)表中数据M的值为 172.0 。
(2)请画出生成沉淀的质量随滴加氯化钙溶液质量的变化关系图(标明恰好反应时点的坐标)。
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
【解答】解:(1)根据表格提供的数据可以看出,11g纯碱样品产生沉淀的总质量为:100g+20.0g×6﹣211.0g=9.0g,开始时每20.0g氯化钙溶液产生2.0g沉淀,第5次到第6次不再改变,说明第5次时沉淀完全,故第4次加入20。0g氯化钙溶液也是产生2.0g沉淀,故M=154.0g+20.0g﹣2g=172.0g,故填:172.0;
(2)综合分析数据可以看出,每10.0g氯化钙溶液产生碳酸钙沉淀1.0g,产生9.0g碳酸钙需要氯化钙溶液的质量为90.0g,故图像为:
故填:;
(3)设碳酸钠的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 9.0g
x=9.54g
故碳酸钠的质量分数为:86.7%
答:该食用碱样品中碳酸钠的质量分数86.7%。
14.(2021 鸡西)某公司生产出的纯碱经检测只含有氯化钠杂质。为测定该纯碱样品中碳酸钠的质量分数,称取26.5g该样品,加入到盛有一定质量稀盐酸的烧杯中,恰好完全反应。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)的关系如图所示。试分析并计算:
(1)生成CO2的质量为 8.8g 。
(2)该纯碱样品中Na2CO3的质量分数。
【解答】解:(1)根据质量守恒定律可得,生成的二氧化碳的质量为:172.5g﹣163.7g=8.8g;
(2)设纯碱样品中Na2CO3的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 8.8g
解得:x=21.2g
该纯碱样品中Na2CO3的质量分数为 ×100%=80%。
答:该纯碱样品中Na2CO3的质量分数为80%;
故答案为:(1)8.8g;
(2)80%。
15.(2021 孝感)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液20g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?(写出计算过程)
【解答】解:设一定量石油产品中含H2SO4的质量为x
2NaOH+H2SO4=Na2SO4+2H2O
80 98
20%×20g x
=
x=4.9g
答:一定量石油产品中含H2SO4的质量为4.9g。
一.选择题(共7小题)
1.(2021 绵阳)取20.0g KMnO4固体制氧气,加热一段时间后,固体质量减少1.6g。已分解KMnO4的质量占取用KMnO4总质量的百分率为( )
A.8% B.39.5% C.79% D.92%
2.(2021 贺州)将含有CH4和H2的混合气体6g完全燃烧,把产生的气体通入足量的澄清石灰水中,得到20g白色沉淀。则原混合气体中CH4和H2的质量比为( )
A.2:3 B.3:10 C.8:1 D.8:7
3.(2021 盐城)将CO和铁的氧化物FexOy置于密闭容器中,一定条件下充分反应至完全。反应过程中容器内部分物质的质量变化如图所示。下列说法正确的是( )
A.m的值为12.6
B.铁的氧化物中x:y=3:4
C.参加反应的铁的氧化物的质量为16g
D.当CO2质量为4.4g时,容器内CO质量为14g
4.(2021 德阳)碳酸氢钠(NaHCO3)是发酵粉的主要成分,常用于制作糕点、馒头的发泡剂。某同学为探究发酵粉样品中NaHCO3的质量分数,他取样品20.0g,进行如图实验探究:
假设样品中除NaHCO3之外的其他成分加热不发生变化,也不与盐酸反应,直接进入固体B中。下列判断正确的是( )
A.加热产生CO2的质量为3.1g
B.固体A中含有Na2CO3的质量为7.5g
C.蒸发结晶得到的固体B中含有剩余的HCl
D.原发酵粉样品中的NaHCO3的质量分数为84.0%
5.(2021 柳州)将8g CuO粉末加入到100g一定质量分数的稀H2SO4溶液中,微热到CuO完全溶解,再向溶液中加入Wg铁粉,使溶液中的溶质完全反应后过滤,将滤渣在低温下烘干,干燥后固体质量仍然为Wg。下列分析不正确的是( )
A.W可能是5.6 B.W可能是6.4 C.W可能是8 D.W可能是12
6.(2021 河南)现将含有某一种氯化物杂质的MgCl2粉末95g溶于水后,与足量的AgNO3溶液反应,可生成AgCl沉淀290g。则该MgCl2粉末中含有的杂质可能是( )
A.NaCl B.CaCl2 C.AlCl3 D.KCl
7.(2021 哈尔滨)实验室为测定铁和铜的固体混合物中铜的质量分数,取11.2g该混合物,向其中加入足量的硫酸铜溶液,充分反应后过滤、洗涤,将不溶性固体在空气中加热,待其完全变为黑色固体(CuO)后,称量黑色固体为15g。则原固体混合物中铜的质量分数为( )
A.64% B.40% C.56% D.50%
二.计算题(共8小题)
8.(2021 荆门)某补钙剂主要成分为碳酸钙(其他成分不溶于水也不与酸反应)。为了测定补钙剂中碳酸钙的质量分数,小明同学称取20g补钙剂放入烧杯中,再将80g稀盐酸分四次加入,充分反应后,测得的实验数据如表所示:
第1次 第2次 第3次 第4次
加入稀盐酸的质量(g) 20 20 20 20
烧杯中剩余物质的质量(g) 38.2 56.4 75.6 95.6
(1)实验全部完成后,烧杯中的溶质为 (填化学式)。
(2)补钙剂中碳酸钙的质量分数是多少?(写出计算过程)
9.(2021 柳州)小华为了测定鸡蛋壳中碳酸钙的含量,进行了如下实验:取50.0g洗净、粉碎后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸(整个过程不考虑盐酸的挥发和气体的溶解,其它杂质不与盐酸反应),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。请回答下列问题:
(1)碳酸钙(CaCO3)由 元素组成,碳酸钙的相对分子质量为 。
(2)从图像可知鸡蛋壳中的碳酸钙恰好完全反应时,烧杯中剩余物质的质量
为 g,产生CO2的总质量为 g。
(3)计算鸡蛋壳中碳酸钙的质量分数。(要求写出计算过程)
10.(2021 仙桃)现有一包氯化镁与氯化钡的混合固体20g,为测定其组成,小明先将该混合固体全部溶于水中,形成混合溶液;再将60g NaOH溶液平均分4次加入到该混合溶液中,每次充分反应后过滤,所得沉淀质量与加入NaOH溶液质量的关系如下表。请回答:
实验次数 一 二 三 四
NaOH溶液质量/g 15 15 15 15
沉淀质量/g 2.0 2.0 1.8 0
(1)沉淀的总质量是 。
(2)计算混合固体中氯化钡的质量分数。(写出计算过程)
11.(2021 宁夏)侯德榜成功研制了“侯氏制碱法”,打破了西方发达国家对我国制碱技术的封锁,为世界制碱工业做出了杰出贡献。某工厂为了测定用“侯氏制碱法”制得的纯碱样品中纯碱的质量分数,工厂技术员完成了如图所示的测定工作(不考虑其它因素对测定结果的影响),请根据图中数据计算:样品中纯碱的质量分数。(计算结果精确到0.1%)
12.(2021 广西)现有一瓶部分变质为碳酸钠的氢氧化钠固体。某同学想了解其变质情况,称取10.00g上述固体样品于烧杯中,加入足量水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,充分反应后,过滤、洗涤、干燥,得到3.94g沉淀。求:
(1)样品中碳酸钠的质量分数为 。
(2)反应后所得溶液中氢氧化钠的质量。
13.(2021 潍坊)用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如表:
实验次数 第1次 第2次 第3次 第4次 第5次 第6次
加入CaCl2溶液的质量/g 20.0 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 M 191.0 211.0
请根据实验数据分析解答下列问题:
(1)表中数据M的值为 。
(2)请画出生成沉淀的质量随滴加氯化钙溶液质量的变化关系图(标明恰好反应时点的坐标)。
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
14.(2021 鸡西)某公司生产出的纯碱经检测只含有氯化钠杂质。为测定该纯碱样品中碳酸钠的质量分数,称取26.5g该样品,加入到盛有一定质量稀盐酸的烧杯中,恰好完全反应。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)的关系如图所示。试分析并计算:
(1)生成CO2的质量为 。
(2)该纯碱样品中Na2CO3的质量分数。
15.(2021 孝感)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液20g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?(写出计算过程)
2021-2022学年华师大版九年级化学方程式简单计算的精选练习
参考答案与试题解析
一.选择题(共7小题)
1.(2021 绵阳)取20.0g KMnO4固体制氧气,加热一段时间后,固体质量减少1.6g。已分解KMnO4的质量占取用KMnO4总质量的百分率为( )
A.8% B.39.5% C.79% D.92%
【解答】解:设生成1.6g氧气需要高锰酸钾的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 1.6g
x=15.8g
已分解KMnO4的质量占取用KMnO4总质量的百分率为:
=79%
故选:C。
2.(2021 贺州)将含有CH4和H2的混合气体6g完全燃烧,把产生的气体通入足量的澄清石灰水中,得到20g白色沉淀。则原混合气体中CH4和H2的质量比为( )
A.2:3 B.3:10 C.8:1 D.8:7
【解答】解:设甲烷质量为x,
由CH4+2O2CO2+2H2O、Ca(OH)2+CO2═CaCO3↓+H2O可知,CH4﹣CaCO3,
CH4﹣CaCO3,
16 100
x 20g
=,
x=3.2g,
则原混合气体中CH4和H2的质量比为:3.2g:(6g﹣3.2g)=8:7.
故选:D。
3.(2021 盐城)将CO和铁的氧化物FexOy置于密闭容器中,一定条件下充分反应至完全。反应过程中容器内部分物质的质量变化如图所示。下列说法正确的是( )
A.m的值为12.6
B.铁的氧化物中x:y=3:4
C.参加反应的铁的氧化物的质量为16g
D.当CO2质量为4.4g时,容器内CO质量为14g
【解答】解:A、由反应的化学方程式:
yCO+FexOyxFe+yCO2,
28y 44y
(m﹣8.4)g 13.2g
m=16.8,故m的值为16.8,故选项说法错误。
B、生成铁的质量为16.8g,参加反应的一氧化碳的质量为16.8g﹣8.4g=8.4g,则铁的氧化物中氧元素的质量为13.2g﹣8.4g=4.8g,则铁的氧化物中x:y=:=1:1,故选项说法错误。
C、参加反应的铁的氧化物的质量为16.8g+4.8g=21.6g,故选项说法错误。
D、当CO2质量为4.4g时,由反应的化学方程式,则参加反应的一氧化碳的质量为2.8g,容器内CO质量为16.8g﹣2.8g=14g,故选项说法正确。
故选:D。
4.(2021 德阳)碳酸氢钠(NaHCO3)是发酵粉的主要成分,常用于制作糕点、馒头的发泡剂。某同学为探究发酵粉样品中NaHCO3的质量分数,他取样品20.0g,进行如图实验探究:
假设样品中除NaHCO3之外的其他成分加热不发生变化,也不与盐酸反应,直接进入固体B中。下列判断正确的是( )
A.加热产生CO2的质量为3.1g
B.固体A中含有Na2CO3的质量为7.5g
C.蒸发结晶得到的固体B中含有剩余的HCl
D.原发酵粉样品中的NaHCO3的质量分数为84.0%
【解答】解:A.碳酸氢钠分解的反应方程式为2NaHCO3Na2CO3+H2O+CO2↑,依据质量守恒定律可知,加热产生H2O和CO2的质量为20.0g﹣16.9g=3.1g;故A错误;
B.设加热生成碳酸钠的质量为x
2NaHCO3Na2CO3+H2O+CO2↑ 固体减少量△N
168 106 62
x 3.1g
=
x=5.3g
则固体A中含有Na2CO3的质量为5.3g,故B错误;
C.HCl为气体,则蒸发结晶得到的固体B中不可能含有剩余的HCl,故C错误;
D.分析2NaHCO3Na2CO3+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,Na2CO3+2HCl=2NaCl+H2O+CO2↑可得如下关系
设原固体中NaHCO3的质量为y
NaHCO3~~NaCl 固体减少量△M
84 58.5 25.5
y 20.0g﹣14.9g
=
y=16.8g
则原发酵粉样品中的NaHCO3的质量分数为×100%=84.0%
故D正确;
故选:D。
5.(2021 柳州)将8g CuO粉末加入到100g一定质量分数的稀H2SO4溶液中,微热到CuO完全溶解,再向溶液中加入Wg铁粉,使溶液中的溶质完全反应后过滤,将滤渣在低温下烘干,干燥后固体质量仍然为Wg。下列分析不正确的是( )
A.W可能是5.6 B.W可能是6.4 C.W可能是8 D.W可能是12
【解答】解:铁与稀硫酸反应生成硫酸亚铁和氢气,铁与硫酸铜反应生成硫酸亚铁和铜。反应中铁、铜质量比为56:64。若加入铁粉后,铁只与硫酸铜反应,则反应后固体质量增加。根据题干信息,反应前所加铁粉质量与最终所得固体质量相等,说明最初加入8g氧化铜完全反应后,稀硫酸有剩余,即Wg铁粉中一部分与硫酸反应了,另一部分与硫酸铜反应。氧化铜与稀硫酸反应生成硫酸铜和水,反应中氧化铜和硫酸铜的质量比为80:160。因此8g氧化铜完全溶解,生成硫酸铜质量为16g。铁与硫酸铜的反应中铁和硫酸铜质量比为56:160,因此16g硫酸铜反应消耗铁的质量为5.6g。若W是5.6生成铜的质量为6.4g,A说法不正确;若W大于5.6,则除5.6g与硫酸铜反应外,其余部分铁与剩余的稀硫酸反应,干燥后固体质量可能不变。所以B、C、D说法正确。
故选:A。
6.(2021 河南)现将含有某一种氯化物杂质的MgCl2粉末95g溶于水后,与足量的AgNO3溶液反应,可生成AgCl沉淀290g。则该MgCl2粉末中含有的杂质可能是( )
A.NaCl B.CaCl2 C.AlCl3 D.KCl
【解答】解:若考虑极限情况,即氯化镁中不含杂质,则95g可生成AgCl287g,现生成AgCl沉淀290g,说明杂质是含氯量大于MgCl2中含氯量的物质,氯化镁中Cl的含量为≈0.75。
A、氯化钠中Cl的含量为:≈0.61,小于氯化镁中Cl的含量,故A错误;
B、氯化钙中Cl的含量为:≈0.64,小于氯化镁中Cl的含量,故B错误;
C、氯化铝中Cl的含量为:≈0.80,大于氯化镁中Cl的含量,故C正确;
D、氯化钾中Cl的含量为:≈0.48,小于氯化镁中Cl的含量,故D错误;
故选:C。
7.(2021 哈尔滨)实验室为测定铁和铜的固体混合物中铜的质量分数,取11.2g该混合物,向其中加入足量的硫酸铜溶液,充分反应后过滤、洗涤,将不溶性固体在空气中加热,待其完全变为黑色固体(CuO)后,称量黑色固体为15g。则原固体混合物中铜的质量分数为( )
A.64% B.40% C.56% D.50%
【解答】解,设固体混合物中铁的质量为x,则其中铜的质量为11.2g﹣x
设x的铁与硫酸铜反应生成的铜的质量为m
Fe+CuSO4=Cu+FeSO4
56 64
x m
=
m=x
2Cu+O2 2CuO
2×64 2×80
(11.2g﹣x)+x 15g
=
x=5.6g
因此原固体混合物中铜的质量分数为×100%=50%
故选:D。
二.计算题(共8小题)
8.(2021 荆门)某补钙剂主要成分为碳酸钙(其他成分不溶于水也不与酸反应)。为了测定补钙剂中碳酸钙的质量分数,小明同学称取20g补钙剂放入烧杯中,再将80g稀盐酸分四次加入,充分反应后,测得的实验数据如表所示:
第1次 第2次 第3次 第4次
加入稀盐酸的质量(g) 20 20 20 20
烧杯中剩余物质的质量(g) 38.2 56.4 75.6 95.6
(1)实验全部完成后,烧杯中的溶质为 HCl、CaCl2 (填化学式)。
(2)补钙剂中碳酸钙的质量分数是多少?(写出计算过程)
【解答】解:(1)第4次加入20g稀盐酸,烧杯中剩余物质质量增加95.6g﹣75.6g=20g,说明碳酸钙已经完全反应,全部完成后,盐酸有剩余,烧杯中的溶质为HCl、CaCl2。
(2)由质量守恒定律,产生二氧化碳气体的质量为20g+80g﹣95.6g=4.4g。
设该补钙剂中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
x=10g
该补钙剂中碳酸钙的质量分数为×100%=50%。
答:该补钙剂中碳酸钙的质量分数为50%。
故答案为:(1)HCl、CaCl2;(2)50%。
9.(2021 柳州)小华为了测定鸡蛋壳中碳酸钙的含量,进行了如下实验:取50.0g洗净、粉碎后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸(整个过程不考虑盐酸的挥发和气体的溶解,其它杂质不与盐酸反应),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。请回答下列问题:
(1)碳酸钙(CaCO3)由 钙、碳、氧三种 元素组成,碳酸钙的相对分子质量为 100 。
(2)从图像可知鸡蛋壳中的碳酸钙恰好完全反应时,烧杯中剩余物质的质量
为 132.4 g,产生CO2的总质量为 17.6 g。
(3)计算鸡蛋壳中碳酸钙的质量分数。(要求写出计算过程)
【解答】解:(1)碳酸钙是由钙、碳、氧三种元素组成的;碳酸钙的相对分子质量为40+12+16×3=100;
(2)由图中信息,可知鸡蛋壳中的碳酸钙恰好完全反应,即加入100g盐酸时,烧杯中剩余物质的质量=132.4g,根据质量守恒定律可知反应前后减少的质量就是生成二氧化碳的质量,产生CO2的总质量为50.0g+100g﹣132.4g=17.6g;
(3)设鸡蛋壳中碳酸钙的质量是x。
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 17.6g
x=40g
鸡蛋壳中碳酸钙的质量分数=80%
答:鸡蛋壳中碳酸钙的质量分数为80%。
故答案为:(1)钙、碳、氧三种;100;(2)132.4;17.6;(3)80%。
10.(2021 仙桃)现有一包氯化镁与氯化钡的混合固体20g,为测定其组成,小明先将该混合固体全部溶于水中,形成混合溶液;再将60g NaOH溶液平均分4次加入到该混合溶液中,每次充分反应后过滤,所得沉淀质量与加入NaOH溶液质量的关系如下表。请回答:
实验次数 一 二 三 四
NaOH溶液质量/g 15 15 15 15
沉淀质量/g 2.0 2.0 1.8 0
(1)沉淀的总质量是 5.8g 。
(2)计算混合固体中氯化钡的质量分数。(写出计算过程)
【解答】解:(1)沉淀的总质量是:2.0g+2.0g+1.8g=5.8g。
故填:5.8g。
(2)设氯化镁质量为x,
MgCl2+2NaOH═Mg(OH)2↓+2NaCl,
95 58
x 5.8g
=,
x=9.5g,
混合固体中氯化钡的质量分数是:100%=52.5%,
答:混合固体中氯化钡的质量分数是52.5%。
11.(2021 宁夏)侯德榜成功研制了“侯氏制碱法”,打破了西方发达国家对我国制碱技术的封锁,为世界制碱工业做出了杰出贡献。某工厂为了测定用“侯氏制碱法”制得的纯碱样品中纯碱的质量分数,工厂技术员完成了如图所示的测定工作(不考虑其它因素对测定结果的影响),请根据图中数据计算:样品中纯碱的质量分数。(计算结果精确到0.1%)
【解答】解:生成二氧化碳的质量为:378.5g﹣376.3g=2.2g;
设参加反应的碳酸钠的质量为x
2HCl+Na2CO3=2NaCl+H2O+CO2↑
106 44
x 2.2g
=
x=5.3g
所以样品中纯碱的质量分数是×100%≈96.4%
答:样品中纯碱的质量分数是96.4%。
12.(2021 广西)现有一瓶部分变质为碳酸钠的氢氧化钠固体。某同学想了解其变质情况,称取10.00g上述固体样品于烧杯中,加入足量水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,充分反应后,过滤、洗涤、干燥,得到3.94g沉淀。求:
(1)样品中碳酸钠的质量分数为 21.2% 。
(2)反应后所得溶液中氢氧化钠的质量。
【解答】解:(1)设参加反应的碳酸钠的质量为x,生成氢氧化钠的质量为y。
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
106 197 80
x 3.94g y
x=2.12g y=1.60g,
样品中碳酸钠的质量分数为:
=21.2%;
(2)反应后所得溶液中氢氧化钠的质量为:
1.60g+(10.00g﹣2.12g)=9.48g
答:反应后所得溶液中氢氧化钠的质量为9.48g。
故答案为:
(1)21.2%;
(2)9.48g。
13.(2021 潍坊)用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如表:
实验次数 第1次 第2次 第3次 第4次 第5次 第6次
加入CaCl2溶液的质量/g 20.0 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 M 191.0 211.0
请根据实验数据分析解答下列问题:
(1)表中数据M的值为 172.0 。
(2)请画出生成沉淀的质量随滴加氯化钙溶液质量的变化关系图(标明恰好反应时点的坐标)。
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
【解答】解:(1)根据表格提供的数据可以看出,11g纯碱样品产生沉淀的总质量为:100g+20.0g×6﹣211.0g=9.0g,开始时每20.0g氯化钙溶液产生2.0g沉淀,第5次到第6次不再改变,说明第5次时沉淀完全,故第4次加入20。0g氯化钙溶液也是产生2.0g沉淀,故M=154.0g+20.0g﹣2g=172.0g,故填:172.0;
(2)综合分析数据可以看出,每10.0g氯化钙溶液产生碳酸钙沉淀1.0g,产生9.0g碳酸钙需要氯化钙溶液的质量为90.0g,故图像为:
故填:;
(3)设碳酸钠的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 9.0g
x=9.54g
故碳酸钠的质量分数为:86.7%
答:该食用碱样品中碳酸钠的质量分数86.7%。
14.(2021 鸡西)某公司生产出的纯碱经检测只含有氯化钠杂质。为测定该纯碱样品中碳酸钠的质量分数,称取26.5g该样品,加入到盛有一定质量稀盐酸的烧杯中,恰好完全反应。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)的关系如图所示。试分析并计算:
(1)生成CO2的质量为 8.8g 。
(2)该纯碱样品中Na2CO3的质量分数。
【解答】解:(1)根据质量守恒定律可得,生成的二氧化碳的质量为:172.5g﹣163.7g=8.8g;
(2)设纯碱样品中Na2CO3的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 8.8g
解得:x=21.2g
该纯碱样品中Na2CO3的质量分数为 ×100%=80%。
答:该纯碱样品中Na2CO3的质量分数为80%;
故答案为:(1)8.8g;
(2)80%。
15.(2021 孝感)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液20g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?(写出计算过程)
【解答】解:设一定量石油产品中含H2SO4的质量为x
2NaOH+H2SO4=Na2SO4+2H2O
80 98
20%×20g x
=
x=4.9g
答:一定量石油产品中含H2SO4的质量为4.9g。
