鲁教版五四制九年级化学4.2金属的化学性质同步练习(word 含解析)
文档属性
| 名称 | 鲁教版五四制九年级化学4.2金属的化学性质同步练习(word 含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 146.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-18 13:51:27 | ||
图片预览




文档简介
金属的化学性质
一、单选题
下列各组物质不能验证Mg、Fe、Cu三种金属活动性强弱的是
A. 稀盐酸
B. 溶液 Fe Cu
C. Mg 溶液 Cu
D. 溶液 Fe 溶液
向溶液中加入一定质量铜和锌的混合物,充分反应后过滤得到无色溶液和滤渣,下列说法正确的是
A. 充分反应后所得的溶液中一定含有,一定不含和
B. 反应后所得的溶液中一定含有,可能含有和
C. 反应后所得的滤渣中一定含有Ag,一定不含Cu和Zn
D. 反应后所得的滤渣中一定含有Cu,可能含有Zn和Ag
现有a、b、c三种金属,如果把a和b分别投入稀硫酸中,b溶解并产生气泡,a不反应;如果把a和b分别放入c的硝酸盐溶液中,在a、b表面均有c析出。则a、b、c的金属活动性由强到弱的顺序是
A. B. C. D.
将甲、乙、丙三种金属分别放入稀盐酸中,甲、乙表面有气泡产生,丙没有明显现象;甲放入乙的硝酸盐溶液中,没有明显现象。甲、乙、丙的金属活动性由强到弱的顺序是
A. 甲乙丙 B. 甲丙乙 C. 乙丙甲 D. 乙甲丙
某种金属混合物样品由Mg、Al、Fe、Zn四种金属中的两种组成,取样品跟足量稀硫酸反应,得到氢气,则此混合物中一定含有的金属是
A. Zn B. Al C. Mg D. Fe
质量相等的锌和铁分别和质量相等、溶质质量分数也相等的稀盐酸反应,反应情况如图所示.则下列叙述中正确的是
A. 图线a、b分别表示铁、锌的反应情况
B. 锌、铁均反应完,盐酸有剩余
C. 盐酸均反应完,一定有锌剩余
D. 盐酸均反应完,一定有铁剩余
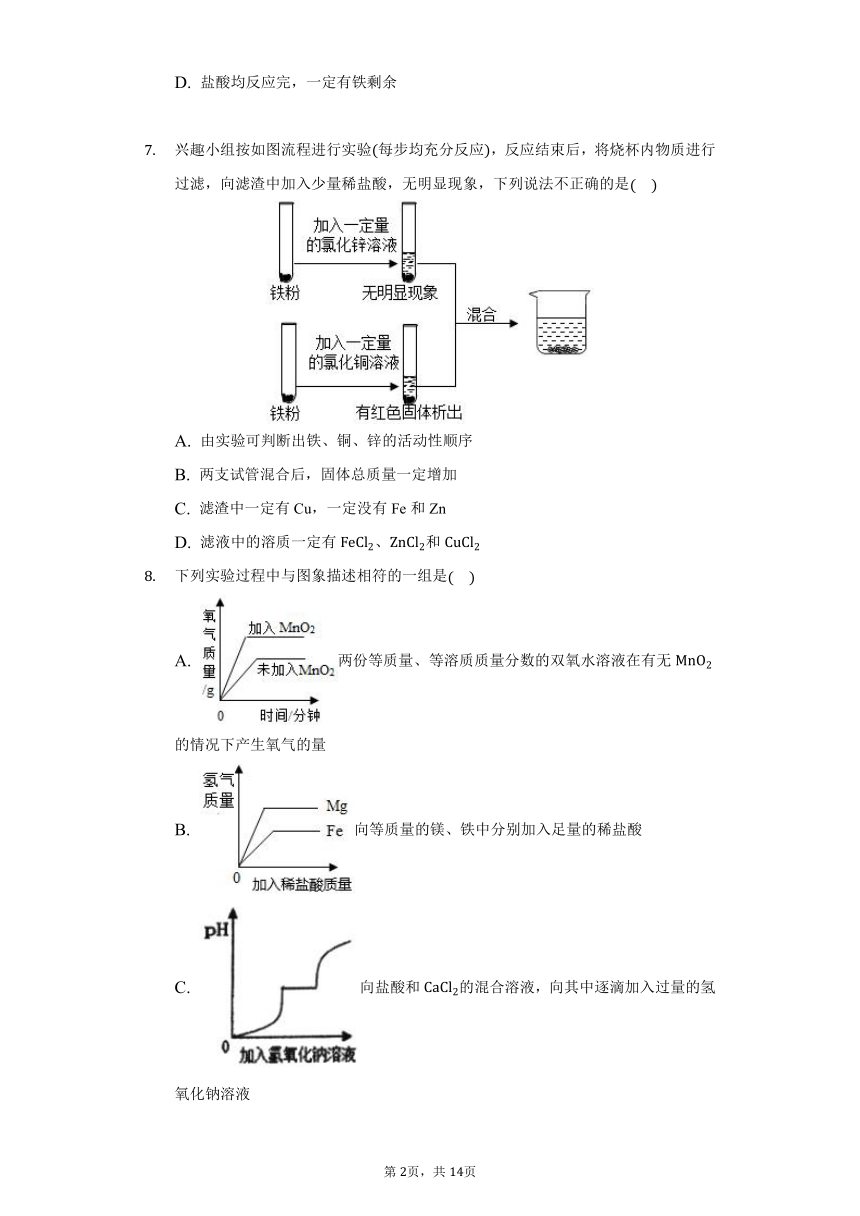
兴趣小组按如图流程进行实验每步均充分反应,反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,下列说法不正确的是
A. 由实验可判断出铁、铜、锌的活动性顺序
B. 两支试管混合后,固体总质量一定增加
C. 滤渣中一定有Cu,一定没有Fe和Zn
D. 滤液中的溶质一定有、和
下列实验过程中与图象描述相符的一组是
A. 两份等质量、等溶质质量分数的双氧水溶液在有无的情况下产生氧气的量
B. 向等质量的镁、铁中分别加入足量的稀盐酸
C. 向盐酸和的混合溶液,向其中逐滴加入过量的氢氧化钠溶液
D. 向等质量、等质量分数的两份稀硫酸中分别加入足量氧化锌、碳酸锌固体
X、Y、Z是三种金属,根据下列有关化学式方程式可知,三种金属的活动性顺序是
、、不反应
A. B. C. D.
将质量相等的镁、铝、铁三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系如图所示。则下列说法中正确的是
A. 铝可能有剩余
B. 硫酸一定完全反应
C. 铁一定完全反应
D. 参加反应的镁的质量最少
现有等质量甲、乙、丙三种金属,分别放入三份浓度相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示已知甲、乙、丙在生成物中化合价均为价则下列说法中不正确的是
A. 生成氢气的质量:甲乙丙 B. 金属活动性:乙甲丙
C. 相对原子质量:乙丙甲 D. 消耗硫酸的质量:甲乙丙
提升“中国芯”的性能是我国信息产业的当务之急。“中国芯”的核心材料是高纯度的单质硅,工业上制取粗硅的化学方程式为: ,下列说法正确的是
A. 硅元素在地壳中的含量比氧元素多
B. 该反应的基本类型为置换反应
C. 在此反应中硅元素的化合价升高
D. 该反应体现了碳的氧化性
二、推断题
某种手机电路板中含有Fe、Cu、Au、Ag、镍,银白色金属等金属,如图是某工厂回收部分金属的流程图。已知:
操作的名称是______。
写出滤液中金属阳离子符号______。
写出滤液和铁粉发生反应的一个化学方程式______。
、Ag、Ni在溶液中的活动性由强到弱的顺序依次是______。
三、流程题
从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示:
图中“操作”的名称是______。
写出所得贵重金属中任意一种成分的化学式______。
写出中发生的化学反应方程式______任写一种;该反应的基本类型为______。
写出中发生的化学反应方程式______。
四、实验题
某研究小组为验证铁、铜、锌、银的金属活动性顺序,设计如图甲所示三个实验三种金属均已用砂纸打磨过,其形状和大小相同,稀盐酸的浓度和用量也相同。
一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为______色,这说明铜比银的金属活动性______选填“强”或“弱”,该反应的化学方程式为______。
甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是______。
乙同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,乙同学又补做了一个实验,装置如图乙所示,且实现了探究目的。
乙同学的实验:X是金属______,Y是______溶液。填化学式
答案和解析
1.【答案】B
【解析】解:A、Mg、Fe都能与稀盐酸反应,且镁的反应比铁剧烈,铜不能与稀盐酸反应,能比较Mg、Fe、Cu三种金属活动性强弱,A不符合题意;
B、都不与溶液,说明金属活动性镁铁、铜,但不能比较铁、铜的金属活动性大小,不能验证Mg、Fe、Cu三种金属活动性强弱,故B符合题意;
C、铜不能与溶液反应,说明金属活动性铁铜,Mg能与溶液反应,说明金属活动性镁铁,能验证Mg、Fe、Cu三种金属活动性强弱,故C不符合题意;
D、铁能与溶液反应,说明金属活动性铁铜,Fe不能与溶液反应,说明金属活动性镁铁,可以证Mg、Fe、Cu三种金属活动性强弱,故D不符合题意。
故选B。
在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,据此设计实验验证金属的活动性顺序。
同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱。氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来,有些时候可以利用物质间反应的中间产物进行实验。
2.【答案】A
【解析】解:向溶液中加入一定质量铜和锌的混合物,锌会先与硝酸银反应生成硝酸锌和银,然后铜再与硝酸银反应生成硝酸铜和银,所以
A、充分反应后过滤得到无色溶液和滤渣,所以溶液中不含硝酸铜,反应后所得的溶液中一定含有,一定不含和,故A正确;
B、反应后所得的溶液中一定含有,可能含有和,故B正确;
C、反应后所得的滤渣中一定含有Ag,可能含Cu和Zn,故C错误;
D、反应后所得的滤渣中一定含有Ag,可能含Cu和Zn,故D错误。
故选:A。
根据在金属活动性顺序中只要排在前面的金属就能把排在后面的金属从其盐溶液中置换出来,由于金属的活动性;用不同的金属置换同种盐溶液,盐中金属先被排在金属活动性顺序中较前的金属置换出来,另外,若有一种金属和多种混合盐溶液反应,最先反应的是最不活泼的那个金属的盐溶液进行分析。
本题主要考查了对金属的活动性顺序的应用和金属与盐反应时应该注意的事项,培养学生分析问题、解决问题的能力。
3.【答案】A
【解析】解:现有a、b、c三种金属,如果把a和b分别投入稀硫酸中,b溶解并产生气泡,a不反应,说明b的位置排在氢的前面,a的位置排在氢的后面,即;
如果把a和b分别放入c的硝酸盐溶液中,在a、b表面均有c析出,说明a、b的金属活动性比c强,即a、;
则Xa、b、c的金属活动性由强到弱的顺序为:。
故选:A。
在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定三种金属活动性由强到弱的顺序。
本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
4.【答案】D
【解析】解:将甲、乙、丙三种金属分别放入稀盐酸中,甲、乙表面有气泡产生,丙没有明显现象,这说明金属丙的活动性最弱;甲放入乙的硝酸盐溶液中,没有明显现象,说明甲的活动性不如乙,故三种金属的活动性强弱关系是:乙甲丙。
故选:D。
在金属活动性顺序中,只有排在氢前面的金属才可以和稀酸溶液除稀硝酸反应生成氢气,只有排在前面的金属才可以把排在它后面的金属从盐溶液中置换出来钾、钙、钠除外,根据这一规律,根据反应的发生可以判断出金属的活动性强弱。
本题难度较小,主要考查了根据反应的发生来判断金属的活动性强弱,从而加深学生对金属活动性顺序的理解和应用。
5.【答案】A
【解析】解:Mg、Al、Fe、Zn四种金属和稀硫酸反应的化学方程式及其质量关系:
,
24 2
,
54 6
,
65 2
,
56 2
由以上质量关系可知,镁和铝完全反应生成氢气质量大于,镁和铁完全反应生成氢气质量大于,镁和锌完全反应生成氢气质量可能是,铝和铁完全反应生成氢气质量大于,铝和锌完全反应生成氢气质量可能是,铁和锌完全反应生成氢气质量小于,因此此混合物中一定含有的金属是锌。
故选:A。
金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。
6.【答案】D
【解析】解:A、由于在金属活动性顺序中,锌在铁前,即锌的金属活动性比铁强,所以图线a、b分别表示锌、铁的反应情况,故A错误;
B、由于得到的氢气一样多,说明稀盐酸全部参与反应,故B错误;
C、由于得到的氢气一样多,说明稀盐酸全部参与反应,而这两种金属都有剩余或铁有剩余,故C错误;
D、由上可知,等质量的稀盐酸消耗的锌多,又因生成的气体一样多,因此铁一定有剩余,故D正确。
故选:D。
根据在金属活动性顺序中,越靠前的金属金属活动性越强,和稀酸溶液反应时就越剧烈,则相同质量的金属和同质量、同溶质质量分数的稀酸溶液反应所需的时间也就越少进行分析.
本题难度较大,主要考查了对金属活动性顺序的应用,重在培养学生的分析能力和解决问题的能力.
7.【答案】D
【解析】解:由于金属的活动性强弱是:锌铁铜,在进行实验时,铁不能与氯化锌反应,能与氯化铜反应生成了氯化亚铁和铜,反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,说明了铁没有剩余。所以:
A、根据铁不能与氯化锌反应,能与氯化铜反应,可以判断出铁、铜、锌的活动性顺序,故A说法正确;
B、由于每56份质量的铁能置换出64份质量的铜,所以两支试管混合后,固体总质量一定增加,故B说法正确;
C、由上述分析可知,滤渣中一定有Cu,一定没有Fe和Zn,故C说法正确。
D、由上述分析可知,滤液中的溶质一定有、,可能含有,说法不正确。
故选:D。
金属的活动性强弱是锌铁铜,在进行实验时,铁不能与氯化锌反应,铁能与氯化铜反应生成了氯化亚铁和铜,反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,说明了铁没有剩余,据此分析判断有关的说法。
本题难度不是很大,熟练掌握金属的化学性质、确定能发生的反应是正确解答此类题的关键。
8.【答案】D
【解析】解:A、等质量、等溶质质量分数的双氧水溶液完全分解生成氧气质量相等,该选项对应关系不正确;
B、反应的稀盐酸质量相等时,生成氢气质量相等,该选项对应关系不正确;
C、向盐酸和的混合溶液,向其中逐滴加入过量的氢氧化钠溶液,氢氧化钠和盐酸反应生成氯化钠和水,过程中pH升高,恰好完全反应时的,继续滴加氢氧化钠溶液时,pH继续升高,没有中间水平线,该选项对应关系不正确;
D、稀硫酸和氧化锌、碳酸锌反应的化学方程式及其质量关系:
,
81 98 161
,
125 98 161
由以上质量关系可知,反应的氧化锌和碳酸锌质量相等时,氧化锌反应生成的硫酸锌质量大,最终硫酸完全反应时,生成硫酸锌质量相等,该选项对应关系正确。
故选:D。
A、过氧化氢分解生成水和氧气;
B、稀盐酸和镁反应生成氯化镁和氢气,和铁反应生成氯化亚铁和氢气;
C、氢氧化钠和盐酸反应生成氯化钠和水;
D、稀硫酸和氧化锌反应生成硫酸锌和水、和碳酸锌反应生成硫酸锌、水和二氧化碳。
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
9.【答案】A
【解析】解:根据金属活动性顺序表的意义可知:,说明活动性顺序X在氢前;,说明活动性顺序;和稀不反应,说明活动性顺序Y在氢后;综合以上分析可知XYZ三者的活动性有强到弱的顺序为:。
故选:A。
本题考查金属活动性顺序,解题的主要依据是能与酸反应置换出酸中H元素的金属,活动性处于H之前;不能置换酸中H的金属,其活动性处于H之后;能置换出盐溶液中金属元素的金属,其活动性比盐中金属活动性强,难度较易。
10.【答案】B
【解析】解:A、因为三种金属生成的氢气质量相等,结合生成的氢气质量金属的质量,可知:镁、铝一定过量,铁可能反应完,故A结论正错误;
B、由图象可知最终镁、铝、铁三种金属生成的氢气质量相等,因为参加反应的稀硫酸的质量是相等的,所以硫酸都已完全反应,故B结论正确;
C、由上述分析可知:镁、铝一定过量,铁可能反应完,故C结论错误;
D、因为三种金属生成的氢气质量相等,结合生成的氢气质量金属的质量,消耗三种金属铁的质量最大,铝的质量最小,故D结论错误。
故选:B。
通过图象可知镁、铝、铁三种金属与酸反应的速率和生成氢气的质量,由此可推出金属活动性顺序,并结合化学方程式的计算可推出金属和酸的用量问题。
本题考查金属与酸反应的有关知识,综合性较强,不仅需要根据图象和题意分析出直接信息,还需要根据计算得出用量问题。
11.【答案】C
【解析】
【分析】
本题考查金属活动性顺序,利用反应后生成价化合物以及图中信息,进行分析解答即可。
【解答】
A.根据题意,甲、乙、丙在生成物中化合价均为价,结合题中图示可知,生成氢气的质量:甲乙丙,故A正确;
B.从产生相同质量的氢气所用的时间来看,金属活动性:乙甲丙,故B正确;
C.相对原子质量越小,反应产生的氢气越多,故相对原子质量:丙乙甲,故C错误;
D.相对原子质量越小,反应产生的氢气越多,消耗硫酸越多,故消耗硫酸的质量:甲乙丙,故D正确。
故选C。
12.【答案】B
【解析】解:A、硅元素在地壳中的含量比氧元素少,故选项说法错误。
B、该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项说法正确。
C、在此反应中硅元素的化合价由价变为0价,化合价降低,故选项说法错误。
D、碳夺取了二氧化硅中的氧,具有还原性,故选项说法错误。
故选:B。
A、根据地壳中元素含量,进行分析判断。
B、置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
C、根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,进行分析判断。
D、根据碳夺取了二氧化硅中的氧,进行分析判断。
本题难度不大,掌握碳具有还原性、置换反应的特征、化合价的原则等是正确解答本题的关键。
13.【答案】过滤 Ni、Cu、Ag
【解析】解:排在氢前面的金属可以将酸中的氢置换出来,排在前面的金属可以将排在后面的金属从其盐溶液中置换出来,所以
操作可以将不溶性固体从溶液中分离出来,所以操作的名称是过滤;
铁在置换反应中生成亚铁离子,所以滤液中金属阳离子符号;
滤液和铁粉发生的反应是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:;
镍会与硫酸反应生成滤液中的一种成分,铜可以将银置换出来,所以Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是:Ni、Cu、Ag。
故答案为:过滤;
;
;
、Cu、Ag。
根据排在氢前面的金属可以将酸中的氢置换出来,排在前面的金属可以将排在后面的金属从其盐溶液中置换出来进行分析。
本题主要考查了金属活动性顺序的应用,难度不大,需要在平时的学习中加强记忆即可完成。
14.【答案】过滤;
或;
或;置换反应;
【解析】解:图中“操作”实现固液分离,名称是过滤,
故填:过滤;
所得贵重金属是金、铂,化学式分别是Au、Pt,
故填:或;
中稀硫酸和铁反应生成硫酸亚铁和氢气、和铝反应生成硫酸铝和氢气,发生的化学反应方程式:、,都是置换反应,
故填: 或;置换反应;
中加热条件下稀硫酸和铜、氧气反应生成硫酸铜和水,发生的化学反应方程式:,
故填:。
过滤能够实现固液分离;
金、铂化学性质不活泼,不能和稀硫酸反应;
稀硫酸和铁反应生成硫酸亚铁和氢气,和铝反应生成硫酸铝和氢气;
加热条件下稀硫酸和铜、氧气反应生成硫酸铜和水。
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
15.【答案】蓝;强;;
锌与盐酸反应产生氢气比铁快;
;合理答案即可
【解析】解:铜能与硝酸银反应生成硝酸铜和银,硝酸铜的溶液为蓝色,铜能与硝酸银反应生成硝酸铜和银,故填:蓝;强;;
锌和铁都与盐酸反应,锌反应的速率比铁快,说明锌在铁的前面,故填:锌与盐酸反应产生氢气比铁快;
能说明铁在氢的前面,B说明铜在银的前面,C说明锌在氢的前面,A、C说明锌在铁的前面,故通过A、B、C说明,,不能说明铁和铜的活动性,故可以通过金属与酸或金属与盐其他金属化合物溶液的反应来证明铁和铜的活动性强弱,故填:Fe;。合理答案即可
本考点主要考查了金属的活动性顺序的探究、实验现象的描述等。金属的活动性顺序是中考的热点内容,经常出现在选择题和实验题中,同学们要认真掌握。
第2页,共2页
第1页,共1页
一、单选题
下列各组物质不能验证Mg、Fe、Cu三种金属活动性强弱的是
A. 稀盐酸
B. 溶液 Fe Cu
C. Mg 溶液 Cu
D. 溶液 Fe 溶液
向溶液中加入一定质量铜和锌的混合物,充分反应后过滤得到无色溶液和滤渣,下列说法正确的是
A. 充分反应后所得的溶液中一定含有,一定不含和
B. 反应后所得的溶液中一定含有,可能含有和
C. 反应后所得的滤渣中一定含有Ag,一定不含Cu和Zn
D. 反应后所得的滤渣中一定含有Cu,可能含有Zn和Ag
现有a、b、c三种金属,如果把a和b分别投入稀硫酸中,b溶解并产生气泡,a不反应;如果把a和b分别放入c的硝酸盐溶液中,在a、b表面均有c析出。则a、b、c的金属活动性由强到弱的顺序是
A. B. C. D.
将甲、乙、丙三种金属分别放入稀盐酸中,甲、乙表面有气泡产生,丙没有明显现象;甲放入乙的硝酸盐溶液中,没有明显现象。甲、乙、丙的金属活动性由强到弱的顺序是
A. 甲乙丙 B. 甲丙乙 C. 乙丙甲 D. 乙甲丙
某种金属混合物样品由Mg、Al、Fe、Zn四种金属中的两种组成,取样品跟足量稀硫酸反应,得到氢气,则此混合物中一定含有的金属是
A. Zn B. Al C. Mg D. Fe
质量相等的锌和铁分别和质量相等、溶质质量分数也相等的稀盐酸反应,反应情况如图所示.则下列叙述中正确的是
A. 图线a、b分别表示铁、锌的反应情况
B. 锌、铁均反应完,盐酸有剩余
C. 盐酸均反应完,一定有锌剩余
D. 盐酸均反应完,一定有铁剩余
兴趣小组按如图流程进行实验每步均充分反应,反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,下列说法不正确的是
A. 由实验可判断出铁、铜、锌的活动性顺序
B. 两支试管混合后,固体总质量一定增加
C. 滤渣中一定有Cu,一定没有Fe和Zn
D. 滤液中的溶质一定有、和
下列实验过程中与图象描述相符的一组是
A. 两份等质量、等溶质质量分数的双氧水溶液在有无的情况下产生氧气的量
B. 向等质量的镁、铁中分别加入足量的稀盐酸
C. 向盐酸和的混合溶液,向其中逐滴加入过量的氢氧化钠溶液
D. 向等质量、等质量分数的两份稀硫酸中分别加入足量氧化锌、碳酸锌固体
X、Y、Z是三种金属,根据下列有关化学式方程式可知,三种金属的活动性顺序是
、、不反应
A. B. C. D.
将质量相等的镁、铝、铁三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系如图所示。则下列说法中正确的是
A. 铝可能有剩余
B. 硫酸一定完全反应
C. 铁一定完全反应
D. 参加反应的镁的质量最少
现有等质量甲、乙、丙三种金属,分别放入三份浓度相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示已知甲、乙、丙在生成物中化合价均为价则下列说法中不正确的是
A. 生成氢气的质量:甲乙丙 B. 金属活动性:乙甲丙
C. 相对原子质量:乙丙甲 D. 消耗硫酸的质量:甲乙丙
提升“中国芯”的性能是我国信息产业的当务之急。“中国芯”的核心材料是高纯度的单质硅,工业上制取粗硅的化学方程式为: ,下列说法正确的是
A. 硅元素在地壳中的含量比氧元素多
B. 该反应的基本类型为置换反应
C. 在此反应中硅元素的化合价升高
D. 该反应体现了碳的氧化性
二、推断题
某种手机电路板中含有Fe、Cu、Au、Ag、镍,银白色金属等金属,如图是某工厂回收部分金属的流程图。已知:
操作的名称是______。
写出滤液中金属阳离子符号______。
写出滤液和铁粉发生反应的一个化学方程式______。
、Ag、Ni在溶液中的活动性由强到弱的顺序依次是______。
三、流程题
从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示:
图中“操作”的名称是______。
写出所得贵重金属中任意一种成分的化学式______。
写出中发生的化学反应方程式______任写一种;该反应的基本类型为______。
写出中发生的化学反应方程式______。
四、实验题
某研究小组为验证铁、铜、锌、银的金属活动性顺序,设计如图甲所示三个实验三种金属均已用砂纸打磨过,其形状和大小相同,稀盐酸的浓度和用量也相同。
一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为______色,这说明铜比银的金属活动性______选填“强”或“弱”,该反应的化学方程式为______。
甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是______。
乙同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,乙同学又补做了一个实验,装置如图乙所示,且实现了探究目的。
乙同学的实验:X是金属______,Y是______溶液。填化学式
答案和解析
1.【答案】B
【解析】解:A、Mg、Fe都能与稀盐酸反应,且镁的反应比铁剧烈,铜不能与稀盐酸反应,能比较Mg、Fe、Cu三种金属活动性强弱,A不符合题意;
B、都不与溶液,说明金属活动性镁铁、铜,但不能比较铁、铜的金属活动性大小,不能验证Mg、Fe、Cu三种金属活动性强弱,故B符合题意;
C、铜不能与溶液反应,说明金属活动性铁铜,Mg能与溶液反应,说明金属活动性镁铁,能验证Mg、Fe、Cu三种金属活动性强弱,故C不符合题意;
D、铁能与溶液反应,说明金属活动性铁铜,Fe不能与溶液反应,说明金属活动性镁铁,可以证Mg、Fe、Cu三种金属活动性强弱,故D不符合题意。
故选B。
在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,据此设计实验验证金属的活动性顺序。
同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱。氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来,有些时候可以利用物质间反应的中间产物进行实验。
2.【答案】A
【解析】解:向溶液中加入一定质量铜和锌的混合物,锌会先与硝酸银反应生成硝酸锌和银,然后铜再与硝酸银反应生成硝酸铜和银,所以
A、充分反应后过滤得到无色溶液和滤渣,所以溶液中不含硝酸铜,反应后所得的溶液中一定含有,一定不含和,故A正确;
B、反应后所得的溶液中一定含有,可能含有和,故B正确;
C、反应后所得的滤渣中一定含有Ag,可能含Cu和Zn,故C错误;
D、反应后所得的滤渣中一定含有Ag,可能含Cu和Zn,故D错误。
故选:A。
根据在金属活动性顺序中只要排在前面的金属就能把排在后面的金属从其盐溶液中置换出来,由于金属的活动性;用不同的金属置换同种盐溶液,盐中金属先被排在金属活动性顺序中较前的金属置换出来,另外,若有一种金属和多种混合盐溶液反应,最先反应的是最不活泼的那个金属的盐溶液进行分析。
本题主要考查了对金属的活动性顺序的应用和金属与盐反应时应该注意的事项,培养学生分析问题、解决问题的能力。
3.【答案】A
【解析】解:现有a、b、c三种金属,如果把a和b分别投入稀硫酸中,b溶解并产生气泡,a不反应,说明b的位置排在氢的前面,a的位置排在氢的后面,即;
如果把a和b分别放入c的硝酸盐溶液中,在a、b表面均有c析出,说明a、b的金属活动性比c强,即a、;
则Xa、b、c的金属活动性由强到弱的顺序为:。
故选:A。
在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定三种金属活动性由强到弱的顺序。
本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
4.【答案】D
【解析】解:将甲、乙、丙三种金属分别放入稀盐酸中,甲、乙表面有气泡产生,丙没有明显现象,这说明金属丙的活动性最弱;甲放入乙的硝酸盐溶液中,没有明显现象,说明甲的活动性不如乙,故三种金属的活动性强弱关系是:乙甲丙。
故选:D。
在金属活动性顺序中,只有排在氢前面的金属才可以和稀酸溶液除稀硝酸反应生成氢气,只有排在前面的金属才可以把排在它后面的金属从盐溶液中置换出来钾、钙、钠除外,根据这一规律,根据反应的发生可以判断出金属的活动性强弱。
本题难度较小,主要考查了根据反应的发生来判断金属的活动性强弱,从而加深学生对金属活动性顺序的理解和应用。
5.【答案】A
【解析】解:Mg、Al、Fe、Zn四种金属和稀硫酸反应的化学方程式及其质量关系:
,
24 2
,
54 6
,
65 2
,
56 2
由以上质量关系可知,镁和铝完全反应生成氢气质量大于,镁和铁完全反应生成氢气质量大于,镁和锌完全反应生成氢气质量可能是,铝和铁完全反应生成氢气质量大于,铝和锌完全反应生成氢气质量可能是,铁和锌完全反应生成氢气质量小于,因此此混合物中一定含有的金属是锌。
故选:A。
金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。
6.【答案】D
【解析】解:A、由于在金属活动性顺序中,锌在铁前,即锌的金属活动性比铁强,所以图线a、b分别表示锌、铁的反应情况,故A错误;
B、由于得到的氢气一样多,说明稀盐酸全部参与反应,故B错误;
C、由于得到的氢气一样多,说明稀盐酸全部参与反应,而这两种金属都有剩余或铁有剩余,故C错误;
D、由上可知,等质量的稀盐酸消耗的锌多,又因生成的气体一样多,因此铁一定有剩余,故D正确。
故选:D。
根据在金属活动性顺序中,越靠前的金属金属活动性越强,和稀酸溶液反应时就越剧烈,则相同质量的金属和同质量、同溶质质量分数的稀酸溶液反应所需的时间也就越少进行分析.
本题难度较大,主要考查了对金属活动性顺序的应用,重在培养学生的分析能力和解决问题的能力.
7.【答案】D
【解析】解:由于金属的活动性强弱是:锌铁铜,在进行实验时,铁不能与氯化锌反应,能与氯化铜反应生成了氯化亚铁和铜,反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,说明了铁没有剩余。所以:
A、根据铁不能与氯化锌反应,能与氯化铜反应,可以判断出铁、铜、锌的活动性顺序,故A说法正确;
B、由于每56份质量的铁能置换出64份质量的铜,所以两支试管混合后,固体总质量一定增加,故B说法正确;
C、由上述分析可知,滤渣中一定有Cu,一定没有Fe和Zn,故C说法正确。
D、由上述分析可知,滤液中的溶质一定有、,可能含有,说法不正确。
故选:D。
金属的活动性强弱是锌铁铜,在进行实验时,铁不能与氯化锌反应,铁能与氯化铜反应生成了氯化亚铁和铜,反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,说明了铁没有剩余,据此分析判断有关的说法。
本题难度不是很大,熟练掌握金属的化学性质、确定能发生的反应是正确解答此类题的关键。
8.【答案】D
【解析】解:A、等质量、等溶质质量分数的双氧水溶液完全分解生成氧气质量相等,该选项对应关系不正确;
B、反应的稀盐酸质量相等时,生成氢气质量相等,该选项对应关系不正确;
C、向盐酸和的混合溶液,向其中逐滴加入过量的氢氧化钠溶液,氢氧化钠和盐酸反应生成氯化钠和水,过程中pH升高,恰好完全反应时的,继续滴加氢氧化钠溶液时,pH继续升高,没有中间水平线,该选项对应关系不正确;
D、稀硫酸和氧化锌、碳酸锌反应的化学方程式及其质量关系:
,
81 98 161
,
125 98 161
由以上质量关系可知,反应的氧化锌和碳酸锌质量相等时,氧化锌反应生成的硫酸锌质量大,最终硫酸完全反应时,生成硫酸锌质量相等,该选项对应关系正确。
故选:D。
A、过氧化氢分解生成水和氧气;
B、稀盐酸和镁反应生成氯化镁和氢气,和铁反应生成氯化亚铁和氢气;
C、氢氧化钠和盐酸反应生成氯化钠和水;
D、稀硫酸和氧化锌反应生成硫酸锌和水、和碳酸锌反应生成硫酸锌、水和二氧化碳。
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
9.【答案】A
【解析】解:根据金属活动性顺序表的意义可知:,说明活动性顺序X在氢前;,说明活动性顺序;和稀不反应,说明活动性顺序Y在氢后;综合以上分析可知XYZ三者的活动性有强到弱的顺序为:。
故选:A。
本题考查金属活动性顺序,解题的主要依据是能与酸反应置换出酸中H元素的金属,活动性处于H之前;不能置换酸中H的金属,其活动性处于H之后;能置换出盐溶液中金属元素的金属,其活动性比盐中金属活动性强,难度较易。
10.【答案】B
【解析】解:A、因为三种金属生成的氢气质量相等,结合生成的氢气质量金属的质量,可知:镁、铝一定过量,铁可能反应完,故A结论正错误;
B、由图象可知最终镁、铝、铁三种金属生成的氢气质量相等,因为参加反应的稀硫酸的质量是相等的,所以硫酸都已完全反应,故B结论正确;
C、由上述分析可知:镁、铝一定过量,铁可能反应完,故C结论错误;
D、因为三种金属生成的氢气质量相等,结合生成的氢气质量金属的质量,消耗三种金属铁的质量最大,铝的质量最小,故D结论错误。
故选:B。
通过图象可知镁、铝、铁三种金属与酸反应的速率和生成氢气的质量,由此可推出金属活动性顺序,并结合化学方程式的计算可推出金属和酸的用量问题。
本题考查金属与酸反应的有关知识,综合性较强,不仅需要根据图象和题意分析出直接信息,还需要根据计算得出用量问题。
11.【答案】C
【解析】
【分析】
本题考查金属活动性顺序,利用反应后生成价化合物以及图中信息,进行分析解答即可。
【解答】
A.根据题意,甲、乙、丙在生成物中化合价均为价,结合题中图示可知,生成氢气的质量:甲乙丙,故A正确;
B.从产生相同质量的氢气所用的时间来看,金属活动性:乙甲丙,故B正确;
C.相对原子质量越小,反应产生的氢气越多,故相对原子质量:丙乙甲,故C错误;
D.相对原子质量越小,反应产生的氢气越多,消耗硫酸越多,故消耗硫酸的质量:甲乙丙,故D正确。
故选C。
12.【答案】B
【解析】解:A、硅元素在地壳中的含量比氧元素少,故选项说法错误。
B、该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项说法正确。
C、在此反应中硅元素的化合价由价变为0价,化合价降低,故选项说法错误。
D、碳夺取了二氧化硅中的氧,具有还原性,故选项说法错误。
故选:B。
A、根据地壳中元素含量,进行分析判断。
B、置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
C、根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,进行分析判断。
D、根据碳夺取了二氧化硅中的氧,进行分析判断。
本题难度不大,掌握碳具有还原性、置换反应的特征、化合价的原则等是正确解答本题的关键。
13.【答案】过滤 Ni、Cu、Ag
【解析】解:排在氢前面的金属可以将酸中的氢置换出来,排在前面的金属可以将排在后面的金属从其盐溶液中置换出来,所以
操作可以将不溶性固体从溶液中分离出来,所以操作的名称是过滤;
铁在置换反应中生成亚铁离子,所以滤液中金属阳离子符号;
滤液和铁粉发生的反应是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:;
镍会与硫酸反应生成滤液中的一种成分,铜可以将银置换出来,所以Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是:Ni、Cu、Ag。
故答案为:过滤;
;
;
、Cu、Ag。
根据排在氢前面的金属可以将酸中的氢置换出来,排在前面的金属可以将排在后面的金属从其盐溶液中置换出来进行分析。
本题主要考查了金属活动性顺序的应用,难度不大,需要在平时的学习中加强记忆即可完成。
14.【答案】过滤;
或;
或;置换反应;
【解析】解:图中“操作”实现固液分离,名称是过滤,
故填:过滤;
所得贵重金属是金、铂,化学式分别是Au、Pt,
故填:或;
中稀硫酸和铁反应生成硫酸亚铁和氢气、和铝反应生成硫酸铝和氢气,发生的化学反应方程式:、,都是置换反应,
故填: 或;置换反应;
中加热条件下稀硫酸和铜、氧气反应生成硫酸铜和水,发生的化学反应方程式:,
故填:。
过滤能够实现固液分离;
金、铂化学性质不活泼,不能和稀硫酸反应;
稀硫酸和铁反应生成硫酸亚铁和氢气,和铝反应生成硫酸铝和氢气;
加热条件下稀硫酸和铜、氧气反应生成硫酸铜和水。
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
15.【答案】蓝;强;;
锌与盐酸反应产生氢气比铁快;
;合理答案即可
【解析】解:铜能与硝酸银反应生成硝酸铜和银,硝酸铜的溶液为蓝色,铜能与硝酸银反应生成硝酸铜和银,故填:蓝;强;;
锌和铁都与盐酸反应,锌反应的速率比铁快,说明锌在铁的前面,故填:锌与盐酸反应产生氢气比铁快;
能说明铁在氢的前面,B说明铜在银的前面,C说明锌在氢的前面,A、C说明锌在铁的前面,故通过A、B、C说明,,不能说明铁和铜的活动性,故可以通过金属与酸或金属与盐其他金属化合物溶液的反应来证明铁和铜的活动性强弱,故填:Fe;。合理答案即可
本考点主要考查了金属的活动性顺序的探究、实验现象的描述等。金属的活动性顺序是中考的热点内容,经常出现在选择题和实验题中,同学们要认真掌握。
第2页,共2页
第1页,共1页
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
