2.2金属的化学性质 同步练习(含解析)
文档属性
| 名称 | 2.2金属的化学性质 同步练习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 82.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-19 19:51:39 | ||
图片预览

文档简介
金属的化学性质
一、单选题
1.将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液中分别加入足量的稀盐酸,均无现象。则滤渣中( )
A. 一定有银,可能有铜、锌 B. 一定有银,可能有铜,一定没有锌
C. 一定有银和铜,可能有锌 D. 一定有银和铜,一定没有锌
2.向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,充分反应后过滤,得到滤渣和蓝色滤液,下列说法正确的是( )
A. 向滤渣中加入稀盐酸,可能有气泡产生
B. 向滤液中加入稀盐酸,可能有沉淀产生
C. 滤渣中一定有Ag,一定无Zn和Cu
D. 滤液中一定有Cu(NO3)2 , 可能有Zn(NO3)2和AgNO3
3.往硝酸银、硝酸铜、硝酸锌的混合溶液中加入一定量的铁粉,待反应完成后再过滤,可能存在的情况是( )
A. 滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+
B. 滤纸上有Ag、Cu,滤液中有Ag+、Zn2+、Fe2+
C. 滤纸上有Ag、Cu、Fe,滤液中有Cu2+、Zn2+、Fe2+
D. 滤纸上有Ag、Cu、Fe、Zn,滤液中有Zn2+、Fe2+
4.将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液分别加入足量的稀盐酸,均无现象。则滤渣中( )
A. 一定有银,可能有铜和锌 B. 一定有银,可能有铜,一定没有锌
C. 一定有银和铜,可能有锌 D. 一定有银和铜,一定没有锌
5.电脑芯片的制作要用到高纯度的硅。目前广泛采用石英砂(主要成分是SiO2 , )为原料制取,其中一步反应为:SiO2+2C Si+2CO↑。该反应类型属于( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
6.将一定质量的铁粉加入含AgNO3和Zn(NO3)2两种溶质的溶液中,反应结束后过滤,分别向滤液和滤渣中加入稀盐酸,均无明显现象,下列对滤渣和滤液的说明中,不正确的是( )
A. 滤渣的成分只有银 B. 滤液中的溶质是Zn(NO3)2、Fe (NO3)2
C. 滤渣的成分可能是银、锌的混合物 D. 所得滤液的质量小于反应前原溶液的质量
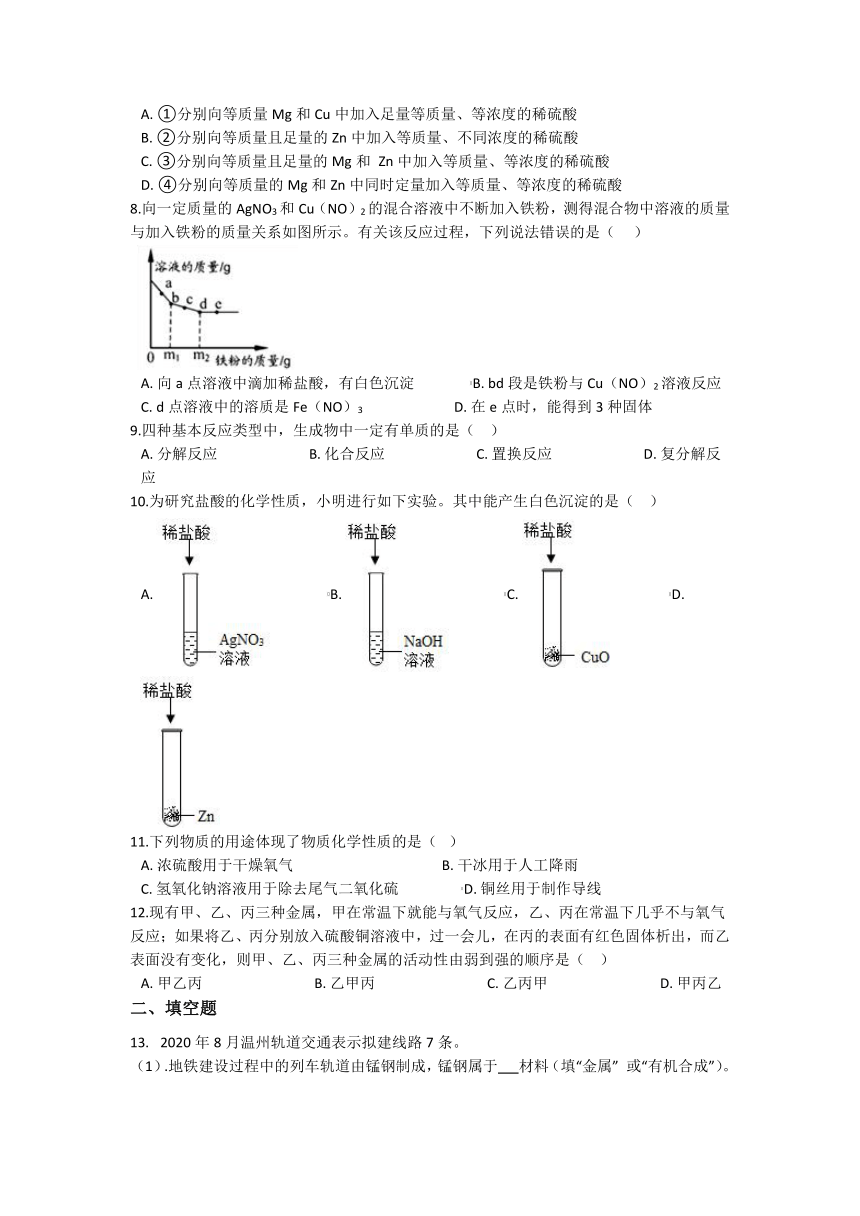
7.如图所示的四个图象,分别对应四种过程,其中正确的是( )
A. ①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B. ②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C. ③分别向等质量且足量的Mg和 Zn中加入等质量、等浓度的稀硫酸
D. ④分别向等质量的Mg和Zn中同时定量加入等质量、等浓度的稀硫酸
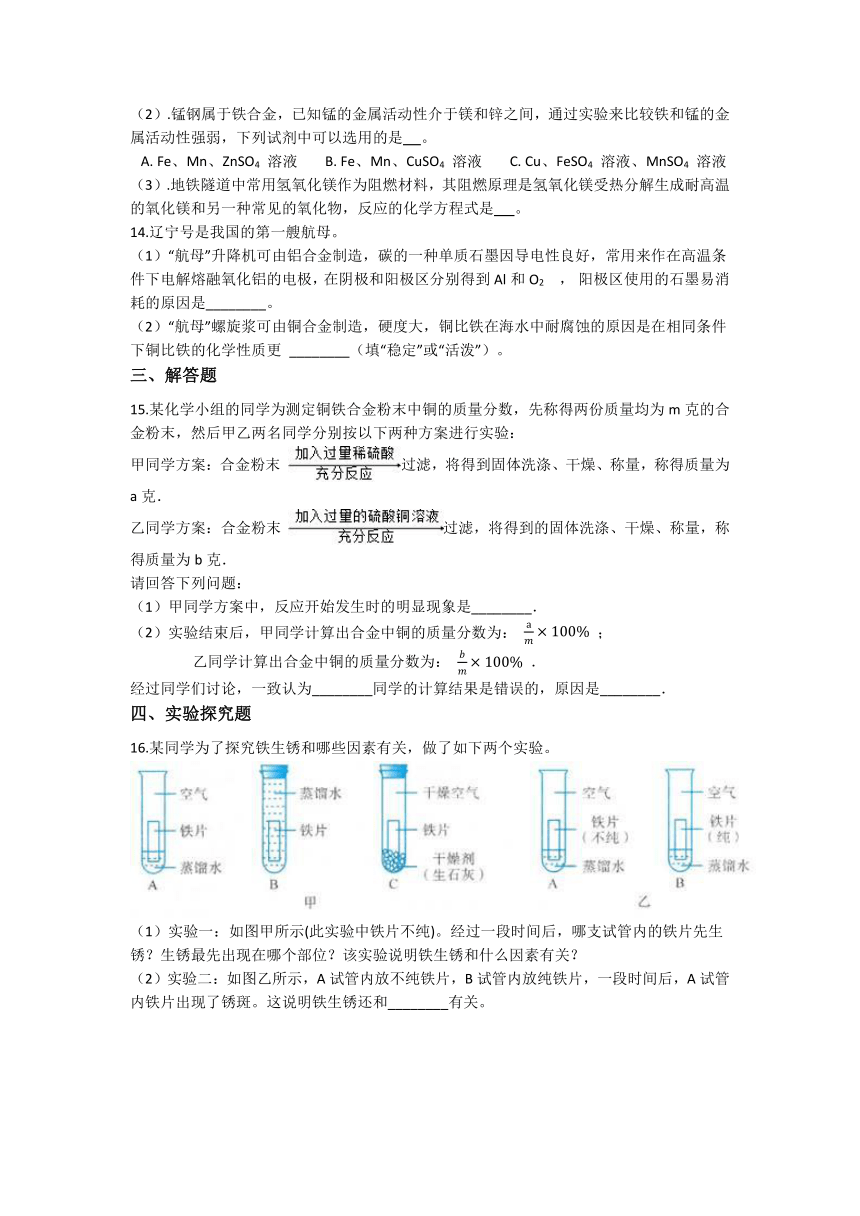
8.向一定质量的AgNO3和Cu(NO)2的混合溶液中不断加入铁粉,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。有关该反应过程,下列说法错误的是( )
A. 向a点溶液中滴加稀盐酸,有白色沉淀 B. bd段是铁粉与Cu(NO)2溶液反应
C. d点溶液中的溶质是Fe(NO)3 D. 在e点时,能得到3种固体
9.四种基本反应类型中,生成物中一定有单质的是( )
A. 分解反应 B. 化合反应 C. 置换反应 D. 复分解反应
10.为研究盐酸的化学性质,小明进行如下实验。其中能产生白色沉淀的是( )
A. B. C. D.
11.下列物质的用途体现了物质化学性质的是( )
A. 浓硫酸用于干燥氧气 B. 干冰用于人工降雨
C. 氢氧化钠溶液用于除去尾气二氧化硫 D. 铜丝用于制作导线
12.现有甲、乙、丙三种金属,甲在常温下就能与氧气反应,乙、丙在常温下几乎不与氧气反应;如果将乙、丙分别放入硫酸铜溶液中,过一会儿,在丙的表面有红色固体析出,而乙表面没有变化,则甲、乙、丙三种金属的活动性由弱到强的顺序是( )
A. 甲乙丙 B. 乙甲丙 C. 乙丙甲 D. 甲丙乙
二、填空题
13. 2020年8月温州轨道交通表示拟建线路7条。
(1).地铁建设过程中的列车轨道由锰钢制成,锰钢属于 材料(填“金属” 或“有机合成”)。
(2).锰钢属于铁合金,已知锰的金属活动性介于镁和锌之间,通过实验来比较铁和锰的金属活动性强弱,下列试剂中可以选用的是 。
A. Fe、Mn、ZnSO4 溶液 B. Fe、Mn、CuSO4 溶液 C. Cu、FeSO4 溶液、MnSO4 溶液
(3).地铁隧道中常用氢氧化镁作为阻燃材料,其阻燃原理是氢氧化镁受热分解生成耐高温的氧化镁和另一种常见的氧化物,反应的化学方程式是 。
14.辽宁号是我国的第一艘航母。
(1)“航母”升降机可由铝合金制造,碳的一种单质石墨因导电性良好,常用来作在高温条件下电解熔融氧化铝的电极,在阴极和阳极区分别得到Al和O2 , 阳极区使用的石墨易消耗的原因是________。
(2)“航母”螺旋浆可由铜合金制造,硬度大,铜比铁在海水中耐腐蚀的原因是在相同条件下铜比铁的化学性质更 ________(填“稳定”或“活泼”)。
三、解答题
15.某化学小组的同学为测定铜铁合金粉末中铜的质量分数,先称得两份质量均为m克的合金粉末,然后甲乙两名同学分别按以下两种方案进行实验:
甲同学方案:合金粉末 过滤,将得到固体洗涤、干燥、称量,称得质量为a克.
乙同学方案:合金粉末 过滤,将得到的固体洗涤、干燥、称量,称得质量为b克.
请回答下列问题:
(1)甲同学方案中,反应开始发生时的明显现象是________.
(2)实验结束后,甲同学计算出合金中铜的质量分数为: ;
乙同学计算出合金中铜的质量分数为: .
经过同学们讨论,一致认为________同学的计算结果是错误的,原因是________.
四、实验探究题
16.某同学为了探究铁生锈和哪些因素有关,做了如下两个实验。
(1)实验一:如图甲所示(此实验中铁片不纯)。经过一段时间后,哪支试管内的铁片先生锈?生锈最先出现在哪个部位?该实验说明铁生锈和什么因素有关?
(2)实验二:如图乙所示,A试管内放不纯铁片,B试管内放纯铁片,一段时间后,A试管内铁片出现了锈斑。这说明铁生锈还和________有关。
答案解析部分
一、单选题
1.【答案】 B
【解析】【分析】根据将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,铜和锌都能与硝酸银反应,且锌先反应,然后铜再反应分析。
【解答】 将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,铜和锌都能与硝酸银反应,且锌先反应,然后铜再反应,充分反应后过滤,向得到的滤渣和滤液中分别加入足量的稀盐酸,均无现象,因锌和硝酸银都能与盐酸,分别产生气泡和沉淀,所以证明滤渣中无锌,滤液中无硝酸银,则滤渣中一定有银,可能有铜,一定没有锌,滤液中一定有硝酸锌,可能有硝酸铜,一定没有硝酸银;
故选B。
2.【答案】 B
【解析】【分析】根据向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,锌先与硝酸银发生反应,然后铜再与硝酸银反应且硝酸铜的溶液呈蓝色分析。
【解答】 向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,充分反应后过滤,得到滤渣和蓝色滤液, 说明溶液中一定含有硝酸锌和硝酸铜,可能含有硝酸银,滤渣中一定含有银,可能含有铜,一定不含锌;
A、 滤渣中一定不含锌,向滤渣中加入稀盐酸,产会有气泡产生 ,不符合题意;
B、滤液中可能含硝酸银,向滤液中加入稀盐酸,可能有沉淀产生 ,符合题意;
C、 滤渣中一定有Ag,一定无Zn,可能有Cu ,不符合题意;
D、 滤液中一定有Zn(NO3)2和Cu(NO3)2 , 可能有AgNO3 ,不符合题意;
故选B。
3.【答案】 A
【解析】【分析】根据金属活动性顺序的应用分析,在金属活动性顺序表中,排在氢前的金属能与酸发生反应,排在前面的金属能与排在后面的金属的盐溶液反应,根据反应是否发生也可证明金属的活动性的强弱。
【解答】 往硝酸银、硝酸铜、硝酸锌的混合溶液中加入一定量的铁粉, 铁先与硝酸银反应,然后再与硝酸铜反应,不能和硝酸锌反应,所以滤纸上一定存在银,可能存在铜或铁,滤液中一定存在硝酸锌和硝酸亚铁,可能存在硝酸铜、硝酸银;
故选A。
4.【答案】 B
【解析】【分析】根据一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中, 锌先与硝酸银反应,然后铜再与硝酸银反应分析。
【解答】 将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中, 锌先与硝酸银反应,然后铜再与硝酸银反应, 向得到的滤渣和滤液分别加入足量的稀盐酸,均无现象 ,说明滤液中硝酸银没有剩余,一定有硝酸锌,可能有硝酸铜,滤渣中锌一定没有剩余,一定有银,可能有铜;
故答案为:B。
5.【答案】 C
【解析】【分析】根据反应物和生成物的种类和数量,对化学反应的种类进行判断。
【解答】根据化学方程式 SiO2+2C Si+2CO↑ 可知,反应物为化合物和单质,生成物也是单质和化合物,因此属于置换反应,故C正确,而A、B、D错误。
故选C。
6.【答案】 C
【解析】【分析】根据金属活动性顺序的应用分析,在金属活动性顺序表中,排在氢前的金属能与酸发生反应,排在前面的金属能与排在后面的金属的盐溶液反应。
【解答】 铁粉加入含AgNO3和Zn(NO3)2两种溶质的溶液中,铁只能与硝酸银发生反应,反应结束后过滤,分别向滤液和滤渣中加入稀盐酸,均无明显现象 ,说明滤液中没有硝酸银,一定有硝酸锌和硝酸亚铁,滤渣中没有铁,只有银,A、B正确;C不正确;根据方程式可知,铁与硝酸银反应时,每56份质量的铁能置换出216份质量的银,溶液质量要减小,D正确;
故选C。
7.【答案】 C
【解析】【分析】(1)在金属活动性顺序表中,只有排在氢前面的金属才能将氢气从酸中置换出来;
(2)金属的活动性越强,与酸反应的越剧烈,产生氢气的速度越快;
(3)在金属和酸的反应中,如果酸过量,产生氢气的量由金属决定;如果金属足量,那么产生氢气的质量由酸决定。
【解答】A. ①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸 ,由于Cu不能与酸反应产生氢气,故A错误;
B. ②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸 ,此时产生氢气的质量由硫酸中溶质的质量决定,因此最终20%的硫酸中溶质质量多,产生的氢气质量大,故B错误;
C.③分别向等质量且足量的Mg和 Zn中加入等质量、等浓度的稀硫酸,此时产生氢气的质量由硫酸中溶质的质量决定,因为稀硫酸中溶质质量相同,所以产生氢气的质量相等;因为Mg更活泼,所以它的反应更快,故C正确;
D. ④分别向等质量的Mg和Zn中同时定量加入等质量、等浓度的稀硫酸 ,由于Mg比Zn的活动性更强,所以它产生氢气的速度更快,故D错误。
故选C。
8.【答案】 C
【解析】【分析】根据金属活动性顺序中排在前面的金属能与排在后面的金属的盐溶液发生反应,且两金属相差越多越先反应分析。
【解答】 向一定质量的AgNO3和Cu(NO)2的混合溶液中不断加入铁粉, 铁先与硝酸银反应,然后再与硝酸铜反应;
A、 a点溶液为硝酸银部分反应的图像,向a点溶液中滴加稀盐酸,有白色沉淀产生,不符合题意;
B、 bd段是铁粉与Cu(NO)2溶液反应 ,不符合题意;
C、 d点为硝酸银和硝酸铜恰好完全反应的图像,溶液中的溶质是硝酸亚铁,不是硝酸铁,符合题意;
D、 e点为镁粉过量的图像,在e点时,固体 为银、铜、铁三种,不符合题意;
故答案为:C。
9.【答案】 C
【解析】【分析】根据四大基本反应类型的特点分析。
【解答】A、分解反应生成物可能有单质,可能没有单质,如碳酸钙分解没有单质,不符合题意;
B、化合反应生成物中一定没单质,不符合题意;
C、置换反应生成物中一定有单质,符合题意;
D、复分解反应生成物中一定没有单质,不符合题意;
故选C。
10.【答案】 A
【解析】【分析】银和汞的氯化物不溶于水,钡和铅的硫酸盐不溶于水,据此判断。
【解答】A.AgNO3溶液与稀盐酸反应生成不溶于水的白色沉淀AgCl,故A符合题意;
B.NaOH与稀盐酸反应生成溶于水的NaCl,故B不合题意;
C.CuO与稀盐酸反应生成溶于水的CuCl2 , 故C不合题意;
D.Zn与稀盐酸反应生成溶于水的ZnCl2 , 故D不合题意。
故选A。
11.【答案】 C
【解析】【分析】化学性质是物质在化学变化中表现出来的性质如:酸性、碱性、氧化性、还原性、热稳定性及一些其它特性,据此分析即可。
【解答】A.浓硫酸用于干燥氧气,是因为浓硫酸具有吸水性, 是物理性质,故A不合题意;
B.干冰用于人工降雨,是因为干冰升华时吸热,周围的水蒸气放热液化而成,是物理性质,故B不合题意;
C.氢氧化钠溶液用于除去尾气二氧化硫,是因为二者反应生成亚硫酸钠和水,是化学性质,故C符合题意;
D.铜丝用于制作导线,利用的金属的导电性,是物理性质,故D不合题意。
故选C。
12.【答案】 C
【解析】【分析】首先根据是否与氧气反应确定甲的活泼性与乙和丙的大小关系,然后再根据是否与硫酸铜反应比较乙和丙的活泼性大小顺序。
【解答】甲在常温下能与氧气反应,而乙和丙不行,说明甲的活泼性大于乙和丙;
丙的表面有红色固体析出,说明丙的活泼性大于铜;
乙的表面没有变化,说明乙的活泼性小于铜;
因此它们活泼性大小的排列顺序为:乙<铜<丙<甲。
故选C。
二、填空题
13.【答案】 (1)金属
(2)A
(3)Mg(OH)2 MgO+H2O
【解析】【分析】(1)根据合金和纯金属都是金属材料分析;
(2)根据金属与盐溶液能否反应可证明金属与盐中金属的活动性顺序分析;
(3)根据氢氧化镁受热分解生成耐高温的氧化镁和水分析。
【解答】(1) 锰钢为合金,属于金属材料;
(2)通过铁不能与硫酸锌反应,锰能与硫酸锌反应,可干劲儿铁和锰的金属活动性强弱,A正确;铁和锰都能与硫酸铜反应,无法证明铁和锰的活动性强弱,B错误;铜不能与硫酸亚铁和硫酸锰反应,无法证明铁和锰的活动性强弱,C错误;
(3) 氢氧化镁受热分解生成耐高温的氧化镁和另一种常见的氧化物,由反应前元素种类可知,该氧化物为水,反应方程式为Mg(OH)2 MgO+H2O ;
14.【答案】 (1)石墨与氧气反应生成了二氧化碳气体
(2)稳定
【解析】【分析】(1)注意碳在高温下和氧气的反应,据此分析石墨消耗的原因;
(2)金属的活动性越强,它就越容易与其他物质发生反应,即化学性质越不稳定,根据金属活动性顺序表对铜和铁的活动性大小进行判断。
【解答】(1)阳极区使用的石墨易消耗的原因是:石墨与氧气反应生成了二氧化碳气体。
(2)根据金属活动性顺序表可知,铜排在铁的后面,那么铜的金属活动性比铁弱,即相同条件下铜比铁的化学性质更稳定。
三、解答题
15.【答案】 (1)有气泡产生
(2)乙;称得固体中既有原混合物中的铜,还有新生成的铜
【解析】【分析】(1)根据金属活动性顺序可以判断,铜铁合金中的铁能与稀硫酸反应生成氢气;(2)根据金属活动性顺序可以判断,铜铁合金中的铁能与硫酸铜溶液反应生成铜和硫酸亚铁溶液.
【解答】解:(1)根据金属活动性顺序可以判断,铜铁合金中的铁能与稀硫酸反应生成氢气,反应开始发生时的明显现象是有气泡产生,故答案为:有气泡产生;(2)乙同学的方案,根据金属活动性顺序可以判断,铜铁合金中的铁能与硫酸铜溶液反应生成铜和硫酸亚铁溶液,这样实验结束时将得到的固体洗涤、干燥、称量,称得质量为b克,要比原来铜铁合金中的铜质量大,故答案为:乙;称得固体中既有原混合物中的铜,还有新生成的铜.
四、实验探究题
16.【答案】 (1)A先生锈,生锈部位在水和空气交界面。该实验说明铁生锈与空气和水分有关。
(2)铁片自身的内部结构
【解析】【分析】根据实验现象及各组实验中的变量分析。
【解答】(1)各实验中A组铁与氧气和水充分接触,最先生锈,生锈部位在与水和空气交界面处;
(2)A中放的不是纯铁,A试管中出现锈斑,还可说明铁生锈与铁的内部结构有关;
故答案为:(1) A先生锈,生锈部位在水和空气交界面。该实验说明铁生锈与空气和水分有关 ; 铁片自身的内部结构 。
一、单选题
1.将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液中分别加入足量的稀盐酸,均无现象。则滤渣中( )
A. 一定有银,可能有铜、锌 B. 一定有银,可能有铜,一定没有锌
C. 一定有银和铜,可能有锌 D. 一定有银和铜,一定没有锌
2.向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,充分反应后过滤,得到滤渣和蓝色滤液,下列说法正确的是( )
A. 向滤渣中加入稀盐酸,可能有气泡产生
B. 向滤液中加入稀盐酸,可能有沉淀产生
C. 滤渣中一定有Ag,一定无Zn和Cu
D. 滤液中一定有Cu(NO3)2 , 可能有Zn(NO3)2和AgNO3
3.往硝酸银、硝酸铜、硝酸锌的混合溶液中加入一定量的铁粉,待反应完成后再过滤,可能存在的情况是( )
A. 滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+
B. 滤纸上有Ag、Cu,滤液中有Ag+、Zn2+、Fe2+
C. 滤纸上有Ag、Cu、Fe,滤液中有Cu2+、Zn2+、Fe2+
D. 滤纸上有Ag、Cu、Fe、Zn,滤液中有Zn2+、Fe2+
4.将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液分别加入足量的稀盐酸,均无现象。则滤渣中( )
A. 一定有银,可能有铜和锌 B. 一定有银,可能有铜,一定没有锌
C. 一定有银和铜,可能有锌 D. 一定有银和铜,一定没有锌
5.电脑芯片的制作要用到高纯度的硅。目前广泛采用石英砂(主要成分是SiO2 , )为原料制取,其中一步反应为:SiO2+2C Si+2CO↑。该反应类型属于( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
6.将一定质量的铁粉加入含AgNO3和Zn(NO3)2两种溶质的溶液中,反应结束后过滤,分别向滤液和滤渣中加入稀盐酸,均无明显现象,下列对滤渣和滤液的说明中,不正确的是( )
A. 滤渣的成分只有银 B. 滤液中的溶质是Zn(NO3)2、Fe (NO3)2
C. 滤渣的成分可能是银、锌的混合物 D. 所得滤液的质量小于反应前原溶液的质量
7.如图所示的四个图象,分别对应四种过程,其中正确的是( )
A. ①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B. ②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C. ③分别向等质量且足量的Mg和 Zn中加入等质量、等浓度的稀硫酸
D. ④分别向等质量的Mg和Zn中同时定量加入等质量、等浓度的稀硫酸
8.向一定质量的AgNO3和Cu(NO)2的混合溶液中不断加入铁粉,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。有关该反应过程,下列说法错误的是( )
A. 向a点溶液中滴加稀盐酸,有白色沉淀 B. bd段是铁粉与Cu(NO)2溶液反应
C. d点溶液中的溶质是Fe(NO)3 D. 在e点时,能得到3种固体
9.四种基本反应类型中,生成物中一定有单质的是( )
A. 分解反应 B. 化合反应 C. 置换反应 D. 复分解反应
10.为研究盐酸的化学性质,小明进行如下实验。其中能产生白色沉淀的是( )
A. B. C. D.
11.下列物质的用途体现了物质化学性质的是( )
A. 浓硫酸用于干燥氧气 B. 干冰用于人工降雨
C. 氢氧化钠溶液用于除去尾气二氧化硫 D. 铜丝用于制作导线
12.现有甲、乙、丙三种金属,甲在常温下就能与氧气反应,乙、丙在常温下几乎不与氧气反应;如果将乙、丙分别放入硫酸铜溶液中,过一会儿,在丙的表面有红色固体析出,而乙表面没有变化,则甲、乙、丙三种金属的活动性由弱到强的顺序是( )
A. 甲乙丙 B. 乙甲丙 C. 乙丙甲 D. 甲丙乙
二、填空题
13. 2020年8月温州轨道交通表示拟建线路7条。
(1).地铁建设过程中的列车轨道由锰钢制成,锰钢属于 材料(填“金属” 或“有机合成”)。
(2).锰钢属于铁合金,已知锰的金属活动性介于镁和锌之间,通过实验来比较铁和锰的金属活动性强弱,下列试剂中可以选用的是 。
A. Fe、Mn、ZnSO4 溶液 B. Fe、Mn、CuSO4 溶液 C. Cu、FeSO4 溶液、MnSO4 溶液
(3).地铁隧道中常用氢氧化镁作为阻燃材料,其阻燃原理是氢氧化镁受热分解生成耐高温的氧化镁和另一种常见的氧化物,反应的化学方程式是 。
14.辽宁号是我国的第一艘航母。
(1)“航母”升降机可由铝合金制造,碳的一种单质石墨因导电性良好,常用来作在高温条件下电解熔融氧化铝的电极,在阴极和阳极区分别得到Al和O2 , 阳极区使用的石墨易消耗的原因是________。
(2)“航母”螺旋浆可由铜合金制造,硬度大,铜比铁在海水中耐腐蚀的原因是在相同条件下铜比铁的化学性质更 ________(填“稳定”或“活泼”)。
三、解答题
15.某化学小组的同学为测定铜铁合金粉末中铜的质量分数,先称得两份质量均为m克的合金粉末,然后甲乙两名同学分别按以下两种方案进行实验:
甲同学方案:合金粉末 过滤,将得到固体洗涤、干燥、称量,称得质量为a克.
乙同学方案:合金粉末 过滤,将得到的固体洗涤、干燥、称量,称得质量为b克.
请回答下列问题:
(1)甲同学方案中,反应开始发生时的明显现象是________.
(2)实验结束后,甲同学计算出合金中铜的质量分数为: ;
乙同学计算出合金中铜的质量分数为: .
经过同学们讨论,一致认为________同学的计算结果是错误的,原因是________.
四、实验探究题
16.某同学为了探究铁生锈和哪些因素有关,做了如下两个实验。
(1)实验一:如图甲所示(此实验中铁片不纯)。经过一段时间后,哪支试管内的铁片先生锈?生锈最先出现在哪个部位?该实验说明铁生锈和什么因素有关?
(2)实验二:如图乙所示,A试管内放不纯铁片,B试管内放纯铁片,一段时间后,A试管内铁片出现了锈斑。这说明铁生锈还和________有关。
答案解析部分
一、单选题
1.【答案】 B
【解析】【分析】根据将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,铜和锌都能与硝酸银反应,且锌先反应,然后铜再反应分析。
【解答】 将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,铜和锌都能与硝酸银反应,且锌先反应,然后铜再反应,充分反应后过滤,向得到的滤渣和滤液中分别加入足量的稀盐酸,均无现象,因锌和硝酸银都能与盐酸,分别产生气泡和沉淀,所以证明滤渣中无锌,滤液中无硝酸银,则滤渣中一定有银,可能有铜,一定没有锌,滤液中一定有硝酸锌,可能有硝酸铜,一定没有硝酸银;
故选B。
2.【答案】 B
【解析】【分析】根据向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,锌先与硝酸银发生反应,然后铜再与硝酸银反应且硝酸铜的溶液呈蓝色分析。
【解答】 向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,充分反应后过滤,得到滤渣和蓝色滤液, 说明溶液中一定含有硝酸锌和硝酸铜,可能含有硝酸银,滤渣中一定含有银,可能含有铜,一定不含锌;
A、 滤渣中一定不含锌,向滤渣中加入稀盐酸,产会有气泡产生 ,不符合题意;
B、滤液中可能含硝酸银,向滤液中加入稀盐酸,可能有沉淀产生 ,符合题意;
C、 滤渣中一定有Ag,一定无Zn,可能有Cu ,不符合题意;
D、 滤液中一定有Zn(NO3)2和Cu(NO3)2 , 可能有AgNO3 ,不符合题意;
故选B。
3.【答案】 A
【解析】【分析】根据金属活动性顺序的应用分析,在金属活动性顺序表中,排在氢前的金属能与酸发生反应,排在前面的金属能与排在后面的金属的盐溶液反应,根据反应是否发生也可证明金属的活动性的强弱。
【解答】 往硝酸银、硝酸铜、硝酸锌的混合溶液中加入一定量的铁粉, 铁先与硝酸银反应,然后再与硝酸铜反应,不能和硝酸锌反应,所以滤纸上一定存在银,可能存在铜或铁,滤液中一定存在硝酸锌和硝酸亚铁,可能存在硝酸铜、硝酸银;
故选A。
4.【答案】 B
【解析】【分析】根据一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中, 锌先与硝酸银反应,然后铜再与硝酸银反应分析。
【解答】 将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中, 锌先与硝酸银反应,然后铜再与硝酸银反应, 向得到的滤渣和滤液分别加入足量的稀盐酸,均无现象 ,说明滤液中硝酸银没有剩余,一定有硝酸锌,可能有硝酸铜,滤渣中锌一定没有剩余,一定有银,可能有铜;
故答案为:B。
5.【答案】 C
【解析】【分析】根据反应物和生成物的种类和数量,对化学反应的种类进行判断。
【解答】根据化学方程式 SiO2+2C Si+2CO↑ 可知,反应物为化合物和单质,生成物也是单质和化合物,因此属于置换反应,故C正确,而A、B、D错误。
故选C。
6.【答案】 C
【解析】【分析】根据金属活动性顺序的应用分析,在金属活动性顺序表中,排在氢前的金属能与酸发生反应,排在前面的金属能与排在后面的金属的盐溶液反应。
【解答】 铁粉加入含AgNO3和Zn(NO3)2两种溶质的溶液中,铁只能与硝酸银发生反应,反应结束后过滤,分别向滤液和滤渣中加入稀盐酸,均无明显现象 ,说明滤液中没有硝酸银,一定有硝酸锌和硝酸亚铁,滤渣中没有铁,只有银,A、B正确;C不正确;根据方程式可知,铁与硝酸银反应时,每56份质量的铁能置换出216份质量的银,溶液质量要减小,D正确;
故选C。
7.【答案】 C
【解析】【分析】(1)在金属活动性顺序表中,只有排在氢前面的金属才能将氢气从酸中置换出来;
(2)金属的活动性越强,与酸反应的越剧烈,产生氢气的速度越快;
(3)在金属和酸的反应中,如果酸过量,产生氢气的量由金属决定;如果金属足量,那么产生氢气的质量由酸决定。
【解答】A. ①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸 ,由于Cu不能与酸反应产生氢气,故A错误;
B. ②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸 ,此时产生氢气的质量由硫酸中溶质的质量决定,因此最终20%的硫酸中溶质质量多,产生的氢气质量大,故B错误;
C.③分别向等质量且足量的Mg和 Zn中加入等质量、等浓度的稀硫酸,此时产生氢气的质量由硫酸中溶质的质量决定,因为稀硫酸中溶质质量相同,所以产生氢气的质量相等;因为Mg更活泼,所以它的反应更快,故C正确;
D. ④分别向等质量的Mg和Zn中同时定量加入等质量、等浓度的稀硫酸 ,由于Mg比Zn的活动性更强,所以它产生氢气的速度更快,故D错误。
故选C。
8.【答案】 C
【解析】【分析】根据金属活动性顺序中排在前面的金属能与排在后面的金属的盐溶液发生反应,且两金属相差越多越先反应分析。
【解答】 向一定质量的AgNO3和Cu(NO)2的混合溶液中不断加入铁粉, 铁先与硝酸银反应,然后再与硝酸铜反应;
A、 a点溶液为硝酸银部分反应的图像,向a点溶液中滴加稀盐酸,有白色沉淀产生,不符合题意;
B、 bd段是铁粉与Cu(NO)2溶液反应 ,不符合题意;
C、 d点为硝酸银和硝酸铜恰好完全反应的图像,溶液中的溶质是硝酸亚铁,不是硝酸铁,符合题意;
D、 e点为镁粉过量的图像,在e点时,固体 为银、铜、铁三种,不符合题意;
故答案为:C。
9.【答案】 C
【解析】【分析】根据四大基本反应类型的特点分析。
【解答】A、分解反应生成物可能有单质,可能没有单质,如碳酸钙分解没有单质,不符合题意;
B、化合反应生成物中一定没单质,不符合题意;
C、置换反应生成物中一定有单质,符合题意;
D、复分解反应生成物中一定没有单质,不符合题意;
故选C。
10.【答案】 A
【解析】【分析】银和汞的氯化物不溶于水,钡和铅的硫酸盐不溶于水,据此判断。
【解答】A.AgNO3溶液与稀盐酸反应生成不溶于水的白色沉淀AgCl,故A符合题意;
B.NaOH与稀盐酸反应生成溶于水的NaCl,故B不合题意;
C.CuO与稀盐酸反应生成溶于水的CuCl2 , 故C不合题意;
D.Zn与稀盐酸反应生成溶于水的ZnCl2 , 故D不合题意。
故选A。
11.【答案】 C
【解析】【分析】化学性质是物质在化学变化中表现出来的性质如:酸性、碱性、氧化性、还原性、热稳定性及一些其它特性,据此分析即可。
【解答】A.浓硫酸用于干燥氧气,是因为浓硫酸具有吸水性, 是物理性质,故A不合题意;
B.干冰用于人工降雨,是因为干冰升华时吸热,周围的水蒸气放热液化而成,是物理性质,故B不合题意;
C.氢氧化钠溶液用于除去尾气二氧化硫,是因为二者反应生成亚硫酸钠和水,是化学性质,故C符合题意;
D.铜丝用于制作导线,利用的金属的导电性,是物理性质,故D不合题意。
故选C。
12.【答案】 C
【解析】【分析】首先根据是否与氧气反应确定甲的活泼性与乙和丙的大小关系,然后再根据是否与硫酸铜反应比较乙和丙的活泼性大小顺序。
【解答】甲在常温下能与氧气反应,而乙和丙不行,说明甲的活泼性大于乙和丙;
丙的表面有红色固体析出,说明丙的活泼性大于铜;
乙的表面没有变化,说明乙的活泼性小于铜;
因此它们活泼性大小的排列顺序为:乙<铜<丙<甲。
故选C。
二、填空题
13.【答案】 (1)金属
(2)A
(3)Mg(OH)2 MgO+H2O
【解析】【分析】(1)根据合金和纯金属都是金属材料分析;
(2)根据金属与盐溶液能否反应可证明金属与盐中金属的活动性顺序分析;
(3)根据氢氧化镁受热分解生成耐高温的氧化镁和水分析。
【解答】(1) 锰钢为合金,属于金属材料;
(2)通过铁不能与硫酸锌反应,锰能与硫酸锌反应,可干劲儿铁和锰的金属活动性强弱,A正确;铁和锰都能与硫酸铜反应,无法证明铁和锰的活动性强弱,B错误;铜不能与硫酸亚铁和硫酸锰反应,无法证明铁和锰的活动性强弱,C错误;
(3) 氢氧化镁受热分解生成耐高温的氧化镁和另一种常见的氧化物,由反应前元素种类可知,该氧化物为水,反应方程式为Mg(OH)2 MgO+H2O ;
14.【答案】 (1)石墨与氧气反应生成了二氧化碳气体
(2)稳定
【解析】【分析】(1)注意碳在高温下和氧气的反应,据此分析石墨消耗的原因;
(2)金属的活动性越强,它就越容易与其他物质发生反应,即化学性质越不稳定,根据金属活动性顺序表对铜和铁的活动性大小进行判断。
【解答】(1)阳极区使用的石墨易消耗的原因是:石墨与氧气反应生成了二氧化碳气体。
(2)根据金属活动性顺序表可知,铜排在铁的后面,那么铜的金属活动性比铁弱,即相同条件下铜比铁的化学性质更稳定。
三、解答题
15.【答案】 (1)有气泡产生
(2)乙;称得固体中既有原混合物中的铜,还有新生成的铜
【解析】【分析】(1)根据金属活动性顺序可以判断,铜铁合金中的铁能与稀硫酸反应生成氢气;(2)根据金属活动性顺序可以判断,铜铁合金中的铁能与硫酸铜溶液反应生成铜和硫酸亚铁溶液.
【解答】解:(1)根据金属活动性顺序可以判断,铜铁合金中的铁能与稀硫酸反应生成氢气,反应开始发生时的明显现象是有气泡产生,故答案为:有气泡产生;(2)乙同学的方案,根据金属活动性顺序可以判断,铜铁合金中的铁能与硫酸铜溶液反应生成铜和硫酸亚铁溶液,这样实验结束时将得到的固体洗涤、干燥、称量,称得质量为b克,要比原来铜铁合金中的铜质量大,故答案为:乙;称得固体中既有原混合物中的铜,还有新生成的铜.
四、实验探究题
16.【答案】 (1)A先生锈,生锈部位在水和空气交界面。该实验说明铁生锈与空气和水分有关。
(2)铁片自身的内部结构
【解析】【分析】根据实验现象及各组实验中的变量分析。
【解答】(1)各实验中A组铁与氧气和水充分接触,最先生锈,生锈部位在与水和空气交界面处;
(2)A中放的不是纯铁,A试管中出现锈斑,还可说明铁生锈与铁的内部结构有关;
故答案为:(1) A先生锈,生锈部位在水和空气交界面。该实验说明铁生锈与空气和水分有关 ; 铁片自身的内部结构 。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
