3.3常见的盐 精选练习 (含答案)
文档属性
| 名称 | 3.3常见的盐 精选练习 (含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 330.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-19 14:21:16 | ||
图片预览


文档简介
2021-2022学年华师大版九年级常见的盐的精选练习
一.选择题(共8小题)
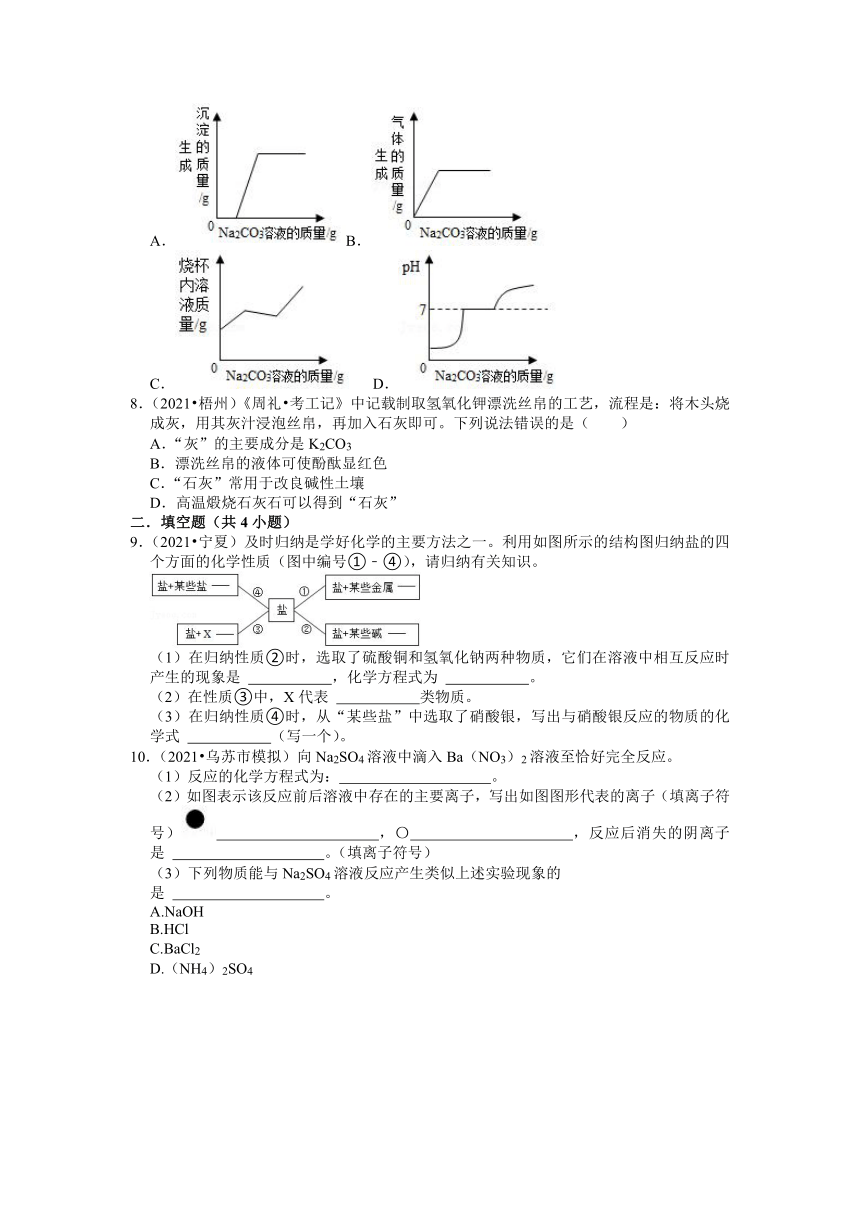
1.(2021 河池)制作包子、蛋糕所用发酵粉的主要成分含有碳酸氢钠。碳酸氢钠的俗称是( )
A.小苏打 B.苏打 C.苛性钠 D.火碱
2.(2021 苏州)下列有关实验室制取二氧化碳气体的操作图示正确的是( )
A.导管连接 B.胶塞塞紧
C.气体验满 D.气体收集
3.(2021 重庆)实验室制取二氧化碳部分操作如图所示,其中错误的是( )
A.检查气密性 B.仪器连接
C.加入药品 D.收集气体
4.(2021 遵义)有一包不纯的K2CO3样品,含有一定量的KOH和KCl。现需测定该样品中K2CO3的质量分数,取10g样品充分溶解后进行实验。下列方案合理的是( )
A.加入过量的Ca(OH)2固体,充分反应后过滤,称滤渣的质量
B.加入足量溶质质量分数为7.3%的稀盐酸,称反应后溶液的质量
C.加入足量的MgCl2溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
D.加入足量的BaCl2溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
5.(2021 恩施州)某公司生产的融雪剂由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成。小洁同学将该融雪剂加水溶解,得到无色溶液,向该溶液中加入K2CO3溶液,有白色沉淀生成。由此可知,该融雪剂的组成可能是( )
A.CuSO4 NaCl B.Na2CO3 NaCl
C.CaCl2 NaCl D.CuSO4 CaCl2
6.(2021 株洲)下列选项中各溶质的溶液混合,无明显现象的是( )
A.NaCl、BaCl2、KNO3 B.CuSO4、NaOH、KCl
C.BaCl2、Na2SO4、HCl D.CaCl2、Na2CO3、KNO3
7.(2021 凉山州)兴趣小组对实验室制取二氧化碳的废液进行了探究,最终确认废液中的溶质为CaCl2和HCl。已知CaCl2溶液呈中性。某同学取了一定质量的该废液于烧杯中,并向其中逐滴加入Na2CO3溶液,以下坐标图是他对烧杯中物质变化情况的分析图,其中明显不合理的是( )
A.B.
C. D.
8.(2021 梧州)《周礼 考工记》中记载制取氢氧化钾漂洗丝帛的工艺,流程是:将木头烧成灰,用其灰汁浸泡丝帛,再加入石灰即可。下列说法错误的是( )
A.“灰”的主要成分是K2CO3
B.漂洗丝帛的液体可使酚酞显红色
C.“石灰”常用于改良碱性土壤
D.高温煅烧石灰石可以得到“石灰”
二.填空题(共4小题)
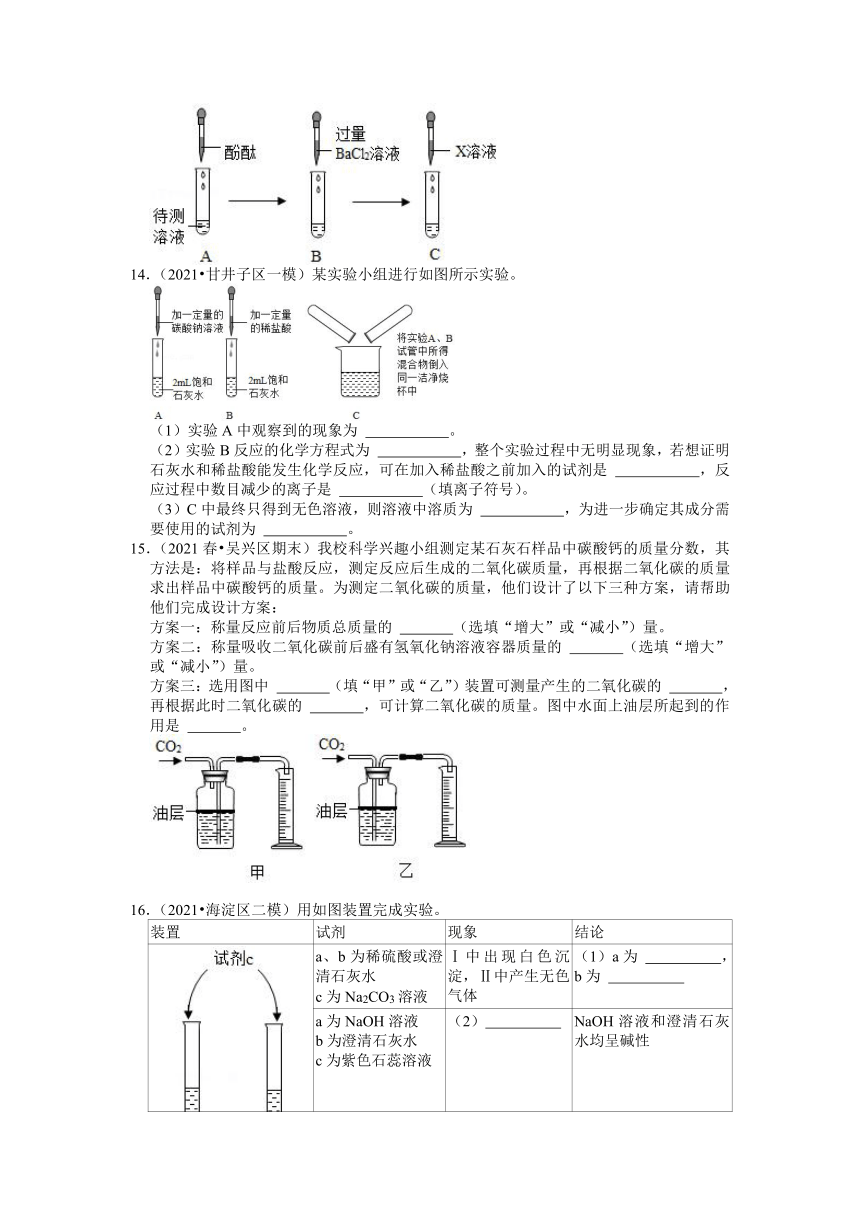
9.(2021 宁夏)及时归纳是学好化学的主要方法之一。利用如图所示的结构图归纳盐的四个方面的化学性质(图中编号①﹣④),请归纳有关知识。
(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是 ,化学方程式为 。
(2)在性质③中,X代表 类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学式 (写一个)。
10.(2021 乌苏市模拟)向Na2SO4溶液中滴入Ba(NO3)2溶液至恰好完全反应。
(1)反应的化学方程式为: 。
(2)如图表示该反应前后溶液中存在的主要离子,写出如图图形代表的离子(填离子符号) ,〇 ,反应后消失的阴离子是 。(填离子符号)
(3)下列物质能与Na2SO4溶液反应产生类似上述实验现象的
是 。
A.NaOH
B.HCl
C.BaCl2
D.(NH4)2SO4
11.(2021 科尔沁区模拟)铁、氯化铜、石灰水、稀盐酸、石灰石之间的反应如图所示,图中两圆相交部分表示物质间的反应,则:
(1)a处化学反应的基本类型为 。
(2)b处的实验现象为 。
(3)c处的化学反应方程式为 。
(4)d处是实验室制取 气体的反应原理,检验该气体的化学反应为 。
12.(2021 河南二模)向含有氯化钠、氯化钙和稀盐酸的混合溶液中滴加碳酸钠溶液,溶液的pH变化情况如图所示:
(1)0﹣a段发生的化学反应方程式为 。
(2)a﹣b段溶液的pH没有变化的原因是: 。
三.实验探究题(共5小题)
13.(2021 韩城市模拟)小兰同学设计了一个验证某NaCl溶液中是否混有Na2CO3、Na2SO4和NaOH的实验流程,如图所示。(已知BaCl2溶液呈中性)
(1)试管A中的溶液呈红色。
(2)滴加过量BaCl2溶液,充分反应后试管B中有白色沉淀产生,溶液仍显红色,则可判断原溶液中一定含有 。B中发生反应的化学方程式可能为 (只写一个)。
(3)再向C中加入适量X溶液,即可确定溶液成分,则X溶液可能是 (填字母)。
A.稀HCl
B.稀H2SO4
C.CaCl2
14.(2021 甘井子区一模)某实验小组进行如图所示实验。
(1)实验A中观察到的现象为 。
(2)实验B反应的化学方程式为 ,整个实验过程中无明显现象,若想证明石灰水和稀盐酸能发生化学反应,可在加入稀盐酸之前加入的试剂是 ,反应过程中数目减少的离子是 (填离子符号)。
(3)C中最终只得到无色溶液,则溶液中溶质为 ,为进一步确定其成分需要使用的试剂为 。
15.(2021春 吴兴区期末)我校科学兴趣小组测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与盐酸反应,测定反应后生成的二氧化碳质量,再根据二氧化碳的质量求出样品中碳酸钙的质量。为测定二氧化碳的质量,他们设计了以下三种方案,请帮助他们完成设计方案:
方案一:称量反应前后物质总质量的 (选填“增大”或“减小”)量。
方案二:称量吸收二氧化碳前后盛有氢氧化钠溶液容器质量的 (选填“增大”或“减小”)量。
方案三:选用图中 (填“甲”或“乙”)装置可测量产生的二氧化碳的 ,再根据此时二氧化碳的 ,可计算二氧化碳的质量。图中水面上油层所起到的作用是 。
16.(2021 海淀区二模)用如图装置完成实验。
装置 试剂 现象 结论
a、b为稀硫酸或澄清石灰水c为Na2CO3溶液 Ⅰ中出现白色沉淀,Ⅱ中产生无色气体 (1)a为 ,b为
a为NaOH溶液b为澄清石灰水c为紫色石蕊溶液 (2) NaOH溶液和澄清石灰水均呈碱性
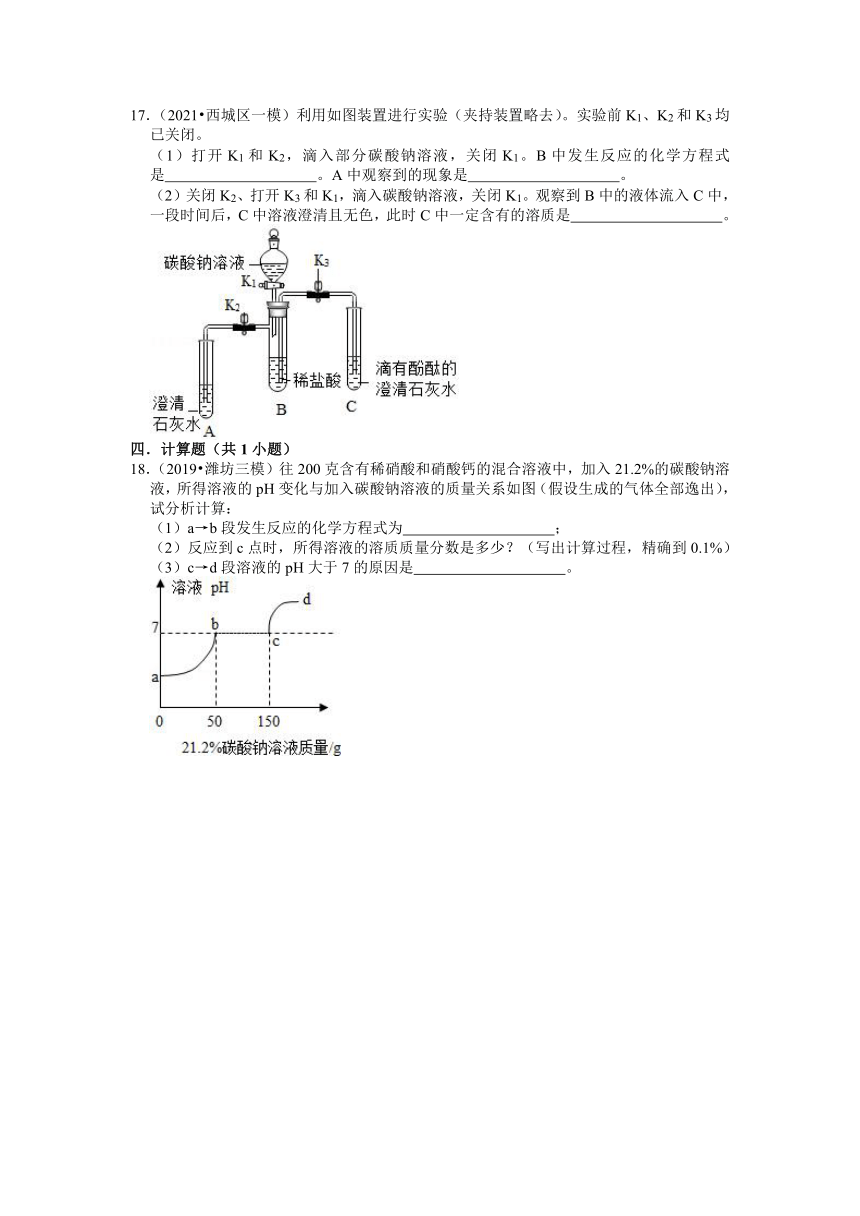
17.(2021 西城区一模)利用如图装置进行实验(夹持装置略去)。实验前K1、K2和K3均已关闭。
(1)打开K1和K2,滴入部分碳酸钠溶液,关闭K1。B中发生反应的化学方程式是 。A中观察到的现象是 。
(2)关闭K2、打开K3和K1,滴入碳酸钠溶液,关闭K1。观察到B中的液体流入C中,一段时间后,C中溶液澄清且无色,此时C中一定含有的溶质是 。
四.计算题(共1小题)
18.(2019 潍坊三模)往200克含有稀硝酸和硝酸钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图(假设生成的气体全部逸出),试分析计算:
(1)a→b段发生反应的化学方程式为 ;
(2)反应到c点时,所得溶液的溶质质量分数是多少?(写出计算过程,精确到0.1%)
(3)c→d段溶液的pH大于7的原因是 。
2021-2022学年华师大版九年级常见的盐的精选练习
参考答案与试题解析
一.选择题(共8小题)
1.(2021 河池)制作包子、蛋糕所用发酵粉的主要成分含有碳酸氢钠。碳酸氢钠的俗称是( )
A.小苏打 B.苏打 C.苛性钠 D.火碱
【解答】解:A、碳酸氢钠俗称小苏打,故选项A正确。
B、苏打是碳酸钠的俗称,故选项B错误。
C、苛性钠是氢氧化钠的俗称,故选项C错误。
D、火碱是氢氧化钠的俗称,故选项D错误。
故选:A。
2.(2021 苏州)下列有关实验室制取二氧化碳气体的操作图示正确的是( )
A.导管连接 B.胶塞塞紧
C.气体验满 D.气体收集
【解答】解:A、导管连接胶皮管时,先把导管一端湿润,然后稍用力转动使之插入胶皮管内,图中所示装置正确。
B、把橡皮塞慢慢转动着塞进试管口,切不可把试管放在桌上再使劲塞进塞子,以免压破试管,图中所示操作错误。
C、检验二氧化碳是否收集满时,应将燃着的木条放在集气瓶口,不能伸入瓶中,图中所示操作错误。
D、二氧化碳能溶于水,不能用排水法收集,且用排水法收集气体时,导管不能伸入集气瓶太长,图中所示操作错误。
故选:A。
3.(2021 重庆)实验室制取二氧化碳部分操作如图所示,其中错误的是( )
A.检查气密性 B.仪器连接
C.加入药品 D.收集气体
【解答】解:A.图示装置在检查装置的气密性时,先由长颈漏斗注水,当水将长颈漏斗的末端浸没起来后,再用双手紧捂锥形瓶的外壁,若观察到导管口处冒出气泡,证明该装置的气密性是良好的,图示操作正确;
B.连接橡胶管和玻璃管时,先将玻璃管一端用水润湿,然后一手持玻璃管,一手持橡胶管,稍稍用力,转动插入,图示操作正确;
C.向锥形瓶中添加块状固体药品时,将锥形瓶倾斜,用镊子将大理石放到瓶口,然后将锥形瓶慢慢竖起,使药品滑落到容器底部,图示操作错误。
D.二氧化碳的密度比空气大,用图示装置来收集二氧化碳时,二氧化碳应从长管进入,图示操作正确。
故选:C。
4.(2021 遵义)有一包不纯的K2CO3样品,含有一定量的KOH和KCl。现需测定该样品中K2CO3的质量分数,取10g样品充分溶解后进行实验。下列方案合理的是( )
A.加入过量的Ca(OH)2固体,充分反应后过滤,称滤渣的质量
B.加入足量溶质质量分数为7.3%的稀盐酸,称反应后溶液的质量
C.加入足量的MgCl2溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
D.加入足量的BaCl2溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
【解答】解:A、常温下,氢氧化钙微溶于水,过量的氢氧化钙也会以沉淀的形式出现,滤渣的质量包括氢氧化钙和碳酸钙,方案不合理,故A错误;
B、碳酸钾和盐酸反应生成氯化钾、水和二氧化碳,二氧化碳会携带一定量的水蒸气,溶液减小的质量将增大,不能测定,故B错误;
C、氯化镁和碳酸钾反应生成碳酸镁沉淀和氯化钾,和氢氧化钾反应生成氢氧化镁沉淀和氯化钾,不能测定,故C错误;
D、碳酸钾和氯化钡反应生成碳酸钡沉淀和氯化钾,依据滤渣碳酸钡的质量可以计算出碳酸钾的质量,进而计算出该样品中K2CO3的质量分数,故D正确。
故选:D。
5.(2021 恩施州)某公司生产的融雪剂由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成。小洁同学将该融雪剂加水溶解,得到无色溶液,向该溶液中加入K2CO3溶液,有白色沉淀生成。由此可知,该融雪剂的组成可能是( )
A.CuSO4 NaCl B.Na2CO3 NaCl
C.CaCl2 NaCl D.CuSO4 CaCl2
【解答】解:某公司生产的融雪剂由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成。将该融雪剂加水溶解,得到无色溶液,则一定不含硫酸铜,因为硫酸铜溶于水显蓝色;向该溶液中加入K2CO3溶液,有白色沉淀生成,碳酸钾能与氯化钙溶液反应生成碳酸钙白色沉淀,则该融雪剂一定含有氯化钙,氯化钙与碳酸钠不能共存,则一定不含碳酸钠,无法确定是否含有氯化钠,则该融雪剂的组成可能是CaCl2 NaCl。
故选:C。
6.(2021 株洲)下列选项中各溶质的溶液混合,无明显现象的是( )
A.NaCl、BaCl2、KNO3 B.CuSO4、NaOH、KCl
C.BaCl2、Na2SO4、HCl D.CaCl2、Na2CO3、KNO3
【解答】解:A、三者之间交换成分没有沉淀或气体或水生成,不能发生复分解反应,无明显现象,故选项正确。
B、CuSO4、NaOH反应生成氢氧化铜沉蓝色淀和硫酸钠,有明显现象,故选项错误。
C、BaCl2、Na2SO4反应生成硫酸钡沉淀和氯化钠,有明显现象,故选项错误。
D、CaCl2、Na2CO3反应生成碳酸钙沉淀和氯化钠,有明显现象,故选项错误。
故选:A。
7.(2021 凉山州)兴趣小组对实验室制取二氧化碳的废液进行了探究,最终确认废液中的溶质为CaCl2和HCl。已知CaCl2溶液呈中性。某同学取了一定质量的该废液于烧杯中,并向其中逐滴加入Na2CO3溶液,以下坐标图是他对烧杯中物质变化情况的分析图,其中明显不合理的是( )
A.
B.
C.
D.
【解答】解:往CaCl2和HCl的混合溶液中滴加Na2CO3溶液时,先发生的反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,后发生的反应为CaCl2+Na2CO3=CaCO3↓+2NaCl;
A、由于先发生的反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,所以一开始滴加碳酸钠溶液时,不产生沉淀,待混合溶液中HCl消耗完后发生的反应为:CaCl2+Na2CO3=CaCO3↓+2NaCl,此时开始产生沉淀,待CaCl2反应结束后沉淀质量不变,选项图示正确;
B、由于先发生的反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,所以一开始滴加碳酸钠溶液时,就开始产生气体,待溶液中HCl消耗完之后,不在产生气体,选项图示正确;
C、往CaCl2和HCl的混合溶液中滴加Na2CO3溶液时,先发生的反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,参与反应的碳酸的质量大于反应生成的二氧化碳的质量,此时溶液质量增加,后发生的反应为CaCl2+Na2CO3=CaCO3↓+2NaCl,参与反应的碳酸钠的质量大于生成的碳酸钙的质量,此时溶液质量继续增加,反应结束后继续滴加碳酸钠溶液,溶液质量继续增加,选项图示错误;
D、由于溶液中含有HCl,溶液一开始pH值小于7,随着碳酸钠的加入,由于碳酸钠和盐酸反应,酸性减弱,溶液测pH值升高,当把盐酸反应完后,碳酸钠再和氯化钙反应生成碳酸钙和氯化钠,此时溶液的pH值等于7,当把氯化钙反应完后,再加入碳酸钠,由于碳酸钠溶液显碱性,所以溶液的pH值又升高且大于7,选项图示正确;
故选:C。
8.(2021 梧州)《周礼 考工记》中记载制取氢氧化钾漂洗丝帛的工艺,流程是:将木头烧成灰,用其灰汁浸泡丝帛,再加入石灰即可。下列说法错误的是( )
A.“灰”的主要成分是K2CO3
B.漂洗丝帛的液体可使酚酞显红色
C.“石灰”常用于改良碱性土壤
D.高温煅烧石灰石可以得到“石灰”
【解答】解:A、木头燃烧后生成灰,主要是碳酸钾,可以作为钾肥使用,选项A正确;
B、漂洗后的液体含有碱氢氧化钾,所以加入酚酞后,溶液变红,选项B正确;
C、石灰是氧化钙的俗称,用于改良酸性土壤,选项C错误;
D、高温煅烧石灰石发生的反应是碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙俗称为石灰,选项D正确;
故选:C。
二.填空题(共4小题)
9.(2021 宁夏)及时归纳是学好化学的主要方法之一。利用如图所示的结构图归纳盐的四个方面的化学性质(图中编号①﹣④),请归纳有关知识。
(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是 产生蓝色沉淀 ,化学方程式为 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 。
(2)在性质③中,X代表 酸 类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学式 NaCl (写一个)。
【解答】解:(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是产生蓝色沉淀,是因为氢氧化钠和硫酸铜反应生成蓝色沉淀氢氧化铜和硫酸钠,化学方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。
故填:产生蓝色沉淀;CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。
(2)在性质③中,X代表酸类物质,即酸能和某些盐反应。
故填:酸。
(3)氯化钠是盐,与硝酸银反应生成白色沉淀氯化银和硝酸钠,与硝酸银反应的物质的化学式是NaCl。
故填:NaCl。
10.(2021 乌苏市模拟)向Na2SO4溶液中滴入Ba(NO3)2溶液至恰好完全反应。
(1)反应的化学方程式为: Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3 。
(2)如图表示该反应前后溶液中存在的主要离子,写出如图图形代表的离子(填离子符号) NO3﹣ ,〇 Na+ ,反应后消失的阴离子是 SO42﹣ 。(填离子符号)
(3)下列物质能与Na2SO4溶液反应产生类似上述实验现象的是 C 。
A.NaOH
B.HCl
C.BaCl2
D.(NH4)2SO4
【解答】解:(1)硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,化学方程式为:Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3;
(2)反应的实质是钡离子和硫酸根离子反应生成硫酸钡沉淀,图形代表的离子NO3﹣;〇Na+,反应后消失的阴离子是SO42﹣;
(3)硫酸钠溶液与氯化钡溶液反应生成硫酸钡沉淀和氯化钠,反应的实质是硫酸根离子和钡离子结合生成硫酸钡沉淀,故选:C。
故答案为:(1)Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3;
(2)NO3﹣;Na+;SO42﹣;
(3)C。
11.(2021 科尔沁区模拟)铁、氯化铜、石灰水、稀盐酸、石灰石之间的反应如图所示,图中两圆相交部分表示物质间的反应,则:
(1)a处化学反应的基本类型为 置换反应 。
(2)b处的实验现象为 产生蓝色沉淀 。
(3)c处的化学反应方程式为 Ca(OH)2+2HCl=CaCl2+2H2O 。
(4)d处是实验室制取 CO2 气体的反应原理,检验该气体的化学反应为 Ca(OH)2+CO2=CaCO3↓+H2O 。
【解答】解:(1)a处的反应是铁和氯化铜反应生成氯化亚铁和铜,基本反应类型为置换反应;
(2)b处的反应是氯化铜和氢氧化钙反应生成氯化钙和氢氧化铜沉淀,实验现象为:产生蓝色沉淀;
(3)c处的反应是氢氧化钙和盐酸反应生成氯化钙和水,化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O;
(4)d处的反应是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,是实验室制取CO2气体的反应原理;检验该气体的反应为二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O。
故答案为:(1)置换反应;
(2)产生蓝色沉淀;
(3)Ca(OH)2+2HCl=CaCl2+2H2O;
(4)CO2;Ca(OH)2+CO2=CaCO3↓+H2O。
12.(2021 河南二模)向含有氯化钠、氯化钙和稀盐酸的混合溶液中滴加碳酸钠溶液,溶液的pH变化情况如图所示:
(1)0﹣a段发生的化学反应方程式为 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 。
(2)a﹣b段溶液的pH没有变化的原因是: 碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,对溶液的酸碱性没有影响 。
【解答】解:(1)向含有氯化钠、氯化钙和稀盐酸的混合溶液中滴加碳酸钠溶液,碳酸钠先与稀盐酸反应生成氯化钠、水和二氧化碳,稀盐酸反应完,再与氯化钙反应生成碳酸钙沉淀和氯化钠。0﹣a段发生的碳酸钠先与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑。
(2)a﹣b段溶液的pH没有变化,是因为碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,对溶液的酸碱性没有影响。
故答案为:
(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,对溶液的酸碱性没有影响。
三.实验探究题(共5小题)
13.(2021 韩城市模拟)小兰同学设计了一个验证某NaCl溶液中是否混有Na2CO3、Na2SO4和NaOH的实验流程,如图所示。(已知BaCl2溶液呈中性)
(1)试管A中的溶液呈红色。
(2)滴加过量BaCl2溶液,充分反应后试管B中有白色沉淀产生,溶液仍显红色,则可判断原溶液中一定含有 氢氧化钠 。B中发生反应的化学方程式可能为 BaCl2+Na2CO3=BaCO3↓+2NaCl或BaCl2+Na2SO4=BaSO4↓+Na2SO4 (只写一个)。
(3)再向C中加入适量X溶液,即可确定溶液成分,则X溶液可能是 A (填字母)。
A.稀HCl
B.稀H2SO4
C.CaCl2
【解答】解:(2)无色酚酞溶液遇酸性溶液不变色,遇中性溶液不变色,遇碱性溶液变红,试管A中的溶液量红色,说明溶液显喊性,含有碳酸钠或氢氧化的中的一种或两种;继续滴加过里的氯化钡溶液,产生白色沉淀,溶液仍显红色,则酸酸钠或硫酸钠被反应完,又知BaC12、NaC1溶液呈中性,即可判断原溶液中一定含有呈碱性的氢氧化钠,试管B中的白色沉淀可能是BaCO3或BaSO4,则发生反应的化学方程式可能为BaCl2+Na2CO3=BaCO3↓+2NaCl或BaCl2+Na2SO4=BaSO4↓+Na2SO4;故答案为:氢氧化钠;BaCl2+Na2CO3=BaCO3↓+2NaCl或BaCl2+Na2SO4=BaSO4↓+Na2SO4;
(3)碳酸钡沉淀能与酸反应,硫酸钡沉淀不溶于酸,则X应为酸溶液,但不能选用稀硫酸,因为会对新酸的的检验造成干扰。根据沉淀部分消失还是全部消失、是否有气泡产生,可以完成对Na2CO3和Na2SO4的验证;故答案为:A。
14.(2021 甘井子区一模)某实验小组进行如图所示实验。
(1)实验A中观察到的现象为 产生白色沉淀 。
(2)实验B反应的化学方程式为 Ca(OH)2+2HCl=CaCl2+2H2O ,整个实验过程中无明显现象,若想证明石灰水和稀盐酸能发生化学反应,可在加入稀盐酸之前加入的试剂是 无色酚酞 ,反应过程中数目减少的离子是 H+、OH﹣ (填离子符号)。
(3)C中最终只得到无色溶液,则溶液中溶质为 氯化钙、氯化钠 ,为进一步确定其成分需要使用的试剂为 碳酸钠溶液 。
【解答】解:(1)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以实验A中观察到的现象为:产生白色沉淀;
(2)实验B的反应是氢氧化钙和盐酸反应生成氯化钙和水,化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O,整个实验过程中无明显现象,若想证明石灰水和稀盐酸能发生化学反应,可在加入稀盐酸之前加入的试剂是无色酚酞;中和反应的实质是氢离子和氢氧根离子反应生成水,所以反应过程中数目减少的离子是H+、OH﹣;
(3)C中最终只得到无色溶液,说明不含碳酸钙,碳酸钙与稀盐酸反应,碳酸根离子不存在,否则会与钙离子继续生成碳酸钙沉淀,碳酸根离子和氢离子反应之前,氢离子先与氢氧根离子反应,所以反应后C中溶质成分一定含有氯化钠、氯化钙,可能含有HCl,要确定HCl,为进一步确定其成分需要使用的试剂为碳酸钠溶液。
故答案为:(1)产生白色沉淀;
(2)Ca(OH)2+2HCl=CaCl2+2H2O;无色酚酞;H+、OH﹣;
(3)氯化钠、氯化钙;碳酸钠溶液。
15.(2021春 吴兴区期末)我校科学兴趣小组测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与盐酸反应,测定反应后生成的二氧化碳质量,再根据二氧化碳的质量求出样品中碳酸钙的质量。为测定二氧化碳的质量,他们设计了以下三种方案,请帮助他们完成设计方案:
方案一:称量反应前后物质总质量的 减小 (选填“增大”或“减小”)量。
方案二:称量吸收二氧化碳前后盛有氢氧化钠溶液容器质量的 增大 (选填“增大”或“减小”)量。
方案三:选用图中 甲 (填“甲”或“乙”)装置可测量产生的二氧化碳的 体积 ,再根据此时二氧化碳的 密度 ,可计算二氧化碳的质量。图中水面上油层所起到的作用是 防止二氧化碳溶于水 。
【解答】解:方案一:称量反应前后物质总质量的减小量,减小量即为反应生成的二氧化碳质量。
故填:减小。
方案二:称量吸收二氧化碳前后盛有氢氧化钠溶液容器质量的增大量,增大量即为反应生成的二氧化碳质量。
故填:增大。
方案三:选用图中甲装置可测量产生的二氧化碳的体积,再根据此时二氧化碳的密度,可计算二氧化碳的质量。图中水面上油层所起到的作用是防止二氧化碳溶于水。
故填:甲;体积;密度;防止二氧化碳溶于水。
16.(2021 海淀区二模)用如图装置完成实验。
装置 试剂 现象 结论
a、b为稀硫酸或澄清石灰水c为Na2CO3溶液 Ⅰ中出现白色沉淀,Ⅱ中产生无色气体 (1)a为 澄清石灰水 ,b为 稀硫酸
a为NaOH溶液b为澄清石灰水c为紫色石蕊溶液 (2) Ⅰ、Ⅱ中溶液均变为蓝色 NaOH溶液和澄清石灰水均呈碱性
【解答】解:(1)碳酸钠能与稀硫酸反应生成二氧化碳气体,能与石灰水反应生成碳酸钙白色沉淀,Ⅰ中出现白色沉淀,Ⅱ中产生无色气体,则a为澄清石灰水;b为稀硫酸。
(2)NaOH溶液、澄清石灰水均呈碱性,均能使紫色石蕊溶液变蓝色,故实验现象为Ⅰ、Ⅱ中溶液均变为蓝色。
故答案为:
(1)澄清石灰水;稀硫酸;
(2)Ⅰ、Ⅱ中溶液均变为蓝色。
17.(2021 西城区一模)利用如图装置进行实验(夹持装置略去)。实验前K1、K2和K3均已关闭。
(1)打开K1和K2,滴入部分碳酸钠溶液,关闭K1。B中发生反应的化学方程式是 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 。A中观察到的现象是 澄清石灰水变浑浊 。
(2)关闭K2、打开K3和K1,滴入碳酸钠溶液,关闭K1。观察到B中的液体流入C中,一段时间后,C中溶液澄清且无色,此时C中一定含有的溶质是 氯化钙和氯化钠 。
【解答】解:(1)打开K1和K2,滴入部分碳酸钠溶液,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑;二氧化碳能使澄清石灰水变浑浊,A中观察到的现象是澄清石灰水变浑浊。
(2)关闭K2、打开K3和K1,滴入碳酸钠溶液,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,关闭K1,B中压强增大,稀盐酸被压入C中,一段时间后,C中溶液澄清且无色,是因为稀盐酸与氢氧化钙反应生成氯化钙和水,溶液可能显中性,也可能显酸性,此时C中一定含有的溶质是氯化钙和氯化钠,可能含有氯化氢。
故答案为:
(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑;澄清石灰水变浑浊;
(2)氯化钙和氯化钠。
四.计算题(共1小题)
18.(2019 潍坊三模)往200克含有稀硝酸和硝酸钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图(假设生成的气体全部逸出),试分析计算:
(1)a→b段发生反应的化学方程式为 Na2CO3+2HNO3=2NaNO3+H2O+CO2↑ ;
(2)反应到c点时,所得溶液的溶质质量分数是多少?(写出计算过程,精确到0.1%)
(3)c→d段溶液的pH大于7的原因是 碳酸钠溶液过量,碳酸钠溶液显碱性 。
【解答】解:(1)稀硝酸和硝酸钙的混合溶液中,加入碳酸钠溶液,碳酸钠先与硝酸反应,方程式是:Na2CO3+2HNO3=2NaNO3+H2O+CO2↑;
(2)设 c 点时生成硝酸钠的质量为x则:
Na2CO3﹣﹣﹣﹣2NaNO3
106 170
150g×21.2% x
根据:解得x=51g;
设生成碳酸钙沉淀质量为y
Na2CO3+Ca(NO3)3=CaCO3↓+2NaNO3
106 100
100g×21.2% y
根据:解得y=20g
设碳酸钠与硝酸反应生成气体二氧化碳的质量为k
Na2CO3+2HNO3=2NaNO3+H2O+CO2↑;
106 44
50g×21.2% k
根据:解得k=4.4g。
反应到 c 点时,所得溶液的溶质质量分数是:=15.7%。
(3)碳酸钠溶液过量,碳酸钠溶液显碱性所以c→d 段溶液的 pH 大于 7。
故答案为:(1)Na2CO3+2HNO3=2NaNO3+H2O+CO2↑;(2)15.7%;(3)碳酸钠溶液过量,碳酸钠溶液显碱性
一.选择题(共8小题)
1.(2021 河池)制作包子、蛋糕所用发酵粉的主要成分含有碳酸氢钠。碳酸氢钠的俗称是( )
A.小苏打 B.苏打 C.苛性钠 D.火碱
2.(2021 苏州)下列有关实验室制取二氧化碳气体的操作图示正确的是( )
A.导管连接 B.胶塞塞紧
C.气体验满 D.气体收集
3.(2021 重庆)实验室制取二氧化碳部分操作如图所示,其中错误的是( )
A.检查气密性 B.仪器连接
C.加入药品 D.收集气体
4.(2021 遵义)有一包不纯的K2CO3样品,含有一定量的KOH和KCl。现需测定该样品中K2CO3的质量分数,取10g样品充分溶解后进行实验。下列方案合理的是( )
A.加入过量的Ca(OH)2固体,充分反应后过滤,称滤渣的质量
B.加入足量溶质质量分数为7.3%的稀盐酸,称反应后溶液的质量
C.加入足量的MgCl2溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
D.加入足量的BaCl2溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
5.(2021 恩施州)某公司生产的融雪剂由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成。小洁同学将该融雪剂加水溶解,得到无色溶液,向该溶液中加入K2CO3溶液,有白色沉淀生成。由此可知,该融雪剂的组成可能是( )
A.CuSO4 NaCl B.Na2CO3 NaCl
C.CaCl2 NaCl D.CuSO4 CaCl2
6.(2021 株洲)下列选项中各溶质的溶液混合,无明显现象的是( )
A.NaCl、BaCl2、KNO3 B.CuSO4、NaOH、KCl
C.BaCl2、Na2SO4、HCl D.CaCl2、Na2CO3、KNO3
7.(2021 凉山州)兴趣小组对实验室制取二氧化碳的废液进行了探究,最终确认废液中的溶质为CaCl2和HCl。已知CaCl2溶液呈中性。某同学取了一定质量的该废液于烧杯中,并向其中逐滴加入Na2CO3溶液,以下坐标图是他对烧杯中物质变化情况的分析图,其中明显不合理的是( )
A.B.
C. D.
8.(2021 梧州)《周礼 考工记》中记载制取氢氧化钾漂洗丝帛的工艺,流程是:将木头烧成灰,用其灰汁浸泡丝帛,再加入石灰即可。下列说法错误的是( )
A.“灰”的主要成分是K2CO3
B.漂洗丝帛的液体可使酚酞显红色
C.“石灰”常用于改良碱性土壤
D.高温煅烧石灰石可以得到“石灰”
二.填空题(共4小题)
9.(2021 宁夏)及时归纳是学好化学的主要方法之一。利用如图所示的结构图归纳盐的四个方面的化学性质(图中编号①﹣④),请归纳有关知识。
(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是 ,化学方程式为 。
(2)在性质③中,X代表 类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学式 (写一个)。
10.(2021 乌苏市模拟)向Na2SO4溶液中滴入Ba(NO3)2溶液至恰好完全反应。
(1)反应的化学方程式为: 。
(2)如图表示该反应前后溶液中存在的主要离子,写出如图图形代表的离子(填离子符号) ,〇 ,反应后消失的阴离子是 。(填离子符号)
(3)下列物质能与Na2SO4溶液反应产生类似上述实验现象的
是 。
A.NaOH
B.HCl
C.BaCl2
D.(NH4)2SO4
11.(2021 科尔沁区模拟)铁、氯化铜、石灰水、稀盐酸、石灰石之间的反应如图所示,图中两圆相交部分表示物质间的反应,则:
(1)a处化学反应的基本类型为 。
(2)b处的实验现象为 。
(3)c处的化学反应方程式为 。
(4)d处是实验室制取 气体的反应原理,检验该气体的化学反应为 。
12.(2021 河南二模)向含有氯化钠、氯化钙和稀盐酸的混合溶液中滴加碳酸钠溶液,溶液的pH变化情况如图所示:
(1)0﹣a段发生的化学反应方程式为 。
(2)a﹣b段溶液的pH没有变化的原因是: 。
三.实验探究题(共5小题)
13.(2021 韩城市模拟)小兰同学设计了一个验证某NaCl溶液中是否混有Na2CO3、Na2SO4和NaOH的实验流程,如图所示。(已知BaCl2溶液呈中性)
(1)试管A中的溶液呈红色。
(2)滴加过量BaCl2溶液,充分反应后试管B中有白色沉淀产生,溶液仍显红色,则可判断原溶液中一定含有 。B中发生反应的化学方程式可能为 (只写一个)。
(3)再向C中加入适量X溶液,即可确定溶液成分,则X溶液可能是 (填字母)。
A.稀HCl
B.稀H2SO4
C.CaCl2
14.(2021 甘井子区一模)某实验小组进行如图所示实验。
(1)实验A中观察到的现象为 。
(2)实验B反应的化学方程式为 ,整个实验过程中无明显现象,若想证明石灰水和稀盐酸能发生化学反应,可在加入稀盐酸之前加入的试剂是 ,反应过程中数目减少的离子是 (填离子符号)。
(3)C中最终只得到无色溶液,则溶液中溶质为 ,为进一步确定其成分需要使用的试剂为 。
15.(2021春 吴兴区期末)我校科学兴趣小组测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与盐酸反应,测定反应后生成的二氧化碳质量,再根据二氧化碳的质量求出样品中碳酸钙的质量。为测定二氧化碳的质量,他们设计了以下三种方案,请帮助他们完成设计方案:
方案一:称量反应前后物质总质量的 (选填“增大”或“减小”)量。
方案二:称量吸收二氧化碳前后盛有氢氧化钠溶液容器质量的 (选填“增大”或“减小”)量。
方案三:选用图中 (填“甲”或“乙”)装置可测量产生的二氧化碳的 ,再根据此时二氧化碳的 ,可计算二氧化碳的质量。图中水面上油层所起到的作用是 。
16.(2021 海淀区二模)用如图装置完成实验。
装置 试剂 现象 结论
a、b为稀硫酸或澄清石灰水c为Na2CO3溶液 Ⅰ中出现白色沉淀,Ⅱ中产生无色气体 (1)a为 ,b为
a为NaOH溶液b为澄清石灰水c为紫色石蕊溶液 (2) NaOH溶液和澄清石灰水均呈碱性
17.(2021 西城区一模)利用如图装置进行实验(夹持装置略去)。实验前K1、K2和K3均已关闭。
(1)打开K1和K2,滴入部分碳酸钠溶液,关闭K1。B中发生反应的化学方程式是 。A中观察到的现象是 。
(2)关闭K2、打开K3和K1,滴入碳酸钠溶液,关闭K1。观察到B中的液体流入C中,一段时间后,C中溶液澄清且无色,此时C中一定含有的溶质是 。
四.计算题(共1小题)
18.(2019 潍坊三模)往200克含有稀硝酸和硝酸钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图(假设生成的气体全部逸出),试分析计算:
(1)a→b段发生反应的化学方程式为 ;
(2)反应到c点时,所得溶液的溶质质量分数是多少?(写出计算过程,精确到0.1%)
(3)c→d段溶液的pH大于7的原因是 。
2021-2022学年华师大版九年级常见的盐的精选练习
参考答案与试题解析
一.选择题(共8小题)
1.(2021 河池)制作包子、蛋糕所用发酵粉的主要成分含有碳酸氢钠。碳酸氢钠的俗称是( )
A.小苏打 B.苏打 C.苛性钠 D.火碱
【解答】解:A、碳酸氢钠俗称小苏打,故选项A正确。
B、苏打是碳酸钠的俗称,故选项B错误。
C、苛性钠是氢氧化钠的俗称,故选项C错误。
D、火碱是氢氧化钠的俗称,故选项D错误。
故选:A。
2.(2021 苏州)下列有关实验室制取二氧化碳气体的操作图示正确的是( )
A.导管连接 B.胶塞塞紧
C.气体验满 D.气体收集
【解答】解:A、导管连接胶皮管时,先把导管一端湿润,然后稍用力转动使之插入胶皮管内,图中所示装置正确。
B、把橡皮塞慢慢转动着塞进试管口,切不可把试管放在桌上再使劲塞进塞子,以免压破试管,图中所示操作错误。
C、检验二氧化碳是否收集满时,应将燃着的木条放在集气瓶口,不能伸入瓶中,图中所示操作错误。
D、二氧化碳能溶于水,不能用排水法收集,且用排水法收集气体时,导管不能伸入集气瓶太长,图中所示操作错误。
故选:A。
3.(2021 重庆)实验室制取二氧化碳部分操作如图所示,其中错误的是( )
A.检查气密性 B.仪器连接
C.加入药品 D.收集气体
【解答】解:A.图示装置在检查装置的气密性时,先由长颈漏斗注水,当水将长颈漏斗的末端浸没起来后,再用双手紧捂锥形瓶的外壁,若观察到导管口处冒出气泡,证明该装置的气密性是良好的,图示操作正确;
B.连接橡胶管和玻璃管时,先将玻璃管一端用水润湿,然后一手持玻璃管,一手持橡胶管,稍稍用力,转动插入,图示操作正确;
C.向锥形瓶中添加块状固体药品时,将锥形瓶倾斜,用镊子将大理石放到瓶口,然后将锥形瓶慢慢竖起,使药品滑落到容器底部,图示操作错误。
D.二氧化碳的密度比空气大,用图示装置来收集二氧化碳时,二氧化碳应从长管进入,图示操作正确。
故选:C。
4.(2021 遵义)有一包不纯的K2CO3样品,含有一定量的KOH和KCl。现需测定该样品中K2CO3的质量分数,取10g样品充分溶解后进行实验。下列方案合理的是( )
A.加入过量的Ca(OH)2固体,充分反应后过滤,称滤渣的质量
B.加入足量溶质质量分数为7.3%的稀盐酸,称反应后溶液的质量
C.加入足量的MgCl2溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
D.加入足量的BaCl2溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
【解答】解:A、常温下,氢氧化钙微溶于水,过量的氢氧化钙也会以沉淀的形式出现,滤渣的质量包括氢氧化钙和碳酸钙,方案不合理,故A错误;
B、碳酸钾和盐酸反应生成氯化钾、水和二氧化碳,二氧化碳会携带一定量的水蒸气,溶液减小的质量将增大,不能测定,故B错误;
C、氯化镁和碳酸钾反应生成碳酸镁沉淀和氯化钾,和氢氧化钾反应生成氢氧化镁沉淀和氯化钾,不能测定,故C错误;
D、碳酸钾和氯化钡反应生成碳酸钡沉淀和氯化钾,依据滤渣碳酸钡的质量可以计算出碳酸钾的质量,进而计算出该样品中K2CO3的质量分数,故D正确。
故选:D。
5.(2021 恩施州)某公司生产的融雪剂由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成。小洁同学将该融雪剂加水溶解,得到无色溶液,向该溶液中加入K2CO3溶液,有白色沉淀生成。由此可知,该融雪剂的组成可能是( )
A.CuSO4 NaCl B.Na2CO3 NaCl
C.CaCl2 NaCl D.CuSO4 CaCl2
【解答】解:某公司生产的融雪剂由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成。将该融雪剂加水溶解,得到无色溶液,则一定不含硫酸铜,因为硫酸铜溶于水显蓝色;向该溶液中加入K2CO3溶液,有白色沉淀生成,碳酸钾能与氯化钙溶液反应生成碳酸钙白色沉淀,则该融雪剂一定含有氯化钙,氯化钙与碳酸钠不能共存,则一定不含碳酸钠,无法确定是否含有氯化钠,则该融雪剂的组成可能是CaCl2 NaCl。
故选:C。
6.(2021 株洲)下列选项中各溶质的溶液混合,无明显现象的是( )
A.NaCl、BaCl2、KNO3 B.CuSO4、NaOH、KCl
C.BaCl2、Na2SO4、HCl D.CaCl2、Na2CO3、KNO3
【解答】解:A、三者之间交换成分没有沉淀或气体或水生成,不能发生复分解反应,无明显现象,故选项正确。
B、CuSO4、NaOH反应生成氢氧化铜沉蓝色淀和硫酸钠,有明显现象,故选项错误。
C、BaCl2、Na2SO4反应生成硫酸钡沉淀和氯化钠,有明显现象,故选项错误。
D、CaCl2、Na2CO3反应生成碳酸钙沉淀和氯化钠,有明显现象,故选项错误。
故选:A。
7.(2021 凉山州)兴趣小组对实验室制取二氧化碳的废液进行了探究,最终确认废液中的溶质为CaCl2和HCl。已知CaCl2溶液呈中性。某同学取了一定质量的该废液于烧杯中,并向其中逐滴加入Na2CO3溶液,以下坐标图是他对烧杯中物质变化情况的分析图,其中明显不合理的是( )
A.
B.
C.
D.
【解答】解:往CaCl2和HCl的混合溶液中滴加Na2CO3溶液时,先发生的反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,后发生的反应为CaCl2+Na2CO3=CaCO3↓+2NaCl;
A、由于先发生的反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,所以一开始滴加碳酸钠溶液时,不产生沉淀,待混合溶液中HCl消耗完后发生的反应为:CaCl2+Na2CO3=CaCO3↓+2NaCl,此时开始产生沉淀,待CaCl2反应结束后沉淀质量不变,选项图示正确;
B、由于先发生的反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,所以一开始滴加碳酸钠溶液时,就开始产生气体,待溶液中HCl消耗完之后,不在产生气体,选项图示正确;
C、往CaCl2和HCl的混合溶液中滴加Na2CO3溶液时,先发生的反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,参与反应的碳酸的质量大于反应生成的二氧化碳的质量,此时溶液质量增加,后发生的反应为CaCl2+Na2CO3=CaCO3↓+2NaCl,参与反应的碳酸钠的质量大于生成的碳酸钙的质量,此时溶液质量继续增加,反应结束后继续滴加碳酸钠溶液,溶液质量继续增加,选项图示错误;
D、由于溶液中含有HCl,溶液一开始pH值小于7,随着碳酸钠的加入,由于碳酸钠和盐酸反应,酸性减弱,溶液测pH值升高,当把盐酸反应完后,碳酸钠再和氯化钙反应生成碳酸钙和氯化钠,此时溶液的pH值等于7,当把氯化钙反应完后,再加入碳酸钠,由于碳酸钠溶液显碱性,所以溶液的pH值又升高且大于7,选项图示正确;
故选:C。
8.(2021 梧州)《周礼 考工记》中记载制取氢氧化钾漂洗丝帛的工艺,流程是:将木头烧成灰,用其灰汁浸泡丝帛,再加入石灰即可。下列说法错误的是( )
A.“灰”的主要成分是K2CO3
B.漂洗丝帛的液体可使酚酞显红色
C.“石灰”常用于改良碱性土壤
D.高温煅烧石灰石可以得到“石灰”
【解答】解:A、木头燃烧后生成灰,主要是碳酸钾,可以作为钾肥使用,选项A正确;
B、漂洗后的液体含有碱氢氧化钾,所以加入酚酞后,溶液变红,选项B正确;
C、石灰是氧化钙的俗称,用于改良酸性土壤,选项C错误;
D、高温煅烧石灰石发生的反应是碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙俗称为石灰,选项D正确;
故选:C。
二.填空题(共4小题)
9.(2021 宁夏)及时归纳是学好化学的主要方法之一。利用如图所示的结构图归纳盐的四个方面的化学性质(图中编号①﹣④),请归纳有关知识。
(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是 产生蓝色沉淀 ,化学方程式为 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 。
(2)在性质③中,X代表 酸 类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学式 NaCl (写一个)。
【解答】解:(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是产生蓝色沉淀,是因为氢氧化钠和硫酸铜反应生成蓝色沉淀氢氧化铜和硫酸钠,化学方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。
故填:产生蓝色沉淀;CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。
(2)在性质③中,X代表酸类物质,即酸能和某些盐反应。
故填:酸。
(3)氯化钠是盐,与硝酸银反应生成白色沉淀氯化银和硝酸钠,与硝酸银反应的物质的化学式是NaCl。
故填:NaCl。
10.(2021 乌苏市模拟)向Na2SO4溶液中滴入Ba(NO3)2溶液至恰好完全反应。
(1)反应的化学方程式为: Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3 。
(2)如图表示该反应前后溶液中存在的主要离子,写出如图图形代表的离子(填离子符号) NO3﹣ ,〇 Na+ ,反应后消失的阴离子是 SO42﹣ 。(填离子符号)
(3)下列物质能与Na2SO4溶液反应产生类似上述实验现象的是 C 。
A.NaOH
B.HCl
C.BaCl2
D.(NH4)2SO4
【解答】解:(1)硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,化学方程式为:Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3;
(2)反应的实质是钡离子和硫酸根离子反应生成硫酸钡沉淀,图形代表的离子NO3﹣;〇Na+,反应后消失的阴离子是SO42﹣;
(3)硫酸钠溶液与氯化钡溶液反应生成硫酸钡沉淀和氯化钠,反应的实质是硫酸根离子和钡离子结合生成硫酸钡沉淀,故选:C。
故答案为:(1)Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3;
(2)NO3﹣;Na+;SO42﹣;
(3)C。
11.(2021 科尔沁区模拟)铁、氯化铜、石灰水、稀盐酸、石灰石之间的反应如图所示,图中两圆相交部分表示物质间的反应,则:
(1)a处化学反应的基本类型为 置换反应 。
(2)b处的实验现象为 产生蓝色沉淀 。
(3)c处的化学反应方程式为 Ca(OH)2+2HCl=CaCl2+2H2O 。
(4)d处是实验室制取 CO2 气体的反应原理,检验该气体的化学反应为 Ca(OH)2+CO2=CaCO3↓+H2O 。
【解答】解:(1)a处的反应是铁和氯化铜反应生成氯化亚铁和铜,基本反应类型为置换反应;
(2)b处的反应是氯化铜和氢氧化钙反应生成氯化钙和氢氧化铜沉淀,实验现象为:产生蓝色沉淀;
(3)c处的反应是氢氧化钙和盐酸反应生成氯化钙和水,化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O;
(4)d处的反应是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,是实验室制取CO2气体的反应原理;检验该气体的反应为二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O。
故答案为:(1)置换反应;
(2)产生蓝色沉淀;
(3)Ca(OH)2+2HCl=CaCl2+2H2O;
(4)CO2;Ca(OH)2+CO2=CaCO3↓+H2O。
12.(2021 河南二模)向含有氯化钠、氯化钙和稀盐酸的混合溶液中滴加碳酸钠溶液,溶液的pH变化情况如图所示:
(1)0﹣a段发生的化学反应方程式为 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 。
(2)a﹣b段溶液的pH没有变化的原因是: 碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,对溶液的酸碱性没有影响 。
【解答】解:(1)向含有氯化钠、氯化钙和稀盐酸的混合溶液中滴加碳酸钠溶液,碳酸钠先与稀盐酸反应生成氯化钠、水和二氧化碳,稀盐酸反应完,再与氯化钙反应生成碳酸钙沉淀和氯化钠。0﹣a段发生的碳酸钠先与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑。
(2)a﹣b段溶液的pH没有变化,是因为碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,对溶液的酸碱性没有影响。
故答案为:
(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,对溶液的酸碱性没有影响。
三.实验探究题(共5小题)
13.(2021 韩城市模拟)小兰同学设计了一个验证某NaCl溶液中是否混有Na2CO3、Na2SO4和NaOH的实验流程,如图所示。(已知BaCl2溶液呈中性)
(1)试管A中的溶液呈红色。
(2)滴加过量BaCl2溶液,充分反应后试管B中有白色沉淀产生,溶液仍显红色,则可判断原溶液中一定含有 氢氧化钠 。B中发生反应的化学方程式可能为 BaCl2+Na2CO3=BaCO3↓+2NaCl或BaCl2+Na2SO4=BaSO4↓+Na2SO4 (只写一个)。
(3)再向C中加入适量X溶液,即可确定溶液成分,则X溶液可能是 A (填字母)。
A.稀HCl
B.稀H2SO4
C.CaCl2
【解答】解:(2)无色酚酞溶液遇酸性溶液不变色,遇中性溶液不变色,遇碱性溶液变红,试管A中的溶液量红色,说明溶液显喊性,含有碳酸钠或氢氧化的中的一种或两种;继续滴加过里的氯化钡溶液,产生白色沉淀,溶液仍显红色,则酸酸钠或硫酸钠被反应完,又知BaC12、NaC1溶液呈中性,即可判断原溶液中一定含有呈碱性的氢氧化钠,试管B中的白色沉淀可能是BaCO3或BaSO4,则发生反应的化学方程式可能为BaCl2+Na2CO3=BaCO3↓+2NaCl或BaCl2+Na2SO4=BaSO4↓+Na2SO4;故答案为:氢氧化钠;BaCl2+Na2CO3=BaCO3↓+2NaCl或BaCl2+Na2SO4=BaSO4↓+Na2SO4;
(3)碳酸钡沉淀能与酸反应,硫酸钡沉淀不溶于酸,则X应为酸溶液,但不能选用稀硫酸,因为会对新酸的的检验造成干扰。根据沉淀部分消失还是全部消失、是否有气泡产生,可以完成对Na2CO3和Na2SO4的验证;故答案为:A。
14.(2021 甘井子区一模)某实验小组进行如图所示实验。
(1)实验A中观察到的现象为 产生白色沉淀 。
(2)实验B反应的化学方程式为 Ca(OH)2+2HCl=CaCl2+2H2O ,整个实验过程中无明显现象,若想证明石灰水和稀盐酸能发生化学反应,可在加入稀盐酸之前加入的试剂是 无色酚酞 ,反应过程中数目减少的离子是 H+、OH﹣ (填离子符号)。
(3)C中最终只得到无色溶液,则溶液中溶质为 氯化钙、氯化钠 ,为进一步确定其成分需要使用的试剂为 碳酸钠溶液 。
【解答】解:(1)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以实验A中观察到的现象为:产生白色沉淀;
(2)实验B的反应是氢氧化钙和盐酸反应生成氯化钙和水,化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O,整个实验过程中无明显现象,若想证明石灰水和稀盐酸能发生化学反应,可在加入稀盐酸之前加入的试剂是无色酚酞;中和反应的实质是氢离子和氢氧根离子反应生成水,所以反应过程中数目减少的离子是H+、OH﹣;
(3)C中最终只得到无色溶液,说明不含碳酸钙,碳酸钙与稀盐酸反应,碳酸根离子不存在,否则会与钙离子继续生成碳酸钙沉淀,碳酸根离子和氢离子反应之前,氢离子先与氢氧根离子反应,所以反应后C中溶质成分一定含有氯化钠、氯化钙,可能含有HCl,要确定HCl,为进一步确定其成分需要使用的试剂为碳酸钠溶液。
故答案为:(1)产生白色沉淀;
(2)Ca(OH)2+2HCl=CaCl2+2H2O;无色酚酞;H+、OH﹣;
(3)氯化钠、氯化钙;碳酸钠溶液。
15.(2021春 吴兴区期末)我校科学兴趣小组测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与盐酸反应,测定反应后生成的二氧化碳质量,再根据二氧化碳的质量求出样品中碳酸钙的质量。为测定二氧化碳的质量,他们设计了以下三种方案,请帮助他们完成设计方案:
方案一:称量反应前后物质总质量的 减小 (选填“增大”或“减小”)量。
方案二:称量吸收二氧化碳前后盛有氢氧化钠溶液容器质量的 增大 (选填“增大”或“减小”)量。
方案三:选用图中 甲 (填“甲”或“乙”)装置可测量产生的二氧化碳的 体积 ,再根据此时二氧化碳的 密度 ,可计算二氧化碳的质量。图中水面上油层所起到的作用是 防止二氧化碳溶于水 。
【解答】解:方案一:称量反应前后物质总质量的减小量,减小量即为反应生成的二氧化碳质量。
故填:减小。
方案二:称量吸收二氧化碳前后盛有氢氧化钠溶液容器质量的增大量,增大量即为反应生成的二氧化碳质量。
故填:增大。
方案三:选用图中甲装置可测量产生的二氧化碳的体积,再根据此时二氧化碳的密度,可计算二氧化碳的质量。图中水面上油层所起到的作用是防止二氧化碳溶于水。
故填:甲;体积;密度;防止二氧化碳溶于水。
16.(2021 海淀区二模)用如图装置完成实验。
装置 试剂 现象 结论
a、b为稀硫酸或澄清石灰水c为Na2CO3溶液 Ⅰ中出现白色沉淀,Ⅱ中产生无色气体 (1)a为 澄清石灰水 ,b为 稀硫酸
a为NaOH溶液b为澄清石灰水c为紫色石蕊溶液 (2) Ⅰ、Ⅱ中溶液均变为蓝色 NaOH溶液和澄清石灰水均呈碱性
【解答】解:(1)碳酸钠能与稀硫酸反应生成二氧化碳气体,能与石灰水反应生成碳酸钙白色沉淀,Ⅰ中出现白色沉淀,Ⅱ中产生无色气体,则a为澄清石灰水;b为稀硫酸。
(2)NaOH溶液、澄清石灰水均呈碱性,均能使紫色石蕊溶液变蓝色,故实验现象为Ⅰ、Ⅱ中溶液均变为蓝色。
故答案为:
(1)澄清石灰水;稀硫酸;
(2)Ⅰ、Ⅱ中溶液均变为蓝色。
17.(2021 西城区一模)利用如图装置进行实验(夹持装置略去)。实验前K1、K2和K3均已关闭。
(1)打开K1和K2,滴入部分碳酸钠溶液,关闭K1。B中发生反应的化学方程式是 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 。A中观察到的现象是 澄清石灰水变浑浊 。
(2)关闭K2、打开K3和K1,滴入碳酸钠溶液,关闭K1。观察到B中的液体流入C中,一段时间后,C中溶液澄清且无色,此时C中一定含有的溶质是 氯化钙和氯化钠 。
【解答】解:(1)打开K1和K2,滴入部分碳酸钠溶液,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑;二氧化碳能使澄清石灰水变浑浊,A中观察到的现象是澄清石灰水变浑浊。
(2)关闭K2、打开K3和K1,滴入碳酸钠溶液,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,关闭K1,B中压强增大,稀盐酸被压入C中,一段时间后,C中溶液澄清且无色,是因为稀盐酸与氢氧化钙反应生成氯化钙和水,溶液可能显中性,也可能显酸性,此时C中一定含有的溶质是氯化钙和氯化钠,可能含有氯化氢。
故答案为:
(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑;澄清石灰水变浑浊;
(2)氯化钙和氯化钠。
四.计算题(共1小题)
18.(2019 潍坊三模)往200克含有稀硝酸和硝酸钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图(假设生成的气体全部逸出),试分析计算:
(1)a→b段发生反应的化学方程式为 Na2CO3+2HNO3=2NaNO3+H2O+CO2↑ ;
(2)反应到c点时,所得溶液的溶质质量分数是多少?(写出计算过程,精确到0.1%)
(3)c→d段溶液的pH大于7的原因是 碳酸钠溶液过量,碳酸钠溶液显碱性 。
【解答】解:(1)稀硝酸和硝酸钙的混合溶液中,加入碳酸钠溶液,碳酸钠先与硝酸反应,方程式是:Na2CO3+2HNO3=2NaNO3+H2O+CO2↑;
(2)设 c 点时生成硝酸钠的质量为x则:
Na2CO3﹣﹣﹣﹣2NaNO3
106 170
150g×21.2% x
根据:解得x=51g;
设生成碳酸钙沉淀质量为y
Na2CO3+Ca(NO3)3=CaCO3↓+2NaNO3
106 100
100g×21.2% y
根据:解得y=20g
设碳酸钠与硝酸反应生成气体二氧化碳的质量为k
Na2CO3+2HNO3=2NaNO3+H2O+CO2↑;
106 44
50g×21.2% k
根据:解得k=4.4g。
反应到 c 点时,所得溶液的溶质质量分数是:=15.7%。
(3)碳酸钠溶液过量,碳酸钠溶液显碱性所以c→d 段溶液的 pH 大于 7。
故答案为:(1)Na2CO3+2HNO3=2NaNO3+H2O+CO2↑;(2)15.7%;(3)碳酸钠溶液过量,碳酸钠溶液显碱性
