2021-2022学年高一上学期化学苏教版(2019)必修第一册专题2 第一单元研究物质的实验方法 同步练习 (含解析)
文档属性
| 名称 | 2021-2022学年高一上学期化学苏教版(2019)必修第一册专题2 第一单元研究物质的实验方法 同步练习 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 880.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-20 08:00:56 | ||
图片预览



文档简介
专题2研究物质的基本方法第一单元研究物质的实验方法—2021-2022学年上学期高一化学苏教版(2019)必修第一册
一、选择题(共16题)
1.下图所示的化学实验基本操作正确的是
A.称量氯化钠 B.点燃酒精灯
C.取用固体 D.加热液体
2.如图所示四种常见仪器能直接加热的是
A. B. C. D.
3.可用于分液操作的实验装置是
A B. C. D.
4.若在宇宙飞船的太空实验室(失重条件下)进行以下实验,其中最难完成的是
A.将金粉和铜粉混合 B.将牛奶加入水中混合
C.蒸发食盐水制取食盐晶体 D.用漏斗、滤纸过滤除去水中的泥沙
5.下列装置或操作图示错误的是
A.海带灼烧 B.铝热反应
C.石油的分馏 D.分离乙酸乙酯和水
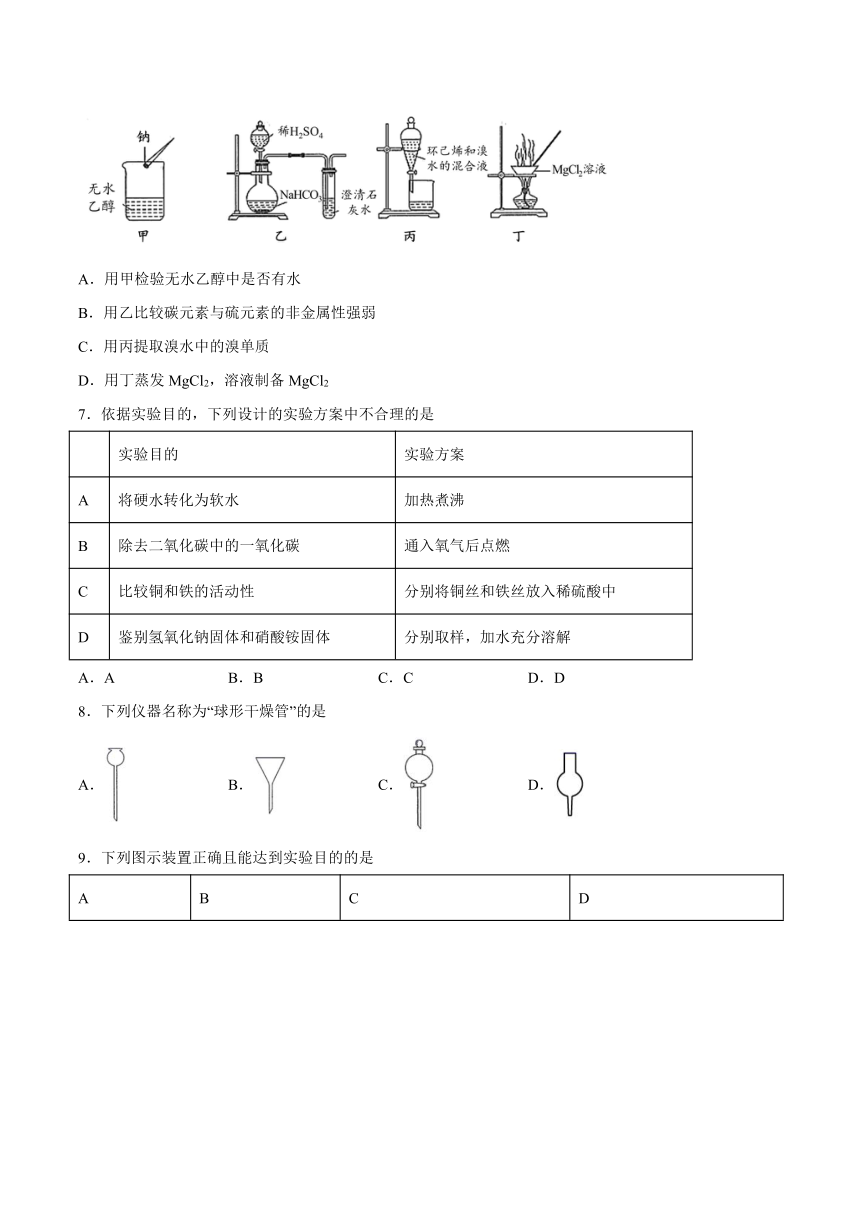
6.利用下列装置进行实验,能达到实验目的的是
A.用甲检验无水乙醇中是否有水
B.用乙比较碳元素与硫元素的非金属性强弱
C.用丙提取溴水中的溴单质
D.用丁蒸发MgCl2,溶液制备MgCl2
7.依据实验目的,下列设计的实验方案中不合理的是
实验目的 实验方案
A 将硬水转化为软水 加热煮沸
B 除去二氧化碳中的一氧化碳 通入氧气后点燃
C 比较铜和铁的活动性 分别将铜丝和铁丝放入稀硫酸中
D 鉴别氢氧化钠固体和硝酸铵固体 分别取样,加水充分溶解
A.A B.B C.C D.D
8.下列仪器名称为“球形干燥管”的是
A. B. C. D.
9.下列图示装置正确且能达到实验目的的是
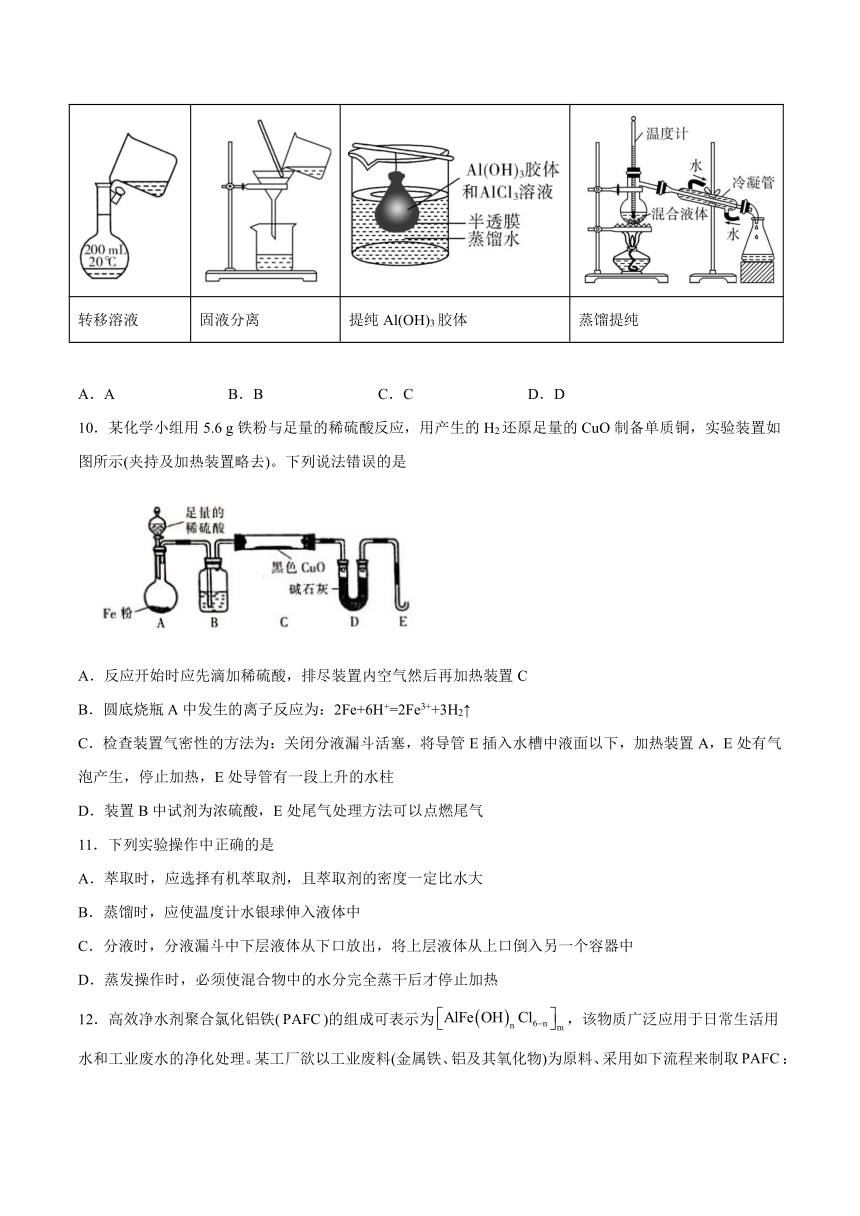
A B C D
转移溶液 固液分离 提纯Al(OH)3胶体 蒸馏提纯
A.A B.B C.C D.D
10.某化学小组用5.6 g铁粉与足量的稀硫酸反应,用产生的H2还原足量的CuO制备单质铜,实验装置如图所示(夹持及加热装置略去)。下列说法错误的是
A.反应开始时应先滴加稀硫酸,排尽装置内空气然后再加热装置C
B.圆底烧瓶A中发生的离子反应为:2Fe+6H+=2Fe3++3H2↑
C.检查装置气密性的方法为:关闭分液漏斗活塞,将导管E插入水槽中液面以下,加热装置A,E处有气泡产生,停止加热,E处导管有一段上升的水柱
D.装置B中试剂为浓硫酸,E处尾气处理方法可以点燃尾气
11.下列实验操作中正确的是
A.萃取时,应选择有机萃取剂,且萃取剂的密度一定比水大
B.蒸馏时,应使温度计水银球伸入液体中
C.分液时,分液漏斗中下层液体从下口放出,将上层液体从上口倒入另一个容器中
D.蒸发操作时,必须使混合物中的水分完全蒸干后才停止加热
12.高效净水剂聚合氯化铝铁()的组成可表示为,该物质广泛应用于日常生活用水和工业废水的净化处理。某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取:
下列判断错误的是
A.因在水中生成氢氧化铝和氢氧化铁而能净水
B.往甲溶液中滴入溶液后溶液一定呈血红色
C.试剂具有氧化性
D.乙溶液一定不呈强碱性
13.下列说法不正确的是
A.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
B.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
C.抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快
D.硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁,促使晶体析出
14.蒸馏是常见分离或提纯操作,下列仪器不需要用到的是
A. B. C. D.
15.用下列装置或操作进行实验,能达到实验目的且操作正确的是
A.图甲:制取NH3 B.图乙:制取少量CO2气体
C.图丙:蒸馏 D.图丁:加热碘水溶液制固体碘
16.四氟化氙(XeF4)熔点117.1℃,是一种强氟化剂,能将金属铂(Pt)氟化为PtF4。四氟化氙储存时应贴的化学品标志是
A. B. C. D.
二、综合题(共4题)
17.三盐基硫酸铅(3PbO·PbSO4·H2O)用作聚氯乙烯的热稳定剂。用废旧铅蓄电池的填充物能制得三盐基硫酸铅,其工艺流程如下:
已知:① 废旧铅蓄电池填充物的主要成分有PbO、PbO2、PbSO4;
② Pb(NO3)2易溶于水,Ksp(PbSO4)=1.80×10-8,Ksp(PbCO3)=1.44×10-13。
请回答下列有关问题:
(1) 铅蓄电池在放电过程中,正极上发生的电极反应式为___________。
(2) 已知①中PbO2转化为PbCO3,该转化过程的离子方程式为___________。
(3) 测得滤液Ⅰ中c(SO)=0.1 mol·L-1,则该滤液中c(CO)=___________mol·L-1。
(4) 已知②中铅的浸出率与温度的关系如下图所示:
当温度高于T0时,铅的浸出率降低的原因可能有___________。
(5) 该流程中可循环利用的物质为___________(填名称)。
(6) ④中所发生反应的化学方程式为___________。
18.现在工业上主要采用离子交换膜法电解饱和食盐水制取NaOH、H2和Cl2。阳离子交换膜有一种特殊的性质,即它只允许阳离子通过,而阻止阴离子和气体通过。
请回答下列问题:
(1)电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、等杂质离子,使用的试剂有:a.Na2CO3溶液, b.Ba(OH)2溶液, c.稀盐酸,其合理的加入顺序为(填试剂序号)_____。
(2)在电解过程中,对水的电离是_________的(填“促进”或“抑制”或“没有影响”);与电源正极相连的电极上所发生的电极反应式为________。
(3)如果在容积为10L的离子交换膜电解槽中,1min后在阴极可产生11.2L(标准状况)H2,这时溶液的pH值是_________(填“升高”、“降低”或“不变”),溶液中c(OH-)为(设体积保持不变)________。
(4)若没有阳离子交换膜的存在,改用下图电解发生器(b为电源正极,用石墨作电极),可制备家用环保型消毒液(NaClO溶液)。则此实验时电解饱和食盐水的总化学方程式是 _________。
(5)室温条件下,该消毒液(NaClO)溶液的pH>7,原因是_____(用离子方程式表示)。
19.已知某工业废水中含有大量 CuSO4,少量 Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
(1)步骤 1 的主要操作是___________,需用到的玻璃仪器除烧杯外还有____________。
(2)步骤 2 中需加入某种试剂后再将混合物分离,该试剂是(填化学式)_________________,生成固体残渣成分是(填化学式)______________。
步骤 3 中涉及的操作是:蒸发浓缩、______________________、过滤、干燥。
步骤 2 应该在通风橱中进行,原因是_______________________________________。
20.现有含有Fe2+杂质的硫酸铜晶体(CuSO4·5H2O),为了制取纯净的 CuSO4·5H2O),首先将其制成水溶液,然后按图示步骤进行提纯:
已知:各离子开始沉淀和完全沉淀时的pH如下表:
离子 开始沉淀时的pH 完全沉淀时的pH
6.4 9.6
1.5 3.2
4.7 6.7
请回答下列问题:
(1)加入氧化剂的目的是______,最适合的氧化剂X是______(填字母)。
A.KMnO4 B.氯水 C.H2O2 D.HNO3
(2)物质Y是(写一种即可)______(填化学式)。
(3)本实验用加碱沉淀法能不能达到目的?______,原因是______。
(4)除去 Fe3+的有关离子方程式为______。
(5)请设计一种实验方案检验溶液中Fe3+是否被完全除去(写出操作步骤、现象和结论):______。
(6)除铁后得到的 Fe(OH)3可用KClO 溶液在碱性环境中将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式:______。
参考答案
1.B
【详解】
A.托盘天平称量固体时,物品放左边托盘,砝码放右边托盘,A错误;
B.用燃着的火柴点燃酒精灯,B正确;
C.把锌粒等固体颗粒放入试管的操作为:试管横放、把固体颗粒放在试管口、慢慢竖起试管,让固体颗粒慢慢滑入试管底部,这样可避免按如图操作时在试管底部砸出小洞,C错误;
D.给试管内的液体加热时,液体体积不能超过试管容积的1/3、试管和桌面的夹角约45度角、试管夹夹在离试管口约1/3的地方,并用酒精灯的外焰给试管中加热,D错误;
答案选B。
2.D
【详解】
A.图示仪器为容量瓶,是配制溶液的仪器,不能加热,A错误;
B.图示仪器为漏斗,是添加试剂、过滤操作中的仪器,不能加热,B错误;
C.图示仪器为烧瓶,加热时必须垫石棉网,不能直接加热,C错误;
D.图中仪器为蒸发皿,用来蒸发溶液的仪器,可以直接加热,D正确;
故选D。
3.B
【详解】
A.用于蒸馏的实验装置;B.用于分液操作的实验装置;
C.用于蒸发操作的实验装置;D.用于过滤的实验装置;
故答案选B。
4.D
【详解】略
5.A
【详解】
A.灼烧固体需要在坩埚中进行,不能在烧杯中灼烧固体,A错误;
B.用镁带做引燃剂,使氯酸钾分解,引发铝热反应,B正确;
C.分馏装置中温度计位置,冷凝水流向等均正确,C正确;
D.乙酸乙酯和水不互溶,采用分液漏斗分液进行分离,D正确;
答案为:A。
6.B
【详解】
A.乙醇和水均能和金属钠反应生成氢气,无法检验无水乙醇中是否有水,实验不能达到预期目的,可选用无水硫酸铜检验无水乙醇中是否有水,故A错误;
B.用乙比较的是S和C的最高价含氧酸的酸:硫酸和碳酸的酸性,酸性越强非金属性越强,故B正确;
C.环已烯与溴水中的溴发生加成反应,故不可以用环己烯提取溴水中的溴单质,故C错误;
D.蒸发溶液由于水解,得不到纯净的,故D错误;
故选B。
7.B
【详解】
A.碳酸氢钙受热分解生成碳酸钙、水跟二氧化碳;水中的碳酸氢镁经长时间加热转化为氢氧化镁,则加热煮沸将硬水转化为软水,A不符合;
B.二氧化碳不可燃,能灭火。通入氧气再点燃,无法除去二氧化碳中的一氧化碳,应把混合气体通过灼热的氧化铜,将一氧化碳转变为二氧化碳,B符合;
C.铁能与稀硫酸反应产生氢气,铜不与稀硫酸反应,分别将铜丝和铁丝放入稀硫酸中能比较铜和铁的活动性,C不符合;
D.氢氧化钠的固体溶于水时大量放热、硝酸铵固体溶于水时明显吸热,故用水可鉴别氢氧化钠固体和硝酸铵固体,D不符合;
答案选B。
8.D
【详解】
A.是长颈漏斗,故A不符合题意;
B.是漏斗,故B不符合题意;
C.是分液漏斗,故C不符合题意;
D.是干燥管,故D符合题意;
故选D。
9.C
【详解】
A.向容量瓶中转移溶液时需要玻璃棒引流,A错误;
B.过滤时漏斗颈下端紧靠烧杯内壁,B错误;
C.胶体不能透过半透膜,溶液可以,该装置可以提纯Al(OH)3胶体,C正确;
D.蒸馏时温度计测量的是蒸汽温度,温度计水银球应放在蒸馏烧瓶支管出口处,D错误;
答案选C。
10.B
【分析】
A装置中Fe与稀硫酸反应产生FeSO4、H2,H2经装置B中浓硫酸的干燥作用进入C中,发生反应:H2+CuOH2O+Cu,装置D碱石灰的作用是吸收水分,防止空气中的水蒸气对实验造成干扰,最后多余的H2点燃变为H2O排出。
【详解】
A.H2与O2的混合气体点燃会发生爆炸,反应开始时应先滴加稀硫酸,排尽装置内空气,然后再加热装置C,以免发生爆炸事故,A正确;
B.圆底烧瓶A中Fe与稀硫酸反应产生FeSO4、H2,发生的离子反应为:Fe+2H+=Fe2++H2↑,B错误;
C.检查装置气密性的方法为:关闭分液漏斗活塞,将导管E插入水槽中液面以下,加热装置A、E处有气泡产生,停止加热,温度降低,气体的体积减小,导致E处导管有一段上升的水柱,故能够说明装置的气密性良好,C正确;
D.装置B中试剂为浓硫酸,作用是干燥氢气;由于H2是可燃性气体,所以E处尾气处理方法可以点燃尾气,D正确;
故合理选项是B。
11.C
【详解】
A.萃取剂与原溶剂不能互溶,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,萃取剂和溶质不反应,萃取剂的密度不一定比水大,如苯的密度小于水,故A错误;
B.蒸馏时,需要测蒸气温度,应使温度计水银球在蒸馏烧瓶的支管口,故B错误;
C.为防止液体相互混合,分液时,分液漏斗中下层液体从下口放出,将上层液体从上口倒入另一个容器中,故C正确;
D.等蒸发皿中出现较多量固体时,停止加热,用余热蒸干,故D错误;
选C。
12.B
【详解】
A.在水中可生成具有吸附性的氢氧化铝和氢氧化铁,可用于净水,A不符合题意;
B.由于、以及的物质的量的关系无法确定,故不能确定甲溶液中元素的存在形式,即不能确定溶液中是否存在,则加入溶液后溶液不一定呈血红色,B符合题意;
C.因中为价,故试剂X应为氧化剂,将氧化成,C不符合题意;
D.若乙溶液呈强碱性,因氢氧化铝与氢氧化钠反应生成偏铝酸钠,则不可能生成,故意溶液不一定呈强碱性,D不符合题意。
故选:B。
13.B
【详解】
A.重结晶时,冷却速度慢时,可使溶液的过饱和度缓慢释放,使晶体有充足的时间生长,所以得到的晶体颗粒越大,因此重结晶时,溶液冷却速度越慢得到的晶体颗粒越大,A正确;
B.萃取操作时,要求萃取剂与原溶剂互不相溶,且溶质在萃取剂中的溶解度比原溶剂大,但其密度不一定比水大,B错误;
C.抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作时使用抽气泵给吸滤瓶减压,导致装置内部的压强降低,漏斗中的固液混合物由于重力作用可以快速分离,从而使过滤的速度加快,C正确;
D.硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁,产生玻璃碎末,这样就可以以玻璃碎末为“中心”进行聚集,从而可促使晶体析出,D正确;
故合理选项是B。
14.B
【详解】
蒸馏是常见分离或提纯操作,需要酒精灯、铁架台、石棉网、蒸馏烧瓶、冷凝管、牛角管、锥形瓶等,不需要干燥管,故选B。
15.C
【详解】
A.实验室用加热氯化铵和氢氧化钙混合物的方法制取NH3;单纯加热氯化铵,氯化铵分解为氨气和氯化氢,氨气和氯化氢在试管口又生成氯化铵,故不选A;
B.实验室用石灰石和稀盐酸反应制备少量CO2气体,故不选B;
C.图丙为蒸馏装置,用图丙进行蒸馏操作,故选C;
D.碘易升华,加热碘水溶液得不到制固体碘,一般用萃取法提取碘水中的碘,故不选D;
选C。
16.C
【详解】
能将Pt氧化为+4价,说明四氟化氙具有强氧化性,故应贴的标志是氧化剂,选C。
17.PbO2++4H++2e-=PbSO4+2H2O PbO2+++H2O=PbCO3↓++2OH- 8.0×10-7 硝酸的挥发速率和分解速率加快 硝酸 4PbSO4+6NaOH=3PbO·PbSO4·H2O+3Na2SO4+2H2O
【详解】
(1)铅蓄电池正极材料为PbO2,负极材料为Pb,硫酸溶液作电解液,两极均生成难溶物PbSO4,正极上,PbO2发生还原反应生成的Pb2+与结合生成PbSO4:PbO2++4H++2e-=PbSO4+2H2O;
(2)根据“①中PbO2转化为PbCO3”发生了还原反应,结合流程①中所加试剂可确定Na2SO3为该反应的还原剂,再根据“Ksp(PbSO4)=1.80×10-8>Ksp(PbCO3)=1.44×10-13”,说明反应生成了更难溶的PbCO3;根据得失电子守恒有PbO2++ ——PbCO3↓+,再根据电荷守恒有PbO2++——PbCO3↓+SO+2OH-(根据所加Na2CO3和Na2SO3溶液均水解显碱性),最后根据原子守恒得PbO2+++H2O=PbCO3↓++2OH-;
(3)①中存在“PbSO4转化为更难溶的PbCO3”,结合(2)中分析知,滤液Ⅰ中的PbSO4和PbCO3均处于沉淀溶解平衡状态,则有==,将“Ksp(PbSO4)=1.80×10-8、Ksp(PbCO3)=1.44×10-13、c()=0.1 mol·L-1”代入上式解得c()=8.0×10-7 mol·L-1;
(4)根据流程图知,②中反应为“PbO和PbCO3”与硝酸的反应,加热有利于反应的进行,铅的浸出率升高,但是,由于硝酸沸点低,易挥发,硝酸不稳定,受热易分解,故当温度高于T0时,硝酸的挥发速率和分解速率加快,不利于②中反应的进行,导致铅的浸出率降低;
(5) ②中,PbO和PbCO3在硝酸的作用下转化成Pb(NO3)2,③中,向Pb(NO3)2中加稀硫酸转化成PbSO4沉淀和硝酸,由此确定滤液Ⅱ为稀硝酸,HNO3在反应流程中可循环利用(即在②中加以循环利用);
(6) 根据流程图分析知,④中的反应物有PbSO4和NaOH,生成物之一为3PbO·PbSO4·H2O,然后利用原子守恒可写出④中所发生反应的化学方程式为4PbSO4+6NaOH=3PbO·PbSO4·H2O+3Na2SO4+2H2O。
18.bac 促进 2Cl--2e-===Cl2↑ 升高 0.1mol/ L NaCl+H2ONaClO+H2↑ ClO- +H2OHClO+OH-
【分析】
(1)盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;
(2)电解NaCl溶液时,水电离出来的氢离子在阴极反应,阳极上氯离子放电生成氯气;
(3)阴极电极反应式为 2H++2e-=H2↑,生成11.2L氢气消耗1mol氢离子,溶液中生成1mol氢氧根离子,据此分析;
(4)若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物是NaClO和H2,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,据此分析解答;
(5)NaClO是弱酸强碱盐,其水解导致溶液显碱性.
【详解】
(1)要先除硫酸根离子,然后再除钙离子,Na2CO3可以除去过量的钡离子,否则过量的钡离子不能完全除尽,至于加NaOH除去镁离子顺序不受限制,可放在加入BaCl2之前或之后,因为过量的NaOH加HCl就可以调节了,只要将三种离子完全除去,过滤即可,最后加HCl除去过量的氢氧根离子和碳酸根离子;
故答案为:bac;
(2)电解NaCl溶液时,水电离出来的氢离子在阴极反应,促进了水的电离,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-===Cl2↑;
故答案为:促进; 2Cl--2e-===Cl2↑;
(3)阴极电极反应式为 2H++2e-=H2↑,生成11.2L氢气即0.5mol氢气,消耗1mol氢离子,溶液中生成1mol氢氧根离子,所以pH升高,c(OH-) = 1mol ÷ 10L = 0.1mol/L;
故答案为:升高;0.1mol/L;
(4)若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物是NaClO和H2,,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,电池反应式为NaCl+H2ONaClO+H2↑;
故答案为:NaCl+H2ONaClO+H2↑;
(5)NaClO是弱酸强碱盐,其水解导致溶液显碱性,水解方程式为ClO- +H2OHClO+OH-,故答案为:ClO- +H2OHClO+OH-。
【点睛】
本题考查原电池和电解池原理、电极反应式的书写、盐类水解,明确电极上得失电子及反应物质是解题关键,电极反应式的书写是学习难点,要注意结合电解质溶液的酸碱性书写,难度中等。
19.过滤 玻璃棒、漏斗 Cu Ag、Cu 冷却结晶 Hg有挥发性,且有毒
【分析】
工业废水中含有大量 CuSO4,少量 Ag+、Hg2+以及部分污泥,通过过滤,先除去污泥,在滤液中加适当加入过量的Cu,可置换出Ag、Hg并将金属单质分离出来,将滤液蒸发浓缩、冷却结晶、过滤、烘干等可得硫酸铜晶体;
【详解】
(1)由流程知,步骤1要将固体和液体分离,可用过滤操作,需要除烧杯外,还需要漏斗、玻璃棒;
(2)Cu的性质比Ag、Hg活泼,加入过量的Cu,可置换出Ag、Hg而分离出来,且不能引入新的杂质,所加入的试剂应为Cu;Hg在常温下为液体,则固体残渣为Ag、Cu;从溶液中获取结晶水合物,需经过蒸发浓缩、冷却结晶、过滤、烘干等操作;Hg有挥发性,且有毒,应在通风橱中进行。
20.将 Fe2+氧化为 Fe3+,便于与 Cu2+分离 C CuO 不能 因为加碱的同时也会使 Cu2+生成 Cu(OH)2沉淀 、 取待检测溶液少许,加入 KSCN 溶液,若溶液不变红色,说明 Fe3+已沉淀完全,若溶液变红色,则说明 Fe3+未完全除去
【分析】
由流程可知,含有Fe2+杂质的硫酸铜晶体(CuSO4·5H2O)溶解后得到水溶液I,加入氧化剂X可以将亚铁离子氧化为铁离子,考虑到不引入新的杂质,则氧化剂X为过氧化氢,溶液II中加入物质Y可促进铁离子水解转化为沉淀,则Y可以是CuO,过滤分离得到硫酸铜的水溶液,然后在酸性环境下蒸发浓缩、冷却结晶,过滤、洗涤、干燥即可得到硫酸铜晶体,以此来解答。
【详解】
(1)加入氧化剂X的目的是将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离;为了不引入新的杂质,最适合的氧化剂X是H2O2;故答案为:将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离;C;
(2)溶液II中加入物质Y可促进铁离子水解转化为沉淀,该物质中和溶液的酸性,调节pH,将铁离子沉淀,铜离子不沉淀,可以加入CuO,故答案为:CuO;
(3)不用物质Y而是直接用碱不能达到目的,因加碱使Fe3+沉淀的同时也能使Cu2+沉淀,故答案为:不能;因为加碱的同时也会使 Cu2+生成 Cu(OH)2沉淀;
(4)加入CuO中和溶液的酸性,反应的离子方程式为:;促进离子水解转化为沉淀,反应的离子方程式为:;故答案为: 、;
(5)可以用KSCN 溶液检验Fe3+,故答案为:取待检测溶液少许,加入 KSCN 溶液,若溶液不变红色,说明 Fe3+已沉淀完全,若溶液变红色,则说明 Fe3+未完全除去;
(6)除铁后得到的 Fe(OH)3可用KClO 溶液在碱性环境中将其氧化得到一种高效的多功能水处理剂——K2FeO4,根据氧化还原反应原理书写并配平反应得,故答案为:。
一、选择题(共16题)
1.下图所示的化学实验基本操作正确的是
A.称量氯化钠 B.点燃酒精灯
C.取用固体 D.加热液体
2.如图所示四种常见仪器能直接加热的是
A. B. C. D.
3.可用于分液操作的实验装置是
A B. C. D.
4.若在宇宙飞船的太空实验室(失重条件下)进行以下实验,其中最难完成的是
A.将金粉和铜粉混合 B.将牛奶加入水中混合
C.蒸发食盐水制取食盐晶体 D.用漏斗、滤纸过滤除去水中的泥沙
5.下列装置或操作图示错误的是
A.海带灼烧 B.铝热反应
C.石油的分馏 D.分离乙酸乙酯和水
6.利用下列装置进行实验,能达到实验目的的是
A.用甲检验无水乙醇中是否有水
B.用乙比较碳元素与硫元素的非金属性强弱
C.用丙提取溴水中的溴单质
D.用丁蒸发MgCl2,溶液制备MgCl2
7.依据实验目的,下列设计的实验方案中不合理的是
实验目的 实验方案
A 将硬水转化为软水 加热煮沸
B 除去二氧化碳中的一氧化碳 通入氧气后点燃
C 比较铜和铁的活动性 分别将铜丝和铁丝放入稀硫酸中
D 鉴别氢氧化钠固体和硝酸铵固体 分别取样,加水充分溶解
A.A B.B C.C D.D
8.下列仪器名称为“球形干燥管”的是
A. B. C. D.
9.下列图示装置正确且能达到实验目的的是
A B C D
转移溶液 固液分离 提纯Al(OH)3胶体 蒸馏提纯
A.A B.B C.C D.D
10.某化学小组用5.6 g铁粉与足量的稀硫酸反应,用产生的H2还原足量的CuO制备单质铜,实验装置如图所示(夹持及加热装置略去)。下列说法错误的是
A.反应开始时应先滴加稀硫酸,排尽装置内空气然后再加热装置C
B.圆底烧瓶A中发生的离子反应为:2Fe+6H+=2Fe3++3H2↑
C.检查装置气密性的方法为:关闭分液漏斗活塞,将导管E插入水槽中液面以下,加热装置A,E处有气泡产生,停止加热,E处导管有一段上升的水柱
D.装置B中试剂为浓硫酸,E处尾气处理方法可以点燃尾气
11.下列实验操作中正确的是
A.萃取时,应选择有机萃取剂,且萃取剂的密度一定比水大
B.蒸馏时,应使温度计水银球伸入液体中
C.分液时,分液漏斗中下层液体从下口放出,将上层液体从上口倒入另一个容器中
D.蒸发操作时,必须使混合物中的水分完全蒸干后才停止加热
12.高效净水剂聚合氯化铝铁()的组成可表示为,该物质广泛应用于日常生活用水和工业废水的净化处理。某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取:
下列判断错误的是
A.因在水中生成氢氧化铝和氢氧化铁而能净水
B.往甲溶液中滴入溶液后溶液一定呈血红色
C.试剂具有氧化性
D.乙溶液一定不呈强碱性
13.下列说法不正确的是
A.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
B.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
C.抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快
D.硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁,促使晶体析出
14.蒸馏是常见分离或提纯操作,下列仪器不需要用到的是
A. B. C. D.
15.用下列装置或操作进行实验,能达到实验目的且操作正确的是
A.图甲:制取NH3 B.图乙:制取少量CO2气体
C.图丙:蒸馏 D.图丁:加热碘水溶液制固体碘
16.四氟化氙(XeF4)熔点117.1℃,是一种强氟化剂,能将金属铂(Pt)氟化为PtF4。四氟化氙储存时应贴的化学品标志是
A. B. C. D.
二、综合题(共4题)
17.三盐基硫酸铅(3PbO·PbSO4·H2O)用作聚氯乙烯的热稳定剂。用废旧铅蓄电池的填充物能制得三盐基硫酸铅,其工艺流程如下:
已知:① 废旧铅蓄电池填充物的主要成分有PbO、PbO2、PbSO4;
② Pb(NO3)2易溶于水,Ksp(PbSO4)=1.80×10-8,Ksp(PbCO3)=1.44×10-13。
请回答下列有关问题:
(1) 铅蓄电池在放电过程中,正极上发生的电极反应式为___________。
(2) 已知①中PbO2转化为PbCO3,该转化过程的离子方程式为___________。
(3) 测得滤液Ⅰ中c(SO)=0.1 mol·L-1,则该滤液中c(CO)=___________mol·L-1。
(4) 已知②中铅的浸出率与温度的关系如下图所示:
当温度高于T0时,铅的浸出率降低的原因可能有___________。
(5) 该流程中可循环利用的物质为___________(填名称)。
(6) ④中所发生反应的化学方程式为___________。
18.现在工业上主要采用离子交换膜法电解饱和食盐水制取NaOH、H2和Cl2。阳离子交换膜有一种特殊的性质,即它只允许阳离子通过,而阻止阴离子和气体通过。
请回答下列问题:
(1)电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、等杂质离子,使用的试剂有:a.Na2CO3溶液, b.Ba(OH)2溶液, c.稀盐酸,其合理的加入顺序为(填试剂序号)_____。
(2)在电解过程中,对水的电离是_________的(填“促进”或“抑制”或“没有影响”);与电源正极相连的电极上所发生的电极反应式为________。
(3)如果在容积为10L的离子交换膜电解槽中,1min后在阴极可产生11.2L(标准状况)H2,这时溶液的pH值是_________(填“升高”、“降低”或“不变”),溶液中c(OH-)为(设体积保持不变)________。
(4)若没有阳离子交换膜的存在,改用下图电解发生器(b为电源正极,用石墨作电极),可制备家用环保型消毒液(NaClO溶液)。则此实验时电解饱和食盐水的总化学方程式是 _________。
(5)室温条件下,该消毒液(NaClO)溶液的pH>7,原因是_____(用离子方程式表示)。
19.已知某工业废水中含有大量 CuSO4,少量 Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
(1)步骤 1 的主要操作是___________,需用到的玻璃仪器除烧杯外还有____________。
(2)步骤 2 中需加入某种试剂后再将混合物分离,该试剂是(填化学式)_________________,生成固体残渣成分是(填化学式)______________。
步骤 3 中涉及的操作是:蒸发浓缩、______________________、过滤、干燥。
步骤 2 应该在通风橱中进行,原因是_______________________________________。
20.现有含有Fe2+杂质的硫酸铜晶体(CuSO4·5H2O),为了制取纯净的 CuSO4·5H2O),首先将其制成水溶液,然后按图示步骤进行提纯:
已知:各离子开始沉淀和完全沉淀时的pH如下表:
离子 开始沉淀时的pH 完全沉淀时的pH
6.4 9.6
1.5 3.2
4.7 6.7
请回答下列问题:
(1)加入氧化剂的目的是______,最适合的氧化剂X是______(填字母)。
A.KMnO4 B.氯水 C.H2O2 D.HNO3
(2)物质Y是(写一种即可)______(填化学式)。
(3)本实验用加碱沉淀法能不能达到目的?______,原因是______。
(4)除去 Fe3+的有关离子方程式为______。
(5)请设计一种实验方案检验溶液中Fe3+是否被完全除去(写出操作步骤、现象和结论):______。
(6)除铁后得到的 Fe(OH)3可用KClO 溶液在碱性环境中将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式:______。
参考答案
1.B
【详解】
A.托盘天平称量固体时,物品放左边托盘,砝码放右边托盘,A错误;
B.用燃着的火柴点燃酒精灯,B正确;
C.把锌粒等固体颗粒放入试管的操作为:试管横放、把固体颗粒放在试管口、慢慢竖起试管,让固体颗粒慢慢滑入试管底部,这样可避免按如图操作时在试管底部砸出小洞,C错误;
D.给试管内的液体加热时,液体体积不能超过试管容积的1/3、试管和桌面的夹角约45度角、试管夹夹在离试管口约1/3的地方,并用酒精灯的外焰给试管中加热,D错误;
答案选B。
2.D
【详解】
A.图示仪器为容量瓶,是配制溶液的仪器,不能加热,A错误;
B.图示仪器为漏斗,是添加试剂、过滤操作中的仪器,不能加热,B错误;
C.图示仪器为烧瓶,加热时必须垫石棉网,不能直接加热,C错误;
D.图中仪器为蒸发皿,用来蒸发溶液的仪器,可以直接加热,D正确;
故选D。
3.B
【详解】
A.用于蒸馏的实验装置;B.用于分液操作的实验装置;
C.用于蒸发操作的实验装置;D.用于过滤的实验装置;
故答案选B。
4.D
【详解】略
5.A
【详解】
A.灼烧固体需要在坩埚中进行,不能在烧杯中灼烧固体,A错误;
B.用镁带做引燃剂,使氯酸钾分解,引发铝热反应,B正确;
C.分馏装置中温度计位置,冷凝水流向等均正确,C正确;
D.乙酸乙酯和水不互溶,采用分液漏斗分液进行分离,D正确;
答案为:A。
6.B
【详解】
A.乙醇和水均能和金属钠反应生成氢气,无法检验无水乙醇中是否有水,实验不能达到预期目的,可选用无水硫酸铜检验无水乙醇中是否有水,故A错误;
B.用乙比较的是S和C的最高价含氧酸的酸:硫酸和碳酸的酸性,酸性越强非金属性越强,故B正确;
C.环已烯与溴水中的溴发生加成反应,故不可以用环己烯提取溴水中的溴单质,故C错误;
D.蒸发溶液由于水解,得不到纯净的,故D错误;
故选B。
7.B
【详解】
A.碳酸氢钙受热分解生成碳酸钙、水跟二氧化碳;水中的碳酸氢镁经长时间加热转化为氢氧化镁,则加热煮沸将硬水转化为软水,A不符合;
B.二氧化碳不可燃,能灭火。通入氧气再点燃,无法除去二氧化碳中的一氧化碳,应把混合气体通过灼热的氧化铜,将一氧化碳转变为二氧化碳,B符合;
C.铁能与稀硫酸反应产生氢气,铜不与稀硫酸反应,分别将铜丝和铁丝放入稀硫酸中能比较铜和铁的活动性,C不符合;
D.氢氧化钠的固体溶于水时大量放热、硝酸铵固体溶于水时明显吸热,故用水可鉴别氢氧化钠固体和硝酸铵固体,D不符合;
答案选B。
8.D
【详解】
A.是长颈漏斗,故A不符合题意;
B.是漏斗,故B不符合题意;
C.是分液漏斗,故C不符合题意;
D.是干燥管,故D符合题意;
故选D。
9.C
【详解】
A.向容量瓶中转移溶液时需要玻璃棒引流,A错误;
B.过滤时漏斗颈下端紧靠烧杯内壁,B错误;
C.胶体不能透过半透膜,溶液可以,该装置可以提纯Al(OH)3胶体,C正确;
D.蒸馏时温度计测量的是蒸汽温度,温度计水银球应放在蒸馏烧瓶支管出口处,D错误;
答案选C。
10.B
【分析】
A装置中Fe与稀硫酸反应产生FeSO4、H2,H2经装置B中浓硫酸的干燥作用进入C中,发生反应:H2+CuOH2O+Cu,装置D碱石灰的作用是吸收水分,防止空气中的水蒸气对实验造成干扰,最后多余的H2点燃变为H2O排出。
【详解】
A.H2与O2的混合气体点燃会发生爆炸,反应开始时应先滴加稀硫酸,排尽装置内空气,然后再加热装置C,以免发生爆炸事故,A正确;
B.圆底烧瓶A中Fe与稀硫酸反应产生FeSO4、H2,发生的离子反应为:Fe+2H+=Fe2++H2↑,B错误;
C.检查装置气密性的方法为:关闭分液漏斗活塞,将导管E插入水槽中液面以下,加热装置A、E处有气泡产生,停止加热,温度降低,气体的体积减小,导致E处导管有一段上升的水柱,故能够说明装置的气密性良好,C正确;
D.装置B中试剂为浓硫酸,作用是干燥氢气;由于H2是可燃性气体,所以E处尾气处理方法可以点燃尾气,D正确;
故合理选项是B。
11.C
【详解】
A.萃取剂与原溶剂不能互溶,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,萃取剂和溶质不反应,萃取剂的密度不一定比水大,如苯的密度小于水,故A错误;
B.蒸馏时,需要测蒸气温度,应使温度计水银球在蒸馏烧瓶的支管口,故B错误;
C.为防止液体相互混合,分液时,分液漏斗中下层液体从下口放出,将上层液体从上口倒入另一个容器中,故C正确;
D.等蒸发皿中出现较多量固体时,停止加热,用余热蒸干,故D错误;
选C。
12.B
【详解】
A.在水中可生成具有吸附性的氢氧化铝和氢氧化铁,可用于净水,A不符合题意;
B.由于、以及的物质的量的关系无法确定,故不能确定甲溶液中元素的存在形式,即不能确定溶液中是否存在,则加入溶液后溶液不一定呈血红色,B符合题意;
C.因中为价,故试剂X应为氧化剂,将氧化成,C不符合题意;
D.若乙溶液呈强碱性,因氢氧化铝与氢氧化钠反应生成偏铝酸钠,则不可能生成,故意溶液不一定呈强碱性,D不符合题意。
故选:B。
13.B
【详解】
A.重结晶时,冷却速度慢时,可使溶液的过饱和度缓慢释放,使晶体有充足的时间生长,所以得到的晶体颗粒越大,因此重结晶时,溶液冷却速度越慢得到的晶体颗粒越大,A正确;
B.萃取操作时,要求萃取剂与原溶剂互不相溶,且溶质在萃取剂中的溶解度比原溶剂大,但其密度不一定比水大,B错误;
C.抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作时使用抽气泵给吸滤瓶减压,导致装置内部的压强降低,漏斗中的固液混合物由于重力作用可以快速分离,从而使过滤的速度加快,C正确;
D.硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁,产生玻璃碎末,这样就可以以玻璃碎末为“中心”进行聚集,从而可促使晶体析出,D正确;
故合理选项是B。
14.B
【详解】
蒸馏是常见分离或提纯操作,需要酒精灯、铁架台、石棉网、蒸馏烧瓶、冷凝管、牛角管、锥形瓶等,不需要干燥管,故选B。
15.C
【详解】
A.实验室用加热氯化铵和氢氧化钙混合物的方法制取NH3;单纯加热氯化铵,氯化铵分解为氨气和氯化氢,氨气和氯化氢在试管口又生成氯化铵,故不选A;
B.实验室用石灰石和稀盐酸反应制备少量CO2气体,故不选B;
C.图丙为蒸馏装置,用图丙进行蒸馏操作,故选C;
D.碘易升华,加热碘水溶液得不到制固体碘,一般用萃取法提取碘水中的碘,故不选D;
选C。
16.C
【详解】
能将Pt氧化为+4价,说明四氟化氙具有强氧化性,故应贴的标志是氧化剂,选C。
17.PbO2++4H++2e-=PbSO4+2H2O PbO2+++H2O=PbCO3↓++2OH- 8.0×10-7 硝酸的挥发速率和分解速率加快 硝酸 4PbSO4+6NaOH=3PbO·PbSO4·H2O+3Na2SO4+2H2O
【详解】
(1)铅蓄电池正极材料为PbO2,负极材料为Pb,硫酸溶液作电解液,两极均生成难溶物PbSO4,正极上,PbO2发生还原反应生成的Pb2+与结合生成PbSO4:PbO2++4H++2e-=PbSO4+2H2O;
(2)根据“①中PbO2转化为PbCO3”发生了还原反应,结合流程①中所加试剂可确定Na2SO3为该反应的还原剂,再根据“Ksp(PbSO4)=1.80×10-8>Ksp(PbCO3)=1.44×10-13”,说明反应生成了更难溶的PbCO3;根据得失电子守恒有PbO2++ ——PbCO3↓+,再根据电荷守恒有PbO2++——PbCO3↓+SO+2OH-(根据所加Na2CO3和Na2SO3溶液均水解显碱性),最后根据原子守恒得PbO2+++H2O=PbCO3↓++2OH-;
(3)①中存在“PbSO4转化为更难溶的PbCO3”,结合(2)中分析知,滤液Ⅰ中的PbSO4和PbCO3均处于沉淀溶解平衡状态,则有==,将“Ksp(PbSO4)=1.80×10-8、Ksp(PbCO3)=1.44×10-13、c()=0.1 mol·L-1”代入上式解得c()=8.0×10-7 mol·L-1;
(4)根据流程图知,②中反应为“PbO和PbCO3”与硝酸的反应,加热有利于反应的进行,铅的浸出率升高,但是,由于硝酸沸点低,易挥发,硝酸不稳定,受热易分解,故当温度高于T0时,硝酸的挥发速率和分解速率加快,不利于②中反应的进行,导致铅的浸出率降低;
(5) ②中,PbO和PbCO3在硝酸的作用下转化成Pb(NO3)2,③中,向Pb(NO3)2中加稀硫酸转化成PbSO4沉淀和硝酸,由此确定滤液Ⅱ为稀硝酸,HNO3在反应流程中可循环利用(即在②中加以循环利用);
(6) 根据流程图分析知,④中的反应物有PbSO4和NaOH,生成物之一为3PbO·PbSO4·H2O,然后利用原子守恒可写出④中所发生反应的化学方程式为4PbSO4+6NaOH=3PbO·PbSO4·H2O+3Na2SO4+2H2O。
18.bac 促进 2Cl--2e-===Cl2↑ 升高 0.1mol/ L NaCl+H2ONaClO+H2↑ ClO- +H2OHClO+OH-
【分析】
(1)盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;
(2)电解NaCl溶液时,水电离出来的氢离子在阴极反应,阳极上氯离子放电生成氯气;
(3)阴极电极反应式为 2H++2e-=H2↑,生成11.2L氢气消耗1mol氢离子,溶液中生成1mol氢氧根离子,据此分析;
(4)若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物是NaClO和H2,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,据此分析解答;
(5)NaClO是弱酸强碱盐,其水解导致溶液显碱性.
【详解】
(1)要先除硫酸根离子,然后再除钙离子,Na2CO3可以除去过量的钡离子,否则过量的钡离子不能完全除尽,至于加NaOH除去镁离子顺序不受限制,可放在加入BaCl2之前或之后,因为过量的NaOH加HCl就可以调节了,只要将三种离子完全除去,过滤即可,最后加HCl除去过量的氢氧根离子和碳酸根离子;
故答案为:bac;
(2)电解NaCl溶液时,水电离出来的氢离子在阴极反应,促进了水的电离,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-===Cl2↑;
故答案为:促进; 2Cl--2e-===Cl2↑;
(3)阴极电极反应式为 2H++2e-=H2↑,生成11.2L氢气即0.5mol氢气,消耗1mol氢离子,溶液中生成1mol氢氧根离子,所以pH升高,c(OH-) = 1mol ÷ 10L = 0.1mol/L;
故答案为:升高;0.1mol/L;
(4)若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物是NaClO和H2,,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,电池反应式为NaCl+H2ONaClO+H2↑;
故答案为:NaCl+H2ONaClO+H2↑;
(5)NaClO是弱酸强碱盐,其水解导致溶液显碱性,水解方程式为ClO- +H2OHClO+OH-,故答案为:ClO- +H2OHClO+OH-。
【点睛】
本题考查原电池和电解池原理、电极反应式的书写、盐类水解,明确电极上得失电子及反应物质是解题关键,电极反应式的书写是学习难点,要注意结合电解质溶液的酸碱性书写,难度中等。
19.过滤 玻璃棒、漏斗 Cu Ag、Cu 冷却结晶 Hg有挥发性,且有毒
【分析】
工业废水中含有大量 CuSO4,少量 Ag+、Hg2+以及部分污泥,通过过滤,先除去污泥,在滤液中加适当加入过量的Cu,可置换出Ag、Hg并将金属单质分离出来,将滤液蒸发浓缩、冷却结晶、过滤、烘干等可得硫酸铜晶体;
【详解】
(1)由流程知,步骤1要将固体和液体分离,可用过滤操作,需要除烧杯外,还需要漏斗、玻璃棒;
(2)Cu的性质比Ag、Hg活泼,加入过量的Cu,可置换出Ag、Hg而分离出来,且不能引入新的杂质,所加入的试剂应为Cu;Hg在常温下为液体,则固体残渣为Ag、Cu;从溶液中获取结晶水合物,需经过蒸发浓缩、冷却结晶、过滤、烘干等操作;Hg有挥发性,且有毒,应在通风橱中进行。
20.将 Fe2+氧化为 Fe3+,便于与 Cu2+分离 C CuO 不能 因为加碱的同时也会使 Cu2+生成 Cu(OH)2沉淀 、 取待检测溶液少许,加入 KSCN 溶液,若溶液不变红色,说明 Fe3+已沉淀完全,若溶液变红色,则说明 Fe3+未完全除去
【分析】
由流程可知,含有Fe2+杂质的硫酸铜晶体(CuSO4·5H2O)溶解后得到水溶液I,加入氧化剂X可以将亚铁离子氧化为铁离子,考虑到不引入新的杂质,则氧化剂X为过氧化氢,溶液II中加入物质Y可促进铁离子水解转化为沉淀,则Y可以是CuO,过滤分离得到硫酸铜的水溶液,然后在酸性环境下蒸发浓缩、冷却结晶,过滤、洗涤、干燥即可得到硫酸铜晶体,以此来解答。
【详解】
(1)加入氧化剂X的目的是将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离;为了不引入新的杂质,最适合的氧化剂X是H2O2;故答案为:将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离;C;
(2)溶液II中加入物质Y可促进铁离子水解转化为沉淀,该物质中和溶液的酸性,调节pH,将铁离子沉淀,铜离子不沉淀,可以加入CuO,故答案为:CuO;
(3)不用物质Y而是直接用碱不能达到目的,因加碱使Fe3+沉淀的同时也能使Cu2+沉淀,故答案为:不能;因为加碱的同时也会使 Cu2+生成 Cu(OH)2沉淀;
(4)加入CuO中和溶液的酸性,反应的离子方程式为:;促进离子水解转化为沉淀,反应的离子方程式为:;故答案为: 、;
(5)可以用KSCN 溶液检验Fe3+,故答案为:取待检测溶液少许,加入 KSCN 溶液,若溶液不变红色,说明 Fe3+已沉淀完全,若溶液变红色,则说明 Fe3+未完全除去;
(6)除铁后得到的 Fe(OH)3可用KClO 溶液在碱性环境中将其氧化得到一种高效的多功能水处理剂——K2FeO4,根据氧化还原反应原理书写并配平反应得,故答案为:。
