2021-2022学年高一上学期化学苏教版(2019)必修第一册专题3 第一单元氯气及氯的化合物 同步练习 (含解析)
文档属性
| 名称 | 2021-2022学年高一上学期化学苏教版(2019)必修第一册专题3 第一单元氯气及氯的化合物 同步练习 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 534.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-20 08:03:44 | ||
图片预览




文档简介
专题3从海水中获得的化学物质第一单元氯气及氯的化合物—2021-2022学年上学期高一化学苏教版(2019)必修第一册
一、选择题(共16题)
1.已知氧化性强弱:。下列反应不可能发生的是
A.
B.
C.
D.
2.下列关于氯气性质描述不正确的是
A.氯气有毒 B.氯气有较强的氧化性
C.通常情况下,氯气是黄绿色的气体 D.纯净的氯气可使干燥的有色布条褪色
3.2008年5月29日上午,因连日下雨,雨水漏进北川县擂鼓镇一间存放消毒用漂白粉的屋子,屋内物质之间发生化学反应,冒出浓烟。据了解,由于风向比较复杂,整个营地的两千多人被紧急疏散。在排险过程中,有61名官兵因氯气中毒,被紧急送往医院救治。下列说法正确的是
A.人群应该向着低洼处紧急疏散
B.可能是漂白粉内的物质在一定条件下发生氧化还原反应而散发出氯气
C.紧急疏散人群的同时,应向散发氯气的地方喷洒氢氧化钠浓溶液
D.漂白粉若长时间放置在露天仓库中变质,其中只发生了一个化学反应
4.下列物质中,不能由单质通过化合反应得到的是
A.FeCl2 B.FeCl3 C.FeS D.Cu2S
5.下列反应中有一种物质既是氧化剂又是还原剂的是
A.2KI+Br2=2KBr+I2 B.2AgNO32Ag↓+2NO2↑+O2↑
C.Cu2(OH)2CO32CuO+CO2↑+H2O D.C+H2OCO+H2
6.下列古代技术的应用中,不涉及氧化还原反应的是
A.古法炼铁 B.化丹(Pb3O4)为铅 C.煅烧贝壳 D.火药爆炸
A.A B.B C.C D.D
7.用下列实验装置进行相应实验,能达到实验目的的是
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NaHCO3饱和溶液制备NaHCO3晶体
C.用图3所示装置除去Fe(OH)3胶体中的FeCl3
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
8.下列化学反应中,不属于氧化还原反应的是
A.CaCO3+2HCl= CaCl2+CO2↑+H2O B.Fe+CuSO4 =Cu+FeSO4
C.Fe2O3+3CO2Fe+3CO2 D.2Cl2+ 2Ca(OH)2=CaCl2 + Ca(C1O)2+2H2O
9.实验室利用如图所示装置制备氯气,图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是
A.①②③ B.①②④ C.②③④ D.①③④
10.属于氧化还原反应的离子方程式的是
A.CaCO3+2H+=Ca2++CO2↑+H2O
B.Fe2++2OH-=Fe(OH)2↓
C.+H+=CO2+H2O
D.2Na+2H2O=2Na++2OH+H2↑
11.用NA表示阿伏伽德罗常数,下列说法正确的是
A.12g金刚石与石墨所含的共价键数目均为2NA
B.1L0.1mol/LNa2CO3溶液中的阴离子总数大于0.1NA
C.标准状况下,22.4L氯气溶于水形成的溶液中:n(Cl-)+n(ClO-)+n(HClO)=NA
D.2L0.5mol·L-1亚硫酸溶液中含有的H+数为2NA
12.下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 向盐酸中滴入少量NaAlO2溶液 无明显现象 与H+未发生反应
B 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 HA放出的氢气多且 反应速率快 HA酸性比HB强
C 用激光笔照射鸡蛋蛋白水溶液 有丁达尔效应 鸡蛋蛋白分子直径小于lnm
D 向FeBr2溶液中加入少量氯水,再加CCl4振荡 CCl4层无色 Fe2+的还原性强于Br-
A.A B.B C.C D.D
13.下列说法正确的是
A.在抽滤装置中洗涤晶体时,为减少晶体溶解损失,应使洗涤剂快速通过滤纸
B.纸层析法分离Cu2+、Fe3+时,用毛细管蘸取试样在滤纸条的原点处轻轻点样,晾干后再点,重复3~5次
C.在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在
D.在“硫酸亚铁铵的制备”实验中,为得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
14.已知2NaClO3+ 4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,NA代表阿伏加德罗常数曲管值。下列说法正确的是
A.100 g溶质质量分数为36.5%的浓盐酸中所含氢原子的数目为NA
B.标准状况下,5.85 g NaCl中所含的电子总数为2.8NA
C.0.4 mol·L-1的NaClO3溶液中所含的阴、阳离子总数为0.8NA
D.常温常压下,每生成3.36 L气体转移的电子总数为0.1NA
15.下列溶液长期暴露在空气中会因氧化变质的是
A.CuSO4溶液 B.Na2SiO3溶液 C.FeSO4溶液 D.NaCl溶液
16.下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是
A.CuCl2 B.FeCl3 C.FeCl2 D.AlCl3
二、综合题(共4题)
17.请分析下列氧化还原反应,该反应为实验室用MnO2和浓盐酸(注意不是稀盐酸)反应制备Cl2
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
①用单线桥法表示出电子转移方向和数量___________。
②该反应的氧化剂是___________。
③HCl在该反应中体现的化学性质有___________、___________。
④实验测定,当MnO2足量时,无论如何控制条件,用含146gHCl的浓盐酸参与反应,得到的氯气始终小于71g,产生该现象的一个原因是HCl易挥发,另一个原因可能是___________
18.化学就在我们身边,它与我们的日常生活密切相关。按要求回答以下问题:
(1)明矾是__________________,漂白粉的有效成分是________(均填化学式)。硅是无机非金属材料的主角,请你举出一种含硅的材料名称________。
(2)①用少量氯气消毒的自来水养金鱼时,通常需要先将自来水晒一晒,其原因是___________(用化学方程式表示)。
②绿柱石(绿宝石)矿藏其主要化学成分为BenAl2Si6O18,可用氧化物形式表示为nBeO·Al2O3·6SiO2,其n值为_______; 北京奥运金牌“金镶玉”环形玉璧由昆仑玉制成,昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,将其化学式改写成氧化物形式为________________。
③缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是___________________。
(3)SiO2广泛存在于自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学反应方程式:_____________________。
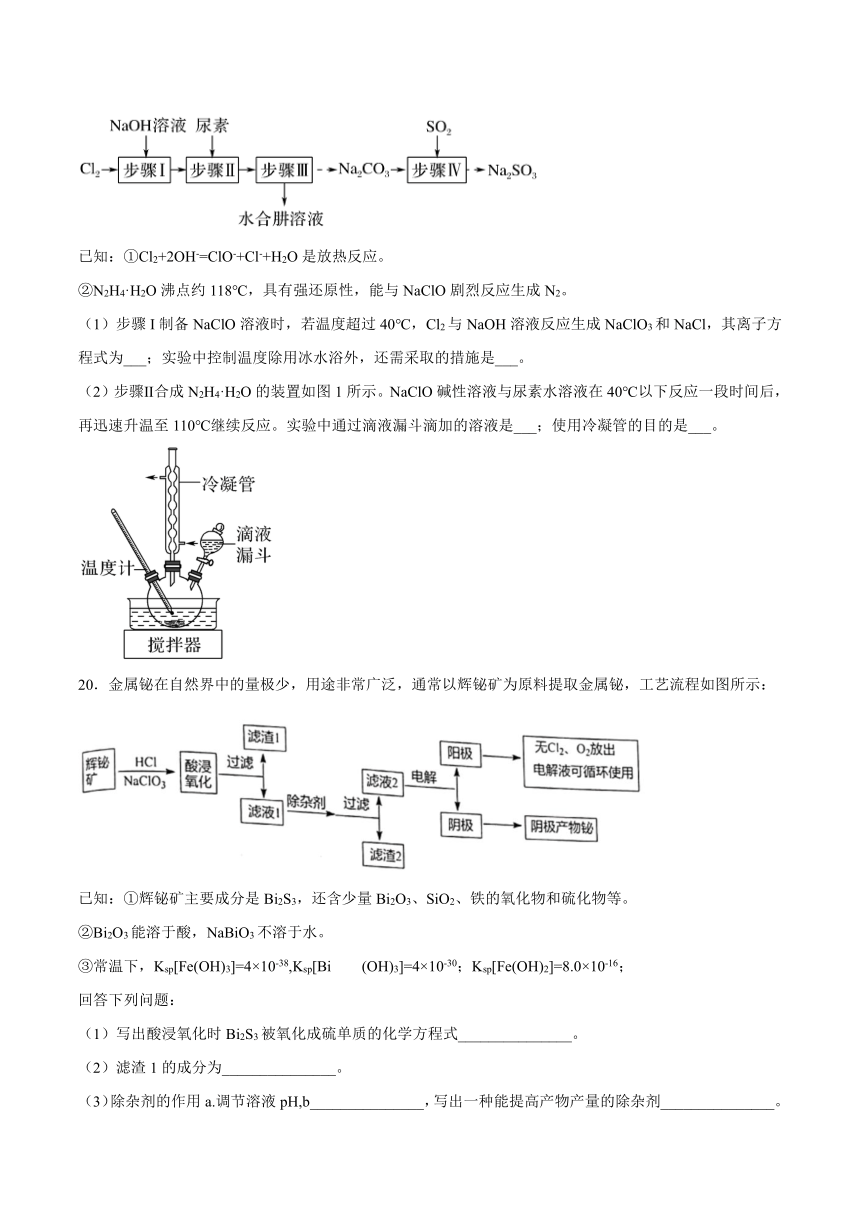
19.以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如图:
已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为___;实验中控制温度除用冰水浴外,还需采取的措施是___。
(2)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是___;使用冷凝管的目的是___。
20.金属铋在自然界中的量极少,用途非常广泛,通常以辉铋矿为原料提取金属铋,工艺流程如图所示:
已知:①辉铋矿主要成分是Bi2S3,还含少量Bi2O3、SiO2、铁的氧化物和硫化物等。
②Bi2O3能溶于酸,NaBiO3不溶于水。
③常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Bi (OH)3]=4×10-30;Ksp[Fe(OH)2]=8.0×10-16;
回答下列问题:
(1)写出酸浸氧化时Bi2S3被氧化成硫单质的化学方程式_______________。
(2)滤渣1的成分为_______________。
(3)除杂剂的作用a.调节溶液pH,b_______________,写出一种能提高产物产量的除杂剂_______________。
(4)滤液2还可用来制备NaBiO3,可向滤液2中加入NaOH和NaClO溶液制取NaBiO3,写出该反应的离子方程式_______________。
(5)滤液2采用电解法制取金属铋单质,阳极产物处理后可继续循环使用,电解装置如图所示。
①交换膜类型为_______________(填“Cl-”或“OH-”)交换膜。
②阳极电极反应式为_______________。
参考答案
1.B
【详解】
A.由氧化性可知,反应可以发生,故不选A项;
B.由题意可知,氧化性,而B项中将Pb2+氧化为PbO2,与反应物的氧化性强于氧化产物的氧化性这一规律不符,反应不能发生,故选B项;
C.由氧化性可知,反应可以发生,故不选C项;
D.由氧化性可知,反应可以发生,故不选D项。
综上所述,本题正确答案为B。
2.D
【详解】
A.氯气具有毒性,主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,会对上呼吸道黏膜造成损害,故A正确;
B.Cl2为活泼非金属单质,具有强氧化性,故B正确;
C.常温常压下为黄绿色,有强烈刺激性气味的气体,故C正确;
D.纯净干燥的氯气无漂白性,不能使干燥的有色布条褪色,故D错误;
综上所述,不正确的是D项,故答案为D。
3.B
【详解】
A.Cl2的密度大于空气的密度,人应该向高处疏散,A错误;
B.漂白粉的主要成分为CaCl2、Ca(ClO)2,在酸性环境中,Cl-、ClO-发生氧化还原反应而产生氯气:Cl-+ClO-+2H+=Cl2↑+H2O,B正确;
C.浓NaOH有强腐蚀性,应洒生石灰,C错误;
D.漂白粉变质的过程中发生了如下反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO与2HClO2HCl+O2↑两个反应,D错误;
答案选B。
4.A
【详解】
A.根据反应2Fe+3Cl2 2FeCl3可知,不能由单质直接通过化合反应生成FeCl2,故A符合题意;
B.根据反应2Fe+3Cl22FeCl3可知,能直接由单质通过化合反应生成FeCl3,故B不符合题意;
C.根据反应Fe+SFeS可知,能直接由单质通过化合反应生成CuCl2,故C不符合题意;
D.根据反应2Cu+SCu2S可知,能直接由单质通过化合反应生成Cu2S,故D不符合题意;
答案选A。
5.B
【分析】
氧化剂得电子化合价降低,还原剂失电子化合价升高。
【详解】
A.反应2KI+Br2=2KBr+I2中,Br元素的化合价降低,Br2为氧化剂,I元素的化合价升高,KI为还原剂,A不符合题意;
B.反应2AgNO32Ag↓+2NO2↑+O2↑中,Ag、N元素的化合价降低,AgNO3为氧化剂,O元素的化合价升高,故AgNO3也是还原剂,B符合题意;
C.反应Cu2(OH)2CO32CuO+CO2↑+H2O中没有元素化合价的变化,不是氧化还原反应,C不符合题意;
D.反应C+H2OCO+H2中,C元素的化合价升高,C是还原剂,H的化合价降低,H2O是氧化剂,D不符合题意;
故选B。
6.C
【详解】
A.古法炼铁中金属元素的化合价降低,为氧化还原反应,故A不选;
B.化丹(Pb3O4)为铅,Pb元素化合价变化,为氧化还原反应,故B不选;
C.煅烧贝壳,是碳酸钙发生分解反应,没有发生氧化还原反应,故C选;
D.火药爆炸,属于剧烈的氧化还原反应,存在元素的化合价变化,故D不选。
故选C。
7.D
【详解】
A.二者均与NaOH反应,不能除杂,应选饱和食盐水、洗气,故A错误;
B.蒸干时NaHCO3分解,应冷却结晶法制备,故B错误;
C.溶液和胶体均能透过半透膜,应该用渗析的方法,故C错误;
D.碘不易溶于水,易溶于四氯化碳,且水的密度小在上层,则图中分层现象合理,故D正确;
故选D。
8.A
【分析】
氧化还原反应的特征是有化合价的升降,所以可以根据有无化合价的升降判断一个反应是否为氧化还原反应。
【详解】
A.在CaCO3+2HCl= CaCl2+CO2↑+H2O中,没有元素的化合价有变化,不属于氧化还原反应,故A选;
B.在Fe+CuSO4 =Cu+FeSO4中,铁元素的化合价升高,铜元素的化合价降低,属于氧化还原反应,故B不选;
C.在Fe2O3+3CO2Fe+3CO2中,铁元素的化合价降低,碳元素的化合价升高,属于氧化还原反应,故C不选;
D.在2Cl2+ 2Ca(OH)2=CaCl2 + Ca(C1O)2+2H2O中,氯元素的化合价既升高又降低,属于氧化还原反应,故D不选;
故选A。
9.C
【详解】
①发生装置正确,②除去HCl应用饱和食盐水,不能用NaOH溶液,③干燥装置中气体应从长管进短管出,④尾气处理要用饱和NaOH溶液,不能用澄清石灰水。故答案选择C。
10.D
【详解】
A.在反应CaCO3+2H+=Ca2++CO2↑+H2O中,元素化合价都没有发生变化,因此反应不属于氧化还原反应,A不符合题意;
B.在反应Fe2++2OH-=Fe(OH)2↓中,元素化合价都没有发生变化,因此反应不属于氧化还原反应,B不符合题意;
C.在反应+H+=CO2+H2O中,元素化合价都没有发生变化,因此反应不属于氧化还原反应,C不符合题意;
D.在反应2Na+2H2O=2Na++2OH+H2↑中,Na元素化合价升高,H元素化合价降低,有元素化合价的变化,因此反应属于氧化还原反应,D符合题意;
故合理选项是D。
11.B
【详解】
A. 12g 金刚石含有C-C共价键数为2NA,12g石墨物质的量为1mol,含有C-C键的数目为1.5NA,故A错误;
B. 在1L 0.1mol/L的碳酸钠溶液中,含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解,导致溶液中阴离子数目增多,所以溶液中阴离子总数大于0.1NA,故B正确;
C. 标准状况下,22.4L氯气溶于水形成的溶液中,氯气和水的反应是可逆反应,溶液中仍存在氯气分子,根据氯守恒:2c(Cl2)+n(Cl-)+n(ClO-)+n(HClO)=NA,故C错误;
D. 亚硫酸为弱酸,不能完全电离,故2L0.5mol·L-1溶液中的氢离子的个数小于2NA个,故D错误;
故选B。
12.D
【详解】略
13.B
【详解】
A.洗涤时为了洗净晶体,应让洗涤剂缓慢通过滤纸,让洗涤剂和晶体充分接触,故A错误;
B.纸层析法分离Cu2+、Fe3+时,点样时不能用玻璃棒,应用毛细管蘸取试样在原点轻轻点样,晾干后再点,重复3~5次,故B正确;
C.未燃过的火柴头中氯元素主要以氯酸钾形式存在,用硝酸银溶液不能检验;燃烧后氯元素以氯化物的形式存在,可以利用AgNO3溶液和稀硝酸检验氯离子,故C错误;
D.亚铁离子加热过程中易被氧化,小火加热蒸发皿,直到有大量晶体析出时停止加热,得不到硫酸亚铁铵晶体,故D错误;
故选B。
14.B
【详解】
A.在100 g溶质质量分数为36.5%的浓盐酸中含有溶质HCl的物质的量是1 mol,在浓盐酸中除溶质HCl中含有H原子,溶剂水中也含有H原子,故在100 g溶质质量分数为36.5%的浓盐酸中所含氢原子的数目大于NA,A错误;
B.5.85 g NaCl的物质的量是0.1 mol,在1个NaCl中含有电子数目是28个,则在0.1 mol的NaCl中所含的电子总数为2.8NA,B正确;
C.只有溶液浓度,缺少溶液体积,不能计算微粒数目,C错误;
D.在反应中每反应产生3 mol气体,转移2 mol电子。在常温常压下气体摩尔体积大于22.4 L/mol,则常温常压下,生成3.36 L气体的物质的量小于0.15 mol,转移电子物质的量小于,故转移电子数目小于0.1 NA,D错误;
故合理选项是B。
15.C
【详解】
A.硫酸铜不具有还原性,在空气中不能被氧化,故A错误;
B.Na2SiO3溶液与空气中的二氧化碳反应而变质,但是不属于氧化反应,故B错误;
C.硫酸亚铁中的二价铁离子具有强的还原性,能被空气中的氧气氧化生成三价铁而变质,故C正确;
D.氯化钠溶液能够稳定存在与空气中不变质,故D错误;
16.D
【详解】
A.氯气化学性质非常活泼,与变价金属反应时生成高价氯化物,,但是铜单质不能与稀盐酸反应,故A错误;
B.,但是铁单质与稀盐酸反应生成FeCl2,故B错误;
C.氯气化学性质非常活泼,与变价金属反应时生成高价氯化物,,铁单质与稀盐酸反应生成FeCl2,故C错误;
D.,铝单质与稀盐酸反应生成,故D正确;
故答案为D。
17. MnO2 酸性 还原性 盐酸浓度变稀,稀盐酸与MnO2不反应
【详解】
①MnO2生成氯化锰,锰元素降低两价,HCl(浓)生成氯气,氯元素升高两价,故MnO2与HCl(浓)加热反应用单线桥法表示电子转移方向和数量为,故答案为:;
②氧化剂为价态降低的反应物,MnO2锰元素价态降低,故MnO2为氧化剂,故答案为:MnO2;
③HCl在该反应中一部分价态不变生成氯化锰,体现酸性,一部分价态升高生成氯气,体现还原性,故HCl在该反应中体现的化学性质有酸性、还原性,故答案为:酸性、还原性;
④浓盐酸与MnO2反应生成Cl2的过程中,随着反应的进行,HCl不断被消耗,且部分HCl挥发,反应中有水生成,这些因素都导致盐酸浓度变稀,稀盐酸与MnO2不反应。故答案为:盐酸浓度变稀,稀盐酸与MnO2不反应。
18.KAl(SO4)2·12H2O Ca(ClO)2 玻璃、水泥、陶瓷、光导纤维等一种即可 2HClO===2HCl+O2↑ 3 2CaO·5MgO·8SiO2·H2O 保护FeSO4不被空气中的氧气氧化 SiO2+2CSi+2CO↑
【详解】
(1)明矾是KAl(SO4)2·12H2O,漂白粉的有效成分是Ca(ClO)2。硅是无机非金属材料的主角,常见含硅的材料有玻璃、水泥、陶瓷、光导纤维等。(2)①用少量氯气消毒的自来水养金鱼时,需要把水中的次氯酸分解掉,所以通常需要先将自来水晒一晒,反应的化学方程式为2HClO2HCl+O2↑。②根据氧原子守恒可知n=18-3-12=3;根据昆仑玉的化学式可知改写成氧化物形式为2CaO·5MgO·8SiO2·H2O。③亚铁盐易被氧化为铁盐,所以这层糖衣的作用是保护FeSO4不被空气中的氧气氧化;(3)工业上用石英制备粗硅的化学反应方程式为SiO2+2CSi+2CO↑。
点睛:注意掌握硅酸盐改写成氧化物形式的方法技巧:(1)氧化物的顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。(2)氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数。需要注意的是:①氧化物之间以“·”隔开;②系数配置出现分数应化为整数。
19.
(1) 3Cl2+6OH-5Cl-+ClO+3H2O 缓慢通入Cl2
(2) NaClO碱性溶液 减少水合肼的挥发
【分析】
步骤Ⅰ中是氯气和氢氧化钠水溶液反应生成次氯酸钠和氯化钠,步骤Ⅱ是次氯酸钠和尿素反应生成水合肼,再通过步骤Ⅲ分离出水合肼和无机盐,最终碳酸钠和二氧化硫生成亚硫酸钠。
(1)
Cl2与NaOH溶液反应生成NaClO3和NaCl,根据得失电子守恒,NaClO3和NaCl的物质的量比是1:5,反应的离子方程式是3Cl2+6OH-5Cl-+ClO+3H2O;实验中可以通过缓慢通入Cl2的方法控制温度;
(2)
步骤Ⅱ是尿素和次氯酸钠反应合成水合肼,由题给信息水合肼能与次氯酸钠剧烈反应,所以滴液漏斗中盛装的是次氯酸钠碱性溶液,由水合肼沸点约为118℃,题给实验反应温度为110℃,故使用冷凝管的目的是减少水合肼的挥发。
20.Bi2S3+6HCl+NaClO3=2BiCl3+NaCl+3S↓+3H2O S和SiO2 除去杂质Fe3+ Bi2O3或Bi(OH)3 Na++Bi3++C1O-+4OH-=NaBiO3↓+Cl-+2H2O Cl- Cl-+6OH--6e-=ClO3-+3H2O
【分析】
辉铋矿酸浸氧化后过滤,得到滤渣1为不溶于酸的二氧化硅和Bi2S3被氧化后生成的硫单质,滤液1中含有BiCl3、NaCl,FeCl3等,为了避免引入新杂质,则加入的除杂试剂可以是Bi2O3或Bi(OH)3,目的是调节pH使铁离子转化成氢氧化铁除去,滤液2中的主要成分为氯化钠和BiCl3,经电解得到铋单质。
【详解】
(1)酸浸氧化时Bi2S3被氧化成硫单质的化学方程式为Bi2S3+6HCl+NaClO3=2BiCl3+NaCl+3S↓+3H2O,故答案为:Bi2S3+6HCl+NaClO3=2BiCl3+NaCl+3S↓+3H2O;
(2)由分析知,滤渣1的成分为S和SiO2,故答案为:S和SiO2;
(3)由分析知,可用Bi2O3或Bi(OH)3调节pH使铁离子转化成氢氧化铁沉淀除去,故答案为:除去杂质Fe3+;Bi2O3或Bi(OH)3;
(4)滤液2中的主要成分为氯化钠和BiCl3,加入NaOH和NaClO溶液制取NaBiO3时发生反应的离子方程式为Na++Bi3++C1O-+4OH-=NaBiO3↓+Cl-+2H2O,故答案为:Na++Bi3++C1O-+4OH-=NaBiO3↓+Cl-+2H2O;
(5)①氯离子为阴离子,电解时,氯离子在阳极放电,氯离子移向阳极,则交换膜类型为Cl-交换膜,故答案为:Cl-;
②阳极电极附近氯离子放电转化为氯酸根,电极反应式为Cl-+6OH--6e-=ClO3-+3H2O,故答案为:Cl-+6OH--6e-=ClO3-+3H2O。
【点睛】
阳极阴离子放电或电极放电,失电子能力强先放电,若阳极是活泼金属(金属活动顺序表Ag以前),溶液中的阴离子一律不放电,而是电极材料失电子;若阳极是惰性(Pt、Au、石墨),则放电顺序为:S2->I->Br->Cl->OH->含氧酸根离子。
一、选择题(共16题)
1.已知氧化性强弱:。下列反应不可能发生的是
A.
B.
C.
D.
2.下列关于氯气性质描述不正确的是
A.氯气有毒 B.氯气有较强的氧化性
C.通常情况下,氯气是黄绿色的气体 D.纯净的氯气可使干燥的有色布条褪色
3.2008年5月29日上午,因连日下雨,雨水漏进北川县擂鼓镇一间存放消毒用漂白粉的屋子,屋内物质之间发生化学反应,冒出浓烟。据了解,由于风向比较复杂,整个营地的两千多人被紧急疏散。在排险过程中,有61名官兵因氯气中毒,被紧急送往医院救治。下列说法正确的是
A.人群应该向着低洼处紧急疏散
B.可能是漂白粉内的物质在一定条件下发生氧化还原反应而散发出氯气
C.紧急疏散人群的同时,应向散发氯气的地方喷洒氢氧化钠浓溶液
D.漂白粉若长时间放置在露天仓库中变质,其中只发生了一个化学反应
4.下列物质中,不能由单质通过化合反应得到的是
A.FeCl2 B.FeCl3 C.FeS D.Cu2S
5.下列反应中有一种物质既是氧化剂又是还原剂的是
A.2KI+Br2=2KBr+I2 B.2AgNO32Ag↓+2NO2↑+O2↑
C.Cu2(OH)2CO32CuO+CO2↑+H2O D.C+H2OCO+H2
6.下列古代技术的应用中,不涉及氧化还原反应的是
A.古法炼铁 B.化丹(Pb3O4)为铅 C.煅烧贝壳 D.火药爆炸
A.A B.B C.C D.D
7.用下列实验装置进行相应实验,能达到实验目的的是
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NaHCO3饱和溶液制备NaHCO3晶体
C.用图3所示装置除去Fe(OH)3胶体中的FeCl3
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
8.下列化学反应中,不属于氧化还原反应的是
A.CaCO3+2HCl= CaCl2+CO2↑+H2O B.Fe+CuSO4 =Cu+FeSO4
C.Fe2O3+3CO2Fe+3CO2 D.2Cl2+ 2Ca(OH)2=CaCl2 + Ca(C1O)2+2H2O
9.实验室利用如图所示装置制备氯气,图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是
A.①②③ B.①②④ C.②③④ D.①③④
10.属于氧化还原反应的离子方程式的是
A.CaCO3+2H+=Ca2++CO2↑+H2O
B.Fe2++2OH-=Fe(OH)2↓
C.+H+=CO2+H2O
D.2Na+2H2O=2Na++2OH+H2↑
11.用NA表示阿伏伽德罗常数,下列说法正确的是
A.12g金刚石与石墨所含的共价键数目均为2NA
B.1L0.1mol/LNa2CO3溶液中的阴离子总数大于0.1NA
C.标准状况下,22.4L氯气溶于水形成的溶液中:n(Cl-)+n(ClO-)+n(HClO)=NA
D.2L0.5mol·L-1亚硫酸溶液中含有的H+数为2NA
12.下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 向盐酸中滴入少量NaAlO2溶液 无明显现象 与H+未发生反应
B 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 HA放出的氢气多且 反应速率快 HA酸性比HB强
C 用激光笔照射鸡蛋蛋白水溶液 有丁达尔效应 鸡蛋蛋白分子直径小于lnm
D 向FeBr2溶液中加入少量氯水,再加CCl4振荡 CCl4层无色 Fe2+的还原性强于Br-
A.A B.B C.C D.D
13.下列说法正确的是
A.在抽滤装置中洗涤晶体时,为减少晶体溶解损失,应使洗涤剂快速通过滤纸
B.纸层析法分离Cu2+、Fe3+时,用毛细管蘸取试样在滤纸条的原点处轻轻点样,晾干后再点,重复3~5次
C.在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在
D.在“硫酸亚铁铵的制备”实验中,为得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
14.已知2NaClO3+ 4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,NA代表阿伏加德罗常数曲管值。下列说法正确的是
A.100 g溶质质量分数为36.5%的浓盐酸中所含氢原子的数目为NA
B.标准状况下,5.85 g NaCl中所含的电子总数为2.8NA
C.0.4 mol·L-1的NaClO3溶液中所含的阴、阳离子总数为0.8NA
D.常温常压下,每生成3.36 L气体转移的电子总数为0.1NA
15.下列溶液长期暴露在空气中会因氧化变质的是
A.CuSO4溶液 B.Na2SiO3溶液 C.FeSO4溶液 D.NaCl溶液
16.下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是
A.CuCl2 B.FeCl3 C.FeCl2 D.AlCl3
二、综合题(共4题)
17.请分析下列氧化还原反应,该反应为实验室用MnO2和浓盐酸(注意不是稀盐酸)反应制备Cl2
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
①用单线桥法表示出电子转移方向和数量___________。
②该反应的氧化剂是___________。
③HCl在该反应中体现的化学性质有___________、___________。
④实验测定,当MnO2足量时,无论如何控制条件,用含146gHCl的浓盐酸参与反应,得到的氯气始终小于71g,产生该现象的一个原因是HCl易挥发,另一个原因可能是___________
18.化学就在我们身边,它与我们的日常生活密切相关。按要求回答以下问题:
(1)明矾是__________________,漂白粉的有效成分是________(均填化学式)。硅是无机非金属材料的主角,请你举出一种含硅的材料名称________。
(2)①用少量氯气消毒的自来水养金鱼时,通常需要先将自来水晒一晒,其原因是___________(用化学方程式表示)。
②绿柱石(绿宝石)矿藏其主要化学成分为BenAl2Si6O18,可用氧化物形式表示为nBeO·Al2O3·6SiO2,其n值为_______; 北京奥运金牌“金镶玉”环形玉璧由昆仑玉制成,昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,将其化学式改写成氧化物形式为________________。
③缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是___________________。
(3)SiO2广泛存在于自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学反应方程式:_____________________。
19.以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如图:
已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为___;实验中控制温度除用冰水浴外,还需采取的措施是___。
(2)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是___;使用冷凝管的目的是___。
20.金属铋在自然界中的量极少,用途非常广泛,通常以辉铋矿为原料提取金属铋,工艺流程如图所示:
已知:①辉铋矿主要成分是Bi2S3,还含少量Bi2O3、SiO2、铁的氧化物和硫化物等。
②Bi2O3能溶于酸,NaBiO3不溶于水。
③常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Bi (OH)3]=4×10-30;Ksp[Fe(OH)2]=8.0×10-16;
回答下列问题:
(1)写出酸浸氧化时Bi2S3被氧化成硫单质的化学方程式_______________。
(2)滤渣1的成分为_______________。
(3)除杂剂的作用a.调节溶液pH,b_______________,写出一种能提高产物产量的除杂剂_______________。
(4)滤液2还可用来制备NaBiO3,可向滤液2中加入NaOH和NaClO溶液制取NaBiO3,写出该反应的离子方程式_______________。
(5)滤液2采用电解法制取金属铋单质,阳极产物处理后可继续循环使用,电解装置如图所示。
①交换膜类型为_______________(填“Cl-”或“OH-”)交换膜。
②阳极电极反应式为_______________。
参考答案
1.B
【详解】
A.由氧化性可知,反应可以发生,故不选A项;
B.由题意可知,氧化性,而B项中将Pb2+氧化为PbO2,与反应物的氧化性强于氧化产物的氧化性这一规律不符,反应不能发生,故选B项;
C.由氧化性可知,反应可以发生,故不选C项;
D.由氧化性可知,反应可以发生,故不选D项。
综上所述,本题正确答案为B。
2.D
【详解】
A.氯气具有毒性,主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,会对上呼吸道黏膜造成损害,故A正确;
B.Cl2为活泼非金属单质,具有强氧化性,故B正确;
C.常温常压下为黄绿色,有强烈刺激性气味的气体,故C正确;
D.纯净干燥的氯气无漂白性,不能使干燥的有色布条褪色,故D错误;
综上所述,不正确的是D项,故答案为D。
3.B
【详解】
A.Cl2的密度大于空气的密度,人应该向高处疏散,A错误;
B.漂白粉的主要成分为CaCl2、Ca(ClO)2,在酸性环境中,Cl-、ClO-发生氧化还原反应而产生氯气:Cl-+ClO-+2H+=Cl2↑+H2O,B正确;
C.浓NaOH有强腐蚀性,应洒生石灰,C错误;
D.漂白粉变质的过程中发生了如下反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO与2HClO2HCl+O2↑两个反应,D错误;
答案选B。
4.A
【详解】
A.根据反应2Fe+3Cl2 2FeCl3可知,不能由单质直接通过化合反应生成FeCl2,故A符合题意;
B.根据反应2Fe+3Cl22FeCl3可知,能直接由单质通过化合反应生成FeCl3,故B不符合题意;
C.根据反应Fe+SFeS可知,能直接由单质通过化合反应生成CuCl2,故C不符合题意;
D.根据反应2Cu+SCu2S可知,能直接由单质通过化合反应生成Cu2S,故D不符合题意;
答案选A。
5.B
【分析】
氧化剂得电子化合价降低,还原剂失电子化合价升高。
【详解】
A.反应2KI+Br2=2KBr+I2中,Br元素的化合价降低,Br2为氧化剂,I元素的化合价升高,KI为还原剂,A不符合题意;
B.反应2AgNO32Ag↓+2NO2↑+O2↑中,Ag、N元素的化合价降低,AgNO3为氧化剂,O元素的化合价升高,故AgNO3也是还原剂,B符合题意;
C.反应Cu2(OH)2CO32CuO+CO2↑+H2O中没有元素化合价的变化,不是氧化还原反应,C不符合题意;
D.反应C+H2OCO+H2中,C元素的化合价升高,C是还原剂,H的化合价降低,H2O是氧化剂,D不符合题意;
故选B。
6.C
【详解】
A.古法炼铁中金属元素的化合价降低,为氧化还原反应,故A不选;
B.化丹(Pb3O4)为铅,Pb元素化合价变化,为氧化还原反应,故B不选;
C.煅烧贝壳,是碳酸钙发生分解反应,没有发生氧化还原反应,故C选;
D.火药爆炸,属于剧烈的氧化还原反应,存在元素的化合价变化,故D不选。
故选C。
7.D
【详解】
A.二者均与NaOH反应,不能除杂,应选饱和食盐水、洗气,故A错误;
B.蒸干时NaHCO3分解,应冷却结晶法制备,故B错误;
C.溶液和胶体均能透过半透膜,应该用渗析的方法,故C错误;
D.碘不易溶于水,易溶于四氯化碳,且水的密度小在上层,则图中分层现象合理,故D正确;
故选D。
8.A
【分析】
氧化还原反应的特征是有化合价的升降,所以可以根据有无化合价的升降判断一个反应是否为氧化还原反应。
【详解】
A.在CaCO3+2HCl= CaCl2+CO2↑+H2O中,没有元素的化合价有变化,不属于氧化还原反应,故A选;
B.在Fe+CuSO4 =Cu+FeSO4中,铁元素的化合价升高,铜元素的化合价降低,属于氧化还原反应,故B不选;
C.在Fe2O3+3CO2Fe+3CO2中,铁元素的化合价降低,碳元素的化合价升高,属于氧化还原反应,故C不选;
D.在2Cl2+ 2Ca(OH)2=CaCl2 + Ca(C1O)2+2H2O中,氯元素的化合价既升高又降低,属于氧化还原反应,故D不选;
故选A。
9.C
【详解】
①发生装置正确,②除去HCl应用饱和食盐水,不能用NaOH溶液,③干燥装置中气体应从长管进短管出,④尾气处理要用饱和NaOH溶液,不能用澄清石灰水。故答案选择C。
10.D
【详解】
A.在反应CaCO3+2H+=Ca2++CO2↑+H2O中,元素化合价都没有发生变化,因此反应不属于氧化还原反应,A不符合题意;
B.在反应Fe2++2OH-=Fe(OH)2↓中,元素化合价都没有发生变化,因此反应不属于氧化还原反应,B不符合题意;
C.在反应+H+=CO2+H2O中,元素化合价都没有发生变化,因此反应不属于氧化还原反应,C不符合题意;
D.在反应2Na+2H2O=2Na++2OH+H2↑中,Na元素化合价升高,H元素化合价降低,有元素化合价的变化,因此反应属于氧化还原反应,D符合题意;
故合理选项是D。
11.B
【详解】
A. 12g 金刚石含有C-C共价键数为2NA,12g石墨物质的量为1mol,含有C-C键的数目为1.5NA,故A错误;
B. 在1L 0.1mol/L的碳酸钠溶液中,含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解,导致溶液中阴离子数目增多,所以溶液中阴离子总数大于0.1NA,故B正确;
C. 标准状况下,22.4L氯气溶于水形成的溶液中,氯气和水的反应是可逆反应,溶液中仍存在氯气分子,根据氯守恒:2c(Cl2)+n(Cl-)+n(ClO-)+n(HClO)=NA,故C错误;
D. 亚硫酸为弱酸,不能完全电离,故2L0.5mol·L-1溶液中的氢离子的个数小于2NA个,故D错误;
故选B。
12.D
【详解】略
13.B
【详解】
A.洗涤时为了洗净晶体,应让洗涤剂缓慢通过滤纸,让洗涤剂和晶体充分接触,故A错误;
B.纸层析法分离Cu2+、Fe3+时,点样时不能用玻璃棒,应用毛细管蘸取试样在原点轻轻点样,晾干后再点,重复3~5次,故B正确;
C.未燃过的火柴头中氯元素主要以氯酸钾形式存在,用硝酸银溶液不能检验;燃烧后氯元素以氯化物的形式存在,可以利用AgNO3溶液和稀硝酸检验氯离子,故C错误;
D.亚铁离子加热过程中易被氧化,小火加热蒸发皿,直到有大量晶体析出时停止加热,得不到硫酸亚铁铵晶体,故D错误;
故选B。
14.B
【详解】
A.在100 g溶质质量分数为36.5%的浓盐酸中含有溶质HCl的物质的量是1 mol,在浓盐酸中除溶质HCl中含有H原子,溶剂水中也含有H原子,故在100 g溶质质量分数为36.5%的浓盐酸中所含氢原子的数目大于NA,A错误;
B.5.85 g NaCl的物质的量是0.1 mol,在1个NaCl中含有电子数目是28个,则在0.1 mol的NaCl中所含的电子总数为2.8NA,B正确;
C.只有溶液浓度,缺少溶液体积,不能计算微粒数目,C错误;
D.在反应中每反应产生3 mol气体,转移2 mol电子。在常温常压下气体摩尔体积大于22.4 L/mol,则常温常压下,生成3.36 L气体的物质的量小于0.15 mol,转移电子物质的量小于,故转移电子数目小于0.1 NA,D错误;
故合理选项是B。
15.C
【详解】
A.硫酸铜不具有还原性,在空气中不能被氧化,故A错误;
B.Na2SiO3溶液与空气中的二氧化碳反应而变质,但是不属于氧化反应,故B错误;
C.硫酸亚铁中的二价铁离子具有强的还原性,能被空气中的氧气氧化生成三价铁而变质,故C正确;
D.氯化钠溶液能够稳定存在与空气中不变质,故D错误;
16.D
【详解】
A.氯气化学性质非常活泼,与变价金属反应时生成高价氯化物,,但是铜单质不能与稀盐酸反应,故A错误;
B.,但是铁单质与稀盐酸反应生成FeCl2,故B错误;
C.氯气化学性质非常活泼,与变价金属反应时生成高价氯化物,,铁单质与稀盐酸反应生成FeCl2,故C错误;
D.,铝单质与稀盐酸反应生成,故D正确;
故答案为D。
17. MnO2 酸性 还原性 盐酸浓度变稀,稀盐酸与MnO2不反应
【详解】
①MnO2生成氯化锰,锰元素降低两价,HCl(浓)生成氯气,氯元素升高两价,故MnO2与HCl(浓)加热反应用单线桥法表示电子转移方向和数量为,故答案为:;
②氧化剂为价态降低的反应物,MnO2锰元素价态降低,故MnO2为氧化剂,故答案为:MnO2;
③HCl在该反应中一部分价态不变生成氯化锰,体现酸性,一部分价态升高生成氯气,体现还原性,故HCl在该反应中体现的化学性质有酸性、还原性,故答案为:酸性、还原性;
④浓盐酸与MnO2反应生成Cl2的过程中,随着反应的进行,HCl不断被消耗,且部分HCl挥发,反应中有水生成,这些因素都导致盐酸浓度变稀,稀盐酸与MnO2不反应。故答案为:盐酸浓度变稀,稀盐酸与MnO2不反应。
18.KAl(SO4)2·12H2O Ca(ClO)2 玻璃、水泥、陶瓷、光导纤维等一种即可 2HClO===2HCl+O2↑ 3 2CaO·5MgO·8SiO2·H2O 保护FeSO4不被空气中的氧气氧化 SiO2+2CSi+2CO↑
【详解】
(1)明矾是KAl(SO4)2·12H2O,漂白粉的有效成分是Ca(ClO)2。硅是无机非金属材料的主角,常见含硅的材料有玻璃、水泥、陶瓷、光导纤维等。(2)①用少量氯气消毒的自来水养金鱼时,需要把水中的次氯酸分解掉,所以通常需要先将自来水晒一晒,反应的化学方程式为2HClO2HCl+O2↑。②根据氧原子守恒可知n=18-3-12=3;根据昆仑玉的化学式可知改写成氧化物形式为2CaO·5MgO·8SiO2·H2O。③亚铁盐易被氧化为铁盐,所以这层糖衣的作用是保护FeSO4不被空气中的氧气氧化;(3)工业上用石英制备粗硅的化学反应方程式为SiO2+2CSi+2CO↑。
点睛:注意掌握硅酸盐改写成氧化物形式的方法技巧:(1)氧化物的顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。(2)氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数。需要注意的是:①氧化物之间以“·”隔开;②系数配置出现分数应化为整数。
19.
(1) 3Cl2+6OH-5Cl-+ClO+3H2O 缓慢通入Cl2
(2) NaClO碱性溶液 减少水合肼的挥发
【分析】
步骤Ⅰ中是氯气和氢氧化钠水溶液反应生成次氯酸钠和氯化钠,步骤Ⅱ是次氯酸钠和尿素反应生成水合肼,再通过步骤Ⅲ分离出水合肼和无机盐,最终碳酸钠和二氧化硫生成亚硫酸钠。
(1)
Cl2与NaOH溶液反应生成NaClO3和NaCl,根据得失电子守恒,NaClO3和NaCl的物质的量比是1:5,反应的离子方程式是3Cl2+6OH-5Cl-+ClO+3H2O;实验中可以通过缓慢通入Cl2的方法控制温度;
(2)
步骤Ⅱ是尿素和次氯酸钠反应合成水合肼,由题给信息水合肼能与次氯酸钠剧烈反应,所以滴液漏斗中盛装的是次氯酸钠碱性溶液,由水合肼沸点约为118℃,题给实验反应温度为110℃,故使用冷凝管的目的是减少水合肼的挥发。
20.Bi2S3+6HCl+NaClO3=2BiCl3+NaCl+3S↓+3H2O S和SiO2 除去杂质Fe3+ Bi2O3或Bi(OH)3 Na++Bi3++C1O-+4OH-=NaBiO3↓+Cl-+2H2O Cl- Cl-+6OH--6e-=ClO3-+3H2O
【分析】
辉铋矿酸浸氧化后过滤,得到滤渣1为不溶于酸的二氧化硅和Bi2S3被氧化后生成的硫单质,滤液1中含有BiCl3、NaCl,FeCl3等,为了避免引入新杂质,则加入的除杂试剂可以是Bi2O3或Bi(OH)3,目的是调节pH使铁离子转化成氢氧化铁除去,滤液2中的主要成分为氯化钠和BiCl3,经电解得到铋单质。
【详解】
(1)酸浸氧化时Bi2S3被氧化成硫单质的化学方程式为Bi2S3+6HCl+NaClO3=2BiCl3+NaCl+3S↓+3H2O,故答案为:Bi2S3+6HCl+NaClO3=2BiCl3+NaCl+3S↓+3H2O;
(2)由分析知,滤渣1的成分为S和SiO2,故答案为:S和SiO2;
(3)由分析知,可用Bi2O3或Bi(OH)3调节pH使铁离子转化成氢氧化铁沉淀除去,故答案为:除去杂质Fe3+;Bi2O3或Bi(OH)3;
(4)滤液2中的主要成分为氯化钠和BiCl3,加入NaOH和NaClO溶液制取NaBiO3时发生反应的离子方程式为Na++Bi3++C1O-+4OH-=NaBiO3↓+Cl-+2H2O,故答案为:Na++Bi3++C1O-+4OH-=NaBiO3↓+Cl-+2H2O;
(5)①氯离子为阴离子,电解时,氯离子在阳极放电,氯离子移向阳极,则交换膜类型为Cl-交换膜,故答案为:Cl-;
②阳极电极附近氯离子放电转化为氯酸根,电极反应式为Cl-+6OH--6e-=ClO3-+3H2O,故答案为:Cl-+6OH--6e-=ClO3-+3H2O。
【点睛】
阳极阴离子放电或电极放电,失电子能力强先放电,若阳极是活泼金属(金属活动顺序表Ag以前),溶液中的阴离子一律不放电,而是电极材料失电子;若阳极是惰性(Pt、Au、石墨),则放电顺序为:S2->I->Br->Cl->OH->含氧酸根离子。
