2.5.3 物质的转化(课件17页+练习+视频素材)
文档属性
| 名称 | 2.5.3 物质的转化(课件17页+练习+视频素材) |  | |
| 格式 | pptx | ||
| 文件大小 | 28.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-20 09:23:48 | ||
图片预览





文档简介
(共17张PPT)
物质的转化
第三课时
浙教版 九年级上
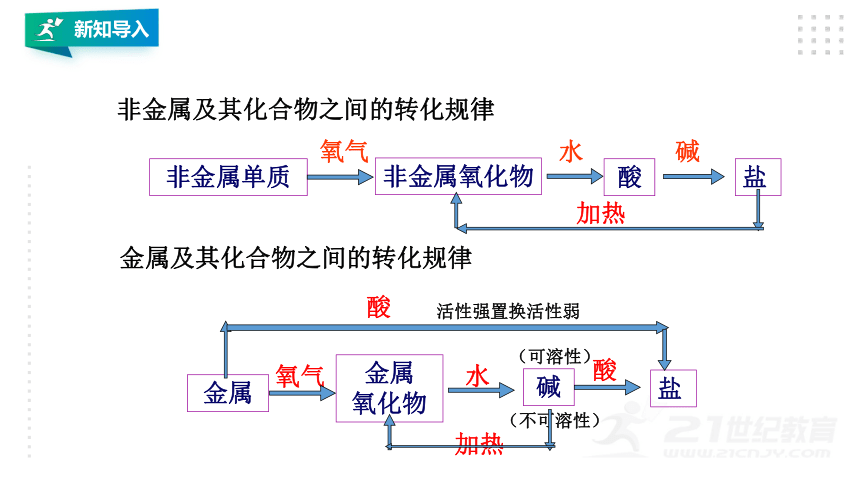
新知导入
非金属及其化合物之间的转化规律
金属及其化合物之间的转化规律
非金属单质
非金属氧化物
酸
氧气
水
盐
碱
加热
氧气
水
酸
酸
(可溶性)
金属
金属
氧化物
碱
盐
活性强置换活性弱
(不可溶性)
加热
新知讲解
赤铁矿
方铅矿
孔雀石
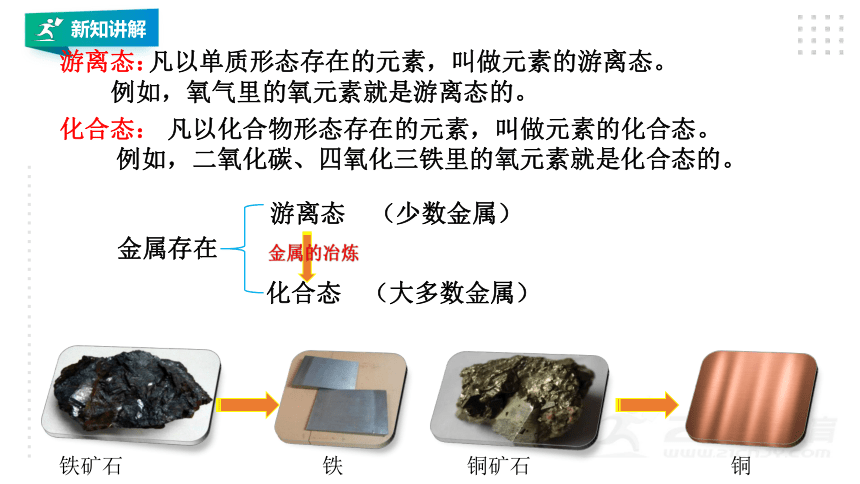
自然界中,大多数金属是以化合态的形式存在的
黄金矿
银矿
铂金属
仅有少数金属以游离态(即单质)的形式存在
新知讲解
金属存在
游离态
(少数金属)
化合态
(大多数金属)
凡以单质形态存在的元素,叫做元素的游离态。
例如,氧气里的氧元素就是游离态的。
凡以化合物形态存在的元素,叫做元素的化合态。
例如,二氧化碳、四氧化三铁里的氧元素就是化合态的。
化合态:
游离态:
铁矿石
铜矿石
铁
铜
金属的冶炼
新知讲解
1.观察氧化铜的颜色:______ 。
2.在一支试管中加入少量氧化铜, 通入氢气,过一会儿, 再给氧化铜加热,注意观察试管中的氧 化铜有什么变化。
3.反应完成后停止加热,继续通入 氢气,直到试管冷却。试管中氧化铜与 氢气反应的化学方程式为:____________ ___________。
H2 + CuO = Cu + H2O
Δ
黑色粉末
黑色粉末变红,试管口有水珠.
注意事项:
1.通氢气的导管,要伸入到试管的底部.
2.放氧化铜的试管口略向下倾斜,防止水倒流,使试管炸裂.
3.先通氢气后加热。
4.实验完成后先停止加热,后停止通氢气,防止氢气与氧气在试管中反应,引起试管爆裂
5.氢气与一氧化碳都是可燃性气体,做实验前需对气体验纯,防止发生爆炸
氢气还原氧化铜
新知讲解
1.碳与氧化铜反应
①取活性炭粉和氧化铜少量均匀混合在一起,装入试管中。
②加热一段时间后,发现试管壁出现:______
③澄清石灰水变:_______,说明了___________________。
红色物质
变浑浊
产生的气体是二氧化碳
C + 2CuO = 2Cu + CO2↑
高温
由氧化铜制取铜,还可用其他什么方法?
一氧化碳还原氧化铜
CO+CuO Cu+CO2
△
2.一氧化碳与氧化铜反应
注意:一氧化碳有毒,不能直接排到空气中。
在导管口放酒精灯燃烧掉,或在导管口加气囊收集
铜在空气中加热很容易氧化变成氧化铜,在实验过程中要注意什么?
当黑色的氧化铜变成红色的铜后,停止加热,继续通入氢气,直到铜冷却至室温,防止红热的铜再次被空气中的氧气氧化。
新知讲解
1.还原反应
(1)还原反应
(2)还原性
(3)还原剂
含氧化合物里的氧被夺取的反应
CO+CuO Cu+CO2
△
CuO中的氧被C、H2、CO等夺取,CuO发生了还原反应
能从含氧化合物中夺取氧的性质
具有还原性的物质可做还原剂
C、H2、CO是常见的还原剂
2.置换法
H2 + CuO = Cu + H2O
Δ
C + 2CuO = 2Cu + CO2↑
高温
新知讲解
反应前后元素的化合价具有相应的升降变化的化学反应。
在反应过程中有元素化合价变化的化学反应叫做氧化还原反应。这种反应可以理解成由两个半反应构成,即氧化反应和还原反应。
氧化还原反应
反应实质
2.强弱律:反应中满足:氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物>氧化产物
3.价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
3CO + Fe2O3 === 2Fe + 3CO2
高温
+3
0
化合价降低
+2
+4
化合价升高
新知讲解
铁的使用非常广泛,但由于铁的化学性质比较活泼,所以地壳中的铁都是以化合物(铁矿石)的形式存在的。
怎样从铁矿石中提炼铁呢?
小组讨论
一氧化碳
氧化铁
石灰水
装置图:
原理:高温下,用还原剂(主要是一氧化碳)从铁矿石里把铁还原出来。
3CO+Fe2O3=2Fe+3CO2
高温
红色的固体逐渐变为黑色(铁粉),同时产生能使澄清石灰水变浑浊的气体
工业炼铁:
新知讲解
金属冶炼过程中有关纯度问题的计算
例题100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨
(85%,96%两个质量分数代表什么含义,你清楚吗?)
85%:铁矿中三氧化二铁占85%
96%:生铁中含铁96%
两者中铁的质量是相等
答:提炼出的生铁质量约为 62 吨。
x =62 吨
解:设可提炼出含铁的质量分数为 96% 的生铁的质量为 x。
3CO + Fe2O3 = 2Fe + 3CO2
160 112
100吨×85% x×96%
160∶112 =(100吨×85%)∶(x×96%)
新知讲解
以上解法是根据化学方程式进行计算。本题还可以根据什么求解?
化学式直接求解
m生铁= 59.5 吨 ÷96% ≈ 62 吨
答:提炼出的生铁质量约为 62 吨。
铁矿石中含 Fe2O3 的质量 mFe2O3 = 100 吨 ×85% = 85 吨
因为 Fe2O3 中含有 Fe 的质量为 mFe,
可得 2Fe ∶ Fe2O3 = mFe ∶ 85 吨
所以 mFe = 85 吨 × 2Fe / Fe2O3 = 85 吨 × 112 /160 = 59.5 吨
解:
课堂总结
常用方法:
(1)还原法
(2)置换法
还原反应:
含氧化合物里的氧被夺取的反应。
还原剂:
具有从含氧化合物里夺取氧的能力。
还原性:
具有还原性的物质
常用还原剂:
游离态
化合态
金属的冶炼
C、H2、CO是常见的还原剂
CO+CuO Cu+CO2
△
3CO+Fe2O3=2Fe+3CO2
高温
H2+CuO =Cu + H2O
Δ
C +2CuO = 2Cu +CO2↑
高温
课堂练习
2.工业炼铁中会发生一氧化碳与氧化铁的反应,该反应中发生还原反应的物质是( )
A.CO B.Fe2O3 C.CO2 D.Fe
B
1.在燃烧正旺的煤炉上滴水,炉火不仅不会熄灭,反而燃烧得更旺,原因是炽热的煤炭和水蒸气反应生成水煤气(主要成分是氢气和一氧化碳),水煤气又会燃烧,所以燃烧得更旺。请写出这一过程中涉及的所有反应的化学方程式:
(1)____________________;
(2)____________________________;
(3)____________________________ 。
C+H2O=CO+H2
高温
2CO+O2=2CO2
点燃
2H2+O2 =2H2O
点燃
课堂练习
3.某同学用如图所示装置进行CO与Fe2O3的反应。下列说法错误的是( )
A.该实验装置应增加尾气处理装置
B.加热前应先通入一段时间的CO以排尽装置内的空气
C.NaOH溶液应改为Ca(OH)2溶液以检验产生的CO2气体
D.反应后的固体是Fe和Fe2O3的混合物,可以采用加入盐酸并过滤的方法得到Fe
D
课堂练习
4.某煤厂向原煤中加入适量生石灰制成供居民取暖用的“环保煤”,以有效地减少二氧化硫的排放,削弱二氧化硫对空气的污染,燃烧时吸收二氧化硫的化学方程式为 2CaO + 2SO2 + O2 = 2CaSO4 。该煤厂现有含硫3.2%的原煤1000吨,问:
高温
(1)如果这些原煤不经过“加工处理”直接燃烧,硫完全转化为二氧化硫时,可生成二氧化硫多少吨?
(2)如果要将这些原煤全部制成合格的“环保煤”,理论上需要含氧化钙 98%的生石灰多少吨(计算结果保留1位小数)
(1)该煤厂现有含硫3.2%原煤1000t,硫完全转化为二氧化硫时,可生成二氧化硫的质量为1000t×3.2%/[32 /( 32+16×2)×100%]=64t.
(2)设理论上需含氧化钙98%的生石灰的质量为x,
2CaO + 2SO2 + O2 ═ 2CaSO4
112 128
98%x 64t
112/128=98%x64t x≈57.1t.
答:(1)可生成二氧化硫64t;(2)理论上需含氧化钙98%的生石灰57.1t
解:
https://www.21cnjy.com/help/help_extract.php
物质的转化
第三课时
浙教版 九年级上
新知导入
非金属及其化合物之间的转化规律
金属及其化合物之间的转化规律
非金属单质
非金属氧化物
酸
氧气
水
盐
碱
加热
氧气
水
酸
酸
(可溶性)
金属
金属
氧化物
碱
盐
活性强置换活性弱
(不可溶性)
加热
新知讲解
赤铁矿
方铅矿
孔雀石
自然界中,大多数金属是以化合态的形式存在的
黄金矿
银矿
铂金属
仅有少数金属以游离态(即单质)的形式存在
新知讲解
金属存在
游离态
(少数金属)
化合态
(大多数金属)
凡以单质形态存在的元素,叫做元素的游离态。
例如,氧气里的氧元素就是游离态的。
凡以化合物形态存在的元素,叫做元素的化合态。
例如,二氧化碳、四氧化三铁里的氧元素就是化合态的。
化合态:
游离态:
铁矿石
铜矿石
铁
铜
金属的冶炼
新知讲解
1.观察氧化铜的颜色:______ 。
2.在一支试管中加入少量氧化铜, 通入氢气,过一会儿, 再给氧化铜加热,注意观察试管中的氧 化铜有什么变化。
3.反应完成后停止加热,继续通入 氢气,直到试管冷却。试管中氧化铜与 氢气反应的化学方程式为:____________ ___________。
H2 + CuO = Cu + H2O
Δ
黑色粉末
黑色粉末变红,试管口有水珠.
注意事项:
1.通氢气的导管,要伸入到试管的底部.
2.放氧化铜的试管口略向下倾斜,防止水倒流,使试管炸裂.
3.先通氢气后加热。
4.实验完成后先停止加热,后停止通氢气,防止氢气与氧气在试管中反应,引起试管爆裂
5.氢气与一氧化碳都是可燃性气体,做实验前需对气体验纯,防止发生爆炸
氢气还原氧化铜
新知讲解
1.碳与氧化铜反应
①取活性炭粉和氧化铜少量均匀混合在一起,装入试管中。
②加热一段时间后,发现试管壁出现:______
③澄清石灰水变:_______,说明了___________________。
红色物质
变浑浊
产生的气体是二氧化碳
C + 2CuO = 2Cu + CO2↑
高温
由氧化铜制取铜,还可用其他什么方法?
一氧化碳还原氧化铜
CO+CuO Cu+CO2
△
2.一氧化碳与氧化铜反应
注意:一氧化碳有毒,不能直接排到空气中。
在导管口放酒精灯燃烧掉,或在导管口加气囊收集
铜在空气中加热很容易氧化变成氧化铜,在实验过程中要注意什么?
当黑色的氧化铜变成红色的铜后,停止加热,继续通入氢气,直到铜冷却至室温,防止红热的铜再次被空气中的氧气氧化。
新知讲解
1.还原反应
(1)还原反应
(2)还原性
(3)还原剂
含氧化合物里的氧被夺取的反应
CO+CuO Cu+CO2
△
CuO中的氧被C、H2、CO等夺取,CuO发生了还原反应
能从含氧化合物中夺取氧的性质
具有还原性的物质可做还原剂
C、H2、CO是常见的还原剂
2.置换法
H2 + CuO = Cu + H2O
Δ
C + 2CuO = 2Cu + CO2↑
高温
新知讲解
反应前后元素的化合价具有相应的升降变化的化学反应。
在反应过程中有元素化合价变化的化学反应叫做氧化还原反应。这种反应可以理解成由两个半反应构成,即氧化反应和还原反应。
氧化还原反应
反应实质
2.强弱律:反应中满足:氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物>氧化产物
3.价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
3CO + Fe2O3 === 2Fe + 3CO2
高温
+3
0
化合价降低
+2
+4
化合价升高
新知讲解
铁的使用非常广泛,但由于铁的化学性质比较活泼,所以地壳中的铁都是以化合物(铁矿石)的形式存在的。
怎样从铁矿石中提炼铁呢?
小组讨论
一氧化碳
氧化铁
石灰水
装置图:
原理:高温下,用还原剂(主要是一氧化碳)从铁矿石里把铁还原出来。
3CO+Fe2O3=2Fe+3CO2
高温
红色的固体逐渐变为黑色(铁粉),同时产生能使澄清石灰水变浑浊的气体
工业炼铁:
新知讲解
金属冶炼过程中有关纯度问题的计算
例题100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨
(85%,96%两个质量分数代表什么含义,你清楚吗?)
85%:铁矿中三氧化二铁占85%
96%:生铁中含铁96%
两者中铁的质量是相等
答:提炼出的生铁质量约为 62 吨。
x =62 吨
解:设可提炼出含铁的质量分数为 96% 的生铁的质量为 x。
3CO + Fe2O3 = 2Fe + 3CO2
160 112
100吨×85% x×96%
160∶112 =(100吨×85%)∶(x×96%)
新知讲解
以上解法是根据化学方程式进行计算。本题还可以根据什么求解?
化学式直接求解
m生铁= 59.5 吨 ÷96% ≈ 62 吨
答:提炼出的生铁质量约为 62 吨。
铁矿石中含 Fe2O3 的质量 mFe2O3 = 100 吨 ×85% = 85 吨
因为 Fe2O3 中含有 Fe 的质量为 mFe,
可得 2Fe ∶ Fe2O3 = mFe ∶ 85 吨
所以 mFe = 85 吨 × 2Fe / Fe2O3 = 85 吨 × 112 /160 = 59.5 吨
解:
课堂总结
常用方法:
(1)还原法
(2)置换法
还原反应:
含氧化合物里的氧被夺取的反应。
还原剂:
具有从含氧化合物里夺取氧的能力。
还原性:
具有还原性的物质
常用还原剂:
游离态
化合态
金属的冶炼
C、H2、CO是常见的还原剂
CO+CuO Cu+CO2
△
3CO+Fe2O3=2Fe+3CO2
高温
H2+CuO =Cu + H2O
Δ
C +2CuO = 2Cu +CO2↑
高温
课堂练习
2.工业炼铁中会发生一氧化碳与氧化铁的反应,该反应中发生还原反应的物质是( )
A.CO B.Fe2O3 C.CO2 D.Fe
B
1.在燃烧正旺的煤炉上滴水,炉火不仅不会熄灭,反而燃烧得更旺,原因是炽热的煤炭和水蒸气反应生成水煤气(主要成分是氢气和一氧化碳),水煤气又会燃烧,所以燃烧得更旺。请写出这一过程中涉及的所有反应的化学方程式:
(1)____________________;
(2)____________________________;
(3)____________________________ 。
C+H2O=CO+H2
高温
2CO+O2=2CO2
点燃
2H2+O2 =2H2O
点燃
课堂练习
3.某同学用如图所示装置进行CO与Fe2O3的反应。下列说法错误的是( )
A.该实验装置应增加尾气处理装置
B.加热前应先通入一段时间的CO以排尽装置内的空气
C.NaOH溶液应改为Ca(OH)2溶液以检验产生的CO2气体
D.反应后的固体是Fe和Fe2O3的混合物,可以采用加入盐酸并过滤的方法得到Fe
D
课堂练习
4.某煤厂向原煤中加入适量生石灰制成供居民取暖用的“环保煤”,以有效地减少二氧化硫的排放,削弱二氧化硫对空气的污染,燃烧时吸收二氧化硫的化学方程式为 2CaO + 2SO2 + O2 = 2CaSO4 。该煤厂现有含硫3.2%的原煤1000吨,问:
高温
(1)如果这些原煤不经过“加工处理”直接燃烧,硫完全转化为二氧化硫时,可生成二氧化硫多少吨?
(2)如果要将这些原煤全部制成合格的“环保煤”,理论上需要含氧化钙 98%的生石灰多少吨(计算结果保留1位小数)
(1)该煤厂现有含硫3.2%原煤1000t,硫完全转化为二氧化硫时,可生成二氧化硫的质量为1000t×3.2%/[32 /( 32+16×2)×100%]=64t.
(2)设理论上需含氧化钙98%的生石灰的质量为x,
2CaO + 2SO2 + O2 ═ 2CaSO4
112 128
98%x 64t
112/128=98%x64t x≈57.1t.
答:(1)可生成二氧化硫64t;(2)理论上需含氧化钙98%的生石灰57.1t
解:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
