原电池工作原理
图片预览



文档简介
(共18张PPT)
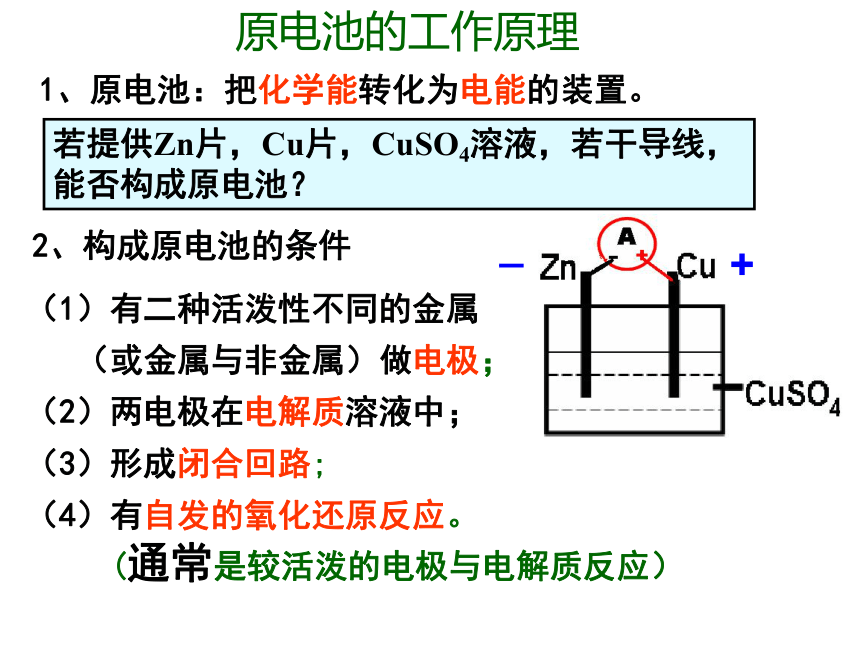
若提供Zn片,Cu片,CuSO4溶液,若干导线,
能否构成原电池?
原电池的工作原理
1、原电池:把化学能转化为电能的装置。
(1)有二种活泼性不同的金属
(或金属与非金属)做电极;
(2)两电极在电解质溶液中;
(3)形成闭合回路;
(4)有自发的氧化还原反应。
(通常是较活泼的电极与电解质反应)
2、构成原电池的条件
_
+
请你结合所给资料分析:电池工作产生电流时,发生的化学反应有什么共同特点?
Zn+2MnO2+2NH4+==Zn2++Mn2O3
+2NH3+H2O
2H2 + O2== 2H2O
Pb+PbO2+2H2SO4==2PbSO4+2H2O
干电池
氢
氧
燃
料
电
池
铅蓄电池
H2 + Cl2== 2HCl
自制电池
请你以反应H2 + Cl2== 2HCl为例分析,为什么只有通过氧化还原反应才能将化学能直接转化成电能?
H2 + Cl2== 2HCl
得电子
失电子
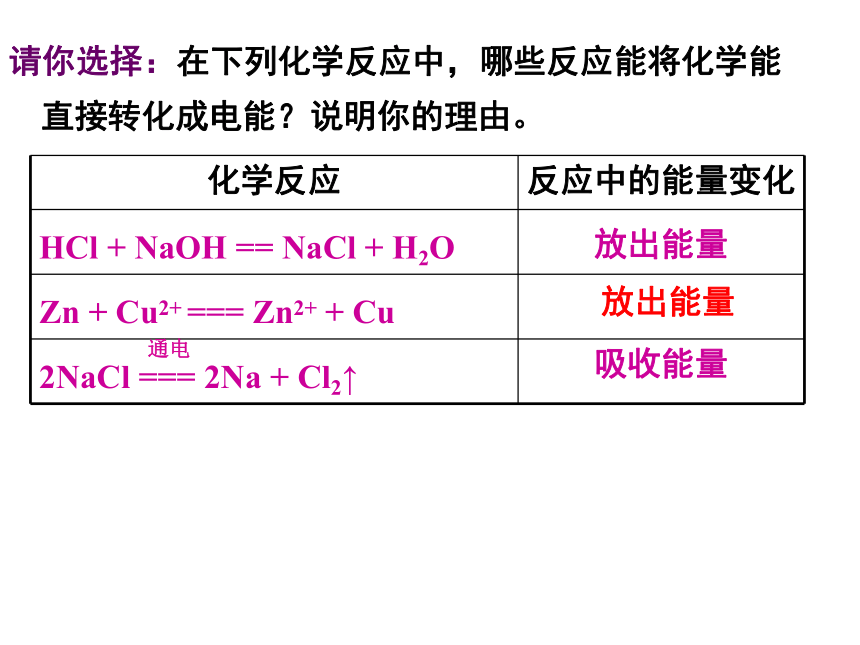
请你选择:在下列化学反应中,哪些反应能将化学能直接转化成电能?说明你的理由。
化学反应 反应中的能量变化
HCl + NaOH == NaCl + H2O 放出能量
Zn + Cu2+ === Zn2+ + Cu
2NaCl === 2Na + Cl2↑ 吸收能量
通电
放出能量
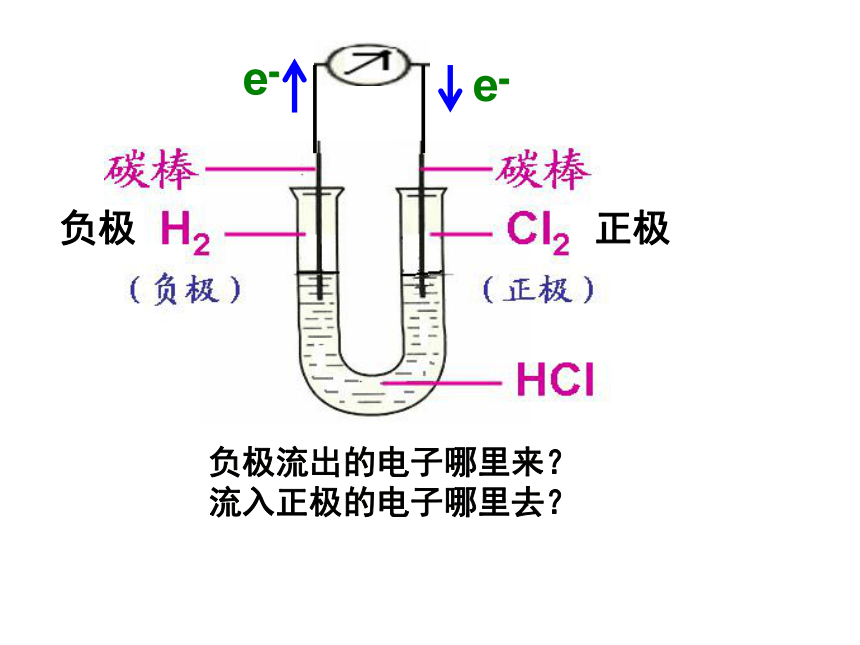
负极
正极
e-
e-
负极流出的电子哪里来?
流入正极的电子哪里去?
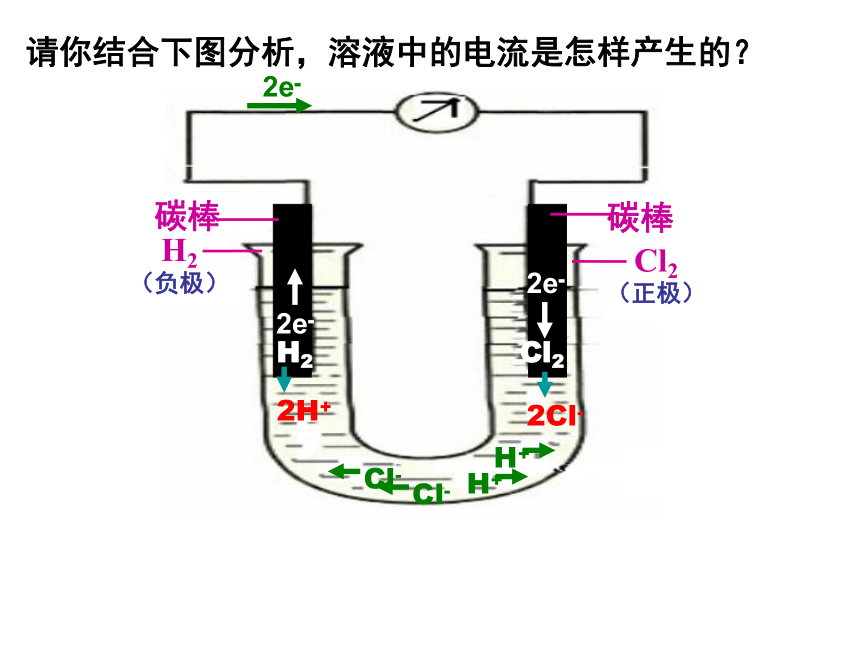
请你结合下图分析,溶液中的电流是怎样产生的?
H2
Cl2
2H+
2Cl-
Cl-
Cl-
H+
H+
碳棒
碳棒
H2
(负极)
Cl2
(正极)
2e-
2e-
2e-
电池 正极 负极 电解质溶液 工作时发生的化学反应
锌-锰
干电池
MnO2
(石墨棒)
锌片
氯化铵
Zn+2MnO2+2NH4+==Zn2++
Mn2O3+2NH3+H2O
铅蓄电池
PbO2
Pb
硫酸
Pb+PbO2+2H2SO4==2PbSO4+2H2O
氢氧
燃料
电池
O2(石墨)
H2
(石墨)
氢氧化钾
2H2 + O2== 2H2O
原电池的工作原理
A
锌
e-
e-
—
铜
SO42-
Cu2+
SO42-
Cu2+
Cu2+
Zn2+
Cu2+
Cu2+
SO42-
CuSO4溶液
Cu2+
SO42-
e-
e-
e-
e-
+
思考与讨论
该电池的电子流向?
电极反应?
原电池的工作原理
原理分析:
负极:
正极:
电极反应
Zn-2e- = Zn2+
Cu2++2e- = Cu
锌片失去电子,铜离子得到电子,两极之间溶液离子的定向移动和外部导线中电子的定向移动,构成闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流。
总反应:Zn+ Cu2+ = Zn2+ + Cu
氧化反应
还原反应
为避免Zn与CuSO4溶液直接接触而造成部分电子
无法也通过导线导出,如何改进?
ZnSO4
盐桥
原电池的工作原理
盐桥的作用:使Cl-向锌盐方向移动,K+向铜盐方向移动,使锌盐和铜盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极,氧化还原反应得以继续进行,使电流持续传导。
Zn-2e-=Zn2+
Cu2++2e- = Cu
总反应:Zn+ Cu2+ = Zn2+ + Cu
原电池的氧化反应和还原反应分别在两个电极上进行。
半电池:
包括电极材料和电解质溶液。
与合并的原电池反应本质
相同
原电池的工作原理:
原电池由两个半电池组成,
半电池包括电极材料和电解质溶液,
两个隔离的半电池用盐桥相连。
原电池中,
负极上还原剂发生氧化反应,失去电子;
正极上氧化剂发生还原反应,得到电子。
电子流向:
电流流向:
离子的流向:
正极流向负极
负极流向正极
阳离子移向正极,
阴离子移向负极。
外电路
电解质溶液
根据离子反应
Fe+ Cu2+ =Fe2++ Cu
设计一个能产生稳定电流的原电池,画出示意图,
标出电极材料,电解质溶液,写出电极反应式。
正极:
负极:
总反应:
Fe-2e - =Fe2+
Cu2+ +2e- = Cu
Fe+ Cu2+ =Fe2++ Cu
活动与探究:
Fe
FeSO4
C
FeCl2
CuCl2
将原电池反应中的氧化反应与
还原反应分开在两个不同区域内进行,
再以适当的方式连接起来,从而获得
了稳定持续的电流。
原电池的设计思路
(1)以自发进行的氧化还原反应为基础
(2)把氧化还原反应分解为氧化反应和还原反应
两个半反应,从而确定电极反应
(3)根据两极反应,确定电极材料及电解质溶液
(4)画出装置简图
一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
C
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
快速判断
1.(08广东卷)用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B.②③ C.②④ D.③④
C
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,构造如图;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)总方程式: ,
(2) a极是 极,
b极是 极,
(3)电极反应式分别为
,
拓展提升
负
正
负极:2H2-4e-=4H+
正极: O2+ 4H+ +4e-=2H2O
H2SO4溶液
2H2+O2 =2H2O
正极: O2+ 2H2O +4e-= 4OH-
a
b
若提供Zn片,Cu片,CuSO4溶液,若干导线,
能否构成原电池?
原电池的工作原理
1、原电池:把化学能转化为电能的装置。
(1)有二种活泼性不同的金属
(或金属与非金属)做电极;
(2)两电极在电解质溶液中;
(3)形成闭合回路;
(4)有自发的氧化还原反应。
(通常是较活泼的电极与电解质反应)
2、构成原电池的条件
_
+
请你结合所给资料分析:电池工作产生电流时,发生的化学反应有什么共同特点?
Zn+2MnO2+2NH4+==Zn2++Mn2O3
+2NH3+H2O
2H2 + O2== 2H2O
Pb+PbO2+2H2SO4==2PbSO4+2H2O
干电池
氢
氧
燃
料
电
池
铅蓄电池
H2 + Cl2== 2HCl
自制电池
请你以反应H2 + Cl2== 2HCl为例分析,为什么只有通过氧化还原反应才能将化学能直接转化成电能?
H2 + Cl2== 2HCl
得电子
失电子
请你选择:在下列化学反应中,哪些反应能将化学能直接转化成电能?说明你的理由。
化学反应 反应中的能量变化
HCl + NaOH == NaCl + H2O 放出能量
Zn + Cu2+ === Zn2+ + Cu
2NaCl === 2Na + Cl2↑ 吸收能量
通电
放出能量
负极
正极
e-
e-
负极流出的电子哪里来?
流入正极的电子哪里去?
请你结合下图分析,溶液中的电流是怎样产生的?
H2
Cl2
2H+
2Cl-
Cl-
Cl-
H+
H+
碳棒
碳棒
H2
(负极)
Cl2
(正极)
2e-
2e-
2e-
电池 正极 负极 电解质溶液 工作时发生的化学反应
锌-锰
干电池
MnO2
(石墨棒)
锌片
氯化铵
Zn+2MnO2+2NH4+==Zn2++
Mn2O3+2NH3+H2O
铅蓄电池
PbO2
Pb
硫酸
Pb+PbO2+2H2SO4==2PbSO4+2H2O
氢氧
燃料
电池
O2(石墨)
H2
(石墨)
氢氧化钾
2H2 + O2== 2H2O
原电池的工作原理
A
锌
e-
e-
—
铜
SO42-
Cu2+
SO42-
Cu2+
Cu2+
Zn2+
Cu2+
Cu2+
SO42-
CuSO4溶液
Cu2+
SO42-
e-
e-
e-
e-
+
思考与讨论
该电池的电子流向?
电极反应?
原电池的工作原理
原理分析:
负极:
正极:
电极反应
Zn-2e- = Zn2+
Cu2++2e- = Cu
锌片失去电子,铜离子得到电子,两极之间溶液离子的定向移动和外部导线中电子的定向移动,构成闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流。
总反应:Zn+ Cu2+ = Zn2+ + Cu
氧化反应
还原反应
为避免Zn与CuSO4溶液直接接触而造成部分电子
无法也通过导线导出,如何改进?
ZnSO4
盐桥
原电池的工作原理
盐桥的作用:使Cl-向锌盐方向移动,K+向铜盐方向移动,使锌盐和铜盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极,氧化还原反应得以继续进行,使电流持续传导。
Zn-2e-=Zn2+
Cu2++2e- = Cu
总反应:Zn+ Cu2+ = Zn2+ + Cu
原电池的氧化反应和还原反应分别在两个电极上进行。
半电池:
包括电极材料和电解质溶液。
与合并的原电池反应本质
相同
原电池的工作原理:
原电池由两个半电池组成,
半电池包括电极材料和电解质溶液,
两个隔离的半电池用盐桥相连。
原电池中,
负极上还原剂发生氧化反应,失去电子;
正极上氧化剂发生还原反应,得到电子。
电子流向:
电流流向:
离子的流向:
正极流向负极
负极流向正极
阳离子移向正极,
阴离子移向负极。
外电路
电解质溶液
根据离子反应
Fe+ Cu2+ =Fe2++ Cu
设计一个能产生稳定电流的原电池,画出示意图,
标出电极材料,电解质溶液,写出电极反应式。
正极:
负极:
总反应:
Fe-2e - =Fe2+
Cu2+ +2e- = Cu
Fe+ Cu2+ =Fe2++ Cu
活动与探究:
Fe
FeSO4
C
FeCl2
CuCl2
将原电池反应中的氧化反应与
还原反应分开在两个不同区域内进行,
再以适当的方式连接起来,从而获得
了稳定持续的电流。
原电池的设计思路
(1)以自发进行的氧化还原反应为基础
(2)把氧化还原反应分解为氧化反应和还原反应
两个半反应,从而确定电极反应
(3)根据两极反应,确定电极材料及电解质溶液
(4)画出装置简图
一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
C
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
快速判断
1.(08广东卷)用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B.②③ C.②④ D.③④
C
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,构造如图;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)总方程式: ,
(2) a极是 极,
b极是 极,
(3)电极反应式分别为
,
拓展提升
负
正
负极:2H2-4e-=4H+
正极: O2+ 4H+ +4e-=2H2O
H2SO4溶液
2H2+O2 =2H2O
正极: O2+ 2H2O +4e-= 4OH-
a
b
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
