6.1构成物质的微粒(课件 15PPT)
文档属性
| 名称 | 6.1构成物质的微粒(课件 15PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 771.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-20 18:47:47 | ||
图片预览





文档简介
(共15张PPT)
构成物质的微粒
1、通过举例说明由不同微粒构成的物质很多,从物质的组成上认识微粒,形成大千世界都是由微粒——分子、原子、离子构成的意识。
2、通过构成物质的微粒的分析,掌握分子、原子、离子微粒间的联系与区别,能运用微粒的观点解释一些常见的宏观现象。
3、通过对不同微粒构成的物质的化学性质的分析,树立物质的化学性质是由构成物质的微粒决定的观念。
4、通过典型化学反应的微观实质分析,认识到电子在化学反应中的作用,理解化学变化的本质。
复习目标
问题一:微粒的共同点
1、都能构成物质
2、都很小,都在不断运动,有间隔,微粒之间有相互作用力
(微粒的性质)
欣赏动画:氯化钠在水中溶解的过程
举例说明?
构成物质的微粒
举例说明?
问题二:微粒的不同点
1、在化学变化中,分子可分,原子不可分
(原子是化学变化中的最小微粒)
2、分子、原子不带电,离子带电
3、分子是保持化学性质的最小微粒。
构成物质的微粒
举例说明?
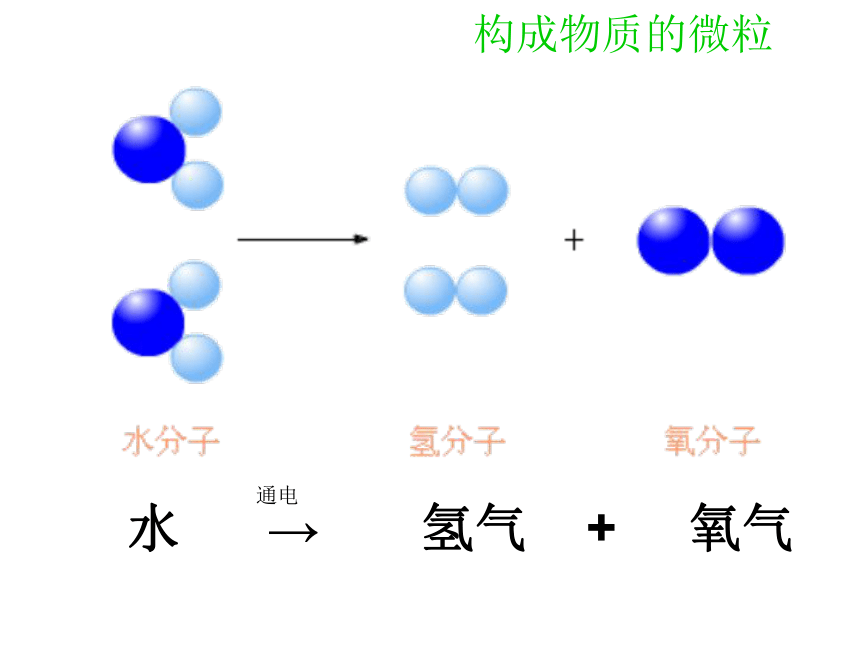
电解水可以得到氧气和氢气。氧气、氢气和水各有自己独特的性质。
为什么水不具有氧气、氢气的性质呢?
构成物质的微粒
水 → 氢气 + 氧气
通电
构成物质的微粒
构成物质的微粒
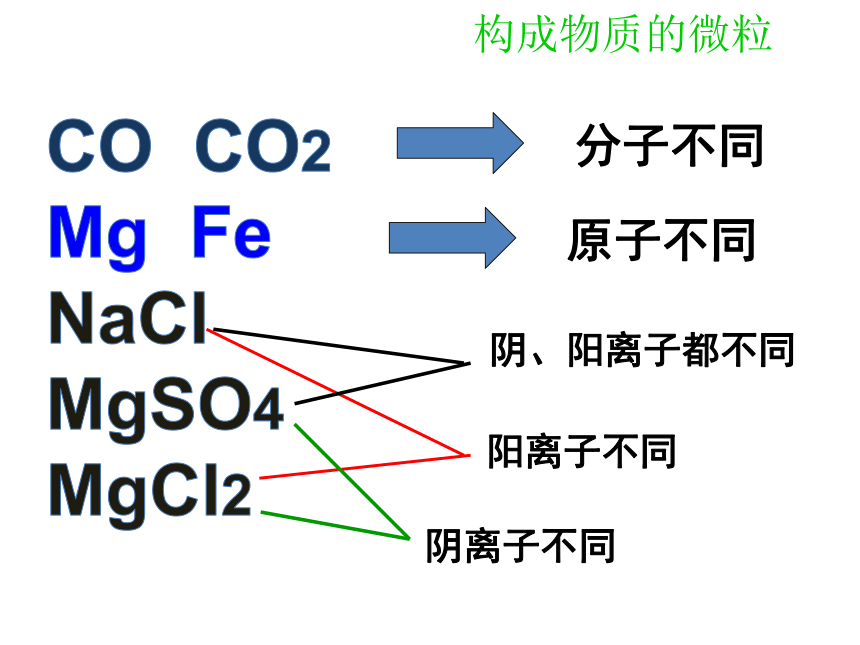
分子不同
原子不同
阴、阳离子都不同
阳离子不同
阴离子不同
同种物质的微粒的化学性质相同,
不同种物质的微粒的化学性质不同。
结论:
不同的物质具有不同的性质,这是由于构成不同物质的微粒不同。
构成物质的微粒
问题三:微粒之间的联系
离子
得失电子
分成
构成
原子
分子
构成物质的微粒
Fe+CuSO4=FeSO4+Cu
Fe+Cu = Fe +Cu
2+
2+
失去2个电子
原子 离子 离子 原子
得到2个电子
构成物质的微粒
Fe+2H = Fe +H2
+
2+
失去2个电子
原子 离子 离子 分子
得到1个电子
构成物质的微粒
Fe+H2SO4=FeSO4+H2
O2
2H2O
2
X
X
分子 分子 分子
构成物质的微粒
原子 分子 离子
HCl + NaOH = H2O +NaCl
离子 离子 分子
分子 原子 分子
微粒观点解释下列变化
1、水受热沸腾?
2、水银温度计温度升高时
水银柱上升的原因?
构成物质的微粒
在物理变化中 微粒不变
变化的是间隔和排列方式
分子和原子、离子的比较
分子 原子 离子
相同 (1)都能直接构成物质
(2)都具有微观粒子的性质
(3)都能保持各自物质的化学性质
区别 在化学变化中可分 在化学变化不可再分 离子带电
联系
分子 原子 离子
变化本质 在物理变化中 微 粒不变;在化学变化中 微粒改变;
归纳总结
电子
电子
谢谢大家,请多提宝贵意见!
构成物质的微粒
1、通过举例说明由不同微粒构成的物质很多,从物质的组成上认识微粒,形成大千世界都是由微粒——分子、原子、离子构成的意识。
2、通过构成物质的微粒的分析,掌握分子、原子、离子微粒间的联系与区别,能运用微粒的观点解释一些常见的宏观现象。
3、通过对不同微粒构成的物质的化学性质的分析,树立物质的化学性质是由构成物质的微粒决定的观念。
4、通过典型化学反应的微观实质分析,认识到电子在化学反应中的作用,理解化学变化的本质。
复习目标
问题一:微粒的共同点
1、都能构成物质
2、都很小,都在不断运动,有间隔,微粒之间有相互作用力
(微粒的性质)
欣赏动画:氯化钠在水中溶解的过程
举例说明?
构成物质的微粒
举例说明?
问题二:微粒的不同点
1、在化学变化中,分子可分,原子不可分
(原子是化学变化中的最小微粒)
2、分子、原子不带电,离子带电
3、分子是保持化学性质的最小微粒。
构成物质的微粒
举例说明?
电解水可以得到氧气和氢气。氧气、氢气和水各有自己独特的性质。
为什么水不具有氧气、氢气的性质呢?
构成物质的微粒
水 → 氢气 + 氧气
通电
构成物质的微粒
构成物质的微粒
分子不同
原子不同
阴、阳离子都不同
阳离子不同
阴离子不同
同种物质的微粒的化学性质相同,
不同种物质的微粒的化学性质不同。
结论:
不同的物质具有不同的性质,这是由于构成不同物质的微粒不同。
构成物质的微粒
问题三:微粒之间的联系
离子
得失电子
分成
构成
原子
分子
构成物质的微粒
Fe+CuSO4=FeSO4+Cu
Fe+Cu = Fe +Cu
2+
2+
失去2个电子
原子 离子 离子 原子
得到2个电子
构成物质的微粒
Fe+2H = Fe +H2
+
2+
失去2个电子
原子 离子 离子 分子
得到1个电子
构成物质的微粒
Fe+H2SO4=FeSO4+H2
O2
2H2O
2
X
X
分子 分子 分子
构成物质的微粒
原子 分子 离子
HCl + NaOH = H2O +NaCl
离子 离子 分子
分子 原子 分子
微粒观点解释下列变化
1、水受热沸腾?
2、水银温度计温度升高时
水银柱上升的原因?
构成物质的微粒
在物理变化中 微粒不变
变化的是间隔和排列方式
分子和原子、离子的比较
分子 原子 离子
相同 (1)都能直接构成物质
(2)都具有微观粒子的性质
(3)都能保持各自物质的化学性质
区别 在化学变化中可分 在化学变化不可再分 离子带电
联系
分子 原子 离子
变化本质 在物理变化中 微 粒不变;在化学变化中 微粒改变;
归纳总结
电子
电子
谢谢大家,请多提宝贵意见!
同课章节目录
- 第1章 运动和力
- 1 机械运动
- 2 力
- 3 几种常见的力
- 4 运动和力
- 5 二力平衡的条件
- 第2章 压力 压强
- 1 压强
- 2 液体内部的压强
- 3 大气压强
- 4 流体的压强与流速的关系
- 第3章 浮力
- 1 密度
- 2 浮力
- 3 阿基米德原理
- 4 物体浮沉条件及其应用
- 第4章 植物的物质和能量的转化
- 1 绿色开花植物的营养器官
- 2 水在植物体中的代谢
- 3 无机盐在植物体内的代谢
- 4 植物的光合作用和呼吸作用
- 第5章 人体的物质和能量的转化
- 1 食物的消化和吸收
- 2 人体的呼吸
- 3 人体内的物质运输
- 4 人体的排泄
- 5 人体生命活动过程中物质和能量的转化
- 第6章 物质的构成
- 1 构成物质的微粒
- 2 元素
- 3 物质的分类
- 4 化学式
- 5 固态物质
