2021-2022学年高中化学人教版(2019)必修一3.2金属材料(共20张ppt)
文档属性
| 名称 | 2021-2022学年高中化学人教版(2019)必修一3.2金属材料(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-20 19:53:59 | ||
图片预览






文档简介
(共20张PPT)
第三章 铁 金属材料
第二节 金属材料
目录
一、上节回溯
二、知识讲解
三、小结
四、练习
一、上节回溯
1、铁的单质
2、铁的重要化合物——氧化物
3、铁的重要化合物——氢氧化物
4、铁的重要化合物——铁盐和亚铁盐
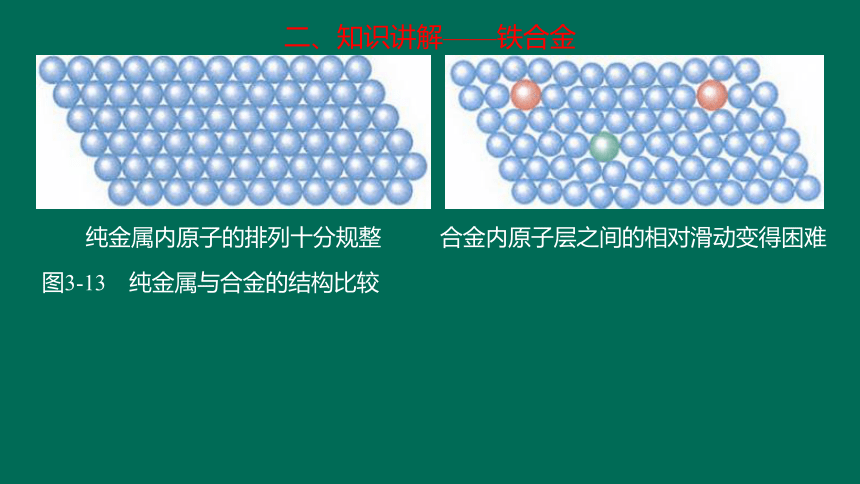
二、知识讲解——铁合金
纯金属内原子的排列十分规整
合金内原子层之间的相对滑动变得困难
图3-13 纯金属与合金的结构比较
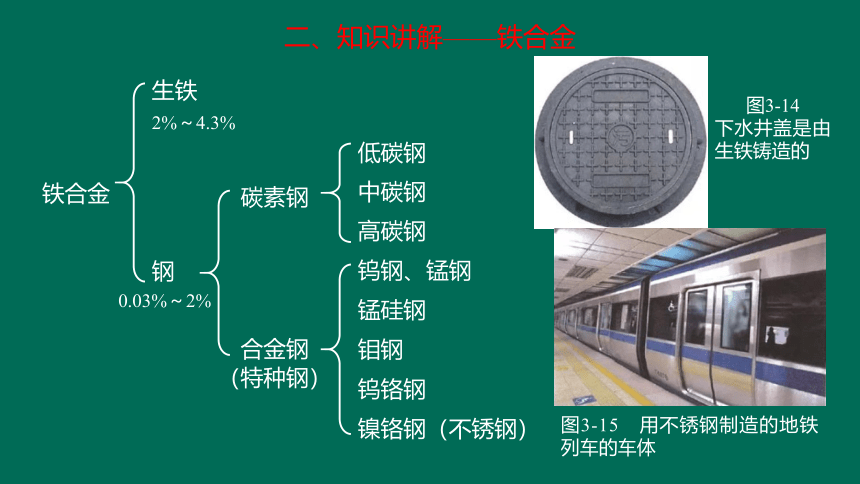
二、知识讲解——铁合金
2%~4.3%
碳素钢
生铁
钢
0.03%~2%
合金钢
(特种钢)
低碳钢
中碳钢
高碳钢
钨钢、锰钢
锰硅钢
钼钢
钨铬钢
镍铬钢(不锈钢)
铁合金
图3-14
下水井盖是由生铁铸造的
图3-15 用不锈钢制造的地铁列车的车体
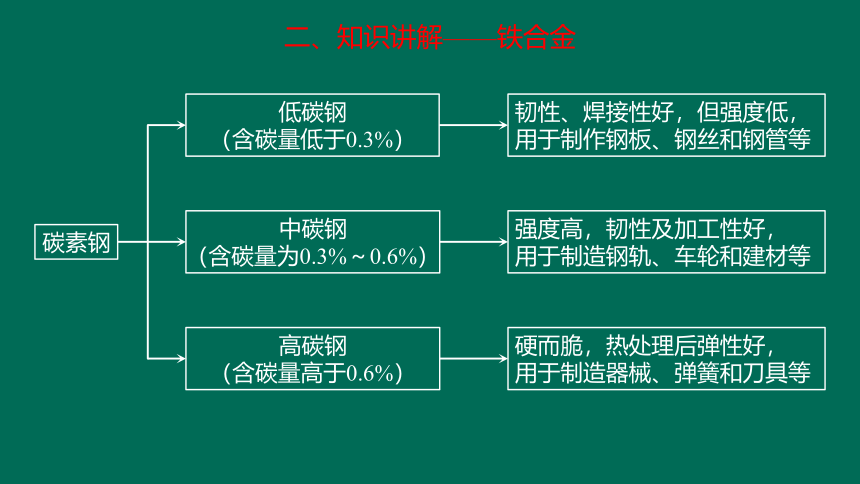
碳素钢
低碳钢
(含碳量低于0.3%)
中碳钢
(含碳量为0.3%~0.6%)
高碳钢
(含碳量高于0.6%)
韧性、焊接性好,但强度低,
用于制作钢板、钢丝和钢管等
强度高,韧性及加工性好,
用于制造钢轨、车轮和建材等
硬而脆,热处理后弹性好,
用于制造器械、弹簧和刀具等
二、知识讲解——铁合金
钢中合金元素的主要作用
二、知识讲解——铁合金
资料卡片
合金元素 主要作用
铬(Cr) 增强耐磨性和抗氧化性;增强高温强度;提高高碳钢的耐磨性等
锰(Mn) 防止硫引起的脆性;增强钢的强度和韧性等
钼(Mo) 降低脆性;增强高温强度;提高红热时的硬度和耐磨性等
钨(W) 提高高温时的强度和硬度;增强工具钢的耐磨性等
钴(Co) 提高红热时的硬度和耐磨性;用于制造磁性合金等
镍(Ni) 增强低温时的韧性;改变高铬钢的内部结构等
硅(Si) 提高低合金钢的强度和硬度;增强高温时的抗氧化性等
思考与讨论
在碳素钢中,由于含碳量不同,高碳钢、中碳钢和低碳钢的性能有很大差异;向碳素钢中加入不同的合金元素,可制得不同性能的合金钢。这对你有什么启示?与同学讨论。
?
二、知识讲解——铁合金
研究物质的性能应从研究物质的结构入手,研制新材料的过程中应加强对组成元素的定性和定量研究等。
二、知识讲解——铝和铝合金
【实验3-4】
在一支试管中加入5 mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
铝片表面有大量气泡产生,试管壁有发热现象。一段时间后将点燃的木条放在试管口(务必注意安全)可观察到淡蓝色火焰。
实验表明,铝表面的保护膜和铝均能与盐酸发生反应:
Al2O3+6HCl === 2AlCl3+3H2O
2Al+6HCl === 2AlCl3+3H2↑
二、知识讲解——铝和铝合金
【实验3-5】
在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两支试管管口,你观察到什么现象?
用砂纸打磨过的铝片立即剧烈反应,表面有大量气泡产生,试管壁有发热现象。未经打磨过的铝片刚开始反应较慢,后逐渐加快,产生大量气泡,试管壁有发热现象。一段时间后,将点燃的木条分别放在两支试管口(务必注意安全)均可观察到淡蓝色火焰。
图3-17 将铝片放入
NaOH溶液中
二、知识讲解——铝和铝合金
铝、氧化铝与NaOH溶液反应的化学方程式分别为:
Al2O3+2NaOH === 2NaAlO2+H2O
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
偏铝酸钠
像Al2O3这类既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物。
图3-18 硬铝常用于制造飞机的外壳
二、知识讲解——新型合金
图3-20 我国“蛟龙”号载人潜水器最关键的部件——供人活动的耐压球壳是用钛合金制造
图3-19 储氢合金可用于以H2为燃料的汽车
图3-21 喷气式飞机的发动机叶片由镍、铁、碳和钴组成的镍钴合金制造,能承受1 100℃的高温
二、知识讲解——物质的量在化学方程式计算中的应用
原理:化学方程式中各物质的化学计量数之比等于各物质的物质的量之比。
【例题】250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;
(2)生成的H2的体积(标准状况)。
【解】参加反应的H2SO4的物质的量为:0.25 L×2 mol/L=0.50 mol
(1)Fe + H2SO4 === FeSO4 + H2↑
1 1
n(Fe) 0.5 mol
1 n(Fe)
1 0.5 mol n(Fe)=0.50 mol
=
二、知识讲解——物质的量在化学方程式计算中的应用
原理:化学方程式中各物质的化学计量数之比等于各物质的物质的量之比。
【例题】250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;
(2)生成的H2的体积(标准状况)。
【解】参加反应的H2SO4的物质的量为:0.25 L×2 mol/L=0.50 mol
(1)Fe + H2SO4 === FeSO4 + H2↑
1 22.4 L
0.5 mol V(H2)
0.50 mol
V(H2)
22.4 L
=
1 mol
V(H2)
=
22.4 L×0.50 mol
1 mol
=
11.2 L
答:(1)参加反应的铁屑的物质的量为0.50 mol;
(2)生成的H2的体积在标准状况下为11.2 L。
三、小结
1、铁合金
2、铝和铝合金
3、新型合金
4、物质的量在化学方程式计算中的应用
四、练习
1.下列关于合金的说法中,正确的是( )
A.合金的熔点一定比各成分金属的低
B.在我国使用最早的合金是钢
C.生铁的含碳量为0.03%~2%
D.稀土金属可以用于生产合金
D
四、练习
2.下列关于铝的说法中,正确的是( )
A.铝的化学性质不活泼
B.铝不与酸、碱反应
C.常温下铝不与氧气反应
D.铝表面容易生成一层致密的氧化铝保护膜
D
四、练习
3.相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下体积之比为( )
A.1:1
B.1:6
C.2:3
D.3:2
A
四、练习
4.把5.4 g Al放入足量氢氧化钠溶液中完全反应,计算生成氢气的体积(标准状况)。
解:2Al +2NaOH+2H2O === 2NaAlO2 + 3H2↑
2×27 g 3×22.4 L
5.4 g V(H2)
2×27 g
5.4 g
V(H2)
3×22.4 L
=
V(H2)=6.72 L
答:生成氢气的体积为6.72 L。
谢谢
第三章 铁 金属材料
第二节 金属材料
目录
一、上节回溯
二、知识讲解
三、小结
四、练习
一、上节回溯
1、铁的单质
2、铁的重要化合物——氧化物
3、铁的重要化合物——氢氧化物
4、铁的重要化合物——铁盐和亚铁盐
二、知识讲解——铁合金
纯金属内原子的排列十分规整
合金内原子层之间的相对滑动变得困难
图3-13 纯金属与合金的结构比较
二、知识讲解——铁合金
2%~4.3%
碳素钢
生铁
钢
0.03%~2%
合金钢
(特种钢)
低碳钢
中碳钢
高碳钢
钨钢、锰钢
锰硅钢
钼钢
钨铬钢
镍铬钢(不锈钢)
铁合金
图3-14
下水井盖是由生铁铸造的
图3-15 用不锈钢制造的地铁列车的车体
碳素钢
低碳钢
(含碳量低于0.3%)
中碳钢
(含碳量为0.3%~0.6%)
高碳钢
(含碳量高于0.6%)
韧性、焊接性好,但强度低,
用于制作钢板、钢丝和钢管等
强度高,韧性及加工性好,
用于制造钢轨、车轮和建材等
硬而脆,热处理后弹性好,
用于制造器械、弹簧和刀具等
二、知识讲解——铁合金
钢中合金元素的主要作用
二、知识讲解——铁合金
资料卡片
合金元素 主要作用
铬(Cr) 增强耐磨性和抗氧化性;增强高温强度;提高高碳钢的耐磨性等
锰(Mn) 防止硫引起的脆性;增强钢的强度和韧性等
钼(Mo) 降低脆性;增强高温强度;提高红热时的硬度和耐磨性等
钨(W) 提高高温时的强度和硬度;增强工具钢的耐磨性等
钴(Co) 提高红热时的硬度和耐磨性;用于制造磁性合金等
镍(Ni) 增强低温时的韧性;改变高铬钢的内部结构等
硅(Si) 提高低合金钢的强度和硬度;增强高温时的抗氧化性等
思考与讨论
在碳素钢中,由于含碳量不同,高碳钢、中碳钢和低碳钢的性能有很大差异;向碳素钢中加入不同的合金元素,可制得不同性能的合金钢。这对你有什么启示?与同学讨论。
?
二、知识讲解——铁合金
研究物质的性能应从研究物质的结构入手,研制新材料的过程中应加强对组成元素的定性和定量研究等。
二、知识讲解——铝和铝合金
【实验3-4】
在一支试管中加入5 mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
铝片表面有大量气泡产生,试管壁有发热现象。一段时间后将点燃的木条放在试管口(务必注意安全)可观察到淡蓝色火焰。
实验表明,铝表面的保护膜和铝均能与盐酸发生反应:
Al2O3+6HCl === 2AlCl3+3H2O
2Al+6HCl === 2AlCl3+3H2↑
二、知识讲解——铝和铝合金
【实验3-5】
在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两支试管管口,你观察到什么现象?
用砂纸打磨过的铝片立即剧烈反应,表面有大量气泡产生,试管壁有发热现象。未经打磨过的铝片刚开始反应较慢,后逐渐加快,产生大量气泡,试管壁有发热现象。一段时间后,将点燃的木条分别放在两支试管口(务必注意安全)均可观察到淡蓝色火焰。
图3-17 将铝片放入
NaOH溶液中
二、知识讲解——铝和铝合金
铝、氧化铝与NaOH溶液反应的化学方程式分别为:
Al2O3+2NaOH === 2NaAlO2+H2O
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
偏铝酸钠
像Al2O3这类既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物。
图3-18 硬铝常用于制造飞机的外壳
二、知识讲解——新型合金
图3-20 我国“蛟龙”号载人潜水器最关键的部件——供人活动的耐压球壳是用钛合金制造
图3-19 储氢合金可用于以H2为燃料的汽车
图3-21 喷气式飞机的发动机叶片由镍、铁、碳和钴组成的镍钴合金制造,能承受1 100℃的高温
二、知识讲解——物质的量在化学方程式计算中的应用
原理:化学方程式中各物质的化学计量数之比等于各物质的物质的量之比。
【例题】250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;
(2)生成的H2的体积(标准状况)。
【解】参加反应的H2SO4的物质的量为:0.25 L×2 mol/L=0.50 mol
(1)Fe + H2SO4 === FeSO4 + H2↑
1 1
n(Fe) 0.5 mol
1 n(Fe)
1 0.5 mol n(Fe)=0.50 mol
=
二、知识讲解——物质的量在化学方程式计算中的应用
原理:化学方程式中各物质的化学计量数之比等于各物质的物质的量之比。
【例题】250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;
(2)生成的H2的体积(标准状况)。
【解】参加反应的H2SO4的物质的量为:0.25 L×2 mol/L=0.50 mol
(1)Fe + H2SO4 === FeSO4 + H2↑
1 22.4 L
0.5 mol V(H2)
0.50 mol
V(H2)
22.4 L
=
1 mol
V(H2)
=
22.4 L×0.50 mol
1 mol
=
11.2 L
答:(1)参加反应的铁屑的物质的量为0.50 mol;
(2)生成的H2的体积在标准状况下为11.2 L。
三、小结
1、铁合金
2、铝和铝合金
3、新型合金
4、物质的量在化学方程式计算中的应用
四、练习
1.下列关于合金的说法中,正确的是( )
A.合金的熔点一定比各成分金属的低
B.在我国使用最早的合金是钢
C.生铁的含碳量为0.03%~2%
D.稀土金属可以用于生产合金
D
四、练习
2.下列关于铝的说法中,正确的是( )
A.铝的化学性质不活泼
B.铝不与酸、碱反应
C.常温下铝不与氧气反应
D.铝表面容易生成一层致密的氧化铝保护膜
D
四、练习
3.相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下体积之比为( )
A.1:1
B.1:6
C.2:3
D.3:2
A
四、练习
4.把5.4 g Al放入足量氢氧化钠溶液中完全反应,计算生成氢气的体积(标准状况)。
解:2Al +2NaOH+2H2O === 2NaAlO2 + 3H2↑
2×27 g 3×22.4 L
5.4 g V(H2)
2×27 g
5.4 g
V(H2)
3×22.4 L
=
V(H2)=6.72 L
答:生成氢气的体积为6.72 L。
谢谢
