2021-2022学年九年级全册化学鲁教版(五四制)常考实验小练(4)粗盐中难溶性杂质的去除
文档属性
| 名称 | 2021-2022学年九年级全册化学鲁教版(五四制)常考实验小练(4)粗盐中难溶性杂质的去除 |  | |
| 格式 | doc | ||
| 文件大小 | 282.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-20 21:50:35 | ||
图片预览

文档简介
2021-2022学年九年级全册化学鲁教版(五四制)常考实验小练
(4)粗盐中难溶性杂质的去除
一、知识讲解
1、实验步骤:
(1)溶解:用托盘天平称取5.0 g粗盐,用量筒量取10 mL水,用药匙将粗盐逐渐加入盛有10 ml水的烧杯中,边加边用玻璃棒搅拌,直到不再溶解为止。
(2)过滤:过滤食盐水,观察滤液是否澄清,若滤液浑浊,需再过滤或检查装置,并找出原因。
(3)蒸发:把所得澄清滤液倒入蒸发皿,如图所示,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液,以防液滴飞溅。待蒸发皿中出现较多固体时,停止加热。利用蒸发皿的余热使滤液蒸干。
(4)计算产率:用玻璃棒把固体转移到纸上,称量,将提纯过后的氯化钠与粗盐作比较,并计算精盐的产率。
2、注意事项
(1)待蒸发皿中出现较多固体时,停止加热,利用余热使剩余水分蒸干,不能将滤液完全蒸干再停止加热。
(2)蒸发皿是可以直接加热的仪器,蒸发时,倒入液体的体积不超过蒸发皿容积的2/3。
(3)加热时,不断用玻璃棒搅拌。
(4)热的蒸发皿不能直接放在实验台上,以免烫坏实验台,如需取下可使用坩埚钳。
3、粗盐提纯中玻璃棒的作用
(1)溶解时,用于搅拌,可以加快粗盐溶解的速率。
(2)过滤时,用于引流,防止液体洒落。
(3)蒸发时,用于搅拌,防止液体局部温度过高,造成液滴飞溅。
(4)转移时,用于转移固体。
二、跟踪练习
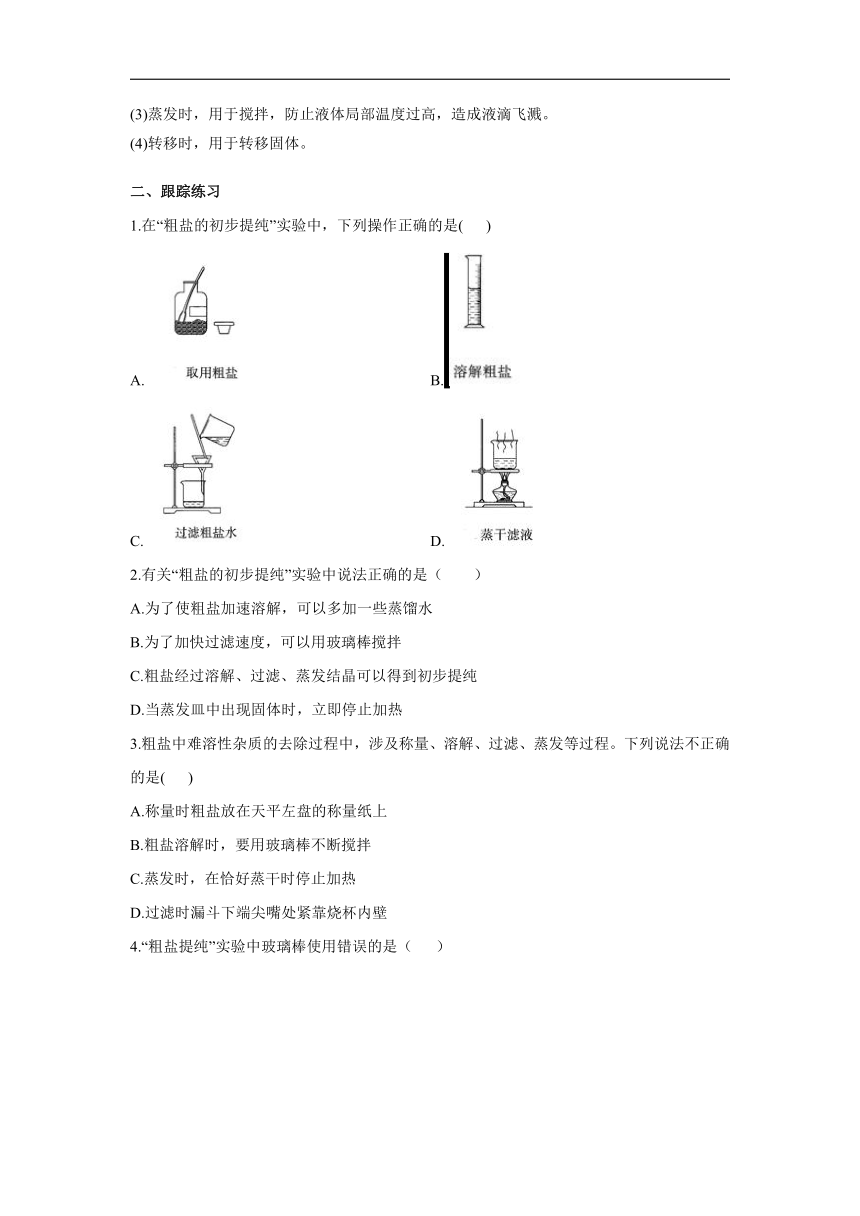
1.在“粗盐的初步提纯”实验中,下列操作正确的是( )
A. B.
C. D.
2.有关“粗盐的初步提纯”实验中说法正确的是( )
A.为了使粗盐加速溶解,可以多加一些蒸馏水
B.为了加快过滤速度,可以用玻璃棒搅拌
C.粗盐经过溶解、过滤、蒸发结晶可以得到初步提纯
D.当蒸发皿中出现固体时,立即停止加热
3.粗盐中难溶性杂质的去除过程中,涉及称量、溶解、过滤、蒸发等过程。下列说法不正确的是( )
A.称量时粗盐放在天平左盘的称量纸上
B.粗盐溶解时,要用玻璃棒不断搅拌
C.蒸发时,在恰好蒸干时停止加热
D.过滤时漏斗下端尖嘴处紧靠烧杯内壁
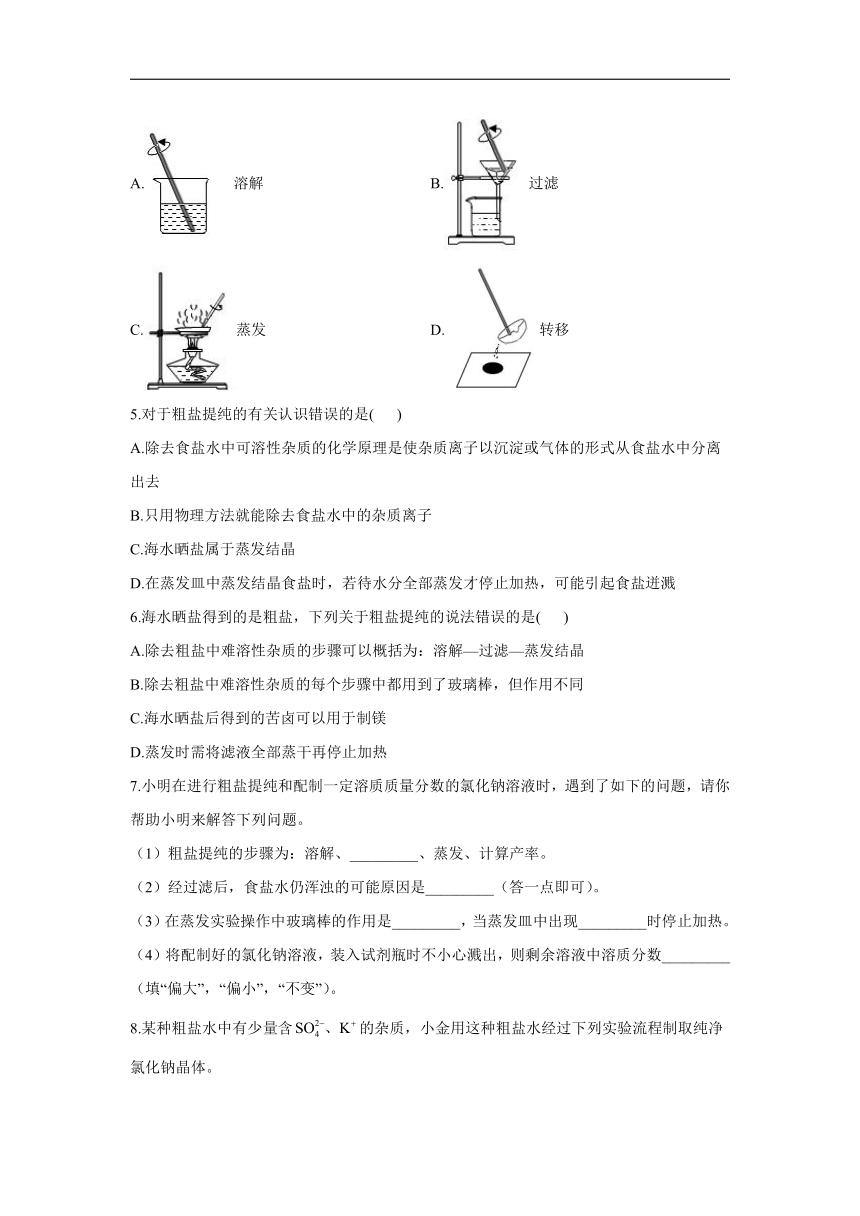
4.“粗盐提纯”实验中玻璃棒使用错误的是( )
A.溶解 B.过滤
C.蒸发 D.转移
5.对于粗盐提纯的有关认识错误的是( )
A.除去食盐水中可溶性杂质的化学原理是使杂质离子以沉淀或气体的形式从食盐水中分离出去
B.只用物理方法就能除去食盐水中的杂质离子
C.海水晒盐属于蒸发结晶
D.在蒸发皿中蒸发结晶食盐时,若待水分全部蒸发才停止加热,可能引起食盐迸溅
6.海水晒盐得到的是粗盐,下列关于粗盐提纯的说法错误的是( )
A.除去粗盐中难溶性杂质的步骤可以概括为:溶解—过滤—蒸发结晶
B.除去粗盐中难溶性杂质的每个步骤中都用到了玻璃棒,但作用不同
C.海水晒盐后得到的苦卤可以用于制镁
D.蒸发时需将滤液全部蒸干再停止加热
7.小明在进行粗盐提纯和配制一定溶质质量分数的氯化钠溶液时,遇到了如下的问题,请你帮助小明来解答下列问题。
(1)粗盐提纯的步骤为:溶解、_________、蒸发、计算产率。
(2)经过滤后,食盐水仍浑浊的可能原因是_________(答一点即可)。
(3)在蒸发实验操作中玻璃棒的作用是_________,当蒸发皿中出现_________时停止加热。
(4)将配制好的氯化钠溶液,装入试剂瓶时不小心溅出,则剩余溶液中溶质分数_________(填“偏大”,“偏小”,“不变”)。
8.某种粗盐水中有少量含的杂质,小金用这种粗盐水经过下列实验流程制取纯净氯化钠晶体。
(1)固体A是_________________。(填化学式)
(2)加碳酸钠溶液时发生反应的化学方程式为_________________。
(3)若将溶液C蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得晶体仍不是纯净的氯化钠,理由是_________________。
9.重庆多地曾出现过盐井,从天然盐井中获取粗盐(含泥沙、等杂质)为了除去以上杂质得到精盐,小明设计如下实验。
【提示】杂质含量较少,不考虑微溶物形成沉淀
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和______。
(2)沉淀b所含物质为 和______。
(3)物质X是______。
(4)滤液c中加入稀盐酸后发生中和反应的化学方程式为______。
(5)为了证明滴加的溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的的有______。
A.B. C、 D.KCl
10.某兴趣小组查阅资料发现除去泥沙等杂质的粗盐,可能还含有等杂质。他们将该粗盐配成溶液,并对粗盐溶液进行探究和除杂
(1)配制溶液时,加速粗盐溶解的玻璃仪器是__________。
【探究过程】
(2)步骤1:向粗盐溶液中加入过量NaOH溶液,未出现明显现象,说明溶液中无________杂质; 向溶液中继续滴加过量溶液,产生白色沉淀固体。
反应的化学方程式为_________________________。
(3)步骤2:向步骤1的滤液中滴加过量溶液,产生白色沉淀,过滤:向滤液中滴加稀盐酸至溶液呈中性即得NaCl溶液。加稀盐酸除去的物质是__________。
【初步结论】杂质成分已确定,且已完全除去。
【反思交流】
(4)小东认为还不能确定是否存在,可向步骤2的沉淀中滴加过量稀盐酸,
若观察到________________的现象,证明粗盐中确实存在。
(5)小红认为杂质也未完全除去,可按照步骤1和步骤2重新实验,并对调其中两种试剂的位置就能达到除杂目的,这两种试剂为__________(填序号)
A.溶液、溶液 B.稀盐酸、溶液 C.NaOH溶液、溶液
答案以及解析
1.答案:C
解析: A.取用固体粉末状药品时,瓶塞要倒放,应用药匙取用,不能用手接触药品,图中瓶塞没有倒放,所示操作错误。B.溶解操作应在烧杯中进行,不能用量筒溶解固体,图中所示操作错误。C.过滤液体时,要注意“一贴、二低、三靠”的原则,图中所示操作正确。D.蒸发操作应用蒸发皿,图中所示操作错误。
2.答案:C
解析:A、不能为了使粗盐加速溶解多加一些蒸馏水,否则加热蒸发的时间过长,故选项说法错误。
B、过滤液体时,注意“一贴、二低、三靠”的原则,不能用玻璃棒搅拌,以防止损坏滤纸,故选项说法错误。
C、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐的过程),通过上述步骤,可以得到初步提纯,故选项说法正确。
D、蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,故选项说法错误。
故选:C。
3.答案:C
解析:称量时粗盐放在天平左盘的称量纸上,故A正确;粗盐溶解时,要用玻璃棒不断搅拌,故B正确;蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,故C错误;过滤液体时,要注意“一贴、二低、三靠”的原则,过滤时漏斗下端尖嘴处紧靠烧杯内壁,故D正确。
4.答案:B
解析:A、溶解时,玻璃棒起到搅拌,加速溶解的作用,操作正确,不符合题意;
B、过滤时,玻璃棒的作用是引流,不能在滤纸中搅拌,以免滤纸破损,操作不正确,符合题意;
C、蒸发时,玻璃棒的作用是搅拌,防止局部温度过高,造成液滴飞溅,操作正确,不符合题意;
D、转移时,使用玻璃棒转移,操作正确,不符合题意。
故选B。
5.答案:B
解析:除去食盐水中可溶性杂质的化学原理是使杂质离子以沉淀或气体的形式从食盐水中分离出去,A正确。氯化钠的溶解度受温度变化影响不大,海水晒盐利用的是蒸发溶剂的方法,C正确。蒸发结晶食盐时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,若待水分全部蒸发才停止加热,可能引起食盐迸溅,D正确。
6.答案:D
解析:蒸发时,当有大量晶体析出时停止加热,用余热把剩余水分蒸干,D错误。
7.答案:(1)过滤
(2)滤纸破损等
(3)搅拌,防止局部温度过高,造成液体飞溅;较多固体
(4)不变
解析:(1)粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,最后计算产率。
(2)过滤后滤液仍浑浊,可能原因是滤纸破损(会使得液体中的不溶物进入下面的烧杯,从而使得滤液浑浊)、液面高于滤纸的边缘(会使部分液体未经过滤纸的过滤直接流下,该操作会使滤液仍然浑浊)或盛接滤液的烧杯不干净等。
(3)在蒸发实验操作中玻璃棒的作用是搅拌,以防止局部温度过高,造成液体飞溅;当蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干。
(4)将配制好的氯化钠溶液,装入试剂瓶时不小心溅出,溶液具有均一性,则剩余溶液中溶质分数不变。
8.答案:(1)(2)(3)钾离子未除去
解析:粗盐水中含有的离子:。向粗盐水中加入稍过量的氯化钡溶液,与结合生成沉淀(固体A),溶液A中含有。向溶液A中加入稍过量的碳酸钠溶液,与结合生成沉淀(固体B),溶液B中含有。向溶液B中加入稍过量的盐酸与结合生成和,溶液C中含有。蒸发结晶过程中,HCl逸出,但钾离子没有被除去。
9.答案:(1). 漏斗 (2). (3). (4). (5). C
解析: (2)加入氢氧化钡溶液发生的反应是:、
、,沉淀b中含有和。
(3)X溶液的作用是除去和过量的,所以是碳酸钠溶液。
(4)滤液c中含有杂质氢氧化钠和碳酸钠,加入过量稀盐酸可以将它们除去,氢氧化钠与盐酸的反应是中和反应。
(5)氢氧化钡溶液过量时,上层清液中含有,碳酸钾、硫酸钠都能与反应生成白色沉淀,但碳酸钾也能与反应生成白色沉淀,故选C。
10.答案:(1)玻璃棒
(2) (或氯化镁);
(3)NaOH(或氢氧化钠)
(4)沉淀部分溶解
(5)A
解析:(1)溶解时用玻璃棒搅拌可加速溶解。
(2)氯化镁能和氢氧化钠溶液反应生成氢氧化镁白色沉淀,加入过量氢氧化钠溶液,未出现明显现象,说明粗盐溶液中没有氯化镁;碳酸钠溶液能和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为。
(3)步骤2中,滴加过量的氯化钡溶液既可以除去杂质,又可以除去步骤1中过量的碳酸钠,滴加稀盐酸的目的是除去溶液中过量的氢氧化钠。
(4)碳酸钡能和稀盐酸反应,硫酸钡不能和稀盐酸反应,沉淀部分溶解说明沉淀中含有硫酸钡,进一步说明粗盐中含有硫酸钠杂质,其和氯化钡溶液反应生成了硫酸钡沉淀。
(5)步骤1和步骤2操作完成后,所得溶液中会含有氯化钡杂质,碳酸钠溶液和氯化钡溶液位置对调后,碳酸钠能除去过量的氯化钡,过量的碳酸钠可用稀盐酸除去。
(4)粗盐中难溶性杂质的去除
一、知识讲解
1、实验步骤:
(1)溶解:用托盘天平称取5.0 g粗盐,用量筒量取10 mL水,用药匙将粗盐逐渐加入盛有10 ml水的烧杯中,边加边用玻璃棒搅拌,直到不再溶解为止。
(2)过滤:过滤食盐水,观察滤液是否澄清,若滤液浑浊,需再过滤或检查装置,并找出原因。
(3)蒸发:把所得澄清滤液倒入蒸发皿,如图所示,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液,以防液滴飞溅。待蒸发皿中出现较多固体时,停止加热。利用蒸发皿的余热使滤液蒸干。
(4)计算产率:用玻璃棒把固体转移到纸上,称量,将提纯过后的氯化钠与粗盐作比较,并计算精盐的产率。
2、注意事项
(1)待蒸发皿中出现较多固体时,停止加热,利用余热使剩余水分蒸干,不能将滤液完全蒸干再停止加热。
(2)蒸发皿是可以直接加热的仪器,蒸发时,倒入液体的体积不超过蒸发皿容积的2/3。
(3)加热时,不断用玻璃棒搅拌。
(4)热的蒸发皿不能直接放在实验台上,以免烫坏实验台,如需取下可使用坩埚钳。
3、粗盐提纯中玻璃棒的作用
(1)溶解时,用于搅拌,可以加快粗盐溶解的速率。
(2)过滤时,用于引流,防止液体洒落。
(3)蒸发时,用于搅拌,防止液体局部温度过高,造成液滴飞溅。
(4)转移时,用于转移固体。
二、跟踪练习
1.在“粗盐的初步提纯”实验中,下列操作正确的是( )
A. B.
C. D.
2.有关“粗盐的初步提纯”实验中说法正确的是( )
A.为了使粗盐加速溶解,可以多加一些蒸馏水
B.为了加快过滤速度,可以用玻璃棒搅拌
C.粗盐经过溶解、过滤、蒸发结晶可以得到初步提纯
D.当蒸发皿中出现固体时,立即停止加热
3.粗盐中难溶性杂质的去除过程中,涉及称量、溶解、过滤、蒸发等过程。下列说法不正确的是( )
A.称量时粗盐放在天平左盘的称量纸上
B.粗盐溶解时,要用玻璃棒不断搅拌
C.蒸发时,在恰好蒸干时停止加热
D.过滤时漏斗下端尖嘴处紧靠烧杯内壁
4.“粗盐提纯”实验中玻璃棒使用错误的是( )
A.溶解 B.过滤
C.蒸发 D.转移
5.对于粗盐提纯的有关认识错误的是( )
A.除去食盐水中可溶性杂质的化学原理是使杂质离子以沉淀或气体的形式从食盐水中分离出去
B.只用物理方法就能除去食盐水中的杂质离子
C.海水晒盐属于蒸发结晶
D.在蒸发皿中蒸发结晶食盐时,若待水分全部蒸发才停止加热,可能引起食盐迸溅
6.海水晒盐得到的是粗盐,下列关于粗盐提纯的说法错误的是( )
A.除去粗盐中难溶性杂质的步骤可以概括为:溶解—过滤—蒸发结晶
B.除去粗盐中难溶性杂质的每个步骤中都用到了玻璃棒,但作用不同
C.海水晒盐后得到的苦卤可以用于制镁
D.蒸发时需将滤液全部蒸干再停止加热
7.小明在进行粗盐提纯和配制一定溶质质量分数的氯化钠溶液时,遇到了如下的问题,请你帮助小明来解答下列问题。
(1)粗盐提纯的步骤为:溶解、_________、蒸发、计算产率。
(2)经过滤后,食盐水仍浑浊的可能原因是_________(答一点即可)。
(3)在蒸发实验操作中玻璃棒的作用是_________,当蒸发皿中出现_________时停止加热。
(4)将配制好的氯化钠溶液,装入试剂瓶时不小心溅出,则剩余溶液中溶质分数_________(填“偏大”,“偏小”,“不变”)。
8.某种粗盐水中有少量含的杂质,小金用这种粗盐水经过下列实验流程制取纯净氯化钠晶体。
(1)固体A是_________________。(填化学式)
(2)加碳酸钠溶液时发生反应的化学方程式为_________________。
(3)若将溶液C蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得晶体仍不是纯净的氯化钠,理由是_________________。
9.重庆多地曾出现过盐井,从天然盐井中获取粗盐(含泥沙、等杂质)为了除去以上杂质得到精盐,小明设计如下实验。
【提示】杂质含量较少,不考虑微溶物形成沉淀
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和______。
(2)沉淀b所含物质为 和______。
(3)物质X是______。
(4)滤液c中加入稀盐酸后发生中和反应的化学方程式为______。
(5)为了证明滴加的溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的的有______。
A.B. C、 D.KCl
10.某兴趣小组查阅资料发现除去泥沙等杂质的粗盐,可能还含有等杂质。他们将该粗盐配成溶液,并对粗盐溶液进行探究和除杂
(1)配制溶液时,加速粗盐溶解的玻璃仪器是__________。
【探究过程】
(2)步骤1:向粗盐溶液中加入过量NaOH溶液,未出现明显现象,说明溶液中无________杂质; 向溶液中继续滴加过量溶液,产生白色沉淀固体。
反应的化学方程式为_________________________。
(3)步骤2:向步骤1的滤液中滴加过量溶液,产生白色沉淀,过滤:向滤液中滴加稀盐酸至溶液呈中性即得NaCl溶液。加稀盐酸除去的物质是__________。
【初步结论】杂质成分已确定,且已完全除去。
【反思交流】
(4)小东认为还不能确定是否存在,可向步骤2的沉淀中滴加过量稀盐酸,
若观察到________________的现象,证明粗盐中确实存在。
(5)小红认为杂质也未完全除去,可按照步骤1和步骤2重新实验,并对调其中两种试剂的位置就能达到除杂目的,这两种试剂为__________(填序号)
A.溶液、溶液 B.稀盐酸、溶液 C.NaOH溶液、溶液
答案以及解析
1.答案:C
解析: A.取用固体粉末状药品时,瓶塞要倒放,应用药匙取用,不能用手接触药品,图中瓶塞没有倒放,所示操作错误。B.溶解操作应在烧杯中进行,不能用量筒溶解固体,图中所示操作错误。C.过滤液体时,要注意“一贴、二低、三靠”的原则,图中所示操作正确。D.蒸发操作应用蒸发皿,图中所示操作错误。
2.答案:C
解析:A、不能为了使粗盐加速溶解多加一些蒸馏水,否则加热蒸发的时间过长,故选项说法错误。
B、过滤液体时,注意“一贴、二低、三靠”的原则,不能用玻璃棒搅拌,以防止损坏滤纸,故选项说法错误。
C、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐的过程),通过上述步骤,可以得到初步提纯,故选项说法正确。
D、蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,故选项说法错误。
故选:C。
3.答案:C
解析:称量时粗盐放在天平左盘的称量纸上,故A正确;粗盐溶解时,要用玻璃棒不断搅拌,故B正确;蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,故C错误;过滤液体时,要注意“一贴、二低、三靠”的原则,过滤时漏斗下端尖嘴处紧靠烧杯内壁,故D正确。
4.答案:B
解析:A、溶解时,玻璃棒起到搅拌,加速溶解的作用,操作正确,不符合题意;
B、过滤时,玻璃棒的作用是引流,不能在滤纸中搅拌,以免滤纸破损,操作不正确,符合题意;
C、蒸发时,玻璃棒的作用是搅拌,防止局部温度过高,造成液滴飞溅,操作正确,不符合题意;
D、转移时,使用玻璃棒转移,操作正确,不符合题意。
故选B。
5.答案:B
解析:除去食盐水中可溶性杂质的化学原理是使杂质离子以沉淀或气体的形式从食盐水中分离出去,A正确。氯化钠的溶解度受温度变化影响不大,海水晒盐利用的是蒸发溶剂的方法,C正确。蒸发结晶食盐时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,若待水分全部蒸发才停止加热,可能引起食盐迸溅,D正确。
6.答案:D
解析:蒸发时,当有大量晶体析出时停止加热,用余热把剩余水分蒸干,D错误。
7.答案:(1)过滤
(2)滤纸破损等
(3)搅拌,防止局部温度过高,造成液体飞溅;较多固体
(4)不变
解析:(1)粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,最后计算产率。
(2)过滤后滤液仍浑浊,可能原因是滤纸破损(会使得液体中的不溶物进入下面的烧杯,从而使得滤液浑浊)、液面高于滤纸的边缘(会使部分液体未经过滤纸的过滤直接流下,该操作会使滤液仍然浑浊)或盛接滤液的烧杯不干净等。
(3)在蒸发实验操作中玻璃棒的作用是搅拌,以防止局部温度过高,造成液体飞溅;当蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干。
(4)将配制好的氯化钠溶液,装入试剂瓶时不小心溅出,溶液具有均一性,则剩余溶液中溶质分数不变。
8.答案:(1)(2)(3)钾离子未除去
解析:粗盐水中含有的离子:。向粗盐水中加入稍过量的氯化钡溶液,与结合生成沉淀(固体A),溶液A中含有。向溶液A中加入稍过量的碳酸钠溶液,与结合生成沉淀(固体B),溶液B中含有。向溶液B中加入稍过量的盐酸与结合生成和,溶液C中含有。蒸发结晶过程中,HCl逸出,但钾离子没有被除去。
9.答案:(1). 漏斗 (2). (3). (4). (5). C
解析: (2)加入氢氧化钡溶液发生的反应是:、
、,沉淀b中含有和。
(3)X溶液的作用是除去和过量的,所以是碳酸钠溶液。
(4)滤液c中含有杂质氢氧化钠和碳酸钠,加入过量稀盐酸可以将它们除去,氢氧化钠与盐酸的反应是中和反应。
(5)氢氧化钡溶液过量时,上层清液中含有,碳酸钾、硫酸钠都能与反应生成白色沉淀,但碳酸钾也能与反应生成白色沉淀,故选C。
10.答案:(1)玻璃棒
(2) (或氯化镁);
(3)NaOH(或氢氧化钠)
(4)沉淀部分溶解
(5)A
解析:(1)溶解时用玻璃棒搅拌可加速溶解。
(2)氯化镁能和氢氧化钠溶液反应生成氢氧化镁白色沉淀,加入过量氢氧化钠溶液,未出现明显现象,说明粗盐溶液中没有氯化镁;碳酸钠溶液能和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为。
(3)步骤2中,滴加过量的氯化钡溶液既可以除去杂质,又可以除去步骤1中过量的碳酸钠,滴加稀盐酸的目的是除去溶液中过量的氢氧化钠。
(4)碳酸钡能和稀盐酸反应,硫酸钡不能和稀盐酸反应,沉淀部分溶解说明沉淀中含有硫酸钡,进一步说明粗盐中含有硫酸钠杂质,其和氯化钡溶液反应生成了硫酸钡沉淀。
(5)步骤1和步骤2操作完成后,所得溶液中会含有氯化钡杂质,碳酸钠溶液和氯化钡溶液位置对调后,碳酸钠能除去过量的氯化钡,过量的碳酸钠可用稀盐酸除去。
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
