4.3.1 氧气课件—2021-2022学年九年级化学鲁教版上册(31张PPT)
文档属性
| 名称 | 4.3.1 氧气课件—2021-2022学年九年级化学鲁教版上册(31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-20 21:58:18 | ||
图片预览









文档简介
(共31张PPT)
4.3.1 氧气
氧气是化学实验室中时常用到的一种药品。
那么在实验室条件下,我们一般是怎么制取氧气的呢?
实验室制取氧气的常用方法
1.加热高锰酸钾(KMnO4)
2.分解过氧化氢(H2O2)溶液
3.加热氯酸钾(KClO3)和二氧化锰(MnO2)的混合物
一、高锰酸钾制氧气
高锰酸钾是一种暗紫色固体,受热时,分解出氧气,同时还有锰酸钾和二氧化锰生成
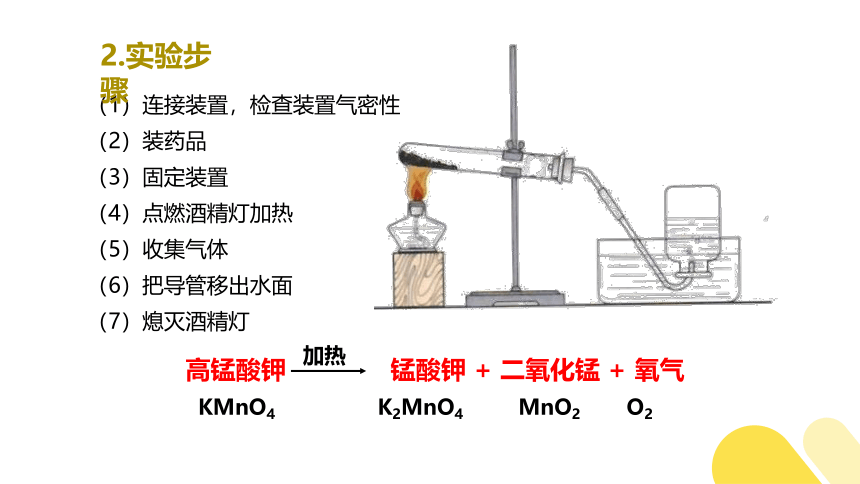
1.实验装置
酒精灯、试管、铁架台(带铁夹)、带导管的橡皮塞、水槽、集气瓶
(1)发生装置
该反应所需药品,只有固体物质高锰酸钾,且需要加热。所以采用加热固体药品的实验装置。
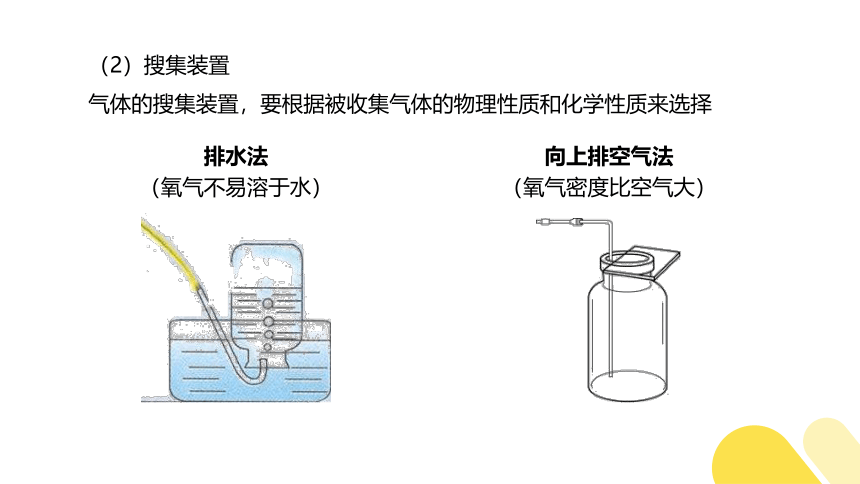
(2)搜集装置
气体的搜集装置,要根据被收集气体的物理性质和化学性质来选择
排水法
(氧气不易溶于水)
向上排空气法
(氧气密度比空气大)
(2)装药品
(4)点燃酒精灯加热
(5)收集气体
(6)把导管移出水面
(3)固定装置
(7)熄灭酒精灯
(1)连接装置,检查装置气密性
2.实验步骤
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
O2
K2MnO4
MnO2
KMnO4
(1)排水法
排水法搜集气体不需要特地验满。当气体充满集气瓶,且集气瓶口有较大气泡放出时,证明已收集满。
(2)向上排空气法
将带火星的木条放在集气瓶口,若木条复燃,证明已收集满。
3.验满方法
讨论探究
“检验氧气搜集满”和“检验瓶中气体是氧气”,都要用到带火星的木条。两者的操作方法一样吗?
验满操作,带火星的木条要放在集气瓶口,木条复燃,证明氧气已经搜集满了
检验氧气,带火星的木条要插入集气瓶内部,木条复燃,证明瓶内气体是氧气
讨论探究
实验结束,为什么要先从水槽中移除导管,再熄灭酒精灯?
如果先熄灭酒精灯,反应装置内气体冷却,压强减小。水槽中的水可能会在外界大气压的作用下倒吸入试管中,使试管因骤然冷却而炸裂。
先撤导管,再撤酒精灯
二、过氧化氢制氧气
纯净的过氧化氢是淡蓝色的黏稠液体,可任意比例与水混溶。水溶液俗称双氧水,为无色透明液体。3%浓度的双氧水适用于医用伤口消毒及环境消毒和食品消毒。
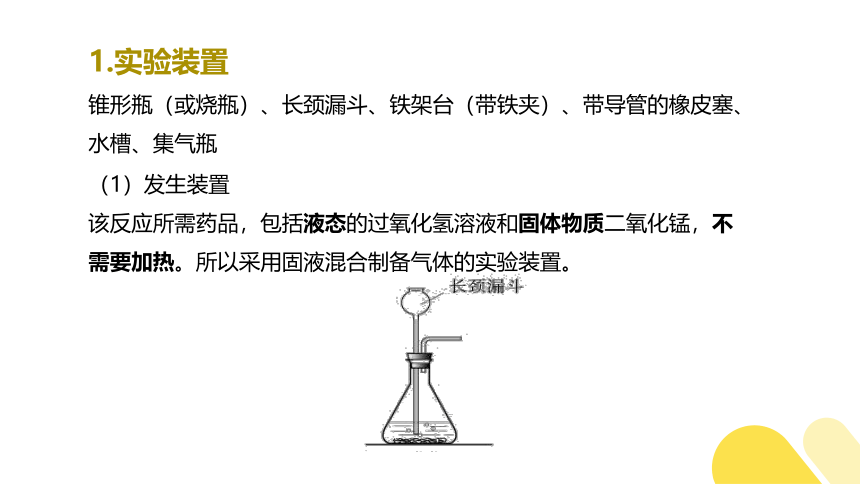
1.实验装置
锥形瓶(或烧瓶)、长颈漏斗、铁架台(带铁夹)、带导管的橡皮塞、水槽、集气瓶
(1)发生装置
该反应所需药品,包括液态的过氧化氢溶液和固体物质二氧化锰,不需要加热。所以采用固液混合制备气体的实验装置。
(2)搜集装置
排水法
(氧气不易溶于水)
向上排空气法
(氧气密度比空气大)
2.实验步骤
(2)装药品
(4)收集气体
(3)固定装置
(1)连接装置,检查装置气密性
二氧化锰
过氧化氢
H2O2
O2
氧气
+
水
H2O
讨论探究
1.在试管中加入5mL5%的过氧化氢溶液,把带火星的木条伸入试管,木条是否复燃。
2.向上述试管中加入少量二氧化锰,把带火星的木条伸入试管,观察现象。
3.待上述试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,观察现象。待试管中没有现象发生时,重复上述操作,观察现象。
实验编号 现 象 分 析
(1)
(2)
(3)
结论 带火星的木条复燃
带火星的木条复燃
带火星的木条不复燃
过氧化氢溶液常温下分解缓慢,放出的氧气很少
二氧化锰使过氧化氢分解加速
二氧化锰的化学性质没有改变
二氧化锰在过氧化氢的分解中起到了加快化学反应速率的作用,而本身的化学性质没有改变。
在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂(又叫触媒)。
3.催化剂
一变
二不变
改变其他物质的化学反应速率
在化学反应的前后不变
本身的质量
化学性质
①一个反应的催化剂并不一定是唯一的。
②没有催化剂并不是意味着不能进行反应,只是反应速率不同。
③催化剂不能增多或减少生成物的总质量。
催化
剂
④催化剂改变化学反应速率,有可能是加快也有可能是减缓。
三、氯酸钾制氧气
氯酸钾为无色片状结晶或白色颗粒粉末。常温下稳定,在400℃ 以上则分解并放出氧气,与还原剂、有机物、易燃物如硫、磷或金属粉末等混合加热时可发生爆炸。遇浓硫酸会爆炸。有毒,口服5~10克可致死
1.实验装置
酒精灯、试管、铁架台(带铁夹)、带导管的橡皮塞、水槽、集气瓶
(1)发生装置
该反应所需药品,包含固体物质氯酸钾和催化剂二氧化锰,且需要加热。所以采用加热固体药品的实验装置。
(2)搜集装置
排水法
(氧气不易溶于水)
向上排空气法
(氧气密度比空气大)
(2)装药品
(4)点燃酒精灯加热
(5)收集气体
(6)把导管移出水面
(3)固定装置
(7)熄灭酒精灯
(1)连接装置,检查装置气密性
2.实验步骤
氯酸钾
KClO3
氯化钾
KCl
+
氧气
O2
二氧化锰
加热
四、工业制氧气
实验室中常用过氧化氢或高锰酸钾分解制取氧气的方法,具有反应快、操作简便、便于收集等特点,但成本高,无法大量生产,只能用于实验室中。
工业生产则需考虑原料是否易得、价格是否便宜、成本是否低廉、能否大量生产以及对环境的影响等。
空气中约含21%的氧气,这是制取氧气的廉价、易得的原料。
分离液态空气法
在低温条件下加压,使空气转化成液态,然后蒸发,利用液态氮(沸点-196℃)和液态氧(沸点-183℃)的沸点不同,氮气先从液态空气中蒸发出来,剩余的主要为氧气。
膜分离法
在一定压力下,让空气通过具有富集氧气功能的薄膜,可得到含氧量较高的富氧空气。
贮存
液态氧贮存于蓝色钢瓶中。
讨论探究
氧气的工业制法和实验室制法的本质区别是什么?
氧气的工业制法是物理变化
氧气的实验室制法是化学变化
(1)说出图中标号仪器名称:① ;② 。
(2)如果用高锰酸钾制取氧气,发生装置选择 ,如果用过氧化氢制取氧气,发生装置选择 ;收集氧气可选择 。
1.探究过氧化氢溶液和二氧化锰制取氧气的装置。下面是实验室制取气体的一些装置,请按要求回答下列问题:
试管
A
集气瓶
B
C或E
2.实验室制取氧气,不宜选用的药品是( )
A.高锰酸钾 B.氯酸钾
C.过氧化氢 D.氧化汞
D
3.下列变化属于分解反应的是( )
A、从空气中分离出氧气和氮气
B、加热高锰酸钾制取氧气
C、红磷在氧气中燃烧生成五氧化二磷
D、蜡烛在氧气中燃烧生成二氧化碳和水
B
C
4.某同学加热氯酸钾制取氧气,错把高锰酸钾当作二氧化锰加热氯酸钾内,其结果与只加热氯酸钾相比,正确的是( )
A.反应速率不变
B.生成氧气的质量不变
C.反应速率加快,生成氧气的质量增加
D.反应速率加快,生成氧气的质量不变
5.下列方法都可用于制取氧气,但其中不属于分解反应的是( )
A.通过分离液态空气制取氧气
B.用过氧化氢溶液和二氧化锰制取氧气
C.加热高锰酸钾制取氧气
D.用氯酸钾与二氧化锰制取氧气
A
再 见
4.3.1 氧气
氧气是化学实验室中时常用到的一种药品。
那么在实验室条件下,我们一般是怎么制取氧气的呢?
实验室制取氧气的常用方法
1.加热高锰酸钾(KMnO4)
2.分解过氧化氢(H2O2)溶液
3.加热氯酸钾(KClO3)和二氧化锰(MnO2)的混合物
一、高锰酸钾制氧气
高锰酸钾是一种暗紫色固体,受热时,分解出氧气,同时还有锰酸钾和二氧化锰生成
1.实验装置
酒精灯、试管、铁架台(带铁夹)、带导管的橡皮塞、水槽、集气瓶
(1)发生装置
该反应所需药品,只有固体物质高锰酸钾,且需要加热。所以采用加热固体药品的实验装置。
(2)搜集装置
气体的搜集装置,要根据被收集气体的物理性质和化学性质来选择
排水法
(氧气不易溶于水)
向上排空气法
(氧气密度比空气大)
(2)装药品
(4)点燃酒精灯加热
(5)收集气体
(6)把导管移出水面
(3)固定装置
(7)熄灭酒精灯
(1)连接装置,检查装置气密性
2.实验步骤
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
O2
K2MnO4
MnO2
KMnO4
(1)排水法
排水法搜集气体不需要特地验满。当气体充满集气瓶,且集气瓶口有较大气泡放出时,证明已收集满。
(2)向上排空气法
将带火星的木条放在集气瓶口,若木条复燃,证明已收集满。
3.验满方法
讨论探究
“检验氧气搜集满”和“检验瓶中气体是氧气”,都要用到带火星的木条。两者的操作方法一样吗?
验满操作,带火星的木条要放在集气瓶口,木条复燃,证明氧气已经搜集满了
检验氧气,带火星的木条要插入集气瓶内部,木条复燃,证明瓶内气体是氧气
讨论探究
实验结束,为什么要先从水槽中移除导管,再熄灭酒精灯?
如果先熄灭酒精灯,反应装置内气体冷却,压强减小。水槽中的水可能会在外界大气压的作用下倒吸入试管中,使试管因骤然冷却而炸裂。
先撤导管,再撤酒精灯
二、过氧化氢制氧气
纯净的过氧化氢是淡蓝色的黏稠液体,可任意比例与水混溶。水溶液俗称双氧水,为无色透明液体。3%浓度的双氧水适用于医用伤口消毒及环境消毒和食品消毒。
1.实验装置
锥形瓶(或烧瓶)、长颈漏斗、铁架台(带铁夹)、带导管的橡皮塞、水槽、集气瓶
(1)发生装置
该反应所需药品,包括液态的过氧化氢溶液和固体物质二氧化锰,不需要加热。所以采用固液混合制备气体的实验装置。
(2)搜集装置
排水法
(氧气不易溶于水)
向上排空气法
(氧气密度比空气大)
2.实验步骤
(2)装药品
(4)收集气体
(3)固定装置
(1)连接装置,检查装置气密性
二氧化锰
过氧化氢
H2O2
O2
氧气
+
水
H2O
讨论探究
1.在试管中加入5mL5%的过氧化氢溶液,把带火星的木条伸入试管,木条是否复燃。
2.向上述试管中加入少量二氧化锰,把带火星的木条伸入试管,观察现象。
3.待上述试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,观察现象。待试管中没有现象发生时,重复上述操作,观察现象。
实验编号 现 象 分 析
(1)
(2)
(3)
结论 带火星的木条复燃
带火星的木条复燃
带火星的木条不复燃
过氧化氢溶液常温下分解缓慢,放出的氧气很少
二氧化锰使过氧化氢分解加速
二氧化锰的化学性质没有改变
二氧化锰在过氧化氢的分解中起到了加快化学反应速率的作用,而本身的化学性质没有改变。
在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂(又叫触媒)。
3.催化剂
一变
二不变
改变其他物质的化学反应速率
在化学反应的前后不变
本身的质量
化学性质
①一个反应的催化剂并不一定是唯一的。
②没有催化剂并不是意味着不能进行反应,只是反应速率不同。
③催化剂不能增多或减少生成物的总质量。
催化
剂
④催化剂改变化学反应速率,有可能是加快也有可能是减缓。
三、氯酸钾制氧气
氯酸钾为无色片状结晶或白色颗粒粉末。常温下稳定,在400℃ 以上则分解并放出氧气,与还原剂、有机物、易燃物如硫、磷或金属粉末等混合加热时可发生爆炸。遇浓硫酸会爆炸。有毒,口服5~10克可致死
1.实验装置
酒精灯、试管、铁架台(带铁夹)、带导管的橡皮塞、水槽、集气瓶
(1)发生装置
该反应所需药品,包含固体物质氯酸钾和催化剂二氧化锰,且需要加热。所以采用加热固体药品的实验装置。
(2)搜集装置
排水法
(氧气不易溶于水)
向上排空气法
(氧气密度比空气大)
(2)装药品
(4)点燃酒精灯加热
(5)收集气体
(6)把导管移出水面
(3)固定装置
(7)熄灭酒精灯
(1)连接装置,检查装置气密性
2.实验步骤
氯酸钾
KClO3
氯化钾
KCl
+
氧气
O2
二氧化锰
加热
四、工业制氧气
实验室中常用过氧化氢或高锰酸钾分解制取氧气的方法,具有反应快、操作简便、便于收集等特点,但成本高,无法大量生产,只能用于实验室中。
工业生产则需考虑原料是否易得、价格是否便宜、成本是否低廉、能否大量生产以及对环境的影响等。
空气中约含21%的氧气,这是制取氧气的廉价、易得的原料。
分离液态空气法
在低温条件下加压,使空气转化成液态,然后蒸发,利用液态氮(沸点-196℃)和液态氧(沸点-183℃)的沸点不同,氮气先从液态空气中蒸发出来,剩余的主要为氧气。
膜分离法
在一定压力下,让空气通过具有富集氧气功能的薄膜,可得到含氧量较高的富氧空气。
贮存
液态氧贮存于蓝色钢瓶中。
讨论探究
氧气的工业制法和实验室制法的本质区别是什么?
氧气的工业制法是物理变化
氧气的实验室制法是化学变化
(1)说出图中标号仪器名称:① ;② 。
(2)如果用高锰酸钾制取氧气,发生装置选择 ,如果用过氧化氢制取氧气,发生装置选择 ;收集氧气可选择 。
1.探究过氧化氢溶液和二氧化锰制取氧气的装置。下面是实验室制取气体的一些装置,请按要求回答下列问题:
试管
A
集气瓶
B
C或E
2.实验室制取氧气,不宜选用的药品是( )
A.高锰酸钾 B.氯酸钾
C.过氧化氢 D.氧化汞
D
3.下列变化属于分解反应的是( )
A、从空气中分离出氧气和氮气
B、加热高锰酸钾制取氧气
C、红磷在氧气中燃烧生成五氧化二磷
D、蜡烛在氧气中燃烧生成二氧化碳和水
B
C
4.某同学加热氯酸钾制取氧气,错把高锰酸钾当作二氧化锰加热氯酸钾内,其结果与只加热氯酸钾相比,正确的是( )
A.反应速率不变
B.生成氧气的质量不变
C.反应速率加快,生成氧气的质量增加
D.反应速率加快,生成氧气的质量不变
5.下列方法都可用于制取氧气,但其中不属于分解反应的是( )
A.通过分离液态空气制取氧气
B.用过氧化氢溶液和二氧化锰制取氧气
C.加热高锰酸钾制取氧气
D.用氯酸钾与二氧化锰制取氧气
A
再 见
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
