2.5物质的转化 同步练习(含解析)
图片预览


文档简介
物质的转化
一、单选题
1.能实现下列物质类别间直接转化的单质是( )
A. 氢气 B. 铜 C. 铁 D. 钙
2.甲、乙、丙、丁均为初中化学常见的物质,它们之间的部分转化关系如图所示(部分反应物、生成物和反应条件已略去.“-”表示物质之间能发生化学反应,“→”表示物质之间的转化关系).下列推论不正确的是( )
A. 若甲是碳酸钙,则乙转化成丙的反应可以是放热反应
B. 若甲是碳酸钠,乙是硫酸钠,则丁可以是氯化钡
C. 若乙是常用的溶剂,则丁可以是单质碳
D. 若丙是二氧化碳,丁是熟石灰,则丁可以通过复分解反应转化为乙
3.电脑芯片的制作要用到高纯度的硅。目前广泛采用石英砂(主要成分是SiO2)为原料制取,其中一步反应为SiO2+2C Si+2CO↑。对该反应分析正确的是( )
A. 该反应伴随着能量转化 B. 碳发生了还原反应
C. 碳元索化合价由0价变为+4价 D. 该反应利用了CO的还原性
4.用电设备发生火灾时,可用装有液态四氯化碳的“灭火弹”扑灭。灭火时,液态四氯化碳迅速转化为气态并覆盖在火焰上。据此推测四氯化碳可能具有的性质是( )
A. 能导电 B. 不易燃烧 C. 不易汽化 D. 密度比空气小
5.如图中“﹣”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质,部分反应物、生成物及反应条件未标出.则不可能出现的情况是( )
A. 甲是H2、乙是O2 B. 甲是HCl,丙是NaCl
C. 乙是CO,丙是CO2 D. 乙是Cu(OH)2、丙是CuSO4
6.甲、乙、丙有如图所示的转化关系(“→”表示反应能一步实现,部分反应物和反应条件略去)下列各组物质按照甲、乙、丙的顺序符合要求的是( )
A. Fe(NO3)3、FeCl3、Fe(OH)3 B. C,CO2 , CO
C. CaCO3、Ca(OH)2、CaO D. CuO、Cu(OH)2、CuCl2
7.如图是物质的分类及部分转化关系图,有关说法正确的是( )
A. 用自来水制取蒸馏水属于转化a B. 转化c可能是物理变化
C. 转化c中一定有元素的化合价发生改变 D. 转化b一定是化学变化
8.如下无机物转化关系图中,每个转化在一定条件下均能按箭头方向一步实现的是( )
A. 只有①② B. 只有①③ C. 只有②③ D. ①②③都是
9.A、B、C、D、E是初中化学常见的物质。其中A是通常状况下密度最小的气体,B和C反应可形成蓝色溶液,D在农业上可用来改良酸性土壤。它们的相互关系如图所示(图中“一”表示两端的物质能发生化学反应,“一”表示物质间的转化关系,部分反应物、生成物及反应条件已略去)。下列说法错误的是( )
A. B的化学式为CuO B. C的物质类别是酸
C. E→A的化学方程式为2H2O 2H2↑+O2↑ D. D一E的转化一定是复分解反应
10.下列物质的一步转化过程不符合A B→C的是( )
A. CO CO2→CaCO3 B. CO2 C16H12O6→H2O
C. O2 H2O+H2 D. H2O O2→FeO
11.甲、乙、丙之间有如图所示的转化关系(其中的“→”表示某种物质可一步反应生成另一种物质,部分反应物和反应条件略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是( )
A. C、CO2、CO B. H2O2、O2、H2O C. NaOH、NaCl、NaNO3 D. CuO、Cu、Cu(NO3)2
12.下列选项所示的物质转化均能一步实现的是( )
A. S SO2 H2SO4 B. CuO CuSO4 CuCl2
C. Fe Fe2O3 Fe(OH)3 D. CO2 Na2CO3 NaOH
二、填空题
13.如图是初中科学中常见的一些氧化物和单质之间的相互转化关系。其中单质Ⅰ为红色固体,氧化物Ⅰ和单质Ⅲ均为黑色固体,氧化物Ⅲ能使澄清石灰水变浑浊。则:
(1)反应①中________(填化学式)被还原。
(2)氧化物Ⅱ除图中所示的化学性质外,还具有________性,对人体有危害。
(3)根据题意,写出反应④的化学方程式:________。
14.有一种将CO2转化的实验流程(如图所示),该实验流程中CO2转化的最终产物为 (写化学式,下同),有一种可循环利用的物质是 。
三、解答题
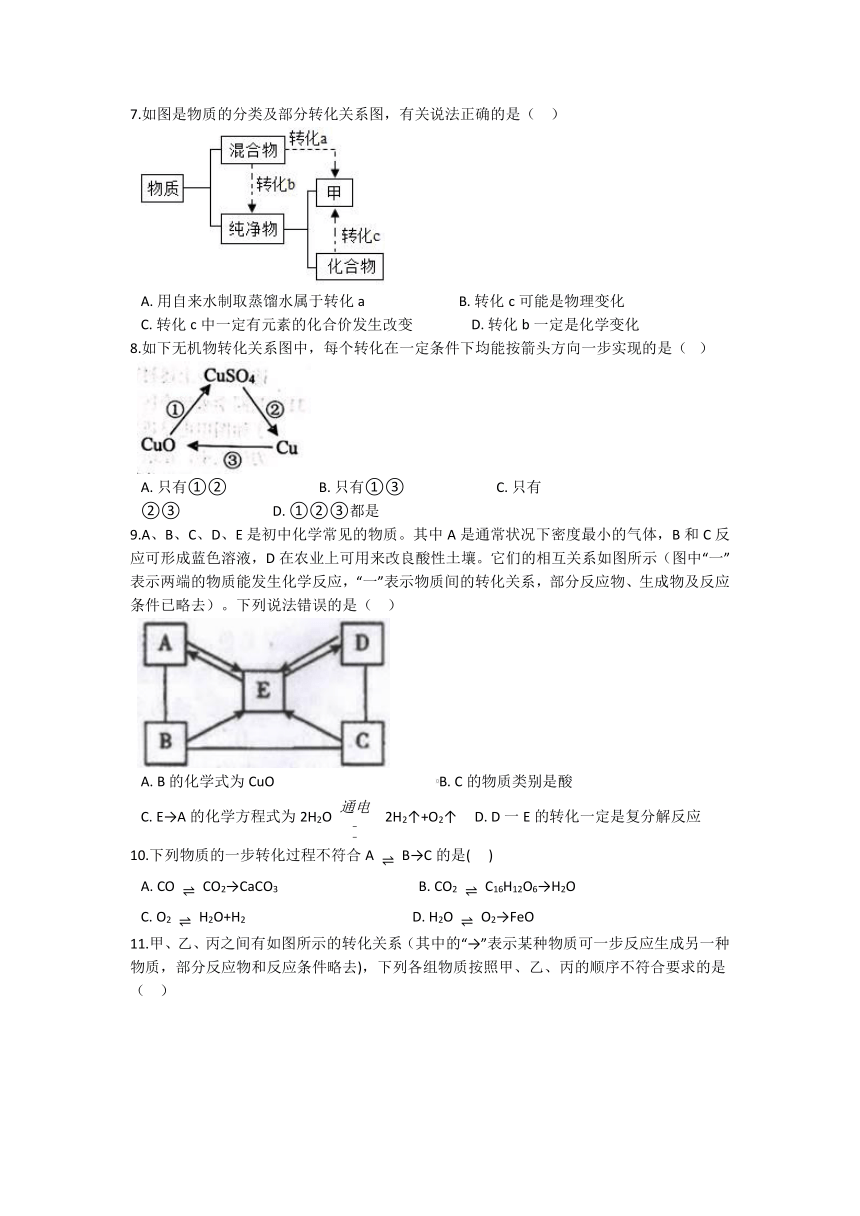
15.采用“双碱法”使烟气(含SO2)脱硫是我国目前环保领域的的经济、实用、高效的一种方法。其脱硫(除去烟气中的二氧化硫)的工业流程如下,试回答:
(1).吸收塔中,用NaOH溶液吸收SO2生成亚硫酸钠(Na2SO3)和水。NaOH溶液喷洒成雾状来吸收SO2的好处是 。
(2).写出沉淀室中发生的反应化学方程式 。
(3).“双碱法”中实际使用的碱原料只有 (填名称或化学式)。
四、实验探究题
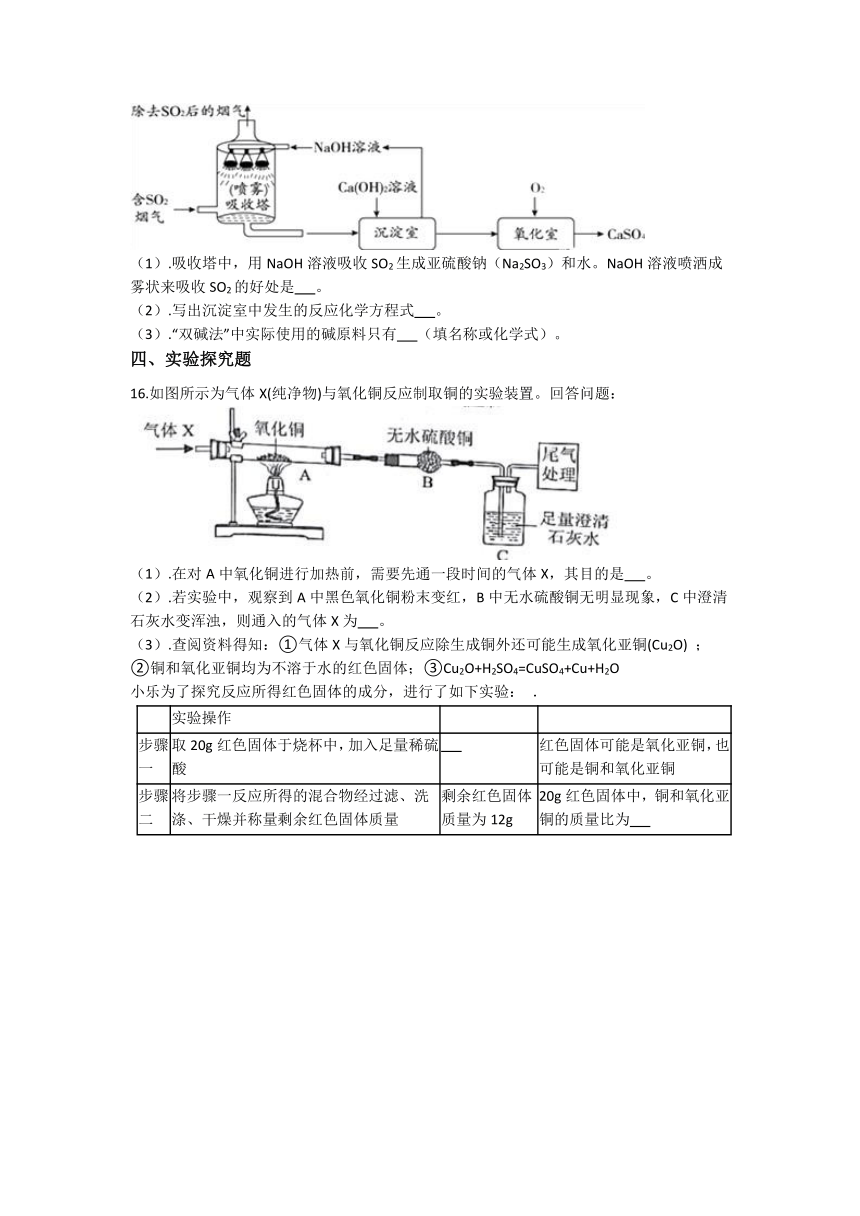
16.如图所示为气体X(纯净物)与氧化铜反应制取铜的实验装置。回答问题:
(1).在对A中氧化铜进行加热前,需要先通一段时间的气体X,其目的是 。
(2).若实验中,观察到A中黑色氧化铜粉末变红,B中无水硫酸铜无明显现象,C中澄清石灰水变浑浊,则通入的气体X为 。
(3).查阅资料得知:①气体X与氧化铜反应除生成铜外还可能生成氧化亚铜(Cu2O) ;
②铜和氧化亚铜均为不溶于水的红色固体;③Cu2O+H2SO4=CuSO4+Cu+H2O
小乐为了探究反应所得红色固体的成分,进行了如下实验: .
实验操作
步骤一 取20g红色固体于烧杯中,加入足量稀硫酸 红色固体可能是氧化亚铜,也可能是铜和氧化亚铜
步骤二 将步骤一反应所得的混合物经过滤、洗涤、干燥并称量剩余红色固体质量 剩余红色固体质量为12g 20g红色固体中,铜和氧化亚铜的质量比为
答案解析部分
一、单选题
1.【答案】 D
【解析】【分析】根据氢气、铜、铁、钙与氧气反应生成的氧化物的性质分析。
【解答】A、氢气与氧气反应生成水,加水无法生成酸或碱,不符合题意;
B、铜与氧气反应生成氧化铜,氧化铜不与水反应,不符合题意;
C、铁与氧气反应生成四氧化三铁,四氧化三铁与水不反应,不符合题意;
D、钙与氧气反应生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙与酸反应生成盐,符合题意;
故选D。
2.【答案】 B
【解析】【分析】本题为推断题,根据各小题中所给提示先确定出转化关系中直接可以判断出的物质,然后再利用该物质的性质及转化关系推导出其它物质,结合选项所给内容进行判断。
【解答】A、 若甲是碳酸钙,则乙转化成丙的反应可以是氧化钙与水化合生成氢氧化钙,属于放热反应,不符合题意;
B、 若甲是碳酸钠,乙是硫酸钠,若丁是氯化钡,则没有满足该关系式的丙物质,符合题意;
C、 若乙是常用的溶剂,丙可以是氧气,丁可以是单质碳,甲可以是金属氧化物,不符合题意;
D、 若丙是二氧化碳,丁是熟石灰,甲可以是碳酸钠,乙可以是碳酸钙,则丁可以通过与碳酸钠发生复分解反应转化为乙 ,不符合题意;
故答案为:B。
3.【答案】 A
【解析】【分析】 SiO2+2C Si+2CO↑,SiO2→Si化合价由+4价变成了0价,化合价降低是氧化剂,被还原,被还原的物质是SiO2;C→CO化合价由0价变成+2价,化合价升高是还原剂,被氧化,还原剂是SiO2。
【解答】A、该反应伴随着能量转化,A符合题意。
B、碳在反应中得到氧元素,被氧化,是还原剂,发生了氧化反应,B不符合题意。
C、碳元索化合价由0价变为+4价,C不符合题意。
D、一氧化碳是该反应的生成物,不是还原剂,D不符合题意。
故答案为:A
4.【答案】 B
【解析】【分析】根据相关现象推测四氯化碳的性质即可。
【解答】A.用电器本身带电,如果四氯化碳能导电,肯定会形成短路现象,故A错误;
B.四氯化碳能够灭火,说明它本身不易燃烧,故B正确;
C.液态的四氯化碳受热后迅速转化为气态,说明它容易汽化,故C错误;
D.四氯化碳气体能够覆盖在火焰上,说明它的密度大于空气,故D错误。
故选B。
5.【答案】 B
【解析】【分析】根据题中所给反应关系逐项代入检验分析,掌握所给物质的性质是解题关键。
【解答】A、甲是氢气,乙是氧气,则丙可以是水,符合转化关系,不符合题意;
B、甲是盐酸,丙是氯化钠,氯化钠无法与乙进行相互转化,符合题意;
C、乙是一氧化碳,丙是二氧化碳,则甲可以是氧气,不符合题意;
D、乙是氢氧化铜,再是硫酸铜,则甲可以是硫酸,不符合题意;
故答案为:B。
6.【答案】 B
【解析】【分析】 一步反应,是指反应物一步就直接转变为生成物的反应称为元反应,又称简单反应。
【解答】A、硝酸铁不能一步转化为氯化铁;故A错误;
B、碳燃烧或者氧化还原反应可以直接转变为二氧化碳,二氧化碳与碳在高温条件下可以转化为一氧化碳;故B正确;
C、碳酸钙不能直接转化为氢氧化钙;故C错误;
D、氧化铜不能直接转化为氢氧化铜;故D错误;
故答案为:B。
7.【答案】 C
【解析】【分析】考查物质的分类和物质转化的变化区分。
【解答】A:自来水制取蒸馏水,混合物变成纯净物,错误;
B:化合物转化成甲,一定是化学变化,错误;
C:根据图意可以推断甲属于单质,有单质生成,一定会有化合价变化,正确;
D:混合物转化成纯净物不一定是化学变化,如空气分离氧气,错误;
故选:C
8.【答案】 D
【解析】【分析】根据金属氧化物与酸能反应生成盐,盐可与金属置换生成金属,金属可与氧气反应生成金属氧化物分析。
【解答】氧化铜与硫酸反应可生成硫酸铜,硫酸铜与铁反应可生成铜,铜与氧气反应可生成氧化铜 ,三个反应都可实现;
故答案为:D。
9.【答案】 D
【解析】【分析】本题考查了物质的推断,在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
【解答】 A是通常状况下密度最小的气体,则A为氢气,B和C反应可形成蓝色溶液,B能与A反应,则B为氧化铜,C为酸,D在农业上可用来改良酸性土壤,D为氢氧化钙,E为水;
A、B 的化学式为CuO ,说法正确;
B、 C的物质类别是酸 ,说法正确;
C、 E→A的化学方程式为2H2O 2H2↑+O2↑ ,说法正确;
D、 D一E的转化为氢氧化钙与水的转化,水变氢氧化钙可以是氧化钙与水化合,不是复分解反应,说法错误;
故答案为:D。
10.【答案】 D
【解析】【分析】根据所给各组内物质的性质判断其转化是否可行分析。
【解答】A、一氧化碳在氧气中燃烧可生成二氧化碳,二氧化碳与碳高温反应生成一氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙,不符合题意;
B、二氧化碳通过光合作用可以生成 C16H12O6 , C16H12O6 与氧气反应可生成二氧化碳和水,不符合题意;
C、氧气与氢气反应可生成水,水通电分解可生成氧气和氢气,不符合题意;
D、水和氧气可相互转化,但氧气不能转化氧化亚铁,符合题意;
故答案为:D。
11.【答案】 C
【解析】【分析】根据图示中各物质间的转化关系,结合所给出物质的性质,由反应物及生成物来判断反应是否完成分析。
【解答】 A、碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,一氧化碳与氧气反应能生成二氧化碳,不符合题意;
B、过氧化氢分解生成水和氧气,水通电分解能生成氧气,不符合题意;
C、氢氧化钠分别与盐酸、硝酸反应生成氯化钠、硝酸钠,但硝酸钠不能生成氯化钠,符合题意;
D、氧化铜与还原剂反应能生成铜,与硝酸反应能生成硝酸铜,铁与硝酸铜反应能生成铜,不符合题意;
故答案为:C。
12.【答案】 D
【解析】【分析】根据所给物质间的转化分析,熟记各物质的性质,由此判断所给物质间是否能发生反应,且是否生成对应的物质。
【解答】A、二氧化硫与水化合形成亚硫酸,不符合题意;
B、硫酸铜与稀盐酸不发生反应,不符合题意;
C、铁与氧气反应生成四氧化三铁,且氧化铁与水不能发生反应,不符合题意;
D、二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,符合题意;
故答案为:D。
二、填空题
13.【答案】 (1)CuO
(2)毒
(3)CO2+C 2CO
【解析】【分析】先根据铜、氧化铜、一氧化碳的性质及图中转化关系推导出所有物质后,按题中要求进行填空解答即可。
【解答】(1) 单质Ⅰ为红色固体,氧化物Ⅰ和单质Ⅲ均为黑色固体,则氧化物Ⅰ为氧化铜,单质Ⅰ为铜,氧化物Ⅲ能使澄清石灰水变浑浊 ,则为二氧化碳,氧化物 Ⅱ 能与单质 Ⅱ 反应生成二氧化碳,说明氧化物 Ⅱ 为一氧化碳,单质 Ⅱ 为氧气,单质III可与二氧化碳生成氧化物 Ⅱ ,则单质III为碳;
(1)反应 ①为一氧化碳与氧化铜的反应, CuO 被还原;
(2) 氧化物Ⅱ为一氧化碳,除图中所示的化学性质还原性外,还具有毒性,对人体有危害;
(3) 反应④为碳和二氧化碳转化成一氧化碳,化学方程式为 CO2+C 2CO ;
故答案为:(1)CuO ;(2)毒;(3) CO2+C 2CO 。
14.【答案】 C和O2、MgCl2·6H2O;HCl
【解析】【分析】根据流程图中所给各转化中反应物和生成物分析。
【解答】由流程图可知,该各步生成物有碳、盐酸、氧气和MgCl2·6H2O,但盐酸是前面反应的反应物,所以是可循环利用的物质,所以最终产物为C、MgCl2·6H2O、O2;
故答案为:C、MgCl2·6H2O、O2;HCl。
三、解答题
15.【答案】 (1)增大与二氧化硫的接触面积,从而充分吸收二氧化碳
(2)Ca(OH)2+Na2SO3=CaSO3↓+2NaOH
(3)氢氧化钙或Ca(OH)2
【解析】【分析】(1)SO2是气体分布在整个容器中,要快速有效吸收SO2可增大NaOH溶液与SO2接触的可能性;
(2)吸收塔中NaOH与SO2反应生成了Na2SO3 , Na2SO3进入沉淀室与Ca(OH)2发生反应;
(3)实验中出现了NaOH和Ca(OH)2 , 由流程图可知,NaOH可循环利用。
【解答】(1)由分析可知:吸收塔中,用NaOH溶液吸收SO2生成亚硫酸钠(Na2SO3)和水。NaOH溶液喷洒成雾状来吸收SO2的好处是增大与二氧化硫的接触面积,从而充分吸收二氧化碳;
(2)沉淀式中有Na2SO3和Ca(OH)2 , 所以反应的化学方程式为:Na2SO3+Ca(OH)2=2NaOH+CaSO3↓;
(3)由流程图可知NaOH可循环使用,所以“双碱法”中实际使用的碱原料只有Ca(OH)2。
故答案为:(1)增大与二氧化硫的接触面积,从而充分吸收二氧化碳;(2)Ca(OH)2+Na2SO3=CaSO3↓+2NaOH;(3)氢氧化钙或Ca(OH)2
四、实验探究题
16.【答案】 (1)排尽A中的空气,防止加热时发生爆炸
(2)一氧化碳(或CO)
(3)烧杯中有红色固体,溶液由无色变为蓝色。;7:18
【解析】【分析】(1)如果气体X中混有空气,那么它们受热后很容易发生爆炸,因此需要提前排进装置A中的空气;
(2)A中氧化铜粉末变红,说明它被还原,那么气体X可能为氢气或一氧化碳。B中无水硫酸铜没有变化,说明反应没有水生成,C中澄清的石灰水变浑浊,说明产生了二氧化碳,那么通入的气体应该是一氧化碳。
(3)步骤一:氧化亚铜与稀硫酸反应,生成硫酸铜,铜和水,铜呈红色,而硫酸铜溶液呈蓝色,因此烧杯中肯定有红色固体存在,而溶液变成蓝色。其中的铜可能是原来就有的,也可能是反应生成的。
步骤二:根据氧化亚铜与稀硫酸反应的方程式,利用反应前后固体质量的变化量计算出参加反应的氧化亚铜的质量,再用20g减去氧化亚铜的质量得到铜的质量,最后做比即可。
【解答】(1)在对A中氧化铜进行加热前,需要先通一段时间的气体X,其目的是:排尽A中的空气,防止加热时发生爆炸。
(2)若实验中,观察到A中黑色氧化铜粉末变红,B中无水硫酸铜无明显现象,C中澄清石灰水变浑浊,则通入的气体X为一氧化碳(或CO)。
(3)设参加反应的氧化亚铜的质量为x,
Cu2O+H2SO4=CuSO4+Cu+H2O ;
144 64 144-64=80
x 20g-12g=8g;
;
解得:x=14.4g;
那么铜和氧化亚铜的质量之比:(20g-14.4g):14.4g=7:18。
实验操作
步骤一 取20g红色固体于烧杯中,加入足量稀硫酸 烧杯中有红色固体,溶液由无色变为蓝色。 红色固体可能是氧化亚铜,也可能是铜和氧化亚铜
步骤二 将步骤一反应所得的混合物经过滤、洗涤、干燥并称量剩余红色固体质量 剩余红色固体质量为12g 20g红色固体中,铜和氧化亚铜的质量比为7:18
一、单选题
1.能实现下列物质类别间直接转化的单质是( )
A. 氢气 B. 铜 C. 铁 D. 钙
2.甲、乙、丙、丁均为初中化学常见的物质,它们之间的部分转化关系如图所示(部分反应物、生成物和反应条件已略去.“-”表示物质之间能发生化学反应,“→”表示物质之间的转化关系).下列推论不正确的是( )
A. 若甲是碳酸钙,则乙转化成丙的反应可以是放热反应
B. 若甲是碳酸钠,乙是硫酸钠,则丁可以是氯化钡
C. 若乙是常用的溶剂,则丁可以是单质碳
D. 若丙是二氧化碳,丁是熟石灰,则丁可以通过复分解反应转化为乙
3.电脑芯片的制作要用到高纯度的硅。目前广泛采用石英砂(主要成分是SiO2)为原料制取,其中一步反应为SiO2+2C Si+2CO↑。对该反应分析正确的是( )
A. 该反应伴随着能量转化 B. 碳发生了还原反应
C. 碳元索化合价由0价变为+4价 D. 该反应利用了CO的还原性
4.用电设备发生火灾时,可用装有液态四氯化碳的“灭火弹”扑灭。灭火时,液态四氯化碳迅速转化为气态并覆盖在火焰上。据此推测四氯化碳可能具有的性质是( )
A. 能导电 B. 不易燃烧 C. 不易汽化 D. 密度比空气小
5.如图中“﹣”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质,部分反应物、生成物及反应条件未标出.则不可能出现的情况是( )
A. 甲是H2、乙是O2 B. 甲是HCl,丙是NaCl
C. 乙是CO,丙是CO2 D. 乙是Cu(OH)2、丙是CuSO4
6.甲、乙、丙有如图所示的转化关系(“→”表示反应能一步实现,部分反应物和反应条件略去)下列各组物质按照甲、乙、丙的顺序符合要求的是( )
A. Fe(NO3)3、FeCl3、Fe(OH)3 B. C,CO2 , CO
C. CaCO3、Ca(OH)2、CaO D. CuO、Cu(OH)2、CuCl2
7.如图是物质的分类及部分转化关系图,有关说法正确的是( )
A. 用自来水制取蒸馏水属于转化a B. 转化c可能是物理变化
C. 转化c中一定有元素的化合价发生改变 D. 转化b一定是化学变化
8.如下无机物转化关系图中,每个转化在一定条件下均能按箭头方向一步实现的是( )
A. 只有①② B. 只有①③ C. 只有②③ D. ①②③都是
9.A、B、C、D、E是初中化学常见的物质。其中A是通常状况下密度最小的气体,B和C反应可形成蓝色溶液,D在农业上可用来改良酸性土壤。它们的相互关系如图所示(图中“一”表示两端的物质能发生化学反应,“一”表示物质间的转化关系,部分反应物、生成物及反应条件已略去)。下列说法错误的是( )
A. B的化学式为CuO B. C的物质类别是酸
C. E→A的化学方程式为2H2O 2H2↑+O2↑ D. D一E的转化一定是复分解反应
10.下列物质的一步转化过程不符合A B→C的是( )
A. CO CO2→CaCO3 B. CO2 C16H12O6→H2O
C. O2 H2O+H2 D. H2O O2→FeO
11.甲、乙、丙之间有如图所示的转化关系(其中的“→”表示某种物质可一步反应生成另一种物质,部分反应物和反应条件略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是( )
A. C、CO2、CO B. H2O2、O2、H2O C. NaOH、NaCl、NaNO3 D. CuO、Cu、Cu(NO3)2
12.下列选项所示的物质转化均能一步实现的是( )
A. S SO2 H2SO4 B. CuO CuSO4 CuCl2
C. Fe Fe2O3 Fe(OH)3 D. CO2 Na2CO3 NaOH
二、填空题
13.如图是初中科学中常见的一些氧化物和单质之间的相互转化关系。其中单质Ⅰ为红色固体,氧化物Ⅰ和单质Ⅲ均为黑色固体,氧化物Ⅲ能使澄清石灰水变浑浊。则:
(1)反应①中________(填化学式)被还原。
(2)氧化物Ⅱ除图中所示的化学性质外,还具有________性,对人体有危害。
(3)根据题意,写出反应④的化学方程式:________。
14.有一种将CO2转化的实验流程(如图所示),该实验流程中CO2转化的最终产物为 (写化学式,下同),有一种可循环利用的物质是 。
三、解答题
15.采用“双碱法”使烟气(含SO2)脱硫是我国目前环保领域的的经济、实用、高效的一种方法。其脱硫(除去烟气中的二氧化硫)的工业流程如下,试回答:
(1).吸收塔中,用NaOH溶液吸收SO2生成亚硫酸钠(Na2SO3)和水。NaOH溶液喷洒成雾状来吸收SO2的好处是 。
(2).写出沉淀室中发生的反应化学方程式 。
(3).“双碱法”中实际使用的碱原料只有 (填名称或化学式)。
四、实验探究题
16.如图所示为气体X(纯净物)与氧化铜反应制取铜的实验装置。回答问题:
(1).在对A中氧化铜进行加热前,需要先通一段时间的气体X,其目的是 。
(2).若实验中,观察到A中黑色氧化铜粉末变红,B中无水硫酸铜无明显现象,C中澄清石灰水变浑浊,则通入的气体X为 。
(3).查阅资料得知:①气体X与氧化铜反应除生成铜外还可能生成氧化亚铜(Cu2O) ;
②铜和氧化亚铜均为不溶于水的红色固体;③Cu2O+H2SO4=CuSO4+Cu+H2O
小乐为了探究反应所得红色固体的成分,进行了如下实验: .
实验操作
步骤一 取20g红色固体于烧杯中,加入足量稀硫酸 红色固体可能是氧化亚铜,也可能是铜和氧化亚铜
步骤二 将步骤一反应所得的混合物经过滤、洗涤、干燥并称量剩余红色固体质量 剩余红色固体质量为12g 20g红色固体中,铜和氧化亚铜的质量比为
答案解析部分
一、单选题
1.【答案】 D
【解析】【分析】根据氢气、铜、铁、钙与氧气反应生成的氧化物的性质分析。
【解答】A、氢气与氧气反应生成水,加水无法生成酸或碱,不符合题意;
B、铜与氧气反应生成氧化铜,氧化铜不与水反应,不符合题意;
C、铁与氧气反应生成四氧化三铁,四氧化三铁与水不反应,不符合题意;
D、钙与氧气反应生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙与酸反应生成盐,符合题意;
故选D。
2.【答案】 B
【解析】【分析】本题为推断题,根据各小题中所给提示先确定出转化关系中直接可以判断出的物质,然后再利用该物质的性质及转化关系推导出其它物质,结合选项所给内容进行判断。
【解答】A、 若甲是碳酸钙,则乙转化成丙的反应可以是氧化钙与水化合生成氢氧化钙,属于放热反应,不符合题意;
B、 若甲是碳酸钠,乙是硫酸钠,若丁是氯化钡,则没有满足该关系式的丙物质,符合题意;
C、 若乙是常用的溶剂,丙可以是氧气,丁可以是单质碳,甲可以是金属氧化物,不符合题意;
D、 若丙是二氧化碳,丁是熟石灰,甲可以是碳酸钠,乙可以是碳酸钙,则丁可以通过与碳酸钠发生复分解反应转化为乙 ,不符合题意;
故答案为:B。
3.【答案】 A
【解析】【分析】 SiO2+2C Si+2CO↑,SiO2→Si化合价由+4价变成了0价,化合价降低是氧化剂,被还原,被还原的物质是SiO2;C→CO化合价由0价变成+2价,化合价升高是还原剂,被氧化,还原剂是SiO2。
【解答】A、该反应伴随着能量转化,A符合题意。
B、碳在反应中得到氧元素,被氧化,是还原剂,发生了氧化反应,B不符合题意。
C、碳元索化合价由0价变为+4价,C不符合题意。
D、一氧化碳是该反应的生成物,不是还原剂,D不符合题意。
故答案为:A
4.【答案】 B
【解析】【分析】根据相关现象推测四氯化碳的性质即可。
【解答】A.用电器本身带电,如果四氯化碳能导电,肯定会形成短路现象,故A错误;
B.四氯化碳能够灭火,说明它本身不易燃烧,故B正确;
C.液态的四氯化碳受热后迅速转化为气态,说明它容易汽化,故C错误;
D.四氯化碳气体能够覆盖在火焰上,说明它的密度大于空气,故D错误。
故选B。
5.【答案】 B
【解析】【分析】根据题中所给反应关系逐项代入检验分析,掌握所给物质的性质是解题关键。
【解答】A、甲是氢气,乙是氧气,则丙可以是水,符合转化关系,不符合题意;
B、甲是盐酸,丙是氯化钠,氯化钠无法与乙进行相互转化,符合题意;
C、乙是一氧化碳,丙是二氧化碳,则甲可以是氧气,不符合题意;
D、乙是氢氧化铜,再是硫酸铜,则甲可以是硫酸,不符合题意;
故答案为:B。
6.【答案】 B
【解析】【分析】 一步反应,是指反应物一步就直接转变为生成物的反应称为元反应,又称简单反应。
【解答】A、硝酸铁不能一步转化为氯化铁;故A错误;
B、碳燃烧或者氧化还原反应可以直接转变为二氧化碳,二氧化碳与碳在高温条件下可以转化为一氧化碳;故B正确;
C、碳酸钙不能直接转化为氢氧化钙;故C错误;
D、氧化铜不能直接转化为氢氧化铜;故D错误;
故答案为:B。
7.【答案】 C
【解析】【分析】考查物质的分类和物质转化的变化区分。
【解答】A:自来水制取蒸馏水,混合物变成纯净物,错误;
B:化合物转化成甲,一定是化学变化,错误;
C:根据图意可以推断甲属于单质,有单质生成,一定会有化合价变化,正确;
D:混合物转化成纯净物不一定是化学变化,如空气分离氧气,错误;
故选:C
8.【答案】 D
【解析】【分析】根据金属氧化物与酸能反应生成盐,盐可与金属置换生成金属,金属可与氧气反应生成金属氧化物分析。
【解答】氧化铜与硫酸反应可生成硫酸铜,硫酸铜与铁反应可生成铜,铜与氧气反应可生成氧化铜 ,三个反应都可实现;
故答案为:D。
9.【答案】 D
【解析】【分析】本题考查了物质的推断,在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
【解答】 A是通常状况下密度最小的气体,则A为氢气,B和C反应可形成蓝色溶液,B能与A反应,则B为氧化铜,C为酸,D在农业上可用来改良酸性土壤,D为氢氧化钙,E为水;
A、B 的化学式为CuO ,说法正确;
B、 C的物质类别是酸 ,说法正确;
C、 E→A的化学方程式为2H2O 2H2↑+O2↑ ,说法正确;
D、 D一E的转化为氢氧化钙与水的转化,水变氢氧化钙可以是氧化钙与水化合,不是复分解反应,说法错误;
故答案为:D。
10.【答案】 D
【解析】【分析】根据所给各组内物质的性质判断其转化是否可行分析。
【解答】A、一氧化碳在氧气中燃烧可生成二氧化碳,二氧化碳与碳高温反应生成一氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙,不符合题意;
B、二氧化碳通过光合作用可以生成 C16H12O6 , C16H12O6 与氧气反应可生成二氧化碳和水,不符合题意;
C、氧气与氢气反应可生成水,水通电分解可生成氧气和氢气,不符合题意;
D、水和氧气可相互转化,但氧气不能转化氧化亚铁,符合题意;
故答案为:D。
11.【答案】 C
【解析】【分析】根据图示中各物质间的转化关系,结合所给出物质的性质,由反应物及生成物来判断反应是否完成分析。
【解答】 A、碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,一氧化碳与氧气反应能生成二氧化碳,不符合题意;
B、过氧化氢分解生成水和氧气,水通电分解能生成氧气,不符合题意;
C、氢氧化钠分别与盐酸、硝酸反应生成氯化钠、硝酸钠,但硝酸钠不能生成氯化钠,符合题意;
D、氧化铜与还原剂反应能生成铜,与硝酸反应能生成硝酸铜,铁与硝酸铜反应能生成铜,不符合题意;
故答案为:C。
12.【答案】 D
【解析】【分析】根据所给物质间的转化分析,熟记各物质的性质,由此判断所给物质间是否能发生反应,且是否生成对应的物质。
【解答】A、二氧化硫与水化合形成亚硫酸,不符合题意;
B、硫酸铜与稀盐酸不发生反应,不符合题意;
C、铁与氧气反应生成四氧化三铁,且氧化铁与水不能发生反应,不符合题意;
D、二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,符合题意;
故答案为:D。
二、填空题
13.【答案】 (1)CuO
(2)毒
(3)CO2+C 2CO
【解析】【分析】先根据铜、氧化铜、一氧化碳的性质及图中转化关系推导出所有物质后,按题中要求进行填空解答即可。
【解答】(1) 单质Ⅰ为红色固体,氧化物Ⅰ和单质Ⅲ均为黑色固体,则氧化物Ⅰ为氧化铜,单质Ⅰ为铜,氧化物Ⅲ能使澄清石灰水变浑浊 ,则为二氧化碳,氧化物 Ⅱ 能与单质 Ⅱ 反应生成二氧化碳,说明氧化物 Ⅱ 为一氧化碳,单质 Ⅱ 为氧气,单质III可与二氧化碳生成氧化物 Ⅱ ,则单质III为碳;
(1)反应 ①为一氧化碳与氧化铜的反应, CuO 被还原;
(2) 氧化物Ⅱ为一氧化碳,除图中所示的化学性质还原性外,还具有毒性,对人体有危害;
(3) 反应④为碳和二氧化碳转化成一氧化碳,化学方程式为 CO2+C 2CO ;
故答案为:(1)CuO ;(2)毒;(3) CO2+C 2CO 。
14.【答案】 C和O2、MgCl2·6H2O;HCl
【解析】【分析】根据流程图中所给各转化中反应物和生成物分析。
【解答】由流程图可知,该各步生成物有碳、盐酸、氧气和MgCl2·6H2O,但盐酸是前面反应的反应物,所以是可循环利用的物质,所以最终产物为C、MgCl2·6H2O、O2;
故答案为:C、MgCl2·6H2O、O2;HCl。
三、解答题
15.【答案】 (1)增大与二氧化硫的接触面积,从而充分吸收二氧化碳
(2)Ca(OH)2+Na2SO3=CaSO3↓+2NaOH
(3)氢氧化钙或Ca(OH)2
【解析】【分析】(1)SO2是气体分布在整个容器中,要快速有效吸收SO2可增大NaOH溶液与SO2接触的可能性;
(2)吸收塔中NaOH与SO2反应生成了Na2SO3 , Na2SO3进入沉淀室与Ca(OH)2发生反应;
(3)实验中出现了NaOH和Ca(OH)2 , 由流程图可知,NaOH可循环利用。
【解答】(1)由分析可知:吸收塔中,用NaOH溶液吸收SO2生成亚硫酸钠(Na2SO3)和水。NaOH溶液喷洒成雾状来吸收SO2的好处是增大与二氧化硫的接触面积,从而充分吸收二氧化碳;
(2)沉淀式中有Na2SO3和Ca(OH)2 , 所以反应的化学方程式为:Na2SO3+Ca(OH)2=2NaOH+CaSO3↓;
(3)由流程图可知NaOH可循环使用,所以“双碱法”中实际使用的碱原料只有Ca(OH)2。
故答案为:(1)增大与二氧化硫的接触面积,从而充分吸收二氧化碳;(2)Ca(OH)2+Na2SO3=CaSO3↓+2NaOH;(3)氢氧化钙或Ca(OH)2
四、实验探究题
16.【答案】 (1)排尽A中的空气,防止加热时发生爆炸
(2)一氧化碳(或CO)
(3)烧杯中有红色固体,溶液由无色变为蓝色。;7:18
【解析】【分析】(1)如果气体X中混有空气,那么它们受热后很容易发生爆炸,因此需要提前排进装置A中的空气;
(2)A中氧化铜粉末变红,说明它被还原,那么气体X可能为氢气或一氧化碳。B中无水硫酸铜没有变化,说明反应没有水生成,C中澄清的石灰水变浑浊,说明产生了二氧化碳,那么通入的气体应该是一氧化碳。
(3)步骤一:氧化亚铜与稀硫酸反应,生成硫酸铜,铜和水,铜呈红色,而硫酸铜溶液呈蓝色,因此烧杯中肯定有红色固体存在,而溶液变成蓝色。其中的铜可能是原来就有的,也可能是反应生成的。
步骤二:根据氧化亚铜与稀硫酸反应的方程式,利用反应前后固体质量的变化量计算出参加反应的氧化亚铜的质量,再用20g减去氧化亚铜的质量得到铜的质量,最后做比即可。
【解答】(1)在对A中氧化铜进行加热前,需要先通一段时间的气体X,其目的是:排尽A中的空气,防止加热时发生爆炸。
(2)若实验中,观察到A中黑色氧化铜粉末变红,B中无水硫酸铜无明显现象,C中澄清石灰水变浑浊,则通入的气体X为一氧化碳(或CO)。
(3)设参加反应的氧化亚铜的质量为x,
Cu2O+H2SO4=CuSO4+Cu+H2O ;
144 64 144-64=80
x 20g-12g=8g;
;
解得:x=14.4g;
那么铜和氧化亚铜的质量之比:(20g-14.4g):14.4g=7:18。
实验操作
步骤一 取20g红色固体于烧杯中,加入足量稀硫酸 烧杯中有红色固体,溶液由无色变为蓝色。 红色固体可能是氧化亚铜,也可能是铜和氧化亚铜
步骤二 将步骤一反应所得的混合物经过滤、洗涤、干燥并称量剩余红色固体质量 剩余红色固体质量为12g 20g红色固体中,铜和氧化亚铜的质量比为7:18
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
