2012温州市高中化学项目组优秀课例专题研修课件:高二《化学反应的焓变》 平阳十一中
文档属性
| 名称 | 2012温州市高中化学项目组优秀课例专题研修课件:高二《化学反应的焓变》 平阳十一中 |

|
|
| 格式 | zip | ||
| 文件大小 | 117.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-24 15:44:29 | ||
图片预览




文档简介
(共11张PPT)
单元1 化学反应中的热效应
专题一:化学反应与能量变化
高二化学化学反应原理
课时1 化学反应的焓变
平阳十一中 林天炜
氢能火箭上天
氢能的优点有哪些?
判断下列反应属于放热反应还是吸热反应
1、碳和氧气点燃
2、盐酸和氢氧化钠
3、镁条和稀硫酸
4、氧化钙和水
5、一氧化碳还原氧化铜
6、氢氧化钠和氯化铵
7、碳酸钙高温
燃烧反应
中和反应
金属和酸
大多数化合反应
CO、H2、C为还原剂的氧化还原反应
铵盐与碱
大多数分解反应
放热反应
放热反应
放热反应
放热反应
吸热反应
吸热反应
吸热反应
化学反应放出热量或吸收热量的本质原因是什么呢?
已知:H-H键能为436kJ mol-1; O= O键能
为498kJ mol-1; H-O键能为463kJ mol-1. 以2H2+O2=2H2O(g)为例,从旧化学键断裂和新化学键形成的角度,分析热量变化。
探究一:化学键角度
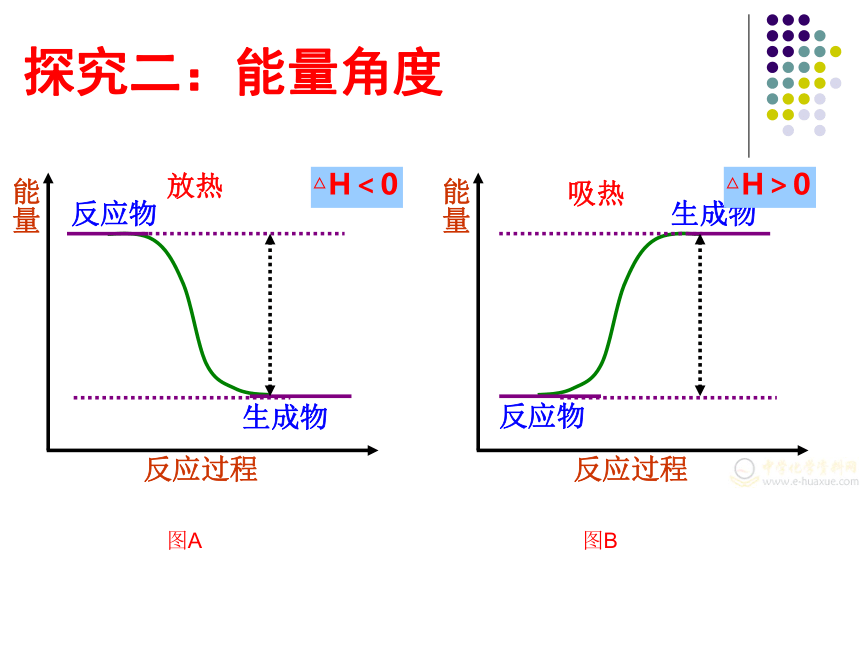
放热
反应物
生成物
能量
反应过程
△H<0
吸热
反应物
生成物
能量
反应过程
△H>0
探究二:能量角度
图A
图B
概念辨析
下列说法正确的是:( )
A.需要加热才能发生的反应一定是吸热反应;
B.任何放热反应在常温条件下一定能发生反应;
C.反应物和生成物所具有的总能量决定了是放热还是吸热;
D.吸热反应在一定条件下(如常温、加热等)也能发生反应.
CD
已知:2H2(g)+02(g)=2H2O(g);△H=-482kJ/mol
问题1、2H2(g)+02(g)=2H2O(l);△H=akJ/mol
a____ -482(填>、=或<)
<
问题2、H2(g)+1/202(g)=H2O(g);△H=bkJ/mol
b=?
b=-241kJ/mol
问题3、H2O(g)=H2(g)+1/202(g);△H=ckJ/mol
c=?
c=+241kJ/mol
①2SO2 + O2 = 2SO3 △H = -196 . 6kJ mol-1
巩固练习:
③ C(s) + O2(g) = CO2 (g) △H = + 393 .6kJ mol-1
判断下列热化学反应方程式书写是否正确?
×
×
×
已知:N2+3H2=2NH3的能量变化如下图所示。
(1)图中a、b、c分别表示什么含义?
(2)N2(g)+3H2(g)=2NH3(l); △H= 。
(3)已知 N2(g)与H2(g)反应生成17克NH3(g)时放出热量46.1 kJ,写出相关的热化学方程式。
(2a-2b-2c)kJ/mol
巩固提升
1/2N2(g)+3/2H2(g)=NH3(g); ΔH=-46.1kJ·mol-1
08海南)白磷与氧气可发生如下反应P4 +5O2 =P4O10 :已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A.(6a+5d-4c-12b) kJ·mol -1
B.(4c+12b-6a-5d) kJ·mol -1
C.(4c+12b-41-5d) kJ·mol -1
D.(4a+5d-4c-12b) kJ·mol -1
A
解析: P4 + 5O2 = P4O10
△H = 6 P-P + 5 O=O -(4 P=O +12 P-O)
△H =6a+5d-4c-12b
方法:
ΔH=E(反应物)总键能-E(生成物)总键能
(S)
(S)
(g)
△H =(6a+5d-4c-12b)KJ·mol-1
触摸高考
单元1 化学反应中的热效应
专题一:化学反应与能量变化
高二化学化学反应原理
课时1 化学反应的焓变
平阳十一中 林天炜
氢能火箭上天
氢能的优点有哪些?
判断下列反应属于放热反应还是吸热反应
1、碳和氧气点燃
2、盐酸和氢氧化钠
3、镁条和稀硫酸
4、氧化钙和水
5、一氧化碳还原氧化铜
6、氢氧化钠和氯化铵
7、碳酸钙高温
燃烧反应
中和反应
金属和酸
大多数化合反应
CO、H2、C为还原剂的氧化还原反应
铵盐与碱
大多数分解反应
放热反应
放热反应
放热反应
放热反应
吸热反应
吸热反应
吸热反应
化学反应放出热量或吸收热量的本质原因是什么呢?
已知:H-H键能为436kJ mol-1; O= O键能
为498kJ mol-1; H-O键能为463kJ mol-1. 以2H2+O2=2H2O(g)为例,从旧化学键断裂和新化学键形成的角度,分析热量变化。
探究一:化学键角度
放热
反应物
生成物
能量
反应过程
△H<0
吸热
反应物
生成物
能量
反应过程
△H>0
探究二:能量角度
图A
图B
概念辨析
下列说法正确的是:( )
A.需要加热才能发生的反应一定是吸热反应;
B.任何放热反应在常温条件下一定能发生反应;
C.反应物和生成物所具有的总能量决定了是放热还是吸热;
D.吸热反应在一定条件下(如常温、加热等)也能发生反应.
CD
已知:2H2(g)+02(g)=2H2O(g);△H=-482kJ/mol
问题1、2H2(g)+02(g)=2H2O(l);△H=akJ/mol
a____ -482(填>、=或<)
<
问题2、H2(g)+1/202(g)=H2O(g);△H=bkJ/mol
b=?
b=-241kJ/mol
问题3、H2O(g)=H2(g)+1/202(g);△H=ckJ/mol
c=?
c=+241kJ/mol
①2SO2 + O2 = 2SO3 △H = -196 . 6kJ mol-1
巩固练习:
③ C(s) + O2(g) = CO2 (g) △H = + 393 .6kJ mol-1
判断下列热化学反应方程式书写是否正确?
×
×
×
已知:N2+3H2=2NH3的能量变化如下图所示。
(1)图中a、b、c分别表示什么含义?
(2)N2(g)+3H2(g)=2NH3(l); △H= 。
(3)已知 N2(g)与H2(g)反应生成17克NH3(g)时放出热量46.1 kJ,写出相关的热化学方程式。
(2a-2b-2c)kJ/mol
巩固提升
1/2N2(g)+3/2H2(g)=NH3(g); ΔH=-46.1kJ·mol-1
08海南)白磷与氧气可发生如下反应P4 +5O2 =P4O10 :已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A.(6a+5d-4c-12b) kJ·mol -1
B.(4c+12b-6a-5d) kJ·mol -1
C.(4c+12b-41-5d) kJ·mol -1
D.(4a+5d-4c-12b) kJ·mol -1
A
解析: P4 + 5O2 = P4O10
△H = 6 P-P + 5 O=O -(4 P=O +12 P-O)
△H =6a+5d-4c-12b
方法:
ΔH=E(反应物)总键能-E(生成物)总键能
(S)
(S)
(g)
△H =(6a+5d-4c-12b)KJ·mol-1
触摸高考
同课章节目录
