2012温州市高中化学项目组优秀课例专题研修课件:高二《硫代硫酸钠与酸反应速率的影响因素》 瓯海二高
文档属性
| 名称 | 2012温州市高中化学项目组优秀课例专题研修课件:高二《硫代硫酸钠与酸反应速率的影响因素》 瓯海二高 |
|
|
| 格式 | zip | ||
| 文件大小 | 153.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-24 15:44:29 | ||
图片预览




文档简介
(共18张PPT)
知识回顾---《化学反应原理》P34
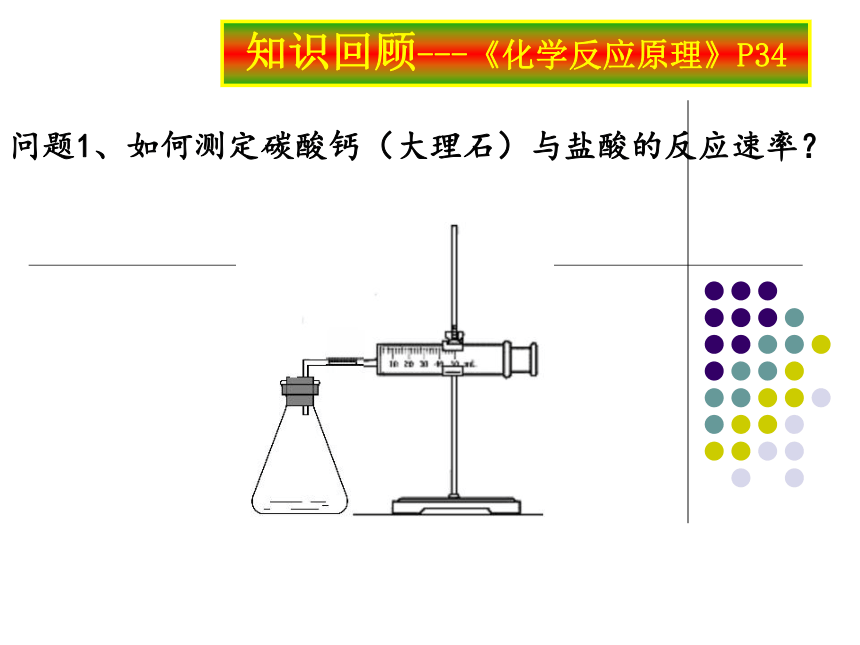
问题1、如何测定碳酸钙(大理石)与盐酸的反应速率?
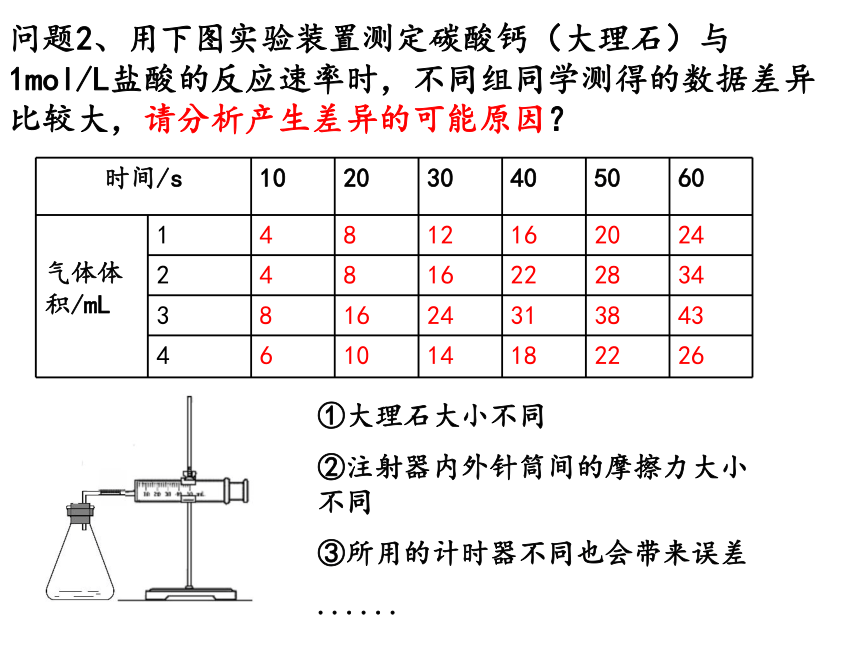
问题2、用下图实验装置测定碳酸钙(大理石)与1mol/L盐酸的反应速率时,不同组同学测得的数据差异比较大,请分析产生差异的可能原因?
①大理石大小不同
②注射器内外针筒间的摩擦力大小不同
③所用的计时器不同也会带来误差
......
时间/s 10 20 30 40 50 60
气体体积/mL 1 4 8 12 16 20 24
2 4 8 16 22 28 34
3 8 16 24 31 38 43
4 6 10 14 18 22 26
课题1:硫代硫酸钠与酸反应速率的影响因素
瓯海二高 金向弟
知识预备
1、影响化学反应快慢的外界因素有哪些?
浓度、压强、反应的温度、催化剂、接触面积等;
2、硫代硫酸钠的性质
单斜晶系白色结晶粉末,易溶于水。化学式:Na2S2O3 ,通常结合5个结晶水,即Na2S2O3·5H2O
俗名:大苏打 海波
用途:主要用于照相业作定影剂。
向Na2S2O3溶液中加入稀硫酸,可发生如下化学反应:Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2↑+S↓
知识预备
知识预备
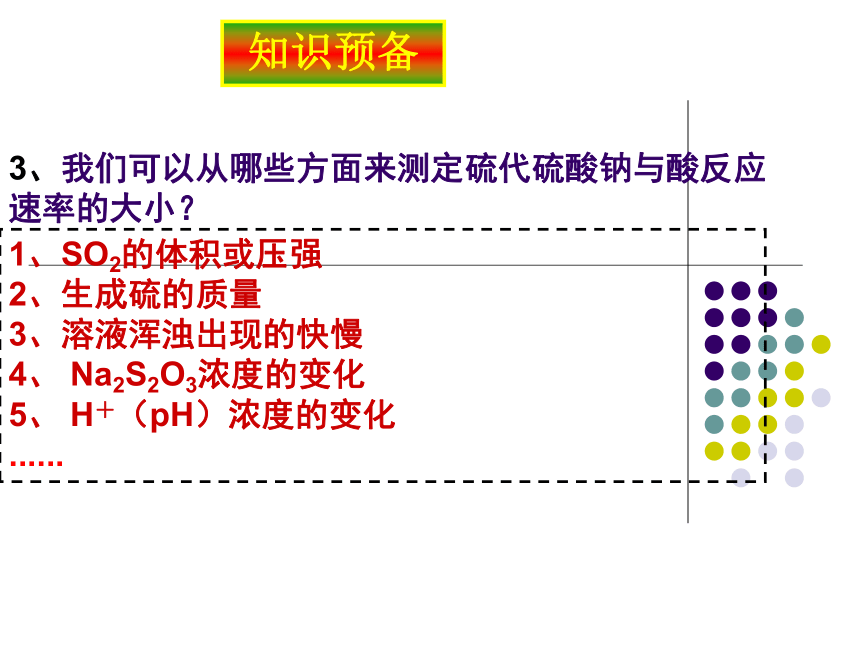
3、我们可以从哪些方面来测定硫代硫酸钠与酸反应速率的大小?
1、SO2的体积或压强
2、生成硫的质量
3、溶液浑浊出现的快慢
4、 Na2S2O3浓度的变化
5、 H+(pH)浓度的变化
......
4、如何比较该实验中出现浑浊的快慢?
在一张白纸上用黑色记号笔在合适的位置画上粗细、深浅一致的“+”,衬在反应容器(烧杯)的底部,实验以Na2S2O3(aq)和稀硫酸相混合时开始计时,到溶液出现的浑浊将烧杯底部的“+”完全遮盖时结束,通过比较记录的反应所需时间,可以判断反应速率的大小。
知识预备
课题方案设计
仪器:四个50mL的烧杯、两支试管、 四个10mL的量筒、计时器、 温度计、白纸、胶头滴管、洗瓶等
试剂:蒸馏水、热水、0.1mol/L的Na2S2O3溶液、0.1mol/L的H2SO4溶液、 0.2mol/L的HCl
【实验用品】
【实验设计】
烧杯编号 0.1mol/L的Na2S2O3溶液 蒸馏水 0.1mol/L的H2SO4溶液 反应
温度℃ 反应
时间
1 (对照组) 10mL 0mL 10mL 室温
2 5mL 5mL 10mL 室温
3 10mL 0mL 10mL 热水:
4
(药品自选) 室温
注:请说明设计实验4的研究目的。
[福建]某学生利用丙酮的溴代反应来研究反应物浓度与反应速率间的关系,其中反应速率v(Br2)是通过测定溴的颜色消失所需时间来确定,在一定温度下,获得如下实验数据,以下所得结论不正确的是…………..( )
溴代反应:
A、增大c(CH3COCH3),v(Br2)增大 B、实验②和③的v(Br2)相等
C、增大c(HCl),v(Br2)增大 D、增大c(Br2),v(Br2)增大
D
课堂练习
1、“碘钟”实验中,3I-+ S2O82- = I3-+SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol·L-1 0.040 0.080 0.080 0.160 0.120
c(S2O32-)/mol·L-1 0.040 0.040 0.080 0.120 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t1= 。
研究反应物I-与S2O82-浓度对反应速率的影响
29.3s
课堂练习
1、“碘钟”实验中,3I-+ S2O32- = I3-+SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol·L-1 0.040 0.080 0.080 0.160 0.120
c(S2O32-)/mol·L-1 0.040 0.040 0.080 0.120 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)。
A.<22s B.22—44s C.>44s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
A
反应速率与反应物起始浓度成正比
课题方案设计
【实验设计】
烧杯编号 0.1mol/L的Na2S2O3溶液 蒸馏水 0.1mol/L的H2SO4溶液 反应
温度℃ 反应
时间(s)
1 10mL 0mL 10mL 室温 60
2 5mL 5mL 10mL 室温 107
3 10mL 0mL 10mL 热水:50 17
4 10mL 5mL 5mL 室温 85
5 10mL 0mL 10mL 0.2mol/L的HCl溶液 室温 58
比较是人们研究各类问题的常用方法,找出事物的相同点和不同点,再进行分析。 在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即保证其他因素相同。
实验比较法
化学反应速率的测定方法
小结
2.测定一定时间所释放出气体的体积。
3.根据在溶液中的颜色变化,当反应物或产物本身有较明显的颜色时,人们常利用颜色深浅和显色物质的浓度间的正比关系来测量反应速率。
1、测定溶液浓度的变化
锥形瓶编号 0.1mol·L-1 Na2S2O3溶液(ml) 蒸馏水(ml) 0.1mol·L-1 H2SO4溶液(ml) 反应温度 反应时间
1 10 0 10 25℃ 2分24秒
4 5 5 10 25℃ 6分30秒
5 10 5 5 25℃ 3分30秒
表5
判断下列实验是研究何条件下对反应速率的影响?
(3)实验2、3的研究目的是
研究H2SO4浓度对相关反应速率的影响
一般思路
空白试验:
(对照组)
设计试验:
(实验组)
实验变量
操纵实验变量
无关变量
控制无关变量
反应变量
检测反应变量
对照分析
实验结论
知识回顾---《化学反应原理》P34
问题1、如何测定碳酸钙(大理石)与盐酸的反应速率?
问题2、用下图实验装置测定碳酸钙(大理石)与1mol/L盐酸的反应速率时,不同组同学测得的数据差异比较大,请分析产生差异的可能原因?
①大理石大小不同
②注射器内外针筒间的摩擦力大小不同
③所用的计时器不同也会带来误差
......
时间/s 10 20 30 40 50 60
气体体积/mL 1 4 8 12 16 20 24
2 4 8 16 22 28 34
3 8 16 24 31 38 43
4 6 10 14 18 22 26
课题1:硫代硫酸钠与酸反应速率的影响因素
瓯海二高 金向弟
知识预备
1、影响化学反应快慢的外界因素有哪些?
浓度、压强、反应的温度、催化剂、接触面积等;
2、硫代硫酸钠的性质
单斜晶系白色结晶粉末,易溶于水。化学式:Na2S2O3 ,通常结合5个结晶水,即Na2S2O3·5H2O
俗名:大苏打 海波
用途:主要用于照相业作定影剂。
向Na2S2O3溶液中加入稀硫酸,可发生如下化学反应:Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2↑+S↓
知识预备
知识预备
3、我们可以从哪些方面来测定硫代硫酸钠与酸反应速率的大小?
1、SO2的体积或压强
2、生成硫的质量
3、溶液浑浊出现的快慢
4、 Na2S2O3浓度的变化
5、 H+(pH)浓度的变化
......
4、如何比较该实验中出现浑浊的快慢?
在一张白纸上用黑色记号笔在合适的位置画上粗细、深浅一致的“+”,衬在反应容器(烧杯)的底部,实验以Na2S2O3(aq)和稀硫酸相混合时开始计时,到溶液出现的浑浊将烧杯底部的“+”完全遮盖时结束,通过比较记录的反应所需时间,可以判断反应速率的大小。
知识预备
课题方案设计
仪器:四个50mL的烧杯、两支试管、 四个10mL的量筒、计时器、 温度计、白纸、胶头滴管、洗瓶等
试剂:蒸馏水、热水、0.1mol/L的Na2S2O3溶液、0.1mol/L的H2SO4溶液、 0.2mol/L的HCl
【实验用品】
【实验设计】
烧杯编号 0.1mol/L的Na2S2O3溶液 蒸馏水 0.1mol/L的H2SO4溶液 反应
温度℃ 反应
时间
1 (对照组) 10mL 0mL 10mL 室温
2 5mL 5mL 10mL 室温
3 10mL 0mL 10mL 热水:
4
(药品自选) 室温
注:请说明设计实验4的研究目的。
[福建]某学生利用丙酮的溴代反应来研究反应物浓度与反应速率间的关系,其中反应速率v(Br2)是通过测定溴的颜色消失所需时间来确定,在一定温度下,获得如下实验数据,以下所得结论不正确的是…………..( )
溴代反应:
A、增大c(CH3COCH3),v(Br2)增大 B、实验②和③的v(Br2)相等
C、增大c(HCl),v(Br2)增大 D、增大c(Br2),v(Br2)增大
D
课堂练习
1、“碘钟”实验中,3I-+ S2O82- = I3-+SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol·L-1 0.040 0.080 0.080 0.160 0.120
c(S2O32-)/mol·L-1 0.040 0.040 0.080 0.120 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t1= 。
研究反应物I-与S2O82-浓度对反应速率的影响
29.3s
课堂练习
1、“碘钟”实验中,3I-+ S2O32- = I3-+SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol·L-1 0.040 0.080 0.080 0.160 0.120
c(S2O32-)/mol·L-1 0.040 0.040 0.080 0.120 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)。
A.<22s B.22—44s C.>44s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
A
反应速率与反应物起始浓度成正比
课题方案设计
【实验设计】
烧杯编号 0.1mol/L的Na2S2O3溶液 蒸馏水 0.1mol/L的H2SO4溶液 反应
温度℃ 反应
时间(s)
1 10mL 0mL 10mL 室温 60
2 5mL 5mL 10mL 室温 107
3 10mL 0mL 10mL 热水:50 17
4 10mL 5mL 5mL 室温 85
5 10mL 0mL 10mL 0.2mol/L的HCl溶液 室温 58
比较是人们研究各类问题的常用方法,找出事物的相同点和不同点,再进行分析。 在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即保证其他因素相同。
实验比较法
化学反应速率的测定方法
小结
2.测定一定时间所释放出气体的体积。
3.根据在溶液中的颜色变化,当反应物或产物本身有较明显的颜色时,人们常利用颜色深浅和显色物质的浓度间的正比关系来测量反应速率。
1、测定溶液浓度的变化
锥形瓶编号 0.1mol·L-1 Na2S2O3溶液(ml) 蒸馏水(ml) 0.1mol·L-1 H2SO4溶液(ml) 反应温度 反应时间
1 10 0 10 25℃ 2分24秒
4 5 5 10 25℃ 6分30秒
5 10 5 5 25℃ 3分30秒
表5
判断下列实验是研究何条件下对反应速率的影响?
(3)实验2、3的研究目的是
研究H2SO4浓度对相关反应速率的影响
一般思路
空白试验:
(对照组)
设计试验:
(实验组)
实验变量
操纵实验变量
无关变量
控制无关变量
反应变量
检测反应变量
对照分析
实验结论
同课章节目录
