第三单元 构成物质的奥秘 单元滚动双测卷(基础卷)-2021-2022学年九年级化学人教版上册(word版 含解析)
文档属性
| 名称 | 第三单元 构成物质的奥秘 单元滚动双测卷(基础卷)-2021-2022学年九年级化学人教版上册(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 106.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-22 07:13:18 | ||
图片预览



文档简介
第三单元 构成物质的奥秘 单元滚动双测卷 (基础卷)
一、单选题
1.关于相对原子质量,下列叙述正确的是
A.相对原子质量可以用来计算原子的质量 B.碳原子的相对原子质量为12g
C.采用相对原子质量后,增大了原子的质量 D.碳原子的相对原子质量为1.993×1026kg
2.硅元素与氧元素的本质区别是
A.电子数不同 B.质子数不同 C.中子数不同 D.最外层电子数不同
3.在近代原子学说的发展过程中,有下列观点,1911 年卢瑟福用带正电的 α 粒子轰击原子,发现多数 α 粒子穿过后仍保持原来的运动方向,但绝少数 α 粒子发生了较大角度的偏转,分析实验结果,可以否定上述观点中的( )
①物质都是由原子构成的;
②原子是实心球体;
③正电荷均匀分布在整个原子内。
A.①② B.①③ C.②③ D.①②③
4.下列操作或现象与分子对应的特性不一致的是
选项 操作或现象 分子的特性
A 给篮球充气 分子间有间隔
B 在花园里可闻到花的香味 分子是运动的
C 100mL酒精和100mL水混合在一起,体积小于200mL 分子是有质量的
D 加热氧化汞可得到金属汞和氧气 分子是可再分的
A.A B.B C.C D.D
5.下列说法正确的是
A.图①所示元素是2017年5月新命名的元素,其原子核内的中子数为172
B.②可用符号表示为Mg+2
C.原子变成离子后电子层数一定会改变
D.③④两种微粒属于同种元素
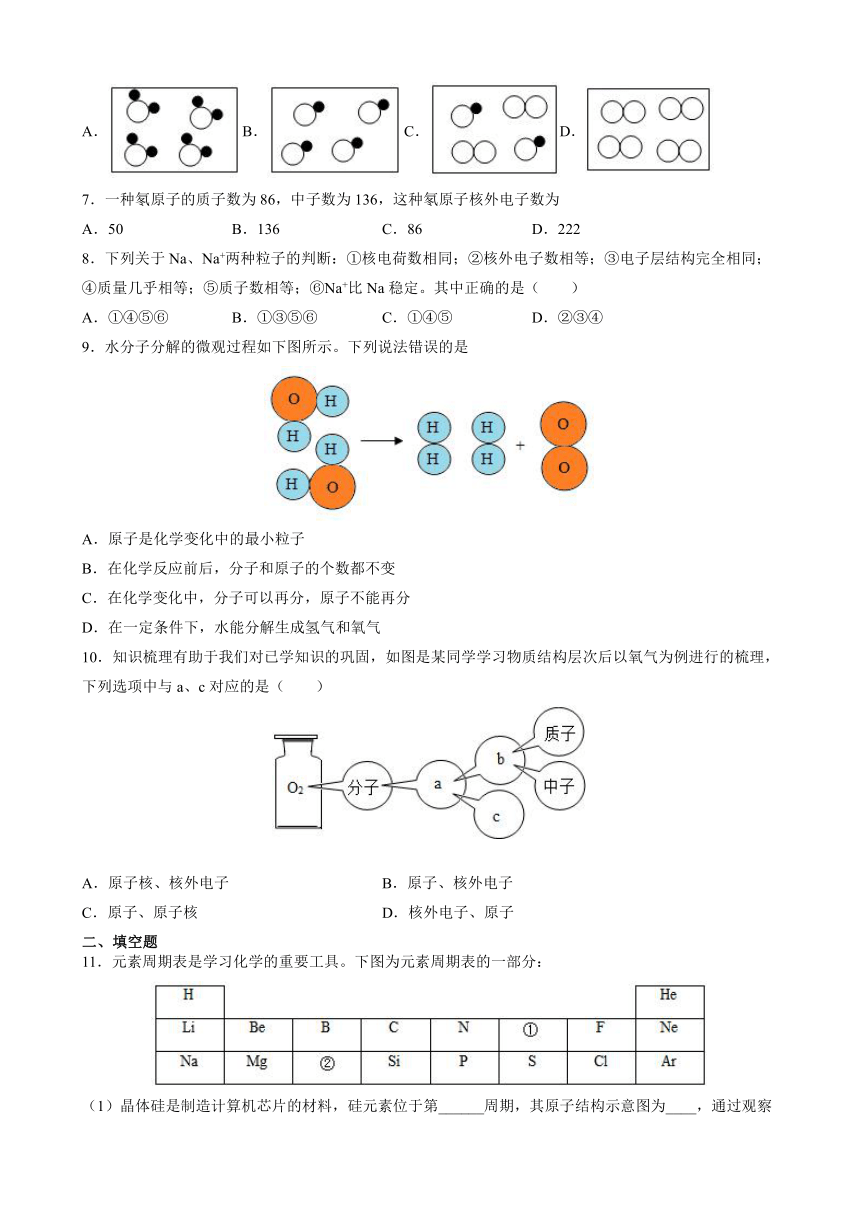
6.下图是表示气体微粒的示意图,图中“”和“”分别表示两种不同元素的原子,那么其中表示混合物的是
A.B.C.D.
7.一种氡原子的质子数为86,中子数为136,这种氡原子核外电子数为
A.50 B.136 C.86 D.222
8.下列关于Na、Na+两种粒子的判断:①核电荷数相同;②核外电子数相等;③电子层结构完全相同;④质量几乎相等;⑤质子数相等;⑥Na+比Na稳定。其中正确的是( )
A.①④⑤⑥ B.①③⑤⑥ C.①④⑤ D.②③④
9.水分子分解的微观过程如下图所示。下列说法错误的是
A.原子是化学变化中的最小粒子
B.在化学反应前后,分子和原子的个数都不变
C.在化学变化中,分子可以再分,原子不能再分
D.在一定条件下,水能分解生成氢气和氧气
10.知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、c对应的是( )
A.原子核、核外电子 B.原子、核外电子
C.原子、原子核 D.核外电子、原子
二、填空题
11.元素周期表是学习化学的重要工具。下图为元素周期表的一部分:
(1)晶体硅是制造计算机芯片的材料,硅元素位于第______周期,其原子结构示意图为____,通过观察发现元素所在的周期数和它的原子结构中的____相等。
(2)M2+和Ne原子具有相同的核外电子数,M2+的离子符号是________。
12.在宏观、微观与符号之间建立联系,是化学学科的特点。
(1)元素、物质、微粒三者之间的关系如图1所示。
①应填_____,②应填_____,③应填_____,④为带正电荷的粒子,应填_____。
(2)图2是氧、硫、氯三种元素的粒子结构示意图。
①氯离子的结构示意图中 x的数值是_____。
②氧和氯两种元素最本质的区别是它们原子中的_____不相同,氧元素和硫元素的化学性质相似的原因是它们原子的_____相同。
13.为了书写和学术交流的方便,采用国际统一的符号来表示各种元素。
(1)用元素符号和数字表示:
氧元素_____,1个氧原子_____;
钠元素_____,两个钠原子_____。
(2)“H”可以表示_____、_____。
14.铁和铜是生产生活中应用很广泛的金属。
(1)图为铁元素在元素周期表中的信息,铁元素的相对原子质量为_____;
(2)铁离子的核外电子数为_____;
(3)通过学习,已经知道铁丝在空气中能与反应而生锈,那么家里炒菜用的铁锅怎样防止生锈了_____?
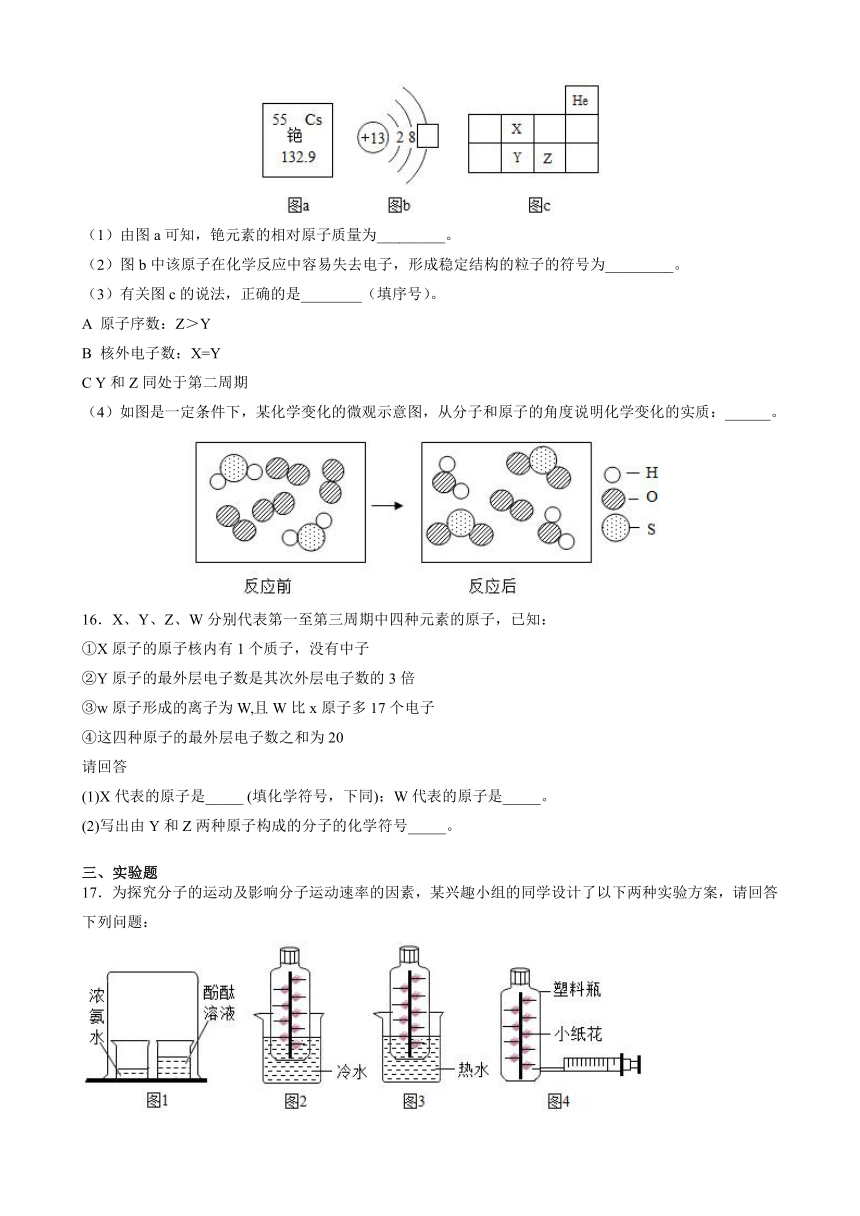
15.图a是铯元素在元素周期表中的信息,图b是铝原子结构示意图,图C为元素周期表的一部分,X、Y、Z代表三种不同元素。
(1)由图a可知,铯元素的相对原子质量为_________。
(2)图b中该原子在化学反应中容易失去电子,形成稳定结构的粒子的符号为_________。
(3)有关图c的说法,正确的是________(填序号)。
A 原子序数:Z>Y
B 核外电子数:X=Y
C Y和Z同处于第二周期
(4)如图是一定条件下,某化学变化的微观示意图,从分子和原子的角度说明化学变化的实质:______。
16.X、Y、Z、W分别代表第一至第三周期中四种元素的原子,已知:
①X原子的原子核内有1个质子,没有中子
②Y原子的最外层电子数是其次外层电子数的3倍
③w原子形成的离子为W,且W比x原子多17个电子
④这四种原子的最外层电子数之和为20
请回答
(1)X代表的原子是_____ (填化学符号,下同);W代表的原子是_____。
(2)写出由Y和Z两种原子构成的分子的化学符号_____。
三、实验题
17.为探究分子的运动及影响分子运动速率的因素,某兴趣小组的同学设计了以下两种实验方案,请回答下列问题:
实验1(如图1)。
(1)该实验能观察到的现象是______。
(2)该方案的不足之处是______(写出一点即可)。
实验2(如图2、图3、图4)。
图2、图3中无色透明塑料瓶的材质、大小、形状完全相同,瓶内用细铁丝固定有用滤纸折叠成的大小和形状相同的小纸花,小纸花上都均匀喷有酚酞溶液,按照图4的操作方式分别用注射器向图2和图3的塑料瓶中同时注入5滴浓氨水,然后将针孔处密封,再将两个塑料瓶分别同时放入等体积的冷水和40℃的热水中。
(3)该实验观察到的现象是______。
(4)由此可得出的结论是______。
四、计算题
18.1立方厘米的小容器内可容纳下约个水分子。1立方厘米的水有20滴,全世界60亿人每人每秒钟数4个水分子,每天24小时不停地数,1滴水里的水分子需要多少年才能数得完?(要有计算步骤,结果取整数)
参考答案
1.A
【解析】A、相对原子质量是一个原子的实际质量与一个碳12原子质量的十二分之一的比值,所以相对原子质量可以用来计算原子的质量,故选项说法正确;
B、相对原子质量是一个比值,单位是“1”,常省略不写,不是克,故选项说法错误;
C、采用相对原子质量后,没有增大了原子的质量,故选项说法错误;
D、相对原子质量是一个原子的实际质量与一个碳12原子质量的十二分之一的比值,碳原子的相对原子质量为12,故选项说法正确。
故选A。
2.B
【解析】根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称,所以硅元素与氧元素之间的本质区别是质子数不同;
故选B。
3.C
【解析】用带正电的α粒子轰击原子,发现多数α粒子穿过后仍保持原来的运动方向,说明带正电的原子核周围有较大空间,因此原子不是实心球体,故②符合题意;
极少数粒子发生了较大角度的偏转,说明正电荷分部在原子核上,较大空间内是没有带正电的粒子,故③符合题意。
该实验与物质是由原子构成的没有任何关系,故①不符合题意。
故选:C。
4.C
【解析】A、给篮球充气,原因是分子间有间隙,压强增大,分子间间隔变小,对应一致,不合题意。
B、在花园中可闻到花的香味,原因是分子在不断运动,香味分子运动到空气中,进入人们的鼻孔,对应一致,不合题意。
C、100mL酒精和100mL水混合在一起,体积小于200mL,原因是分子间有间隔,说法错误,符合题意。
D、加热氧化汞可得到金属汞和氧气,原因是分子是可以再分的,说法正确,不合题意。
故选:C。
5.D
【解析】A、在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=原子的核内质子数=115,在元素周期表中,元素名称下方的数字表示相对原子质量,故其相对原子质量是288,中子数=相对原子质量-质子数=288-115=173,故错误;
B、原子序数=质子数=12,12号元素是镁元素,质子数大于核外电子数,表示阳离子,故B为镁离子,离子符号表示为Mg2+,错误;
C、原子变成离子后,电子层数不一定会改变,如④是氯原子得电子后变成氯离子,电子层数没有变,故错误;
D、③④的质子数相同,属于同种元素,故正确。
故选:D。
6.C
【解析】A、图中只含有一种物质微粒,且该微粒中只有一种原子,属于纯净物物中的单质,故A错误;
B、图中只含有一种物质微粒,且该微粒中有两种原子,属于纯净物物中的化合物,故B错误;
C、图中只含有两种物质微粒,属于混合物,C正确;
D、图中只含有一种物质微粒,且该微粒中只有一种原子,属于纯净物物中的单质,故D错误。
故选:C。
7.C
【解析】在原子中,质子数=核外电子数,故这种氡原子核外电子数为86。
故选C。
8.A
【解析】Na失去1个电子形成Na+,②核外电子数、③电子层结构均发生了改变;核内质子数没有发生改变,则①核电荷数相同;由于原子的质量主要集中在原子核上,故失去一个电子对质量影响很小,质量几乎相等,即④相对原子质量几乎相等,二者质子数都为11,且Na+核外为8电子稳定结构,较钠原子稳定。故①④⑤⑥说法正确。
故选:A。
9.B
【解析】A、化学变化中分子可分,原子不可分,原子是化学变化中的最小粒子,说法正确,不符合题意;
B、在化学反应前后,分子的数目可能改变,例如水分解,分子数目增加,原子的数目一定不变,说法错误,符合题意;
C、在化学变化中,分子会分成原子,原子再重新结合形成新的分子,故分子可以再分,原子不能再分,说法正确,不符合题意;
D、在一定条件下,水分子会分成氢原子和氧原子,氢原子重新结合成氢分子,氧原子重新结合成氧分子,无数氢分子聚集形成氢气,无数氧分子聚集形成氧气,故在一定条件下,水能分解生成氢气和氧气,说法正确,不符合题意;
故选B。
10.B
【解析】分子是由原子构成的,故a是原子,原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,故b是原子核,c是核外电子,观察选项,故选B。
11.三 电子层数 Mg2+
【解析】(1)由图可知,硅元素位于第三周期;
硅是14号元素,原子序数=原子的核外电子数=14,故硅原子的第一层为2个电子,第二层为8个电子,第三层为4个电子,硅原子的原子结构示意图为:;
硅元素位于第三周期,硅原子核外有3个电子层,由此可得出元素所在的周期数和它的原子结构中的电子层数相同;
(2)M2+和Ne原子具有相同的核外电子数,故M2+核外电子数为10,M2+是M原子失去2个电子后形成的,故M原子的核外有12个电子,原子序数=原子的核外电子数=12,故M是镁元素,,M2+的离子符号是:Mg2+;
12.原子 分子 原子核 质子 8 质子数 最外层电子数相同
【解析】(1)①汞是由汞原子构成的;水是由分子构成的。
原子是由原子核和核外电子构成的,原子核是由带正电的质子和不带电的中子构成的。
(2)①氯离子最外层应形成8电子稳定结构,最外层电子数为8,故x的值为8。
②元素是具有相同质子数或核电荷数的一类原子总称,氧和氯两种元素最本质的区别是它们原子中的质子数(核电荷数)不相同。元素原子的最外层电子数相同,化学性质相似。氧元素和硫元素的原子最外层电子数相同,化学性质相似。
13.O O Na 2Na 氢元素 一个氢原子
【解析】(1)氧元素直接用一个大写字母表示:O;氧的元素符号可以表示一个氧原子;
钠由两个字母表示,必须一大二小的原则,所以表示为Na,两个钠原子就是在钠的元素符号前面加上2,所以表示为:2Na;
(2)元素符号表示:一种元素,该元素的一个原子。所以“H”可以表示氢元素,一个氢原子。
14.55.85 23 洗净擦干
【解析】(1)据图可以看出,铁元素的相对原子质量为,故填:;
(2)铁离子的核外电子数为,故填:23;
(3)家里炒菜用的铁锅用完洗净擦干可以防止生锈,故填:洗净擦干。
15.132.9 Al3+ A 在化学反应中,分子分成原子,原子不能再分,原子重新组合成新的分子
【解析】(1)在元素周期表中,元素名称的左上角数字为原子序数,右上角的为元素符号,下边的是相对原子质量。铯元素的相对原子质量为132.9。
(2)离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写,图b中原子为铝原子,失去三个电子形成铝离子,符号为Al3+。
(3)在元素周期表中,同一横行中原子序数从左向右依次递增,原子序数:Z>Y;同一纵行,由上向下电子层数依次递增,核外电子数也依次递增;Y和Z同处于第三周期。
故填:A。
(4)化学变化的实质是:在化学反应中,分子分成原子,原子不能再分,原子重新组合成新的分子。
16.H Cl SO2
【解析】(1)X、Y、Z、W分别代表第一至第三周期中四种元素的原子,已知:①X原子的原子核内有1个质子,没有中子,所以X是氢元素,②Y原子的最外层电子数是其次外层电子数的3倍,所以Y是氧元素,③w原子形成的离子为W,且W比x原子多17个电子,所以W是氯元素,④这四种原子的最外层电子数之和为20,X、Y、W的最外层电子数依次为1、6、7,20-1-6-7=6,所以Z是硫元素,经过验证,推导正确,所以X代表的原子是H,W代表的原子是Cl;
(2)由Y和Z两种原子构成的分子的化学符号是SO2。
故答案为(1)H;
(2)Cl;
(3)SO2。
17.
(1)酚酞试液变红
(2)未做对比实验,证据不足(合理即可)
(3)小红花变红,且图3先变红
(4)分子做无规则运动,且温度越高分子运动速率越快
【解析】
(1)
酚酞溶液变红
(2)
未做对比实验,有缺陷(合理即可)
(3)
小纸花变红,且图3先变红
(4)
分子做无规则运动,且温度越高运动速率越快
18.1982年
【解析】
先计算出1滴水中水分子的个数,再算出60亿人1年数水分子的数量,再用水分子的个数除以60亿人1年数水分子的数量,计算出年数。
解:1滴水中水分子的数量: 1.5×10个;
60亿人1年数水分子的数量:60×10×4×365×24×60×60=7.56864×10个;
需要的年数: 1982年。
答:1滴水里的水分子需要1982年才能数得完。
一、单选题
1.关于相对原子质量,下列叙述正确的是
A.相对原子质量可以用来计算原子的质量 B.碳原子的相对原子质量为12g
C.采用相对原子质量后,增大了原子的质量 D.碳原子的相对原子质量为1.993×1026kg
2.硅元素与氧元素的本质区别是
A.电子数不同 B.质子数不同 C.中子数不同 D.最外层电子数不同
3.在近代原子学说的发展过程中,有下列观点,1911 年卢瑟福用带正电的 α 粒子轰击原子,发现多数 α 粒子穿过后仍保持原来的运动方向,但绝少数 α 粒子发生了较大角度的偏转,分析实验结果,可以否定上述观点中的( )
①物质都是由原子构成的;
②原子是实心球体;
③正电荷均匀分布在整个原子内。
A.①② B.①③ C.②③ D.①②③
4.下列操作或现象与分子对应的特性不一致的是
选项 操作或现象 分子的特性
A 给篮球充气 分子间有间隔
B 在花园里可闻到花的香味 分子是运动的
C 100mL酒精和100mL水混合在一起,体积小于200mL 分子是有质量的
D 加热氧化汞可得到金属汞和氧气 分子是可再分的
A.A B.B C.C D.D
5.下列说法正确的是
A.图①所示元素是2017年5月新命名的元素,其原子核内的中子数为172
B.②可用符号表示为Mg+2
C.原子变成离子后电子层数一定会改变
D.③④两种微粒属于同种元素
6.下图是表示气体微粒的示意图,图中“”和“”分别表示两种不同元素的原子,那么其中表示混合物的是
A.B.C.D.
7.一种氡原子的质子数为86,中子数为136,这种氡原子核外电子数为
A.50 B.136 C.86 D.222
8.下列关于Na、Na+两种粒子的判断:①核电荷数相同;②核外电子数相等;③电子层结构完全相同;④质量几乎相等;⑤质子数相等;⑥Na+比Na稳定。其中正确的是( )
A.①④⑤⑥ B.①③⑤⑥ C.①④⑤ D.②③④
9.水分子分解的微观过程如下图所示。下列说法错误的是
A.原子是化学变化中的最小粒子
B.在化学反应前后,分子和原子的个数都不变
C.在化学变化中,分子可以再分,原子不能再分
D.在一定条件下,水能分解生成氢气和氧气
10.知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、c对应的是( )
A.原子核、核外电子 B.原子、核外电子
C.原子、原子核 D.核外电子、原子
二、填空题
11.元素周期表是学习化学的重要工具。下图为元素周期表的一部分:
(1)晶体硅是制造计算机芯片的材料,硅元素位于第______周期,其原子结构示意图为____,通过观察发现元素所在的周期数和它的原子结构中的____相等。
(2)M2+和Ne原子具有相同的核外电子数,M2+的离子符号是________。
12.在宏观、微观与符号之间建立联系,是化学学科的特点。
(1)元素、物质、微粒三者之间的关系如图1所示。
①应填_____,②应填_____,③应填_____,④为带正电荷的粒子,应填_____。
(2)图2是氧、硫、氯三种元素的粒子结构示意图。
①氯离子的结构示意图中 x的数值是_____。
②氧和氯两种元素最本质的区别是它们原子中的_____不相同,氧元素和硫元素的化学性质相似的原因是它们原子的_____相同。
13.为了书写和学术交流的方便,采用国际统一的符号来表示各种元素。
(1)用元素符号和数字表示:
氧元素_____,1个氧原子_____;
钠元素_____,两个钠原子_____。
(2)“H”可以表示_____、_____。
14.铁和铜是生产生活中应用很广泛的金属。
(1)图为铁元素在元素周期表中的信息,铁元素的相对原子质量为_____;
(2)铁离子的核外电子数为_____;
(3)通过学习,已经知道铁丝在空气中能与反应而生锈,那么家里炒菜用的铁锅怎样防止生锈了_____?
15.图a是铯元素在元素周期表中的信息,图b是铝原子结构示意图,图C为元素周期表的一部分,X、Y、Z代表三种不同元素。
(1)由图a可知,铯元素的相对原子质量为_________。
(2)图b中该原子在化学反应中容易失去电子,形成稳定结构的粒子的符号为_________。
(3)有关图c的说法,正确的是________(填序号)。
A 原子序数:Z>Y
B 核外电子数:X=Y
C Y和Z同处于第二周期
(4)如图是一定条件下,某化学变化的微观示意图,从分子和原子的角度说明化学变化的实质:______。
16.X、Y、Z、W分别代表第一至第三周期中四种元素的原子,已知:
①X原子的原子核内有1个质子,没有中子
②Y原子的最外层电子数是其次外层电子数的3倍
③w原子形成的离子为W,且W比x原子多17个电子
④这四种原子的最外层电子数之和为20
请回答
(1)X代表的原子是_____ (填化学符号,下同);W代表的原子是_____。
(2)写出由Y和Z两种原子构成的分子的化学符号_____。
三、实验题
17.为探究分子的运动及影响分子运动速率的因素,某兴趣小组的同学设计了以下两种实验方案,请回答下列问题:
实验1(如图1)。
(1)该实验能观察到的现象是______。
(2)该方案的不足之处是______(写出一点即可)。
实验2(如图2、图3、图4)。
图2、图3中无色透明塑料瓶的材质、大小、形状完全相同,瓶内用细铁丝固定有用滤纸折叠成的大小和形状相同的小纸花,小纸花上都均匀喷有酚酞溶液,按照图4的操作方式分别用注射器向图2和图3的塑料瓶中同时注入5滴浓氨水,然后将针孔处密封,再将两个塑料瓶分别同时放入等体积的冷水和40℃的热水中。
(3)该实验观察到的现象是______。
(4)由此可得出的结论是______。
四、计算题
18.1立方厘米的小容器内可容纳下约个水分子。1立方厘米的水有20滴,全世界60亿人每人每秒钟数4个水分子,每天24小时不停地数,1滴水里的水分子需要多少年才能数得完?(要有计算步骤,结果取整数)
参考答案
1.A
【解析】A、相对原子质量是一个原子的实际质量与一个碳12原子质量的十二分之一的比值,所以相对原子质量可以用来计算原子的质量,故选项说法正确;
B、相对原子质量是一个比值,单位是“1”,常省略不写,不是克,故选项说法错误;
C、采用相对原子质量后,没有增大了原子的质量,故选项说法错误;
D、相对原子质量是一个原子的实际质量与一个碳12原子质量的十二分之一的比值,碳原子的相对原子质量为12,故选项说法正确。
故选A。
2.B
【解析】根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称,所以硅元素与氧元素之间的本质区别是质子数不同;
故选B。
3.C
【解析】用带正电的α粒子轰击原子,发现多数α粒子穿过后仍保持原来的运动方向,说明带正电的原子核周围有较大空间,因此原子不是实心球体,故②符合题意;
极少数粒子发生了较大角度的偏转,说明正电荷分部在原子核上,较大空间内是没有带正电的粒子,故③符合题意。
该实验与物质是由原子构成的没有任何关系,故①不符合题意。
故选:C。
4.C
【解析】A、给篮球充气,原因是分子间有间隙,压强增大,分子间间隔变小,对应一致,不合题意。
B、在花园中可闻到花的香味,原因是分子在不断运动,香味分子运动到空气中,进入人们的鼻孔,对应一致,不合题意。
C、100mL酒精和100mL水混合在一起,体积小于200mL,原因是分子间有间隔,说法错误,符合题意。
D、加热氧化汞可得到金属汞和氧气,原因是分子是可以再分的,说法正确,不合题意。
故选:C。
5.D
【解析】A、在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=原子的核内质子数=115,在元素周期表中,元素名称下方的数字表示相对原子质量,故其相对原子质量是288,中子数=相对原子质量-质子数=288-115=173,故错误;
B、原子序数=质子数=12,12号元素是镁元素,质子数大于核外电子数,表示阳离子,故B为镁离子,离子符号表示为Mg2+,错误;
C、原子变成离子后,电子层数不一定会改变,如④是氯原子得电子后变成氯离子,电子层数没有变,故错误;
D、③④的质子数相同,属于同种元素,故正确。
故选:D。
6.C
【解析】A、图中只含有一种物质微粒,且该微粒中只有一种原子,属于纯净物物中的单质,故A错误;
B、图中只含有一种物质微粒,且该微粒中有两种原子,属于纯净物物中的化合物,故B错误;
C、图中只含有两种物质微粒,属于混合物,C正确;
D、图中只含有一种物质微粒,且该微粒中只有一种原子,属于纯净物物中的单质,故D错误。
故选:C。
7.C
【解析】在原子中,质子数=核外电子数,故这种氡原子核外电子数为86。
故选C。
8.A
【解析】Na失去1个电子形成Na+,②核外电子数、③电子层结构均发生了改变;核内质子数没有发生改变,则①核电荷数相同;由于原子的质量主要集中在原子核上,故失去一个电子对质量影响很小,质量几乎相等,即④相对原子质量几乎相等,二者质子数都为11,且Na+核外为8电子稳定结构,较钠原子稳定。故①④⑤⑥说法正确。
故选:A。
9.B
【解析】A、化学变化中分子可分,原子不可分,原子是化学变化中的最小粒子,说法正确,不符合题意;
B、在化学反应前后,分子的数目可能改变,例如水分解,分子数目增加,原子的数目一定不变,说法错误,符合题意;
C、在化学变化中,分子会分成原子,原子再重新结合形成新的分子,故分子可以再分,原子不能再分,说法正确,不符合题意;
D、在一定条件下,水分子会分成氢原子和氧原子,氢原子重新结合成氢分子,氧原子重新结合成氧分子,无数氢分子聚集形成氢气,无数氧分子聚集形成氧气,故在一定条件下,水能分解生成氢气和氧气,说法正确,不符合题意;
故选B。
10.B
【解析】分子是由原子构成的,故a是原子,原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,故b是原子核,c是核外电子,观察选项,故选B。
11.三 电子层数 Mg2+
【解析】(1)由图可知,硅元素位于第三周期;
硅是14号元素,原子序数=原子的核外电子数=14,故硅原子的第一层为2个电子,第二层为8个电子,第三层为4个电子,硅原子的原子结构示意图为:;
硅元素位于第三周期,硅原子核外有3个电子层,由此可得出元素所在的周期数和它的原子结构中的电子层数相同;
(2)M2+和Ne原子具有相同的核外电子数,故M2+核外电子数为10,M2+是M原子失去2个电子后形成的,故M原子的核外有12个电子,原子序数=原子的核外电子数=12,故M是镁元素,,M2+的离子符号是:Mg2+;
12.原子 分子 原子核 质子 8 质子数 最外层电子数相同
【解析】(1)①汞是由汞原子构成的;水是由分子构成的。
原子是由原子核和核外电子构成的,原子核是由带正电的质子和不带电的中子构成的。
(2)①氯离子最外层应形成8电子稳定结构,最外层电子数为8,故x的值为8。
②元素是具有相同质子数或核电荷数的一类原子总称,氧和氯两种元素最本质的区别是它们原子中的质子数(核电荷数)不相同。元素原子的最外层电子数相同,化学性质相似。氧元素和硫元素的原子最外层电子数相同,化学性质相似。
13.O O Na 2Na 氢元素 一个氢原子
【解析】(1)氧元素直接用一个大写字母表示:O;氧的元素符号可以表示一个氧原子;
钠由两个字母表示,必须一大二小的原则,所以表示为Na,两个钠原子就是在钠的元素符号前面加上2,所以表示为:2Na;
(2)元素符号表示:一种元素,该元素的一个原子。所以“H”可以表示氢元素,一个氢原子。
14.55.85 23 洗净擦干
【解析】(1)据图可以看出,铁元素的相对原子质量为,故填:;
(2)铁离子的核外电子数为,故填:23;
(3)家里炒菜用的铁锅用完洗净擦干可以防止生锈,故填:洗净擦干。
15.132.9 Al3+ A 在化学反应中,分子分成原子,原子不能再分,原子重新组合成新的分子
【解析】(1)在元素周期表中,元素名称的左上角数字为原子序数,右上角的为元素符号,下边的是相对原子质量。铯元素的相对原子质量为132.9。
(2)离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写,图b中原子为铝原子,失去三个电子形成铝离子,符号为Al3+。
(3)在元素周期表中,同一横行中原子序数从左向右依次递增,原子序数:Z>Y;同一纵行,由上向下电子层数依次递增,核外电子数也依次递增;Y和Z同处于第三周期。
故填:A。
(4)化学变化的实质是:在化学反应中,分子分成原子,原子不能再分,原子重新组合成新的分子。
16.H Cl SO2
【解析】(1)X、Y、Z、W分别代表第一至第三周期中四种元素的原子,已知:①X原子的原子核内有1个质子,没有中子,所以X是氢元素,②Y原子的最外层电子数是其次外层电子数的3倍,所以Y是氧元素,③w原子形成的离子为W,且W比x原子多17个电子,所以W是氯元素,④这四种原子的最外层电子数之和为20,X、Y、W的最外层电子数依次为1、6、7,20-1-6-7=6,所以Z是硫元素,经过验证,推导正确,所以X代表的原子是H,W代表的原子是Cl;
(2)由Y和Z两种原子构成的分子的化学符号是SO2。
故答案为(1)H;
(2)Cl;
(3)SO2。
17.
(1)酚酞试液变红
(2)未做对比实验,证据不足(合理即可)
(3)小红花变红,且图3先变红
(4)分子做无规则运动,且温度越高分子运动速率越快
【解析】
(1)
酚酞溶液变红
(2)
未做对比实验,有缺陷(合理即可)
(3)
小纸花变红,且图3先变红
(4)
分子做无规则运动,且温度越高运动速率越快
18.1982年
【解析】
先计算出1滴水中水分子的个数,再算出60亿人1年数水分子的数量,再用水分子的个数除以60亿人1年数水分子的数量,计算出年数。
解:1滴水中水分子的数量: 1.5×10个;
60亿人1年数水分子的数量:60×10×4×365×24×60×60=7.56864×10个;
需要的年数: 1982年。
答:1滴水里的水分子需要1982年才能数得完。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
