4.3质量守恒定律巩固练习—2021—2022学年九年级化学科粤版上册(有答案)
文档属性
| 名称 | 4.3质量守恒定律巩固练习—2021—2022学年九年级化学科粤版上册(有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 71.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-22 00:00:00 | ||
图片预览



文档简介
第四章4.3质量守恒定律巩固练习2021_2022学年粤教版初中化学九年级上册
一、单选题(共16题)
1.硝酸铜受热分解会产生一种污染空气的有毒气体,该气体可能是( )
A. NO2 B. SO2 C. NH3 D. CO
2.氢化钙与水反应的化学方程式为 CaH2+2H2O=X+2H2↑。下列说法中错误的是()
A. 氢化钙可用于干燥多种气体 B. 氢化钙是一种燃料提供剂
C. X的化学式为Ca(OH)2 D. 氢化钙需要密封保存
3.将“神舟七号”飞船送入太空的是“长征二号”F运载火箭,火箭工作中发生的反应为:C2H8N2+2R=3N2+4H2O+2CO2;其中R的化学式是( )
A. N2O4 B. NO2 C. N2O D. NH3
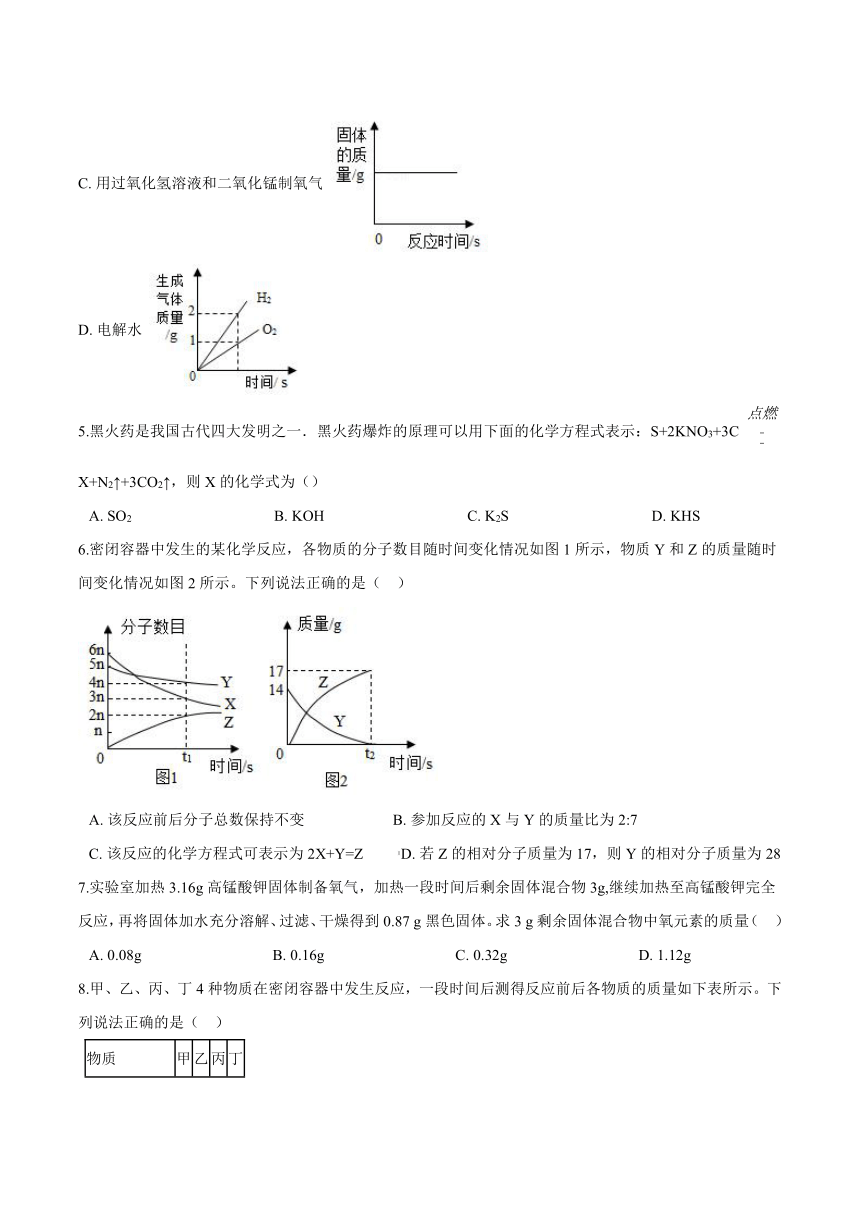
4.下列所示的四个图象能正确反映对应变化关系( )
A. 用红磷测定空气中氧气的含量
B. 加热高锰酸钾制氧气
C. 用过氧化氢溶液和二氧化锰制氧气
D. 电解水
5.黑火药是我国古代四大发明之一.黑火药爆炸的原理可以用下面的化学方程式表示:S+2KNO3+3C X+N2↑+3CO2↑,则X的化学式为()
A. SO2 B. KOH C. K2S D. KHS
6.密闭容器中发生的某化学反应,各物质的分子数目随时间变化情况如图1所示,物质Y和Z的质量随时间变化情况如图2所示。下列说法正确的是( )
A. 该反应前后分子总数保持不变 B. 参加反应的X与Y的质量比为2:7
C. 该反应的化学方程式可表示为2X+Y=Z D. 若Z的相对分子质量为17,则Y的相对分子质量为28
7.实验室加热3.16g高锰酸钾固体制备氧气,加热一段时间后剩余固体混合物3g,继续加热至高锰酸钾完全反应,再将固体加水充分溶解、过滤、干燥得到0.87 g黑色固体。求3 g剩余固体混合物中氧元素的质量( )
A. 0.08g B. 0.16g C. 0.32g D. 1.12g
8.甲、乙、丙、丁4种物质在密闭容器中发生反应,一段时间后测得反应前后各物质的质量如下表所示。下列说法正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 30 3 6 8
反应后质量/g 16 m 4 24
A. 甲和丙两种物质中的元素种类与丁物质中元素种类相同 B. 乙一定是反应的催化剂
C. 参加反应的甲、丙的质量比是5 :1 D. 甲、丙一定都是单质
9.已知某物质X是一种消毒杀菌效率高、二次污染小的水处理剂,又知该物质的制备原理为:2KClO3+4HCl(浓)=2KCl+2X+Cl2↑+2H2O.则X的化学式为()
A. ClO2 B. HClO C. Cl2O5 D. HClO3
10.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下发生反应,测得反应前后各物质的质量如下表,下列描述中正确的是()
物质 甲 乙 丙 丁
反应前质量/g 20 m 8 6
反应后质量/g 4 待测 28 2
A. 反应后甲和丙的质量比为1:7 B. “待测”数值一定为2
C. 乙一定是该反应的催化剂 D. 该反应可能是铝与氧气的反应
11.实验室中的硝酸银溶液需要在棕色试剂瓶中避光保存,是因为硝酸银在光照条件下易分解该反应的化学方程式为 ,则X的化学式为( )
A. H2O B. NO2 C. NO D. N2
12.密闭容器内有两种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法正确的是( )
物质 X Y Z Q
反应前质量 8 2 20 5
反应后质量 a 12 8 15
A. 反应后a值为3 B. 该反应的反应物是X、Y
C. 参加反应的X、Z的质量比是2:3 D. Y、Q的相对分子质量比一定为1:1
13.在一密闭容器中放入四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列分析正确的是()
物质 甲 乙 丙 丁
反应前质量/g 40 40 10 32
反应后质量/g 12 X 10 0
A. 乙可能是单质 B. 参加反应的甲与丁的质量比为7:8
C. 表中x的值为90 D. 丙一定是该反应的催化剂
14.科学观念有助于发展学生的化学学科核心素养,以下错误的是( )
A. 能量观:有些物质溶于水时会吸收热量 B. 守恒观:所有的化学反应前后元素种类不变
C. 分类观:含氧元素的化合物就是氧化物 D. 结构观:原子的最外层电子数决定了元素的化学性质
15.四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示。则有关说法中错误的是()
A. 该反应为分解反应
B. 乙可能是这个反应的催化剂
C. 参加反应的丁的质量一定等于生成甲和丙的质量之和
D. 该反应中甲和丙的相对分子质量之比一定为1:8
16.将一定质量的a,b,c,d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如表:
物质 a b c d
反应前的质量/g 12.8 28.0 6.4 1.0
反应一段时间后的质量/g 20.0 14.4 x 1.0
下列有关说法正确的是()
A. a和b是反应物 B. 该反应属于分解反应 C. D. d一定是催化剂
二、综合题(共4题)
17.化学科学已经日益渗透到社会生活的各个方面,它与我们的生产、生活息息相关。请根据所学知识回答下列问题:
(1)液氯(Cl2)是自来水厂对天然水进行杀菌消毒的常用物质。在实验室制取氯气的化学方程式为:MnO2+4HCl MnCl2+Cl2↑+2R , R的化学式为________;实验中MnO2可以用KMnO4、KClO3等物质替代,KMnO4中Mn元素的化合价为________。
(2)“绿水青山就是金山银山”是建设生态文明的重要理念,下列做法与这一理念相符的是________。
A 为省工省时,就地焚烧农作物秸秆 B 垃圾进行分类回收,实现垃圾变废为宝
C 开发和利用清洁而又高效的新能源 D 大量施用化肥农药,提高农作物的产量
18.化学活动课上,老师给同学们表演了一个”水能生火”的魔术(如图所示),他将包有过氧化钠(Na2O2)粉末的脱脂棉放在石棉网上,向脱脂棉上滴了几滴水,脱脂棉立刻燃烧起来。通过查阅资料可知,过氧化钠和水反应的产物只有两种,都是初中化学常见的物质。根据所学化学知识回答:
(1).从燃烧的条件分析可知,过氧化钠《Na2O2》和水发生反应生成了可以支持燃烧的物质 , 反应 (填”吸收”或“放出”)大量的热;
(2).根据质量守恒定律可推测另一种产物必舍的元素是 ;
(3).过氧化钠和水反应的化学方程式是 。
19.在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质量如下表。
物质 X O2 CO2 H2O
反应前的质量/g 19 34 6 2
反应后的质量/g 11 待测 28 20
表中的待测值为________,X中一定含有________元素,反应中CO2和H2O的质量比为________。
20.化学兴趣小组的同学利用如图所示的装置,对质量守恒定律进行探究。试回答下列问题。
(1).Ⅰ.提出问题:白磷在空气中燃烧遵循质量守恒定律吗
Ⅱ.设计实验:小明同学将一定质量的白磷放入装置内,称得A装置的总质量为208.3g。然后将红热的玻璃管伸入瓶内,并立即塞紧橡胶塞。
Ⅲ.观察现象:此时观察到锥形瓶内的现象是 ,装置冷却后,再次称得A装置的总质量为208.3g。
Ⅳ.总结:①该反应遵循质量守恒定律。
②在实验设计上,玻璃管上方系一个瘪气球的目的是 。
③实验结束后(锥形瓶已冷却至室温),发现瓶中白磷过量,为防止白磷在空气中燃烧,将锥形瓶瓶口倒置于盛满水的水槽中,拔下瓶塞,发现水进入锥形瓶中,则进入瓶中的水约占锥形瓶容积的 , 原因是 。
(2).小兵同学认为碳酸钠与稀盐酸反应(化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑)也遵循质量守恒定律。于是他设计了B装置,药品及装置的总质量为308.5g,反应结束后,他与小明的实验进行对比冷却至室温,气球胀大的是 (填“A”或“B”或“A和B”);称量反应后药品及装置的总质量为308.3g,你认为小兵同学数据减少的原因可能是 (填字母)。
A.稀盐酸不足 B.碳酸钠中含有不与稀盐酸反应的杂质
C.装置气密性不好 D.气球受到浮力的影响
(3).小结:由质量守恒定律可知,化学反应前后一定不变的是 (填序号)。
①原子数目②原子的种类③分子数目④分子的种类⑤元素的种类⑥物质的总质量
(4).某登山运动员要登上最髙峰——珠穆朗玛峰峰顶,需要自带氧气。假如每名运动员冲顶时消耗自带液氧4.8kg,若在实验室用高锰酸钾为原料制取相同质量的氧气,则需要高锰酸钾的质量为多少
答案部分
一、单选题
1.【答案】 A
2.【答案】 A
3.【答案】 A
4.【答案】 C
5.【答案】 C
6.【答案】 D
7.【答案】 D
8.【答案】 A
9.【答案】 A
10.【答案】 A
11.【答案】 B
12.【答案】 C
13.【答案】 B
14.【答案】 C
15.【答案】 D
16.【答案】 B
二、综合题
17.【答案】 (1)H2O;+7
(2)BC
18.【答案】 (1)氧气;放出
(2)钠元素和氢元素
(3)2Na2O2+2H2O=4NaOH+O2↑
19.【答案】 2;C和H;11:9
20.【答案】 (1)白磷燃烧,产生白烟,放出大量的热,气球胀大;平衡装置内外气压,防止瓶塞飞出;;氧气约占空气总体积的
(2)B;D
(3)①②⑤⑥
(4)解:设需要高锰酸钾的质量为x。
2KMnO4 O2↑+K2MnO4+MnO2
316 2
x 4.8kg
x=47.4kg
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
答:若在实验室用高锰酸钾为原料制取相同质量的氧气,则需要47.4kg高锰酸钾。
一、单选题(共16题)
1.硝酸铜受热分解会产生一种污染空气的有毒气体,该气体可能是( )
A. NO2 B. SO2 C. NH3 D. CO
2.氢化钙与水反应的化学方程式为 CaH2+2H2O=X+2H2↑。下列说法中错误的是()
A. 氢化钙可用于干燥多种气体 B. 氢化钙是一种燃料提供剂
C. X的化学式为Ca(OH)2 D. 氢化钙需要密封保存
3.将“神舟七号”飞船送入太空的是“长征二号”F运载火箭,火箭工作中发生的反应为:C2H8N2+2R=3N2+4H2O+2CO2;其中R的化学式是( )
A. N2O4 B. NO2 C. N2O D. NH3
4.下列所示的四个图象能正确反映对应变化关系( )
A. 用红磷测定空气中氧气的含量
B. 加热高锰酸钾制氧气
C. 用过氧化氢溶液和二氧化锰制氧气
D. 电解水
5.黑火药是我国古代四大发明之一.黑火药爆炸的原理可以用下面的化学方程式表示:S+2KNO3+3C X+N2↑+3CO2↑,则X的化学式为()
A. SO2 B. KOH C. K2S D. KHS
6.密闭容器中发生的某化学反应,各物质的分子数目随时间变化情况如图1所示,物质Y和Z的质量随时间变化情况如图2所示。下列说法正确的是( )
A. 该反应前后分子总数保持不变 B. 参加反应的X与Y的质量比为2:7
C. 该反应的化学方程式可表示为2X+Y=Z D. 若Z的相对分子质量为17,则Y的相对分子质量为28
7.实验室加热3.16g高锰酸钾固体制备氧气,加热一段时间后剩余固体混合物3g,继续加热至高锰酸钾完全反应,再将固体加水充分溶解、过滤、干燥得到0.87 g黑色固体。求3 g剩余固体混合物中氧元素的质量( )
A. 0.08g B. 0.16g C. 0.32g D. 1.12g
8.甲、乙、丙、丁4种物质在密闭容器中发生反应,一段时间后测得反应前后各物质的质量如下表所示。下列说法正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 30 3 6 8
反应后质量/g 16 m 4 24
A. 甲和丙两种物质中的元素种类与丁物质中元素种类相同 B. 乙一定是反应的催化剂
C. 参加反应的甲、丙的质量比是5 :1 D. 甲、丙一定都是单质
9.已知某物质X是一种消毒杀菌效率高、二次污染小的水处理剂,又知该物质的制备原理为:2KClO3+4HCl(浓)=2KCl+2X+Cl2↑+2H2O.则X的化学式为()
A. ClO2 B. HClO C. Cl2O5 D. HClO3
10.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下发生反应,测得反应前后各物质的质量如下表,下列描述中正确的是()
物质 甲 乙 丙 丁
反应前质量/g 20 m 8 6
反应后质量/g 4 待测 28 2
A. 反应后甲和丙的质量比为1:7 B. “待测”数值一定为2
C. 乙一定是该反应的催化剂 D. 该反应可能是铝与氧气的反应
11.实验室中的硝酸银溶液需要在棕色试剂瓶中避光保存,是因为硝酸银在光照条件下易分解该反应的化学方程式为 ,则X的化学式为( )
A. H2O B. NO2 C. NO D. N2
12.密闭容器内有两种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法正确的是( )
物质 X Y Z Q
反应前质量 8 2 20 5
反应后质量 a 12 8 15
A. 反应后a值为3 B. 该反应的反应物是X、Y
C. 参加反应的X、Z的质量比是2:3 D. Y、Q的相对分子质量比一定为1:1
13.在一密闭容器中放入四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列分析正确的是()
物质 甲 乙 丙 丁
反应前质量/g 40 40 10 32
反应后质量/g 12 X 10 0
A. 乙可能是单质 B. 参加反应的甲与丁的质量比为7:8
C. 表中x的值为90 D. 丙一定是该反应的催化剂
14.科学观念有助于发展学生的化学学科核心素养,以下错误的是( )
A. 能量观:有些物质溶于水时会吸收热量 B. 守恒观:所有的化学反应前后元素种类不变
C. 分类观:含氧元素的化合物就是氧化物 D. 结构观:原子的最外层电子数决定了元素的化学性质
15.四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示。则有关说法中错误的是()
A. 该反应为分解反应
B. 乙可能是这个反应的催化剂
C. 参加反应的丁的质量一定等于生成甲和丙的质量之和
D. 该反应中甲和丙的相对分子质量之比一定为1:8
16.将一定质量的a,b,c,d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如表:
物质 a b c d
反应前的质量/g 12.8 28.0 6.4 1.0
反应一段时间后的质量/g 20.0 14.4 x 1.0
下列有关说法正确的是()
A. a和b是反应物 B. 该反应属于分解反应 C. D. d一定是催化剂
二、综合题(共4题)
17.化学科学已经日益渗透到社会生活的各个方面,它与我们的生产、生活息息相关。请根据所学知识回答下列问题:
(1)液氯(Cl2)是自来水厂对天然水进行杀菌消毒的常用物质。在实验室制取氯气的化学方程式为:MnO2+4HCl MnCl2+Cl2↑+2R , R的化学式为________;实验中MnO2可以用KMnO4、KClO3等物质替代,KMnO4中Mn元素的化合价为________。
(2)“绿水青山就是金山银山”是建设生态文明的重要理念,下列做法与这一理念相符的是________。
A 为省工省时,就地焚烧农作物秸秆 B 垃圾进行分类回收,实现垃圾变废为宝
C 开发和利用清洁而又高效的新能源 D 大量施用化肥农药,提高农作物的产量
18.化学活动课上,老师给同学们表演了一个”水能生火”的魔术(如图所示),他将包有过氧化钠(Na2O2)粉末的脱脂棉放在石棉网上,向脱脂棉上滴了几滴水,脱脂棉立刻燃烧起来。通过查阅资料可知,过氧化钠和水反应的产物只有两种,都是初中化学常见的物质。根据所学化学知识回答:
(1).从燃烧的条件分析可知,过氧化钠《Na2O2》和水发生反应生成了可以支持燃烧的物质 , 反应 (填”吸收”或“放出”)大量的热;
(2).根据质量守恒定律可推测另一种产物必舍的元素是 ;
(3).过氧化钠和水反应的化学方程式是 。
19.在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质量如下表。
物质 X O2 CO2 H2O
反应前的质量/g 19 34 6 2
反应后的质量/g 11 待测 28 20
表中的待测值为________,X中一定含有________元素,反应中CO2和H2O的质量比为________。
20.化学兴趣小组的同学利用如图所示的装置,对质量守恒定律进行探究。试回答下列问题。
(1).Ⅰ.提出问题:白磷在空气中燃烧遵循质量守恒定律吗
Ⅱ.设计实验:小明同学将一定质量的白磷放入装置内,称得A装置的总质量为208.3g。然后将红热的玻璃管伸入瓶内,并立即塞紧橡胶塞。
Ⅲ.观察现象:此时观察到锥形瓶内的现象是 ,装置冷却后,再次称得A装置的总质量为208.3g。
Ⅳ.总结:①该反应遵循质量守恒定律。
②在实验设计上,玻璃管上方系一个瘪气球的目的是 。
③实验结束后(锥形瓶已冷却至室温),发现瓶中白磷过量,为防止白磷在空气中燃烧,将锥形瓶瓶口倒置于盛满水的水槽中,拔下瓶塞,发现水进入锥形瓶中,则进入瓶中的水约占锥形瓶容积的 , 原因是 。
(2).小兵同学认为碳酸钠与稀盐酸反应(化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑)也遵循质量守恒定律。于是他设计了B装置,药品及装置的总质量为308.5g,反应结束后,他与小明的实验进行对比冷却至室温,气球胀大的是 (填“A”或“B”或“A和B”);称量反应后药品及装置的总质量为308.3g,你认为小兵同学数据减少的原因可能是 (填字母)。
A.稀盐酸不足 B.碳酸钠中含有不与稀盐酸反应的杂质
C.装置气密性不好 D.气球受到浮力的影响
(3).小结:由质量守恒定律可知,化学反应前后一定不变的是 (填序号)。
①原子数目②原子的种类③分子数目④分子的种类⑤元素的种类⑥物质的总质量
(4).某登山运动员要登上最髙峰——珠穆朗玛峰峰顶,需要自带氧气。假如每名运动员冲顶时消耗自带液氧4.8kg,若在实验室用高锰酸钾为原料制取相同质量的氧气,则需要高锰酸钾的质量为多少
答案部分
一、单选题
1.【答案】 A
2.【答案】 A
3.【答案】 A
4.【答案】 C
5.【答案】 C
6.【答案】 D
7.【答案】 D
8.【答案】 A
9.【答案】 A
10.【答案】 A
11.【答案】 B
12.【答案】 C
13.【答案】 B
14.【答案】 C
15.【答案】 D
16.【答案】 B
二、综合题
17.【答案】 (1)H2O;+7
(2)BC
18.【答案】 (1)氧气;放出
(2)钠元素和氢元素
(3)2Na2O2+2H2O=4NaOH+O2↑
19.【答案】 2;C和H;11:9
20.【答案】 (1)白磷燃烧,产生白烟,放出大量的热,气球胀大;平衡装置内外气压,防止瓶塞飞出;;氧气约占空气总体积的
(2)B;D
(3)①②⑤⑥
(4)解:设需要高锰酸钾的质量为x。
2KMnO4 O2↑+K2MnO4+MnO2
316 2
x 4.8kg
x=47.4kg
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
答:若在实验室用高锰酸钾为原料制取相同质量的氧气,则需要47.4kg高锰酸钾。
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
