2021-2022学年高一上学期化学鲁科版(2019)必修第一册2.1.1 元素与物质分类 课件 (32张ppt)
文档属性
| 名称 | 2021-2022学年高一上学期化学鲁科版(2019)必修第一册2.1.1 元素与物质分类 课件 (32张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-24 11:02:19 | ||
图片预览







文档简介
(共32张PPT)
2.1.1 元素与物质分类(1)
元素与物质的关系
联想 质疑
认识物质
钠、镁、铁、氧化镁、氯化钠、氢氧化钠、一氧化碳、二氧化碳、氯气、氢气、氧气、氯化亚铁、三氧化二铁、
碳酸钠、碳单质、硫酸、氯化铁
请写出以上各物质的化学式,从元素组成的角度对这些物质进行分类,完成学案一
仅由一种元素组成的纯净物:如钠、镁、铁、氯气、氢气、氧气、碳单质
一、元素与物质的关系
由两种或两种以上的元素组成的纯净物:如氧化镁、氯化钠、氢氧化钠、一氧化碳、二氧化碳、氯化亚铁、三氧化二铁、碳酸钠、硫酸、氯化铁
单质:
化合物:
游离态
化合态
元素有两种存在形态
——单质中的元素
——化合物中的元素
元素的两种存在形态
游离态:
化合态:
元素以单质的形式存在的状态
元素以化合物的形式存在的状态
(1)很活泼的元素常以化合态存在于自然界中,如钠元素在自然界中无游离钠。Cl2很活泼,自然界无游离氯。
(2)不活泼金属常以游离态存在于自然界中。如元素金
(3)较活泼的元素常以游离态和化合态存在于自然界中,如氧元素,在自然界中有游离的氧气和化合态的水。
物质
单质
化合物
酸
碱
盐
氧化物
纯净物
混合物
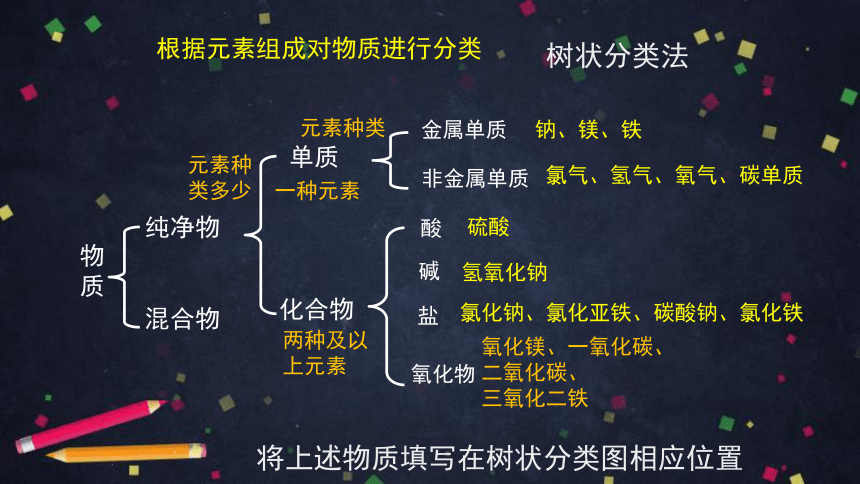
元素种类多少
一种元素
两种及以上元素
元素种类
根据元素组成对物质进行分类
金属单质
非金属单质
钠、镁、铁
氯气、氢气、氧气、碳单质
硫酸
氢氧化钠
氧化镁、一氧化碳、二氧化碳、
三氧化二铁
氯化钠、氯化亚铁、碳酸钠、氯化铁
树状分类法
将上述物质填写在树状分类图相应位置
从上述物质中找出含有钠元素的物质,完成学案二
观察含有同一种元素的不同物质,你有什么发现?
Na
NaCl Na2CO3
NaOH
含有钠元素的物质有很多
根据所学知识,上述含有钠元素的物质之间能否进行转化?
交流 研讨
Na2CO3
HCl
H20
含钠元素的物质之间
可以发生相互转化
Na
NaCl
NaOH
CO2
碳元素是构成物质种类最多的一种元素
含碳元素的物质丰富多彩
C
CO
CO2
H2CO3
Na2CO3
NaHCO3
CH4
说说以上物质中碳元素的化合价
-4
将以上物质填写在学案“价-类”二维图中
上黑板展示
-4
C
CO
CO2
H2CO3
Na2CO3
NaHCO3
0
+2
+4
+4
+4
+4
CH4
+4
+2
0
﹣4
元素化合价
物质类别
酸
氧化物
氢化物
盐
单质
物质类别
酸
氧化物
氢化物
盐
单质
物质类别
酸
氧化物
氢化物
盐
同一种元素不同价态的物质可以存在于不同类别的物质中
碳及其化合物的“价-类”二维图
物质分类的新视角---“价—类”二维角度
这些物质之间可以相互转化
C
CO
CO2
H2CO3
Na2CO3
NaHCO3
CH4
+4
+2
0
﹣4
元素化合价
单质
物质类别
酸
氧化物
氢化物
盐
关于化合价
+3
+3
+2
+2
FeO Fe(OH)2
Fe(OH)3
Fe2O3
Fe3O4
化合价是元素在形成化合物时表现出的一种性质,因此依据核心元素化合价对物质分类有着重要意义。
+2 +3
如何确定陌生元素的化合价?
确定熟悉元素化合价
根据化学式中化合价代数和为0的原则
常见元素的化合价:
一价氢氯(负)钾钠银
二价氧(负)钙钡镁锌
三铝四硅五价磷
二三铁,二四碳
二四六硫都齐全(-2、+4、+6)
铜汞二价最常见
莫忘单质价为零
应用 实践
1.请判断下列物质或微粒中指定元素的化合价
NH3、NH4、NO3 、H2SO3
-
+
完成学案三
应用 实践
请判断下列物质或微粒中指定元素的化合价
NH3、NH4、NO3 、H2SO3
-
+
-3
-3
+5
+4
2.分类是学习和研究化学的一种重要方法,下列分类不合理的是______
A.K2CO3 既属于钾盐,又属于碳酸盐
B.Na2O 和 CO 都属于氧化物
C.KOH 和 Na2CO3 都属于碱
D.H2SO4 和 HNO3 都属于含氧酸
C
应用 实践
3.以 Na、Ba、H、O、C、S、N 中任意两种或三种元素组成合适的物质,分别填在表中(每空填一例)
物质 类别 酸 碱 盐 氧化物 氢化物
化学式
氢化物示例:NH3
应用 实践
以 Na、Ba、H、O、C、S、N 中任意两种或三种元素组成合适的物质,分别填在表中(每空填一例)
物质 类别 酸 碱 盐 氧化物 氢化物
化学式
氢化物示例:NH3
应用 实践
H2SO4
NaO H
BaSO4
BaO
CH4
H2CO3
HNO3
Ba(O H)2
Na2SO4
Na2CO3
Na2O
H2O
H2O
H2S
拓展类知识
氧
化
物
酸性氧化物
碱性氧化物
两性氧化物
CuO、Fe2O3、Na2O
CO、H2O
CO2、SO3
CaO、CuO、K2O
Al2O3、Zn2O
从组成元素分
非金属氧化物
金属氧化物
从性质分
氧化物的分类
过氧化物
不成盐氧化物
H2O2、Na2O2
CO、NO、NO2
1、定义:与碱反应只生成盐和水的氧化物。
2、性质:
(1)与碱反应只生成盐和水.
(2)多数能与水化合生成酸.
酸性氧化物
CO2 + H2O = H2CO3
CO2 + 2NaOH = Na2CO3 + H2O
3、大多数非金属氧化物是酸性氧化物,
个别金属氧化物也是酸性氧化物,如Mn2O7是酸性氧化物。
CO、H2O不是酸性氧化物
1.定义:与酸反应只生成盐和水的氧化物。
2.性质:
(1)能与酸反应只生成盐和水。
(2)少数能与水化合生成碱。
碱性氧化物
(3)能与某些酸性氧化物化合成盐。
Na2O + H2O = 2NaOH
Na2O + 2HCl = 2NaCl + H2O
Na2O + CO2 = Na2CO3
3、碱性氧化物都是金属氧化物,
如:Mn2O7 是酸性氧化物。
金属氧化物不一定是碱性氧化物。
Na2O2不是碱性氧化物。
Al2O3是两性氧化物。
碱性氧化物不一定能与水反应生成相应的碱,例如:CuO不溶于水;
酸性氧化物不一定能与水反应生成相应的酸,例如:SiO2不溶于水.
练习:判断下列说法是否正确。
1、金属氧化物一定是碱性氧化物。 ( )
2、碱性氧化物一定是金属氧化物。 ( )
3、酸性氧化物一定是非金属氧化物。 ( )
4、非金属氧化物不一定是酸性氧化物。( )
5、能电离出H+的化合物一定是酸。 ( )
6、CH3COOH属于一元酸。 ( )
7、含有氧元素的化合物都是氧化物。 ( )
×
√
×
√
×
√
×
酸
从能电离的H+数分
一元酸:
二元酸:
三元酸:
从是否含氧分
含氧酸
高沸点酸:
从沸点高低分
无氧酸:
弱酸:
从电离程度分
强酸:
挥发性酸:
HCl HNO3 HClO
H2SO4 H2CO3 H2S
H3PO4
H2SO4 HNO3 HClO
HCl HF H2S
HCl HBr HI HNO3 H2SO4 HClO4
H2CO3、HF、H2S、CH3COOH、HClO、H3PO4 H2SO3等
H2SO4 H3PO4
HCl HNO3
碱
从电离OH-数分
一元碱:
二元碱:
从溶解性分
可溶性碱:
不溶性碱:
弱碱:
从电离程度分
强碱:
KOH NaOH NH3.H2O
Ba(OH)2 Ca(OH)2 Mg(OH)2
KOH NaOH NH3﹒H2O Ba(OH)2 Ca(OH)2
Mg(OH)2 Cu(OH)2 Fe(OH)3等
KOH NaOH Ba(OH)2 Ca(OH)2
NH3﹒H2O Mg(OH)2 Fe(OH)3 Cu(OH)2等
盐
从中和程度分
正盐:
酸式盐:
碱式盐:
从酸根是否含氧分
含氧酸盐
硫酸盐:
从阴离子分
无氧酸盐:
钠盐
铵盐
从阳离子分
钾盐:
碳酸盐:
从溶解性分
可溶性盐
微溶性盐
难溶性盐
NaCl K2SO4 (NH4)3PO4
NaHSO4 NH4HCO3 KH2PO4
Cu2(OH)2CO3
CuSO4 KNO3 NaClO
NH4Cl CaF2 Na2S
KCl KNO3 K2SO4
Na2CO3 NaF Na2S CH3COONa
(NH4)3PO4 (NH4)2SO4 NH4Cl
K2SO4 Na2SO4 CuSO4
K2CO3 Na2CO3 CaCO3
K2CO3 AgNO3 NaClO NH4Cl
CaSO4 Ag2SO4
BaSO4 CaCO3 AgCl
名称 概念 命名 实例
正盐 酸碱完全中和后的产物 某化某 某酸某 NaCl
NaCO3
酸式盐 酸中的H+被部分中和的产物 某酸氢某 酸式某酸某 NaHCO3
碱式盐 酸中的OH-被部分中和的产物 正盐名称前面加“碱式” Cu2(OH)2CO3
碱式碳酸铜
复盐 含有两种阳离子 读出两种金属名称 KAl(SO4)2H2O
硫酸铝钾
北方交大附中
酸碱盐的溶解性口诀
溶碱一共有四种,钾钠钡氨在其中;
钙碱微溶要注重。
钾钠硝酸铵盐溶,其余碳酸盐不溶(碳酸钾、碳酸钠、碳酸铵以外的碳酸盐不可溶)。
硫酸盐除银钡钙,盐酸盐除银不溶。
(氢氧化钙溶液或者澄清石灰水中的氢氧化钙全部溶解并电离,石灰乳中氢氧化钙部分溶解)
酸碱性溶解性规律
酸除硅酸(H2SiO3)外全溶于水
碱溶钾钠钡铵,钙(微溶);
盐:钾钠铵硝,外加碳酸氢盐均可溶,
盐酸盐不溶银,
硫酸盐不溶银钡钙,
碳酸盐只溶钾钠铵
2.1.1 元素与物质分类(1)
元素与物质的关系
联想 质疑
认识物质
钠、镁、铁、氧化镁、氯化钠、氢氧化钠、一氧化碳、二氧化碳、氯气、氢气、氧气、氯化亚铁、三氧化二铁、
碳酸钠、碳单质、硫酸、氯化铁
请写出以上各物质的化学式,从元素组成的角度对这些物质进行分类,完成学案一
仅由一种元素组成的纯净物:如钠、镁、铁、氯气、氢气、氧气、碳单质
一、元素与物质的关系
由两种或两种以上的元素组成的纯净物:如氧化镁、氯化钠、氢氧化钠、一氧化碳、二氧化碳、氯化亚铁、三氧化二铁、碳酸钠、硫酸、氯化铁
单质:
化合物:
游离态
化合态
元素有两种存在形态
——单质中的元素
——化合物中的元素
元素的两种存在形态
游离态:
化合态:
元素以单质的形式存在的状态
元素以化合物的形式存在的状态
(1)很活泼的元素常以化合态存在于自然界中,如钠元素在自然界中无游离钠。Cl2很活泼,自然界无游离氯。
(2)不活泼金属常以游离态存在于自然界中。如元素金
(3)较活泼的元素常以游离态和化合态存在于自然界中,如氧元素,在自然界中有游离的氧气和化合态的水。
物质
单质
化合物
酸
碱
盐
氧化物
纯净物
混合物
元素种类多少
一种元素
两种及以上元素
元素种类
根据元素组成对物质进行分类
金属单质
非金属单质
钠、镁、铁
氯气、氢气、氧气、碳单质
硫酸
氢氧化钠
氧化镁、一氧化碳、二氧化碳、
三氧化二铁
氯化钠、氯化亚铁、碳酸钠、氯化铁
树状分类法
将上述物质填写在树状分类图相应位置
从上述物质中找出含有钠元素的物质,完成学案二
观察含有同一种元素的不同物质,你有什么发现?
Na
NaCl Na2CO3
NaOH
含有钠元素的物质有很多
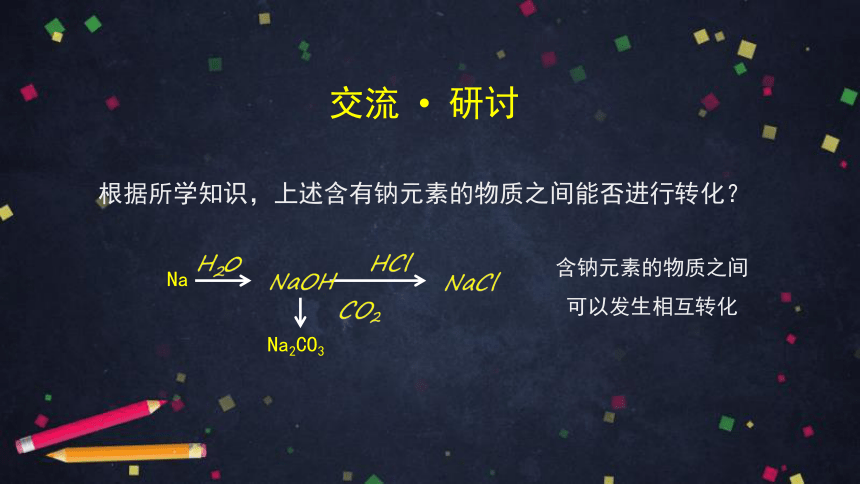
根据所学知识,上述含有钠元素的物质之间能否进行转化?
交流 研讨
Na2CO3
HCl
H20
含钠元素的物质之间
可以发生相互转化
Na
NaCl
NaOH
CO2
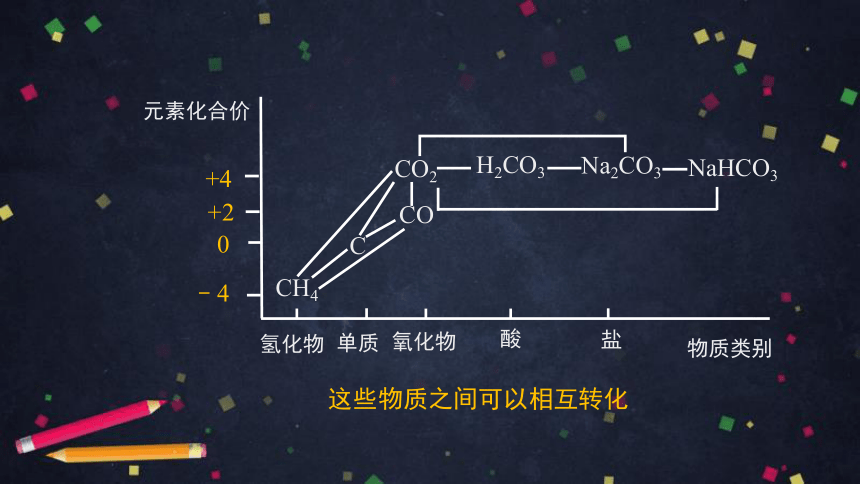
碳元素是构成物质种类最多的一种元素
含碳元素的物质丰富多彩
C
CO
CO2
H2CO3
Na2CO3
NaHCO3
CH4
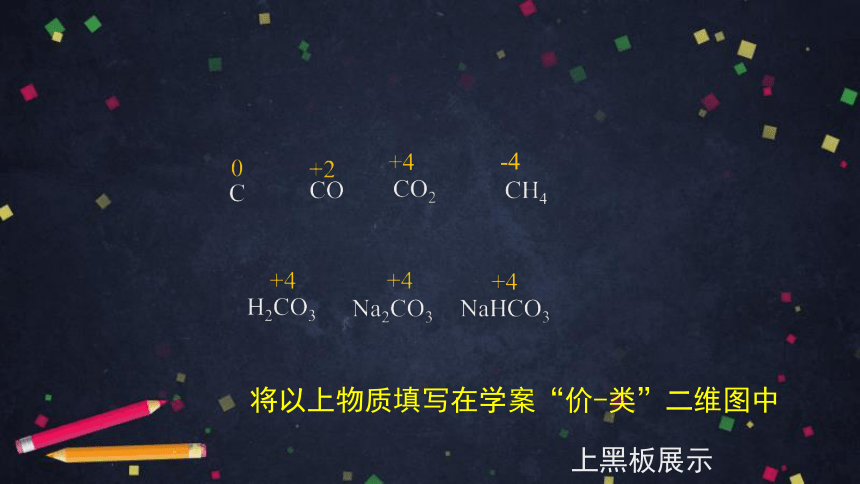
说说以上物质中碳元素的化合价
-4
将以上物质填写在学案“价-类”二维图中
上黑板展示
-4
C
CO
CO2
H2CO3
Na2CO3
NaHCO3
0
+2
+4
+4
+4
+4
CH4
+4
+2
0
﹣4
元素化合价
物质类别
酸
氧化物
氢化物
盐
单质
物质类别
酸
氧化物
氢化物
盐
单质
物质类别
酸
氧化物
氢化物
盐
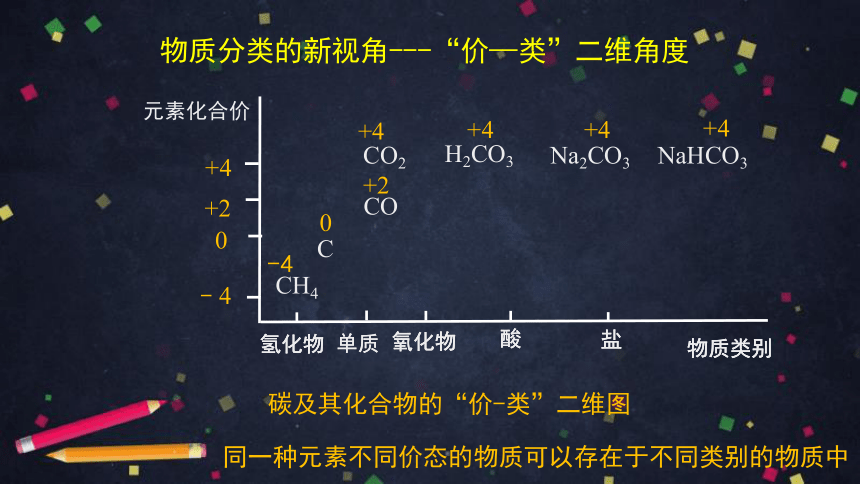
同一种元素不同价态的物质可以存在于不同类别的物质中
碳及其化合物的“价-类”二维图
物质分类的新视角---“价—类”二维角度
这些物质之间可以相互转化
C
CO
CO2
H2CO3
Na2CO3
NaHCO3
CH4
+4
+2
0
﹣4
元素化合价
单质
物质类别
酸
氧化物
氢化物
盐
关于化合价
+3
+3
+2
+2
FeO Fe(OH)2
Fe(OH)3
Fe2O3
Fe3O4
化合价是元素在形成化合物时表现出的一种性质,因此依据核心元素化合价对物质分类有着重要意义。
+2 +3
如何确定陌生元素的化合价?
确定熟悉元素化合价
根据化学式中化合价代数和为0的原则
常见元素的化合价:
一价氢氯(负)钾钠银
二价氧(负)钙钡镁锌
三铝四硅五价磷
二三铁,二四碳
二四六硫都齐全(-2、+4、+6)
铜汞二价最常见
莫忘单质价为零
应用 实践
1.请判断下列物质或微粒中指定元素的化合价
NH3、NH4、NO3 、H2SO3
-
+
完成学案三
应用 实践
请判断下列物质或微粒中指定元素的化合价
NH3、NH4、NO3 、H2SO3
-
+
-3
-3
+5
+4
2.分类是学习和研究化学的一种重要方法,下列分类不合理的是______
A.K2CO3 既属于钾盐,又属于碳酸盐
B.Na2O 和 CO 都属于氧化物
C.KOH 和 Na2CO3 都属于碱
D.H2SO4 和 HNO3 都属于含氧酸
C
应用 实践
3.以 Na、Ba、H、O、C、S、N 中任意两种或三种元素组成合适的物质,分别填在表中(每空填一例)
物质 类别 酸 碱 盐 氧化物 氢化物
化学式
氢化物示例:NH3
应用 实践
以 Na、Ba、H、O、C、S、N 中任意两种或三种元素组成合适的物质,分别填在表中(每空填一例)
物质 类别 酸 碱 盐 氧化物 氢化物
化学式
氢化物示例:NH3
应用 实践
H2SO4
NaO H
BaSO4
BaO
CH4
H2CO3
HNO3
Ba(O H)2
Na2SO4
Na2CO3
Na2O
H2O
H2O
H2S
拓展类知识
氧
化
物
酸性氧化物
碱性氧化物
两性氧化物
CuO、Fe2O3、Na2O
CO、H2O
CO2、SO3
CaO、CuO、K2O
Al2O3、Zn2O
从组成元素分
非金属氧化物
金属氧化物
从性质分
氧化物的分类
过氧化物
不成盐氧化物
H2O2、Na2O2
CO、NO、NO2
1、定义:与碱反应只生成盐和水的氧化物。
2、性质:
(1)与碱反应只生成盐和水.
(2)多数能与水化合生成酸.
酸性氧化物
CO2 + H2O = H2CO3
CO2 + 2NaOH = Na2CO3 + H2O
3、大多数非金属氧化物是酸性氧化物,
个别金属氧化物也是酸性氧化物,如Mn2O7是酸性氧化物。
CO、H2O不是酸性氧化物
1.定义:与酸反应只生成盐和水的氧化物。
2.性质:
(1)能与酸反应只生成盐和水。
(2)少数能与水化合生成碱。
碱性氧化物
(3)能与某些酸性氧化物化合成盐。
Na2O + H2O = 2NaOH
Na2O + 2HCl = 2NaCl + H2O
Na2O + CO2 = Na2CO3
3、碱性氧化物都是金属氧化物,
如:Mn2O7 是酸性氧化物。
金属氧化物不一定是碱性氧化物。
Na2O2不是碱性氧化物。
Al2O3是两性氧化物。
碱性氧化物不一定能与水反应生成相应的碱,例如:CuO不溶于水;
酸性氧化物不一定能与水反应生成相应的酸,例如:SiO2不溶于水.
练习:判断下列说法是否正确。
1、金属氧化物一定是碱性氧化物。 ( )
2、碱性氧化物一定是金属氧化物。 ( )
3、酸性氧化物一定是非金属氧化物。 ( )
4、非金属氧化物不一定是酸性氧化物。( )
5、能电离出H+的化合物一定是酸。 ( )
6、CH3COOH属于一元酸。 ( )
7、含有氧元素的化合物都是氧化物。 ( )
×
√
×
√
×
√
×
酸
从能电离的H+数分
一元酸:
二元酸:
三元酸:
从是否含氧分
含氧酸
高沸点酸:
从沸点高低分
无氧酸:
弱酸:
从电离程度分
强酸:
挥发性酸:
HCl HNO3 HClO
H2SO4 H2CO3 H2S
H3PO4
H2SO4 HNO3 HClO
HCl HF H2S
HCl HBr HI HNO3 H2SO4 HClO4
H2CO3、HF、H2S、CH3COOH、HClO、H3PO4 H2SO3等
H2SO4 H3PO4
HCl HNO3
碱
从电离OH-数分
一元碱:
二元碱:
从溶解性分
可溶性碱:
不溶性碱:
弱碱:
从电离程度分
强碱:
KOH NaOH NH3.H2O
Ba(OH)2 Ca(OH)2 Mg(OH)2
KOH NaOH NH3﹒H2O Ba(OH)2 Ca(OH)2
Mg(OH)2 Cu(OH)2 Fe(OH)3等
KOH NaOH Ba(OH)2 Ca(OH)2
NH3﹒H2O Mg(OH)2 Fe(OH)3 Cu(OH)2等
盐
从中和程度分
正盐:
酸式盐:
碱式盐:
从酸根是否含氧分
含氧酸盐
硫酸盐:
从阴离子分
无氧酸盐:
钠盐
铵盐
从阳离子分
钾盐:
碳酸盐:
从溶解性分
可溶性盐
微溶性盐
难溶性盐
NaCl K2SO4 (NH4)3PO4
NaHSO4 NH4HCO3 KH2PO4
Cu2(OH)2CO3
CuSO4 KNO3 NaClO
NH4Cl CaF2 Na2S
KCl KNO3 K2SO4
Na2CO3 NaF Na2S CH3COONa
(NH4)3PO4 (NH4)2SO4 NH4Cl
K2SO4 Na2SO4 CuSO4
K2CO3 Na2CO3 CaCO3
K2CO3 AgNO3 NaClO NH4Cl
CaSO4 Ag2SO4
BaSO4 CaCO3 AgCl
名称 概念 命名 实例
正盐 酸碱完全中和后的产物 某化某 某酸某 NaCl
NaCO3
酸式盐 酸中的H+被部分中和的产物 某酸氢某 酸式某酸某 NaHCO3
碱式盐 酸中的OH-被部分中和的产物 正盐名称前面加“碱式” Cu2(OH)2CO3
碱式碳酸铜
复盐 含有两种阳离子 读出两种金属名称 KAl(SO4)2H2O
硫酸铝钾
北方交大附中
酸碱盐的溶解性口诀
溶碱一共有四种,钾钠钡氨在其中;
钙碱微溶要注重。
钾钠硝酸铵盐溶,其余碳酸盐不溶(碳酸钾、碳酸钠、碳酸铵以外的碳酸盐不可溶)。
硫酸盐除银钡钙,盐酸盐除银不溶。
(氢氧化钙溶液或者澄清石灰水中的氢氧化钙全部溶解并电离,石灰乳中氢氧化钙部分溶解)
酸碱性溶解性规律
酸除硅酸(H2SiO3)外全溶于水
碱溶钾钠钡铵,钙(微溶);
盐:钾钠铵硝,外加碳酸氢盐均可溶,
盐酸盐不溶银,
硫酸盐不溶银钡钙,
碳酸盐只溶钾钠铵
