人教版九年级化学上册 第三单元《构成物质的奥秘》复习测试题(WORD版,含答案)
文档属性
| 名称 | 人教版九年级化学上册 第三单元《构成物质的奥秘》复习测试题(WORD版,含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 220.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-24 10:53:07 | ||
图片预览


文档简介
第三单元《构成物质的奥秘》复习测试题
一、选择题:
1、我国发射的“天问一号”火星探测器计划于2021年5月到6月择机着陆火星,火星土壤中含量最多的元素与地球地壳中含量最多的元素相同,这种元素是( )
A.氧 B.硅 C.铝 D.铁
2、用分子的相关知识解释下列现象,其中正确的是( )
A.物质能热胀冷缩,说明分子可以再分
B.湿衣服放在阳光下容易干,说明分子质量很小
C.进入超市闻到榴莲的香味,说明分子之间有间隔
D.50mL的酒精和50mL的水混合后总体积小于100mL,说明分子间有间隔
3、如图为硫原子的原子结构示意图。下列说法不正确的是( )
A.硫原子的质子数为16
B.硫原子在化学变化中易失电子
C.硫原子的第二层电子数为8
D.硫原子核外有3个电子层
4、钛元素在元素周期表中的相关信息如图所示。下列说法错误的是( )
A.钛原子的核内中子数为22
B.钛属于金属元素
C.钛的元素符号是Ti
D.钛的相对原子质量是47.87
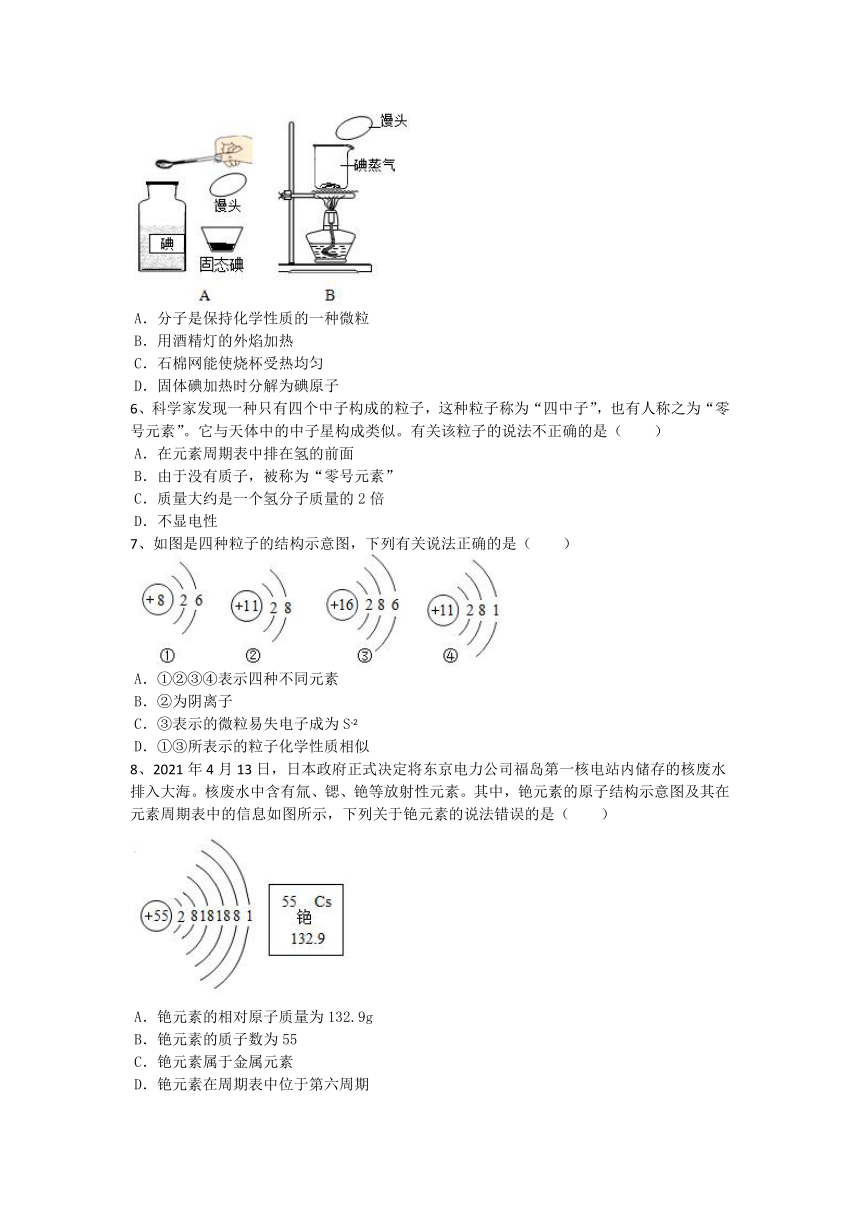
5、碘单质是一种由碘分子构成的非金属,碘单质能使淀粉变蓝色,安安同学利用碘进行了如图所示的实验,A中用湿润的馒头蘸取少量的固体碘,B中把湿润的馒头放在碘蒸气中。以下叙述错误的是( )
A.分子是保持化学性质的一种微粒
B.用酒精灯的外焰加热
C.石棉网能使烧杯受热均匀
D.固体碘加热时分解为碘原子
6、科学家发现一种只有四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )
A.在元素周期表中排在氢的前面
B.由于没有质子,被称为“零号元素”
C.质量大约是一个氢分子质量的2倍
D.不显电性
7、如图是四种粒子的结构示意图,下列有关说法正确的是( )
A.①②③④表示四种不同元素
B.②为阴离子
C.③表示的微粒易失电子成为S-2
D.①③所表示的粒子化学性质相似
8、2021年4月13日,日本政府正式决定将东京电力公司福岛第一核电站内储存的核废水排入大海。核废水中含有氚、锶、铯等放射性元素。其中,铯元素的原子结构示意图及其在元素周期表中的信息如图所示,下列关于铯元素的说法错误的是( )
A.铯元素的相对原子质量为132.9g
B.铯元素的质子数为55
C.铯元素属于金属元素
D.铯元素在周期表中位于第六周期
9、按如图元素周期表(局部)提供的信息,下列有关判断错误的是( )
A.铍和镁属于同一个族
B.同一周期的元素,原子的电子层数相同
C.镁原子的核内质子数为12
D.锂和钠的最外层电子数相同,所以二者的化学性质完全相同
10、下列关于微粒的叙述中错误的是( )
A.原子、分子、离子都是构成物质的微粒,它们在不停地运动
B.一定条件下,钠原子和钠离子能相互转化
C.由分子构成的物质发生物理变化时,分子本身没有改变
D.原子的内部含有带电的微粒,所以原子就带有一定的电性
11、下列排序正确的是( )
A.分子间的空隙:B.原子核外电子层数:
C.地壳中元素含量:D.空气中物质的含量:
12、一定条件下,水在密闭容器里的冷却过程中,温度和时间的关系如图所示。①、②、③表示水在不同时刻的存在状态,下列有关判断正确的是( )
A.水分子的运动速率:②>①
B.状态③的水分子静止不动
C.水分子间的间隔:①>③
D.①→②水分子发生了改变
二、填空题:
13、微粒观、分类观以及化学用语是学习化学的重要观念和工具,请你回答:
(1)从微观看,物质都是由微小的粒子构成的,如 、 、 是构成物质的基本微粒。
(2)分类时化学学习常用的一种学习方法,请回答:
①已知“”、“”表示不同的原子,下列表示的气体物质中,属于纯净物的是 (填序号,下同)。
②下面有六种物质:①冰水混合物;②蒸馏水;③洁净的空气;④氧化镁;⑤液氮;⑥净化后的自来水,其中属于混合物是 ,属于纯净物是 。
③除了对物质的组成进行分类,在化学上,我们目前还学过可以对 进行分类。
14、模型是联系宏观与微观的桥梁。
(1)图1是钠原子结构示意图。
①x的数值为 。
②“11”指的是 。
③钠原子在化学反应中易 (得到、失去)1个电子,形成 (填离子符号)。
④氯化钠是由 构成。
(2)图2是氢分子和氧分子运动的示意图。
①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是 (填标号)。
②从图中可见,影响分子运动速率的因素除温度外,还与 有关。
③举一个能说明“温度升高,分子运动速率加快”的生活事例: 。
15、在宏观、微观和化学符号之间建立联系是化学学科的特点。构成物质和粒子之间的关系如图1所示,几种微粒的结构示意图如图2所示。
(1)寻找规律,填入图1序号所对应的空白① ,② ;
(2)在图2中,共有 种元素(填数字),m= ;
(3)D属于 (填“金属”或“非金属”)元素,在反应中容易 (填“得到”或“失去”)电子;
(4)最外层电子数达到稳定结构的有 (填字母);
16、建立宏观与微观之间的联系,是化学学科特有的思维方式。如图是元素周期表的部分信息:
(1)分析上表规律,可推知,表中X= 。
(2)地壳中含量最多的金属元素的原子核内质子数是 ;由原子变成离子是 (填“物理变化”或“化学变化”)。
(3)门捷列夫编制了元素周期表,元素周期表中的每一个横行叫做一个 ,位于元素周期表中同一横行的元素的原子,具有相同的 (选填“电子层数”或“最外层电子数”)。
我国科学家为相对原子质量的测定做出了卓越贡献,他的名字是 ;1991年,他和另一位科学家合作测定了铟(In)元素的相对原子质量新值。已知铟原子的核电荷数为49,相对原子质量为115.则铟原子的中子数为 。
(4)请写出同一横行元素的原子结构上存在的递变规律 。
17、某兴趣小组在学习了分子的性质后,做了如图两个实验。
实验一:如图1所示,将滴有酚酞的滤纸条放在试管里,平放在实验桌上。
(1)用胶头滴管吸取浓氨水,滴在脱脂棉上,胶头滴管的用途是 。
(2)实验中,观察到的现象是滤纸条上滴有酚酞试液处 依次变红;从微观角度看,此现象说明 。
(3)组内某同学在做此实验时,发现滤纸条没有变色,而试管中所塞的脱脂棉却变成了红色。导致这种现象产生的错误操作可能是 ;这一实验还说明,两种试剂中 具有挥发性,属于该物质的 (填“物理”或“化学”)性质;酚酞变色是发生了 变化(填“物理”或“化学”)。
实验二:先在一支试管中装一半红墨水,再在液面上注满酒精(缓缓注入),加盖密封后静置,30日后再观察,现象如图2所示。
(4)该实验说明的分子性质有 、 。
参考答案
一、选择题:
1、A 2、D 3、B 4、A 5、D 6、A 7、D 8、A 9、D 10、D
11、A 12、C
二、填空题:
13、答案:答案:(1)分子;原子;离子;
(2)①AB;
②③⑥;①②④⑤;
③化学反应的基本类型。
14、答案:(1)①8;
②钠原子的核内有11个质子;
③失去;Na+;
④钠离子和氯离子;
(2)①B、C;
②分子种类;
③衣服在阳光下比阴冷的地方干得快。
15、答案为:(1)原子;分子;
(2)4;8;
(3)非金属;得到;
(4)B、C、E;
16、答案:(1)17;
(2)13;化学变化;
(3)周期;电子层数;张青莲;66;
(4)从左到右,元素原子的最外层电子数依次递增。
17、答案:(1)吸取和滴加少量液体;
(2)从右到左;分子在不断地运动;
(3)浓氨水与酚酞试液滴反了;浓氨水;物理;化学;
(4)分子在不断地运动;分子之间有间隔
一、选择题:
1、我国发射的“天问一号”火星探测器计划于2021年5月到6月择机着陆火星,火星土壤中含量最多的元素与地球地壳中含量最多的元素相同,这种元素是( )
A.氧 B.硅 C.铝 D.铁
2、用分子的相关知识解释下列现象,其中正确的是( )
A.物质能热胀冷缩,说明分子可以再分
B.湿衣服放在阳光下容易干,说明分子质量很小
C.进入超市闻到榴莲的香味,说明分子之间有间隔
D.50mL的酒精和50mL的水混合后总体积小于100mL,说明分子间有间隔
3、如图为硫原子的原子结构示意图。下列说法不正确的是( )
A.硫原子的质子数为16
B.硫原子在化学变化中易失电子
C.硫原子的第二层电子数为8
D.硫原子核外有3个电子层
4、钛元素在元素周期表中的相关信息如图所示。下列说法错误的是( )
A.钛原子的核内中子数为22
B.钛属于金属元素
C.钛的元素符号是Ti
D.钛的相对原子质量是47.87
5、碘单质是一种由碘分子构成的非金属,碘单质能使淀粉变蓝色,安安同学利用碘进行了如图所示的实验,A中用湿润的馒头蘸取少量的固体碘,B中把湿润的馒头放在碘蒸气中。以下叙述错误的是( )
A.分子是保持化学性质的一种微粒
B.用酒精灯的外焰加热
C.石棉网能使烧杯受热均匀
D.固体碘加热时分解为碘原子
6、科学家发现一种只有四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )
A.在元素周期表中排在氢的前面
B.由于没有质子,被称为“零号元素”
C.质量大约是一个氢分子质量的2倍
D.不显电性
7、如图是四种粒子的结构示意图,下列有关说法正确的是( )
A.①②③④表示四种不同元素
B.②为阴离子
C.③表示的微粒易失电子成为S-2
D.①③所表示的粒子化学性质相似
8、2021年4月13日,日本政府正式决定将东京电力公司福岛第一核电站内储存的核废水排入大海。核废水中含有氚、锶、铯等放射性元素。其中,铯元素的原子结构示意图及其在元素周期表中的信息如图所示,下列关于铯元素的说法错误的是( )
A.铯元素的相对原子质量为132.9g
B.铯元素的质子数为55
C.铯元素属于金属元素
D.铯元素在周期表中位于第六周期
9、按如图元素周期表(局部)提供的信息,下列有关判断错误的是( )
A.铍和镁属于同一个族
B.同一周期的元素,原子的电子层数相同
C.镁原子的核内质子数为12
D.锂和钠的最外层电子数相同,所以二者的化学性质完全相同
10、下列关于微粒的叙述中错误的是( )
A.原子、分子、离子都是构成物质的微粒,它们在不停地运动
B.一定条件下,钠原子和钠离子能相互转化
C.由分子构成的物质发生物理变化时,分子本身没有改变
D.原子的内部含有带电的微粒,所以原子就带有一定的电性
11、下列排序正确的是( )
A.分子间的空隙:B.原子核外电子层数:
C.地壳中元素含量:D.空气中物质的含量:
12、一定条件下,水在密闭容器里的冷却过程中,温度和时间的关系如图所示。①、②、③表示水在不同时刻的存在状态,下列有关判断正确的是( )
A.水分子的运动速率:②>①
B.状态③的水分子静止不动
C.水分子间的间隔:①>③
D.①→②水分子发生了改变
二、填空题:
13、微粒观、分类观以及化学用语是学习化学的重要观念和工具,请你回答:
(1)从微观看,物质都是由微小的粒子构成的,如 、 、 是构成物质的基本微粒。
(2)分类时化学学习常用的一种学习方法,请回答:
①已知“”、“”表示不同的原子,下列表示的气体物质中,属于纯净物的是 (填序号,下同)。
②下面有六种物质:①冰水混合物;②蒸馏水;③洁净的空气;④氧化镁;⑤液氮;⑥净化后的自来水,其中属于混合物是 ,属于纯净物是 。
③除了对物质的组成进行分类,在化学上,我们目前还学过可以对 进行分类。
14、模型是联系宏观与微观的桥梁。
(1)图1是钠原子结构示意图。
①x的数值为 。
②“11”指的是 。
③钠原子在化学反应中易 (得到、失去)1个电子,形成 (填离子符号)。
④氯化钠是由 构成。
(2)图2是氢分子和氧分子运动的示意图。
①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是 (填标号)。
②从图中可见,影响分子运动速率的因素除温度外,还与 有关。
③举一个能说明“温度升高,分子运动速率加快”的生活事例: 。
15、在宏观、微观和化学符号之间建立联系是化学学科的特点。构成物质和粒子之间的关系如图1所示,几种微粒的结构示意图如图2所示。
(1)寻找规律,填入图1序号所对应的空白① ,② ;
(2)在图2中,共有 种元素(填数字),m= ;
(3)D属于 (填“金属”或“非金属”)元素,在反应中容易 (填“得到”或“失去”)电子;
(4)最外层电子数达到稳定结构的有 (填字母);
16、建立宏观与微观之间的联系,是化学学科特有的思维方式。如图是元素周期表的部分信息:
(1)分析上表规律,可推知,表中X= 。
(2)地壳中含量最多的金属元素的原子核内质子数是 ;由原子变成离子是 (填“物理变化”或“化学变化”)。
(3)门捷列夫编制了元素周期表,元素周期表中的每一个横行叫做一个 ,位于元素周期表中同一横行的元素的原子,具有相同的 (选填“电子层数”或“最外层电子数”)。
我国科学家为相对原子质量的测定做出了卓越贡献,他的名字是 ;1991年,他和另一位科学家合作测定了铟(In)元素的相对原子质量新值。已知铟原子的核电荷数为49,相对原子质量为115.则铟原子的中子数为 。
(4)请写出同一横行元素的原子结构上存在的递变规律 。
17、某兴趣小组在学习了分子的性质后,做了如图两个实验。
实验一:如图1所示,将滴有酚酞的滤纸条放在试管里,平放在实验桌上。
(1)用胶头滴管吸取浓氨水,滴在脱脂棉上,胶头滴管的用途是 。
(2)实验中,观察到的现象是滤纸条上滴有酚酞试液处 依次变红;从微观角度看,此现象说明 。
(3)组内某同学在做此实验时,发现滤纸条没有变色,而试管中所塞的脱脂棉却变成了红色。导致这种现象产生的错误操作可能是 ;这一实验还说明,两种试剂中 具有挥发性,属于该物质的 (填“物理”或“化学”)性质;酚酞变色是发生了 变化(填“物理”或“化学”)。
实验二:先在一支试管中装一半红墨水,再在液面上注满酒精(缓缓注入),加盖密封后静置,30日后再观察,现象如图2所示。
(4)该实验说明的分子性质有 、 。
参考答案
一、选择题:
1、A 2、D 3、B 4、A 5、D 6、A 7、D 8、A 9、D 10、D
11、A 12、C
二、填空题:
13、答案:答案:(1)分子;原子;离子;
(2)①AB;
②③⑥;①②④⑤;
③化学反应的基本类型。
14、答案:(1)①8;
②钠原子的核内有11个质子;
③失去;Na+;
④钠离子和氯离子;
(2)①B、C;
②分子种类;
③衣服在阳光下比阴冷的地方干得快。
15、答案为:(1)原子;分子;
(2)4;8;
(3)非金属;得到;
(4)B、C、E;
16、答案:(1)17;
(2)13;化学变化;
(3)周期;电子层数;张青莲;66;
(4)从左到右,元素原子的最外层电子数依次递增。
17、答案:(1)吸取和滴加少量液体;
(2)从右到左;分子在不断地运动;
(3)浓氨水与酚酞试液滴反了;浓氨水;物理;化学;
(4)分子在不断地运动;分子之间有间隔
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
