第五单元课题2如何正确书写化学方程式 课后习题—2021-2022学年九年级化学人教版上册(有答案)
文档属性
| 名称 | 第五单元课题2如何正确书写化学方程式 课后习题—2021-2022学年九年级化学人教版上册(有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 116.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-25 17:20:07 | ||
图片预览



文档简介
课题二 如何正确书写化学方程式
一、单选题
1.为了使人们及时发现煤气泄漏,常在每期中加入有特殊气味的乙硫醇C2H5SH,其燃烧的化学方程式为:,则X的化学式( )
A.S B.SO2 C.SO3 D.CO
2.下图中的四位同学对H2+Cl22HCl的认识中,不正确的是( )
A.该反应的条件是点燃 B.该反应前后原子种类和个数没变
C.反应前后分子个数变了 D.表示氢气在氯气中燃烧生成氯化氢
3.根据化学方程式S+O2SO2,无法获得的信息是( )
A.化学反应的剧烈程度
B.参加反应的S和O2的质量比
C.反应前后反应物和生成物的种类
D.反应发生所需要的条件
4.甲烷是天然气的主要成分,其完全燃烧的化学方程式为CH4+2O2CO2+2H2O,根据该化学方程式无法获取的信息是( )
A.反应物和生成物 B.反应所需条件
C.反应物的颜色和状态 D.生成物的分子个数比
5.水蒸气通过红热的铁粉,发生的反应为3Fe+4H2O(气)X+4H2,则X为( )
A.FeO B.Fe2O3 C.Fe3O4 D.Fe(OH)2
6.中国科学家取得了将二氧化碳和氢气反应制取化工原料乙烯的重大突破。该化学反应的微观过程如图所示。下列有关该化学变化的说法正确的是( )
A.该反应一共生成3种新物质
B.从微观角度看,该化学变化改变的微粒是原子
C.乙烯是由分子构成的物质
D.参加反应的两种物质的微粒个数比为1:4
7.从微观角度上,许多化学反应都可用模型示意图来形象的表示其反应发生的过程。下列四个化学反应中能用下图表示的是( )
A.Cl2+H22HCl B.2CO+O22CO2 C.2H2+O22H2O D.CO2+C2CO
8.下列化学方程式书写正确的是( )
A.2S+2O2=2SO2 B.3Fe+2O2Fe2O3
C. D.Mg+O2=MgO2
9.乙炔燃烧放出大量的热,常用于焊接金属,发生的反应的化学方程式为2X+5O24CO2+2H2O,乙炔的化学式为( )
A.C2H4 B.CH C.C2H2 D.C4H4
10.某化学方程式为aC2H6+bO2mCO2+nH2O,下述各式物质间计量数关系正确的是( )
A.2m=a B.3n=2a C.3n=a D.2b=2m+n
11.在化学反应SO2+2X=3S↓+2H2O中,X的化学式为( )
A.S B.H2 C.HS D.H2S
12.书写加热高锰酸钾制氧气的化学方程式时,不需要的符号是( )
A.“=” B.“↑” C.“△” D.“↓”
13.2Mg+O22MgO读法正确的是( )
A.镁加氧气点燃生成氧化镁
B.2Mg和O2 等于2MgO
C.2个镁和1个氧气点燃生成2个氧化镁
D.镁和氧气点燃生成氧化镁
14.“银针验毒”其反应原理之一是4Ag+2X+O2= 2Ag2S+2H2O。则X的化学式为( )
A.S B.H2S C.SO2 D.SO3
15.硅(Si)是信息技术的关键材料,工业制硅的反应之一是 。下列说法正确的是( )
A.Si是地壳中含量最多的元素
B.X的化学式为H4Cl4
C.SiCl4中硅元素的化合价是-4价
D.该反应中只有氯元素的化合价未发生改变
二、填空题
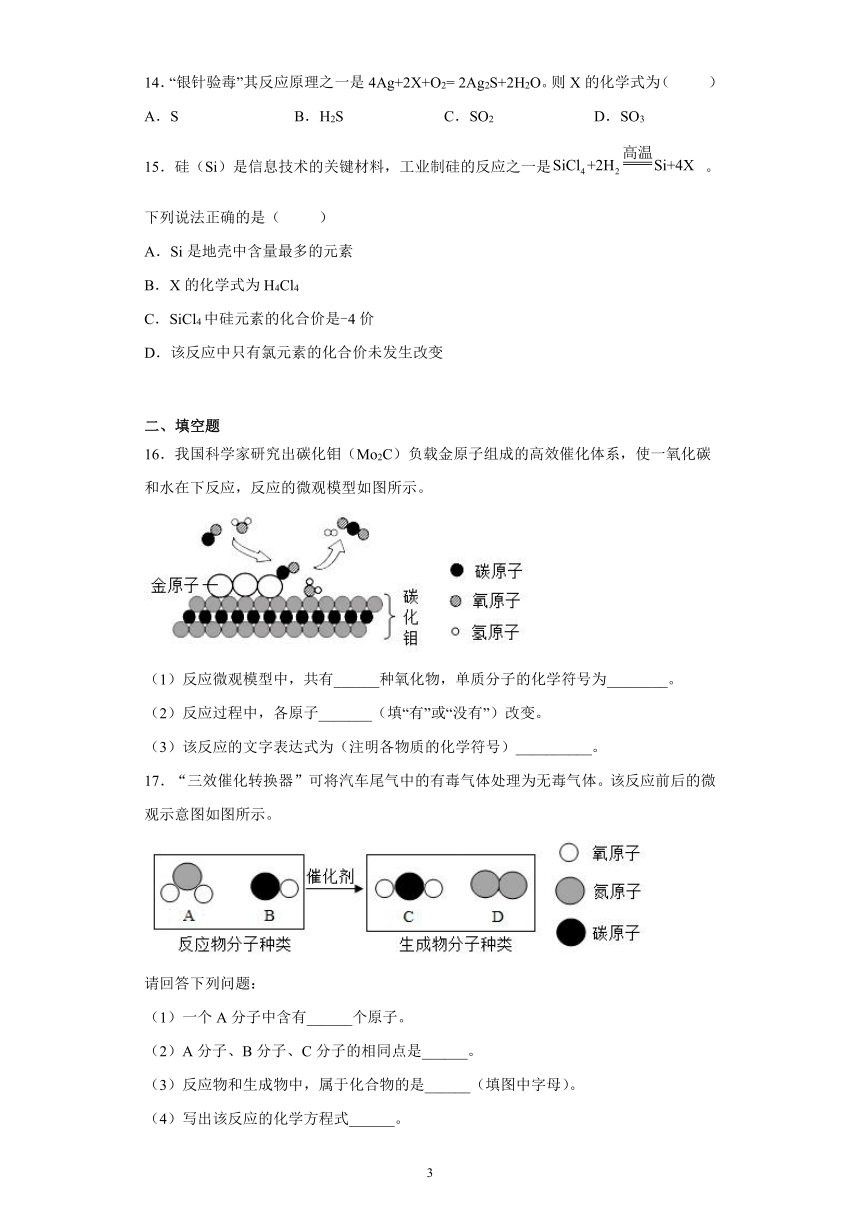
16.我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效催化体系,使一氧化碳和水在下反应,反应的微观模型如图所示。
(1)反应微观模型中,共有______种氧化物,单质分子的化学符号为________。
(2)反应过程中,各原子_______(填“有”或“没有”)改变。
(3)该反应的文字表达式为(注明各物质的化学符号)__________。
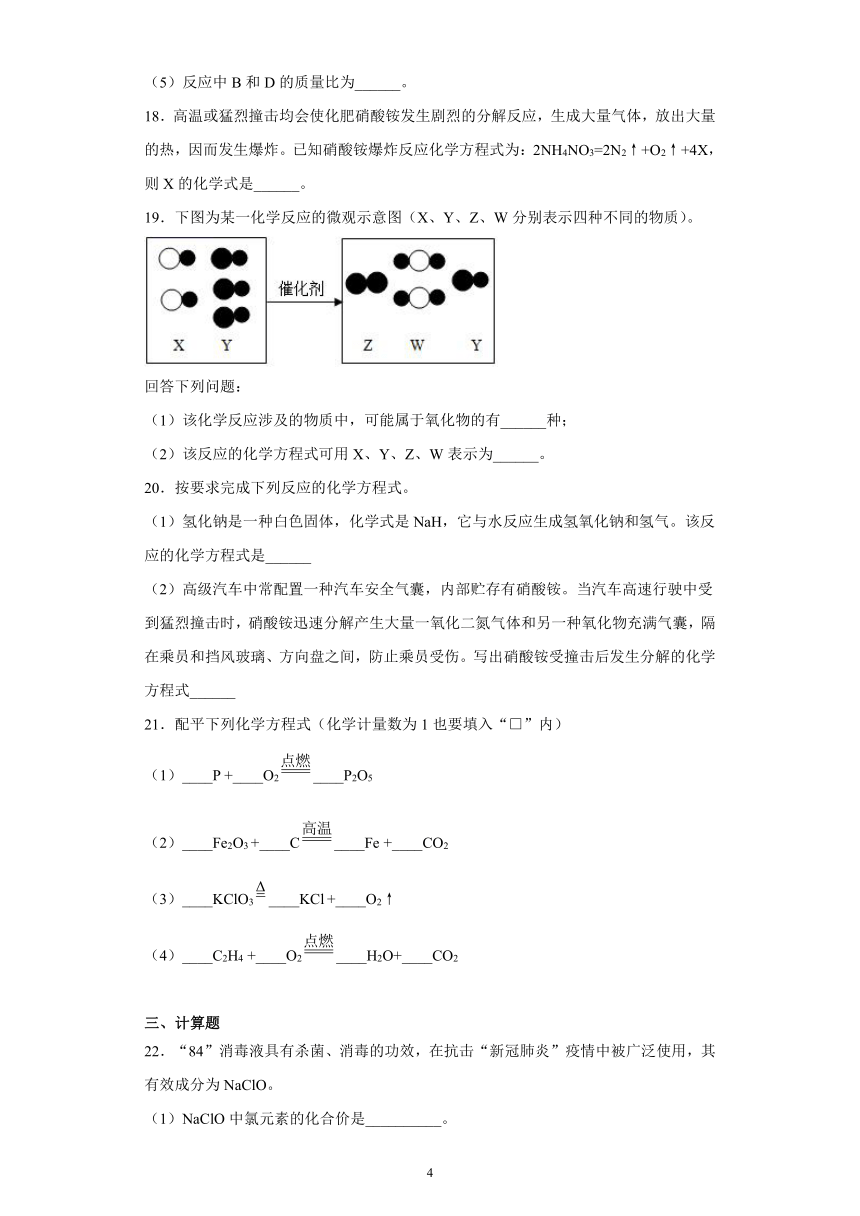
17.“三效催化转换器”可将汽车尾气中的有毒气体处理为无毒气体。该反应前后的微观示意图如图所示。
请回答下列问题:
(1)一个A分子中含有______个原子。
(2)A分子、B分子、C分子的相同点是______。
(3)反应物和生成物中,属于化合物的是______(填图中字母)。
(4)写出该反应的化学方程式______。
(5)反应中B和D的质量比为______。
18.高温或猛烈撞击均会使化肥硝酸铵发生剧烈的分解反应,生成大量气体,放出大量的热,因而发生爆炸。已知硝酸铵爆炸反应化学方程式为:2NH4NO3=2N2↑+O2↑+4X,则X的化学式是______。
19.下图为某一化学反应的微观示意图(X、Y、Z、W分别表示四种不同的物质)。
回答下列问题:
(1)该化学反应涉及的物质中,可能属于氧化物的有______种;
(2)该反应的化学方程式可用X、Y、Z、W表示为______。
20.按要求完成下列反应的化学方程式。
(1)氢化钠是一种白色固体,化学式是NaH,它与水反应生成氢氧化钠和氢气。该反应的化学方程式是______
(2)高级汽车中常配置一种汽车安全气囊,内部贮存有硝酸铵。当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速分解产生大量一氧化二氮气体和另一种氧化物充满气囊,隔在乘员和挡风玻璃、方向盘之间,防止乘员受伤。写出硝酸铵受撞击后发生分解的化学方程式______
21.配平下列化学方程式(化学计量数为1也要填入“□”内)
(1)____P +____O2____P2O5
(2)____Fe2O3 +____C____Fe +____CO2
(3)____KClO3____KCl +____O2↑
(4)____C2H4 +____O2____H2O+____CO2
三、计算题
22.“84”消毒液具有杀菌、消毒的功效,在抗击“新冠肺炎”疫情中被广泛使用,其有效成分为NaClO。
(1)NaClO中氯元素的化合价是__________。
(2)请计算NaClO中氯元素的质量分数。
(3)“84”消毒液不能与洁厕灵这种酸性消毒产品混用,因为会发生如下反应,2HCl+NaClO=NaCl+H2O+__________↑。
23.在预防“新冠肺炎”期间,过氧乙酸是人们广泛使用的消毒剂之一。过氧乙酸的化学式为C2H4O3,是无色且有辛辣味;具有强氧化性,温度稍高即分解放出氧气并生成醋酸(C2H4O2)。请完成下列问题:
(1)过氧乙酸的相对分子质量为______。
(2)过氧乙酸中碳、氢、氧三种元素的质量比为______。(填最简整数比)
(3)过氧乙酸中氧元素的质量分数为______。(计算结果精确到0.1%)
(4)写出过氧乙酸分解的化学方程式为______。
24.2020年,新冠肺炎肆虐,许多场所均采用消毒液进行消毒,阻断了病毒传播。请结合图片及文本信息回答问题。
(1)医用双氧水主要成分是过氧化氢,消毒时产生的无色气泡是 (填化学式),使用这种消毒液的优点是 。
(2)“84消毒液”的主要成分是次氯酸钠(NaClO)。制取NaClO的原理是2NaOH+Cl2═NaClO+X+H2O,其中X的化学式是 。
(3)乙醇俗称酒精,乙醇的化学式为C2H5OH,请计算:
①乙醇中碳元素的质量分数为 (只列式,不计算结果)。
②4.6g乙醇与 g二氧化碳中均含有的碳元素的质量相等(结果精确到0.1)。
25.新冠病毒严重威胁着人们的健康。疫情期间,人们常用84消毒液[主要成分为次氯酸钠(NaClO)]、过氧乙酸(CH3COOOH)等消毒液对环境进行杀菌、消毒。
(1)工业上制备NaClO的反应原理为,Cl2+2=NaCl+NaClO+H2O,请推测方框内物质的化学式为________。
(2)过氧乙酸(CH3COOOH)中碳、氢元素的质量比为________,氧元素的质量分数为________(精确到0.1%);1个过氧乙酸分子中共含________个原子。
(3)84消毒液与洁厕灵不能混合使用,其反应原理为:。
请根据化学方程式计算,36.5克HCl与足量次氯酸钠反应产生氯气的质量为多少?
26.科学研究表明,利用化学反应2Na+H22NaH可实现氢气的存储,计算230g金属钠最多可吸收氢气的质量_____。
参考答案
1.B
2.C
3.A
4.C
5.C
6.C
7.B
8.C
9.C
10.D
11.D
12.D
13.D
14.B
15.D
16.
(1) 3 H2
(2)没有
(3)一氧化碳(CO)+水(H2O)二氧化碳(CO2)+氢气(H2)
17.
(1)3
(2)都含有氧原子
(3)ABC
(4)2NO2+4CO4CO2+N2
(5)4:1
18.H2O
19.
(1)3
(2)2X+2Y Z+2W
20.
(1)NaH+H2O=NaOH+H2↑
(2)NH4NO3N2O↑+2H2O
21.
(1) 4 5 2
(2) 2 3 4 3
(3) 2 2 3
(4) 1 3 2 2
22.(1)+1
(2)NaClO中氯元素的质量分数为
(3)Cl2
23.(1)过氧乙酸的相对分子质量为:12×2+4+16×3=76
(2)过氧乙酸中碳、氢、氧三种元素的质量比为:(12×2):4:(16×3)=6:1:12
(3)过氧乙酸中氧元素的质量分数为:
(4)
24.(1)H2O2;无污染(或安全)(2)NaCl(3)①酒精中碳元素的质量分数为;
②设二氧化碳的质量为x。
x=8.8g。
25.(1)NaOH
(2)6:1 63.2% 9
(3)解:设产生氯气的质量为。
答:产生氯气的质量为35.5 g。
26.10g
一、单选题
1.为了使人们及时发现煤气泄漏,常在每期中加入有特殊气味的乙硫醇C2H5SH,其燃烧的化学方程式为:,则X的化学式( )
A.S B.SO2 C.SO3 D.CO
2.下图中的四位同学对H2+Cl22HCl的认识中,不正确的是( )
A.该反应的条件是点燃 B.该反应前后原子种类和个数没变
C.反应前后分子个数变了 D.表示氢气在氯气中燃烧生成氯化氢
3.根据化学方程式S+O2SO2,无法获得的信息是( )
A.化学反应的剧烈程度
B.参加反应的S和O2的质量比
C.反应前后反应物和生成物的种类
D.反应发生所需要的条件
4.甲烷是天然气的主要成分,其完全燃烧的化学方程式为CH4+2O2CO2+2H2O,根据该化学方程式无法获取的信息是( )
A.反应物和生成物 B.反应所需条件
C.反应物的颜色和状态 D.生成物的分子个数比
5.水蒸气通过红热的铁粉,发生的反应为3Fe+4H2O(气)X+4H2,则X为( )
A.FeO B.Fe2O3 C.Fe3O4 D.Fe(OH)2
6.中国科学家取得了将二氧化碳和氢气反应制取化工原料乙烯的重大突破。该化学反应的微观过程如图所示。下列有关该化学变化的说法正确的是( )
A.该反应一共生成3种新物质
B.从微观角度看,该化学变化改变的微粒是原子
C.乙烯是由分子构成的物质
D.参加反应的两种物质的微粒个数比为1:4
7.从微观角度上,许多化学反应都可用模型示意图来形象的表示其反应发生的过程。下列四个化学反应中能用下图表示的是( )
A.Cl2+H22HCl B.2CO+O22CO2 C.2H2+O22H2O D.CO2+C2CO
8.下列化学方程式书写正确的是( )
A.2S+2O2=2SO2 B.3Fe+2O2Fe2O3
C. D.Mg+O2=MgO2
9.乙炔燃烧放出大量的热,常用于焊接金属,发生的反应的化学方程式为2X+5O24CO2+2H2O,乙炔的化学式为( )
A.C2H4 B.CH C.C2H2 D.C4H4
10.某化学方程式为aC2H6+bO2mCO2+nH2O,下述各式物质间计量数关系正确的是( )
A.2m=a B.3n=2a C.3n=a D.2b=2m+n
11.在化学反应SO2+2X=3S↓+2H2O中,X的化学式为( )
A.S B.H2 C.HS D.H2S
12.书写加热高锰酸钾制氧气的化学方程式时,不需要的符号是( )
A.“=” B.“↑” C.“△” D.“↓”
13.2Mg+O22MgO读法正确的是( )
A.镁加氧气点燃生成氧化镁
B.2Mg和O2 等于2MgO
C.2个镁和1个氧气点燃生成2个氧化镁
D.镁和氧气点燃生成氧化镁
14.“银针验毒”其反应原理之一是4Ag+2X+O2= 2Ag2S+2H2O。则X的化学式为( )
A.S B.H2S C.SO2 D.SO3
15.硅(Si)是信息技术的关键材料,工业制硅的反应之一是 。下列说法正确的是( )
A.Si是地壳中含量最多的元素
B.X的化学式为H4Cl4
C.SiCl4中硅元素的化合价是-4价
D.该反应中只有氯元素的化合价未发生改变
二、填空题
16.我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效催化体系,使一氧化碳和水在下反应,反应的微观模型如图所示。
(1)反应微观模型中,共有______种氧化物,单质分子的化学符号为________。
(2)反应过程中,各原子_______(填“有”或“没有”)改变。
(3)该反应的文字表达式为(注明各物质的化学符号)__________。
17.“三效催化转换器”可将汽车尾气中的有毒气体处理为无毒气体。该反应前后的微观示意图如图所示。
请回答下列问题:
(1)一个A分子中含有______个原子。
(2)A分子、B分子、C分子的相同点是______。
(3)反应物和生成物中,属于化合物的是______(填图中字母)。
(4)写出该反应的化学方程式______。
(5)反应中B和D的质量比为______。
18.高温或猛烈撞击均会使化肥硝酸铵发生剧烈的分解反应,生成大量气体,放出大量的热,因而发生爆炸。已知硝酸铵爆炸反应化学方程式为:2NH4NO3=2N2↑+O2↑+4X,则X的化学式是______。
19.下图为某一化学反应的微观示意图(X、Y、Z、W分别表示四种不同的物质)。
回答下列问题:
(1)该化学反应涉及的物质中,可能属于氧化物的有______种;
(2)该反应的化学方程式可用X、Y、Z、W表示为______。
20.按要求完成下列反应的化学方程式。
(1)氢化钠是一种白色固体,化学式是NaH,它与水反应生成氢氧化钠和氢气。该反应的化学方程式是______
(2)高级汽车中常配置一种汽车安全气囊,内部贮存有硝酸铵。当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速分解产生大量一氧化二氮气体和另一种氧化物充满气囊,隔在乘员和挡风玻璃、方向盘之间,防止乘员受伤。写出硝酸铵受撞击后发生分解的化学方程式______
21.配平下列化学方程式(化学计量数为1也要填入“□”内)
(1)____P +____O2____P2O5
(2)____Fe2O3 +____C____Fe +____CO2
(3)____KClO3____KCl +____O2↑
(4)____C2H4 +____O2____H2O+____CO2
三、计算题
22.“84”消毒液具有杀菌、消毒的功效,在抗击“新冠肺炎”疫情中被广泛使用,其有效成分为NaClO。
(1)NaClO中氯元素的化合价是__________。
(2)请计算NaClO中氯元素的质量分数。
(3)“84”消毒液不能与洁厕灵这种酸性消毒产品混用,因为会发生如下反应,2HCl+NaClO=NaCl+H2O+__________↑。
23.在预防“新冠肺炎”期间,过氧乙酸是人们广泛使用的消毒剂之一。过氧乙酸的化学式为C2H4O3,是无色且有辛辣味;具有强氧化性,温度稍高即分解放出氧气并生成醋酸(C2H4O2)。请完成下列问题:
(1)过氧乙酸的相对分子质量为______。
(2)过氧乙酸中碳、氢、氧三种元素的质量比为______。(填最简整数比)
(3)过氧乙酸中氧元素的质量分数为______。(计算结果精确到0.1%)
(4)写出过氧乙酸分解的化学方程式为______。
24.2020年,新冠肺炎肆虐,许多场所均采用消毒液进行消毒,阻断了病毒传播。请结合图片及文本信息回答问题。
(1)医用双氧水主要成分是过氧化氢,消毒时产生的无色气泡是 (填化学式),使用这种消毒液的优点是 。
(2)“84消毒液”的主要成分是次氯酸钠(NaClO)。制取NaClO的原理是2NaOH+Cl2═NaClO+X+H2O,其中X的化学式是 。
(3)乙醇俗称酒精,乙醇的化学式为C2H5OH,请计算:
①乙醇中碳元素的质量分数为 (只列式,不计算结果)。
②4.6g乙醇与 g二氧化碳中均含有的碳元素的质量相等(结果精确到0.1)。
25.新冠病毒严重威胁着人们的健康。疫情期间,人们常用84消毒液[主要成分为次氯酸钠(NaClO)]、过氧乙酸(CH3COOOH)等消毒液对环境进行杀菌、消毒。
(1)工业上制备NaClO的反应原理为,Cl2+2=NaCl+NaClO+H2O,请推测方框内物质的化学式为________。
(2)过氧乙酸(CH3COOOH)中碳、氢元素的质量比为________,氧元素的质量分数为________(精确到0.1%);1个过氧乙酸分子中共含________个原子。
(3)84消毒液与洁厕灵不能混合使用,其反应原理为:。
请根据化学方程式计算,36.5克HCl与足量次氯酸钠反应产生氯气的质量为多少?
26.科学研究表明,利用化学反应2Na+H22NaH可实现氢气的存储,计算230g金属钠最多可吸收氢气的质量_____。
参考答案
1.B
2.C
3.A
4.C
5.C
6.C
7.B
8.C
9.C
10.D
11.D
12.D
13.D
14.B
15.D
16.
(1) 3 H2
(2)没有
(3)一氧化碳(CO)+水(H2O)二氧化碳(CO2)+氢气(H2)
17.
(1)3
(2)都含有氧原子
(3)ABC
(4)2NO2+4CO4CO2+N2
(5)4:1
18.H2O
19.
(1)3
(2)2X+2Y Z+2W
20.
(1)NaH+H2O=NaOH+H2↑
(2)NH4NO3N2O↑+2H2O
21.
(1) 4 5 2
(2) 2 3 4 3
(3) 2 2 3
(4) 1 3 2 2
22.(1)+1
(2)NaClO中氯元素的质量分数为
(3)Cl2
23.(1)过氧乙酸的相对分子质量为:12×2+4+16×3=76
(2)过氧乙酸中碳、氢、氧三种元素的质量比为:(12×2):4:(16×3)=6:1:12
(3)过氧乙酸中氧元素的质量分数为:
(4)
24.(1)H2O2;无污染(或安全)(2)NaCl(3)①酒精中碳元素的质量分数为;
②设二氧化碳的质量为x。
x=8.8g。
25.(1)NaOH
(2)6:1 63.2% 9
(3)解:设产生氯气的质量为。
答:产生氯气的质量为35.5 g。
26.10g
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
