1.3常见的酸 同步练习 (含解析)
图片预览


文档简介
常见的酸
一、单选题
1.下列关于酸的说法错误的是( )
A. 浓硫酸具有吸水性,浓盐酸具有挥发性 B. 稀盐酸和稀硫酸都可用于金属除锈
C. 稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色 D. 稀硫酸能够与活泼金属反应制取氢气
2.盐酸是一种主要的工业用酸,下列关于盐酸的叙述中,正确的是( )
A. 纯净的盐酸不含杂质,故是纯净物 B. 纯净的浓盐酸是黄色有刺激性气味的液体
C. 人的胃液里含少量的盐酸,可以帮助消化 D. 浓盐酸敞口放置一段时间后,溶质质量分数增大
3.构建知识网络是一种重要的学习方法.如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A、B、C 分别属于不同类别的化合物.则 A、B、C 可能是( )
A. KOH、CuSO4、Na2CO3 B. Ba(OH)2、CuSO4、CuO
C. Ca(OH)2、HNO3、K2CO3 D. NaOH、HCl、Ba(NO3)2
4.与金属锌、氧化铜粉末、烧碱溶液和氯化钡溶液都能反应的物质是( )
A. 硫酸钠溶液 B. 食盐水 C. 稀盐酸 D. 稀硫酸
5.列关于硫酸的说法错误的是( )
A. 浓硫酸具有吸水性 B. 稀硫酸与氯化钡溶液混合得白色沉淀
C. 稀硫酸能用来除铁锈 D. 浓硫酸倒入水中,溶液温度会降低
6.浓硫酸可以用作许多气体的干燥剂,这是利用它的( )
A. 吸水性 B. 脱水性 C. 氧化性 D. 酸性
7.打开盛有①浓盐酸②浓硫酸③稀硫酸④浓硝酸的试剂瓶盖后,在瓶口出现白雾的是( )
A. ①③ B. ①② C. ①④ D. ②④
8.打开下列盛装酸的试剂瓶时在瓶口能看到白雾的是( )
A. 稀硫酸 B. 浓盐酸 C. 碳酸 D. 浓硫酸
9.盐酸是一种主要的工业用酸,下列关盐酸的叙述中,错误的是( )
A. 盐酸是氯化氢的水溶液 B. 浓盐酸是黄色与刺激性气味的液体
C. 人的胃液里含少量的盐酸,可以助消化 D. 浓盐酸具有挥发性,在空气中会形成白雾
10.将浓盐酸和浓硫酸分别暴露在空气中,变化的结果是容器内( )
A. 酸液的质量都增大 B. 酸液的质量都减小 C. 酸液的浓度都增大 D. 酸液的浓度都减小
11.若将浓盐酸和浓硫酸敞口放置在空气中,一段时间后,可以肯定的是( )
A. 溶质的质量分数都减小 B. 溶剂质量都增大 C. 溶液质量都增大 D. 溶质质量都减少
12.目前市场出售的调味品食醋中,一定含有的酸是( )
A. 硫酸 B. 盐酸 C. 醋酸 D. 碳酸
二、实验探究题
13.甲、乙两同学在学完酸的化学性质之后,通过自己的想象做了如下实验:
【观察与讨论1】甲同学在做实验时观察到的明显现象是________.再滴加无色酚酞溶液,无明显现象(已知CaCl2溶液呈中性).
【观察与讨论2】乙同学在做实验时开始没有观察到气泡产生,于是对碳酸钠能否与盐酸反应表示怀疑.甲同学通过查阅资料得知:在碳酸钠溶液中滴加少量稀盐酸,先发生反应Na2CO3+HCl=NaCl+NaHCO3 , 继续滴加稀盐酸,再发生反应,NaHCO3+HCl=NaCl+H2O+CO2↑.所以甲同学认为,乙同学实验时还应继续滴加稀盐酸,才能观察到有气泡产生(已知NaHCO3溶液呈碱性).
【观察与讨论3】甲同学先将废液缓慢倒入一洁净的废液杯中,乙同学在观察到气泡产生后,也将实验废液缓慢倒入该废液杯中,没有观察到明显现象.为了处理实验后产生的废液,甲、乙同学决定对废液杯中最终废液溶质的成分进行探究.
【提出问题】最终废液中含有什么溶质?
【猜想与假设】猜想1:废液中含有NaHCO3、CaCl2、NaCl三种溶质.
猜想2:废液中含有________(写化学式)三种溶质.
猜想3:废液中含有…溶质.
【实验与结论】甲、乙同学为了验证猜想,进行了如下实验:
甲同学实验:取少量废液于试管中,向其中滴加盐酸,有气泡产生.
乙同学实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变蓝色.
猜想________(填“1”或“2”或“3”)正确.
【交流与反思】在分析化学反应后所得物质时,除考虑生成物外,还需要考虑________
三、填空题
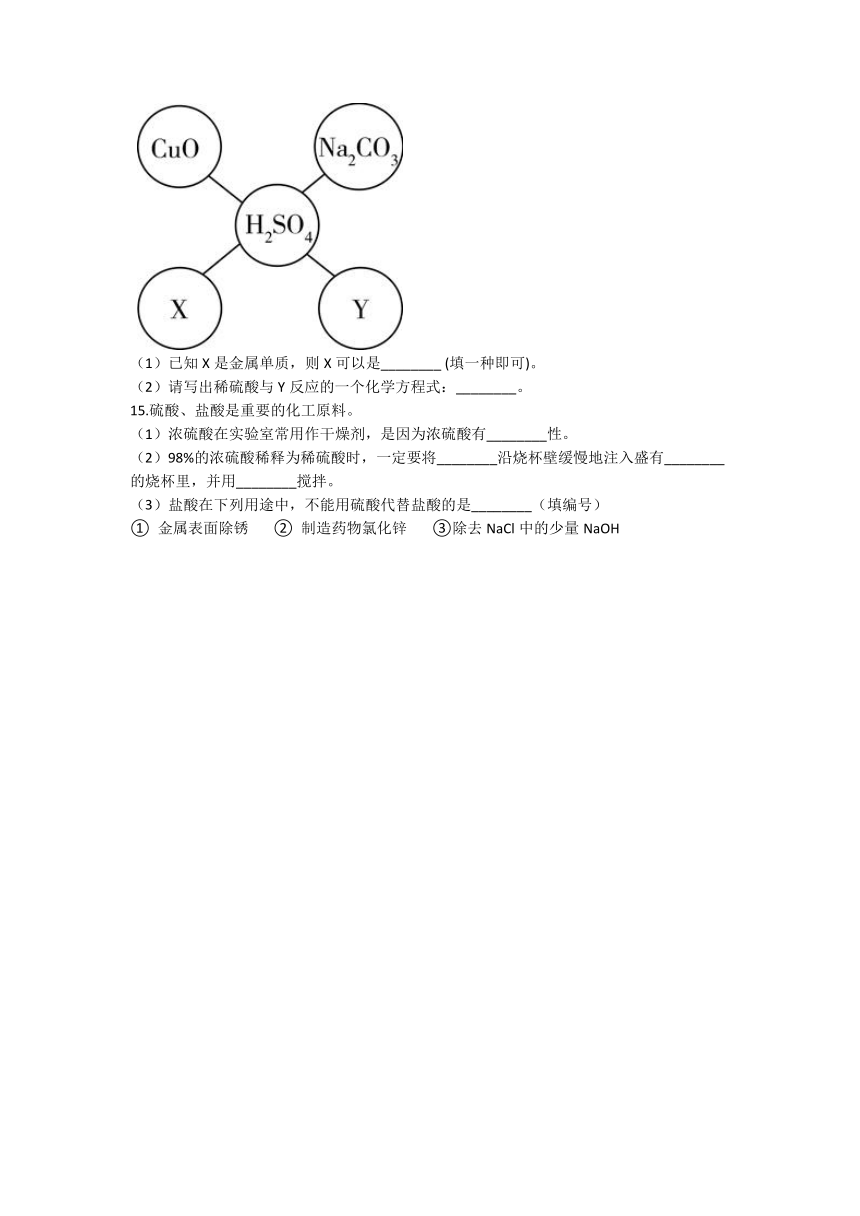
14.对知识的及时整理与归纳是学习科学的重要方法。某同学在学习了硫酸的化学性质后,初步归纳出稀硫酸与其他物质相互反应的关系,如图所示(“—”表示相连的两种物质能发生反应,五个圈中的物质属于不同的类别)。
(1)已知X是金属单质,则X可以是________ (填一种即可)。
(2)请写出稀硫酸与Y反应的一个化学方程式:________。
15.硫酸、盐酸是重要的化工原料。
(1)浓硫酸在实验室常用作干燥剂,是因为浓硫酸有________性。
(2)98%的浓硫酸稀释为稀硫酸时,一定要将________沿烧杯壁缓慢地注入盛有________的烧杯里,并用________搅拌。
(3)盐酸在下列用途中,不能用硫酸代替盐酸的是________(填编号)
① 金属表面除锈 ② 制造药物氯化锌 ③除去NaCl中的少量NaOH
答案解析部分
一、单选题
1.【答案】 C
【解析】【分析】根据酸的化学性质及物理性质分析,由性质再确定其用途。
【解答】A.浓硫酸具有吸水性,浓盐酸具有挥发性,不符合题意;
B.稀盐酸和稀硫酸都能与金属氧化物反应,都可用于金属除锈,不符合题意;
C.稀盐酸能够使紫色石蕊溶液变红色,不能使无色酚酞溶液改变颜色,符合题意;
D.稀硫酸能够与活泼金属发生置换反应制取氢气,不符合题意;
故答案为:C。
2.【答案】 C
【解析】【分析】根据浓盐酸为无色液体,是氯化氢气体的水溶液,有挥发性分析。
【解答】A.盐酸是氯化氢气体的水溶液,属于混合物,不符合题意;
B.纯净的浓盐酸是无色,工业用盐酸因含有铁离子而呈黄色,不符合题意;
C.人的胃液里含少量的盐酸,可以帮助消化,符合题意;
D.浓盐酸敞口放置一段时间后,因挥发出溶质氯化氢气体,溶质质量分数减小,不符合题意;
故答案为:C。
3.【答案】 C
【解析】【分析】首先判断选项中是否有同类物质,如果没有同类物体,那么判断它们是否能够和H2SO4反应,它们之间是否存在图中的反应关系即可。
【解答】酸能跟活泼金属、金属氧化物、盐、碱等物质反应。
A.CuSO4、Na2CO3均属于盐,故A不合要题意;
B.Ba(OH)2能与稀硫酸发生中和反应,能与CuSO4反应生成氢氧化铜沉淀和硫酸钡沉淀;但CuSO4不能与CuO发生化学反应,故B不合题意;
C.Ca(OH)2能与稀硫酸、稀硝酸发生中和反应,且硝酸能与K2CO3反应硝酸钾、水和二氧化碳,且Ca(OH)2、HNO3、K2CO3分别属于碱、酸、盐,故C符合题意;
D.NaOH能与稀硫酸、稀盐酸发生中和反应,但Ba(NO3)2不能与HCl发生化学反应,故D不合题意。
故选C。
4.【答案】 D
【解析】【分析】根据酸、碱、盐的化学性质分析。
【解答】A、硫酸钠只与氯化钡溶液反应,不符合题意;
B、氯化钠与四种物质都不反应,不符合题意;
C、盐酸不能与氯化钡溶液反应,不符合题意;
D、稀硫酸与四种物质都能反应,符合题意;
故答案为:D。
5.【答案】 D
【解析】【分析】A、浓硫酸具有吸水性;
B、硫酸可与氯化钡反应生成硫酸钡沉淀;
C、稀硫酸可与金属氧化物反应;
D、浓硫酸溶于水放热.
【解答】解:
A、浓硫酸具有吸水性,正确;
B、硫酸可与氯化钡反应生成硫酸钡沉淀,所以二者混合会得到白色沉淀,正确;
C、稀硫酸可与金属氧化物反应,故可用来除锈,正确;
D、浓硫酸溶于水放热,会使溶液温度升高,故错误;
答案:D
6.【答案】 A
【解析】【分析】做干燥剂的物质一定具有极易吸水的性质,浓硫酸做干燥剂就是利用了其吸水性的特点.
【解答】解:浓硫酸是常见的液体干燥剂,其原因就是因为浓硫酸具有较强的吸水性,与其它三个选项无必然的联系.
故选A
7.【答案】 C
【解析】【分析】根据物质的性质分析.浓盐酸易挥发出氯化氢气体,与空气中的水蒸气结合形成盐酸的小液滴,出现白雾,浓硝酸也具有挥发性.
【解答】解:由盐酸的挥发性可知,浓盐酸易挥发出氯化氢气体,与空气中的水蒸气结合形成盐酸的小液滴,出现白雾;而打开盛有浓硫酸的试剂瓶盖后,浓硫酸吸收空气中的水分,不会出现白雾;打开盛有稀硫酸的试剂瓶盖后,在瓶口也不会出现白雾,浓硝酸也具有挥发性,挥发出硝酸气体与空气中水蒸气接触形成硝酸小液滴,形成白雾.
故选C.
8.【答案】 B
【解析】【分析】根据物质的性质分析.浓盐酸易挥发出氯化氢气体,与空气中的水蒸气结合形成盐酸的小液滴,出现白雾.
【解答】解:A.稀硫酸不具有挥发性,瓶口不会出现白雾,故不符合题意;
B.由浓盐酸的挥发性可知,浓盐酸易挥发出氯化氢气体,与空气中的水蒸气结合形成盐酸的小液滴,出现白雾,故符合题意;
C.碳酸不具有挥发性,瓶口不会出现白雾,故不符合题意;
D.浓硫酸具有吸水性,不具有挥发性,瓶口不会出现白雾,故不符合题意.
故选B.
9.【答案】 B
【解析】【分析】根据已有的知识进行分析,盐酸时氯化氢的水溶液,浓盐酸具有挥发性,胃液的主要成分是盐酸.
【解答】解:A、盐酸时氯化氢的水溶液,故A正确;
B、浓盐酸是无色液体,故B错误;
C、胃液中的盐酸具有帮助消化的功能,故C正确;
D、浓盐酸具有挥发性,挥发出的氯化氢气体与空气中的水蒸气结合能形成白雾,故D正确;
故选B.
10.【答案】 D
【解析】【分析】根据物质的性质进行分析,浓盐酸具有挥发性,易挥发出溶质氯化氢而导致溶液变稀,浓硫酸具有吸水性,易吸收空气中的水分而使溶液变稀.
【解答】解:A、将浓硫酸和浓盐酸分别暴露在空气中时,浓硫酸溶液的质量增大,浓盐酸的质量减小,该选项说法不正确;
B、将浓硫酸和浓盐酸分别暴露在空气中时,浓硫酸溶液的质量增大,浓盐酸的质量减小,该选项说法不正确;
C、将浓硫酸和浓盐酸分别暴露在空气中时,浓硫酸中,硫酸的质量不变,溶液质量增大,溶质质量分数减小,浓盐酸中,氯化氢的质量减小,溶液质量减小,溶质减小的质量和溶液减小的质量相等,溶质质量分数减小,该选项说法不正确;
D、将浓硫酸和浓盐酸分别暴露在空气中时,浓盐酸和浓硫酸的溶质质量分数都减小,该选项说法正确.
故选:D.
11.【答案】 A
【解析】【分析】浓盐酸是无色有刺激性气味的液体,具有挥发性和腐蚀性;浓硫酸具有吸水性、脱水性、腐蚀性、氧化性等.浓盐酸具有挥发性,浓硫酸具有吸水性,因此敞口放置在空气中,一段时间后,溶质的质量分数都减小;溶剂质量都增大不正确,如果不考虑水分的蒸发,浓盐酸中溶剂质量不变,浓硫酸溶剂质量增大;溶液质量都增大错误,因为浓盐酸质量减小;溶质质量都减少不正确,因为浓硫酸溶质的质量不变.
【解答】解:A、浓盐酸具有挥发性,浓硫酸具有吸水性,因此敞口放置在空气中,一段时间后,溶质的质量分数都减小;故选项正确;
B、溶剂质量都增大不正确,如果不考虑水分的蒸发,浓盐酸中溶剂质量不变,浓硫酸溶剂质量增大,故选项错误;
C、溶液质量都增大错误,因为浓盐酸质量减小,故选项错误;
D、溶质质量都减少不正确,因为浓硫酸溶质的质量不变,故选项错误;
故选A
12.【答案】 C
【解析】【分析】硫酸、盐酸、碳酸都不是调味品.
【解答】解:硫酸、盐酸、碳酸都不是调味品.食醋是调味品,其中含有醋酸.
故选C.
二、实验探究题
13.【答案】 悬浊液变澄清;CaCl2、NaCl、HCl;1;反应物是否剩余
【解析】【分析】【观察与讨论1】氢氧化钙和稀盐酸反应能生成氯化钙和水,由于氢氧化钙完全反应,因此原来的悬浊液会变得澄清;
【猜想与假设】如果稀盐酸不足,废液中含有碳酸氢钠、氯化钙和氯化钠;
如果稀盐酸过量时,废液中含有氯化钙、氯化钠和氯化氢;
如果物质之间恰好完全反应时,废液中含有氯化钙和氯化钠;
【实验与结论】根据实验现象可以判断废液中溶质的组合情况;
【交流与反思】在化学实验中,很难做到反应物刚好完全反应,因此反应结束后反应物是否有剩余是需要研究和讨论的一个问题。
【解答】【观察与讨论1】
甲同学在做实验时观察到的明显现象是悬浊液变澄清;
【猜想与假设】
猜想1:废液中含有NaHCO3、CaCl2、NaCl三种溶质;
猜想2:废液中含有CaCl2、NaCl、HCl三种溶质;
猜想3:废液中含有CaCl2、NaCl;
【实验与结论】
甲同学实验:取少量废液于试管中,向其中滴加盐酸,有气泡产生,说明溶液中含有碳酸氢钠;
乙同学实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变蓝色,说明溶液中不含有氯化氢。
因此猜想1正确。
【交流与反思】在分析化学反应后所得物质时,除考虑生成物外,还需要考虑反应物是否有剩余。
三、填空题
14.【答案】 (1)Zn(或Fe等活泼金属)
(2)H2SO4+2NaOH=Na2SO4+2H2O
【解析】【分析】根据酸能与金属活动性顺序中排在氢前的金属反应、能与金属氧化的反应、能与盐反、能与碱反应分析。
【解答】(1) X是金属单质, 则为在金属活动性顺序中排在氢前的金属,如锌或铁等;
(2)Y属于碱类物质,如氢氧化钠,氢氧化钠与硫酸反应的方程式为 H2SO4+2NaOH=Na2SO4+2H2O 。
故答案为:(1) Zn(或Fe等活泼金属) ;(2) H2SO4+2NaOH=Na2SO4+2H2O 。
15.【答案】 (1)吸水性
(2)浓硫酸;水;玻璃棒
(3)②③
【解析】【分析】(1)根据浓硫酸的物理性质解答;
(2)根据浓硫酸的稀释方法解答;
(3)根据反应产物进行分析判断。
【解答】(1) 浓硫酸在实验室常用作干燥剂,是因为浓硫酸具有吸水性;
(2) 98%的浓硫酸稀释为稀硫酸时,一定要将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,并用玻璃棒搅拌。
(3)①氧化铁和稀盐酸反应生成氯化铁和水, 与稀硫酸反应生成硫酸铁和水,因此两种酸都可以除去铁锈,故①不合题意;
②锌和稀硫酸反应生成硫酸锌而不是氯化锌,故②符合题意;
③稀硫酸与氢氧化钠反应生成硫酸钠和水,引入新的杂质,故③符合题意。
故选②③。
一、单选题
1.下列关于酸的说法错误的是( )
A. 浓硫酸具有吸水性,浓盐酸具有挥发性 B. 稀盐酸和稀硫酸都可用于金属除锈
C. 稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色 D. 稀硫酸能够与活泼金属反应制取氢气
2.盐酸是一种主要的工业用酸,下列关于盐酸的叙述中,正确的是( )
A. 纯净的盐酸不含杂质,故是纯净物 B. 纯净的浓盐酸是黄色有刺激性气味的液体
C. 人的胃液里含少量的盐酸,可以帮助消化 D. 浓盐酸敞口放置一段时间后,溶质质量分数增大
3.构建知识网络是一种重要的学习方法.如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A、B、C 分别属于不同类别的化合物.则 A、B、C 可能是( )
A. KOH、CuSO4、Na2CO3 B. Ba(OH)2、CuSO4、CuO
C. Ca(OH)2、HNO3、K2CO3 D. NaOH、HCl、Ba(NO3)2
4.与金属锌、氧化铜粉末、烧碱溶液和氯化钡溶液都能反应的物质是( )
A. 硫酸钠溶液 B. 食盐水 C. 稀盐酸 D. 稀硫酸
5.列关于硫酸的说法错误的是( )
A. 浓硫酸具有吸水性 B. 稀硫酸与氯化钡溶液混合得白色沉淀
C. 稀硫酸能用来除铁锈 D. 浓硫酸倒入水中,溶液温度会降低
6.浓硫酸可以用作许多气体的干燥剂,这是利用它的( )
A. 吸水性 B. 脱水性 C. 氧化性 D. 酸性
7.打开盛有①浓盐酸②浓硫酸③稀硫酸④浓硝酸的试剂瓶盖后,在瓶口出现白雾的是( )
A. ①③ B. ①② C. ①④ D. ②④
8.打开下列盛装酸的试剂瓶时在瓶口能看到白雾的是( )
A. 稀硫酸 B. 浓盐酸 C. 碳酸 D. 浓硫酸
9.盐酸是一种主要的工业用酸,下列关盐酸的叙述中,错误的是( )
A. 盐酸是氯化氢的水溶液 B. 浓盐酸是黄色与刺激性气味的液体
C. 人的胃液里含少量的盐酸,可以助消化 D. 浓盐酸具有挥发性,在空气中会形成白雾
10.将浓盐酸和浓硫酸分别暴露在空气中,变化的结果是容器内( )
A. 酸液的质量都增大 B. 酸液的质量都减小 C. 酸液的浓度都增大 D. 酸液的浓度都减小
11.若将浓盐酸和浓硫酸敞口放置在空气中,一段时间后,可以肯定的是( )
A. 溶质的质量分数都减小 B. 溶剂质量都增大 C. 溶液质量都增大 D. 溶质质量都减少
12.目前市场出售的调味品食醋中,一定含有的酸是( )
A. 硫酸 B. 盐酸 C. 醋酸 D. 碳酸
二、实验探究题
13.甲、乙两同学在学完酸的化学性质之后,通过自己的想象做了如下实验:
【观察与讨论1】甲同学在做实验时观察到的明显现象是________.再滴加无色酚酞溶液,无明显现象(已知CaCl2溶液呈中性).
【观察与讨论2】乙同学在做实验时开始没有观察到气泡产生,于是对碳酸钠能否与盐酸反应表示怀疑.甲同学通过查阅资料得知:在碳酸钠溶液中滴加少量稀盐酸,先发生反应Na2CO3+HCl=NaCl+NaHCO3 , 继续滴加稀盐酸,再发生反应,NaHCO3+HCl=NaCl+H2O+CO2↑.所以甲同学认为,乙同学实验时还应继续滴加稀盐酸,才能观察到有气泡产生(已知NaHCO3溶液呈碱性).
【观察与讨论3】甲同学先将废液缓慢倒入一洁净的废液杯中,乙同学在观察到气泡产生后,也将实验废液缓慢倒入该废液杯中,没有观察到明显现象.为了处理实验后产生的废液,甲、乙同学决定对废液杯中最终废液溶质的成分进行探究.
【提出问题】最终废液中含有什么溶质?
【猜想与假设】猜想1:废液中含有NaHCO3、CaCl2、NaCl三种溶质.
猜想2:废液中含有________(写化学式)三种溶质.
猜想3:废液中含有…溶质.
【实验与结论】甲、乙同学为了验证猜想,进行了如下实验:
甲同学实验:取少量废液于试管中,向其中滴加盐酸,有气泡产生.
乙同学实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变蓝色.
猜想________(填“1”或“2”或“3”)正确.
【交流与反思】在分析化学反应后所得物质时,除考虑生成物外,还需要考虑________
三、填空题
14.对知识的及时整理与归纳是学习科学的重要方法。某同学在学习了硫酸的化学性质后,初步归纳出稀硫酸与其他物质相互反应的关系,如图所示(“—”表示相连的两种物质能发生反应,五个圈中的物质属于不同的类别)。
(1)已知X是金属单质,则X可以是________ (填一种即可)。
(2)请写出稀硫酸与Y反应的一个化学方程式:________。
15.硫酸、盐酸是重要的化工原料。
(1)浓硫酸在实验室常用作干燥剂,是因为浓硫酸有________性。
(2)98%的浓硫酸稀释为稀硫酸时,一定要将________沿烧杯壁缓慢地注入盛有________的烧杯里,并用________搅拌。
(3)盐酸在下列用途中,不能用硫酸代替盐酸的是________(填编号)
① 金属表面除锈 ② 制造药物氯化锌 ③除去NaCl中的少量NaOH
答案解析部分
一、单选题
1.【答案】 C
【解析】【分析】根据酸的化学性质及物理性质分析,由性质再确定其用途。
【解答】A.浓硫酸具有吸水性,浓盐酸具有挥发性,不符合题意;
B.稀盐酸和稀硫酸都能与金属氧化物反应,都可用于金属除锈,不符合题意;
C.稀盐酸能够使紫色石蕊溶液变红色,不能使无色酚酞溶液改变颜色,符合题意;
D.稀硫酸能够与活泼金属发生置换反应制取氢气,不符合题意;
故答案为:C。
2.【答案】 C
【解析】【分析】根据浓盐酸为无色液体,是氯化氢气体的水溶液,有挥发性分析。
【解答】A.盐酸是氯化氢气体的水溶液,属于混合物,不符合题意;
B.纯净的浓盐酸是无色,工业用盐酸因含有铁离子而呈黄色,不符合题意;
C.人的胃液里含少量的盐酸,可以帮助消化,符合题意;
D.浓盐酸敞口放置一段时间后,因挥发出溶质氯化氢气体,溶质质量分数减小,不符合题意;
故答案为:C。
3.【答案】 C
【解析】【分析】首先判断选项中是否有同类物质,如果没有同类物体,那么判断它们是否能够和H2SO4反应,它们之间是否存在图中的反应关系即可。
【解答】酸能跟活泼金属、金属氧化物、盐、碱等物质反应。
A.CuSO4、Na2CO3均属于盐,故A不合要题意;
B.Ba(OH)2能与稀硫酸发生中和反应,能与CuSO4反应生成氢氧化铜沉淀和硫酸钡沉淀;但CuSO4不能与CuO发生化学反应,故B不合题意;
C.Ca(OH)2能与稀硫酸、稀硝酸发生中和反应,且硝酸能与K2CO3反应硝酸钾、水和二氧化碳,且Ca(OH)2、HNO3、K2CO3分别属于碱、酸、盐,故C符合题意;
D.NaOH能与稀硫酸、稀盐酸发生中和反应,但Ba(NO3)2不能与HCl发生化学反应,故D不合题意。
故选C。
4.【答案】 D
【解析】【分析】根据酸、碱、盐的化学性质分析。
【解答】A、硫酸钠只与氯化钡溶液反应,不符合题意;
B、氯化钠与四种物质都不反应,不符合题意;
C、盐酸不能与氯化钡溶液反应,不符合题意;
D、稀硫酸与四种物质都能反应,符合题意;
故答案为:D。
5.【答案】 D
【解析】【分析】A、浓硫酸具有吸水性;
B、硫酸可与氯化钡反应生成硫酸钡沉淀;
C、稀硫酸可与金属氧化物反应;
D、浓硫酸溶于水放热.
【解答】解:
A、浓硫酸具有吸水性,正确;
B、硫酸可与氯化钡反应生成硫酸钡沉淀,所以二者混合会得到白色沉淀,正确;
C、稀硫酸可与金属氧化物反应,故可用来除锈,正确;
D、浓硫酸溶于水放热,会使溶液温度升高,故错误;
答案:D
6.【答案】 A
【解析】【分析】做干燥剂的物质一定具有极易吸水的性质,浓硫酸做干燥剂就是利用了其吸水性的特点.
【解答】解:浓硫酸是常见的液体干燥剂,其原因就是因为浓硫酸具有较强的吸水性,与其它三个选项无必然的联系.
故选A
7.【答案】 C
【解析】【分析】根据物质的性质分析.浓盐酸易挥发出氯化氢气体,与空气中的水蒸气结合形成盐酸的小液滴,出现白雾,浓硝酸也具有挥发性.
【解答】解:由盐酸的挥发性可知,浓盐酸易挥发出氯化氢气体,与空气中的水蒸气结合形成盐酸的小液滴,出现白雾;而打开盛有浓硫酸的试剂瓶盖后,浓硫酸吸收空气中的水分,不会出现白雾;打开盛有稀硫酸的试剂瓶盖后,在瓶口也不会出现白雾,浓硝酸也具有挥发性,挥发出硝酸气体与空气中水蒸气接触形成硝酸小液滴,形成白雾.
故选C.
8.【答案】 B
【解析】【分析】根据物质的性质分析.浓盐酸易挥发出氯化氢气体,与空气中的水蒸气结合形成盐酸的小液滴,出现白雾.
【解答】解:A.稀硫酸不具有挥发性,瓶口不会出现白雾,故不符合题意;
B.由浓盐酸的挥发性可知,浓盐酸易挥发出氯化氢气体,与空气中的水蒸气结合形成盐酸的小液滴,出现白雾,故符合题意;
C.碳酸不具有挥发性,瓶口不会出现白雾,故不符合题意;
D.浓硫酸具有吸水性,不具有挥发性,瓶口不会出现白雾,故不符合题意.
故选B.
9.【答案】 B
【解析】【分析】根据已有的知识进行分析,盐酸时氯化氢的水溶液,浓盐酸具有挥发性,胃液的主要成分是盐酸.
【解答】解:A、盐酸时氯化氢的水溶液,故A正确;
B、浓盐酸是无色液体,故B错误;
C、胃液中的盐酸具有帮助消化的功能,故C正确;
D、浓盐酸具有挥发性,挥发出的氯化氢气体与空气中的水蒸气结合能形成白雾,故D正确;
故选B.
10.【答案】 D
【解析】【分析】根据物质的性质进行分析,浓盐酸具有挥发性,易挥发出溶质氯化氢而导致溶液变稀,浓硫酸具有吸水性,易吸收空气中的水分而使溶液变稀.
【解答】解:A、将浓硫酸和浓盐酸分别暴露在空气中时,浓硫酸溶液的质量增大,浓盐酸的质量减小,该选项说法不正确;
B、将浓硫酸和浓盐酸分别暴露在空气中时,浓硫酸溶液的质量增大,浓盐酸的质量减小,该选项说法不正确;
C、将浓硫酸和浓盐酸分别暴露在空气中时,浓硫酸中,硫酸的质量不变,溶液质量增大,溶质质量分数减小,浓盐酸中,氯化氢的质量减小,溶液质量减小,溶质减小的质量和溶液减小的质量相等,溶质质量分数减小,该选项说法不正确;
D、将浓硫酸和浓盐酸分别暴露在空气中时,浓盐酸和浓硫酸的溶质质量分数都减小,该选项说法正确.
故选:D.
11.【答案】 A
【解析】【分析】浓盐酸是无色有刺激性气味的液体,具有挥发性和腐蚀性;浓硫酸具有吸水性、脱水性、腐蚀性、氧化性等.浓盐酸具有挥发性,浓硫酸具有吸水性,因此敞口放置在空气中,一段时间后,溶质的质量分数都减小;溶剂质量都增大不正确,如果不考虑水分的蒸发,浓盐酸中溶剂质量不变,浓硫酸溶剂质量增大;溶液质量都增大错误,因为浓盐酸质量减小;溶质质量都减少不正确,因为浓硫酸溶质的质量不变.
【解答】解:A、浓盐酸具有挥发性,浓硫酸具有吸水性,因此敞口放置在空气中,一段时间后,溶质的质量分数都减小;故选项正确;
B、溶剂质量都增大不正确,如果不考虑水分的蒸发,浓盐酸中溶剂质量不变,浓硫酸溶剂质量增大,故选项错误;
C、溶液质量都增大错误,因为浓盐酸质量减小,故选项错误;
D、溶质质量都减少不正确,因为浓硫酸溶质的质量不变,故选项错误;
故选A
12.【答案】 C
【解析】【分析】硫酸、盐酸、碳酸都不是调味品.
【解答】解:硫酸、盐酸、碳酸都不是调味品.食醋是调味品,其中含有醋酸.
故选C.
二、实验探究题
13.【答案】 悬浊液变澄清;CaCl2、NaCl、HCl;1;反应物是否剩余
【解析】【分析】【观察与讨论1】氢氧化钙和稀盐酸反应能生成氯化钙和水,由于氢氧化钙完全反应,因此原来的悬浊液会变得澄清;
【猜想与假设】如果稀盐酸不足,废液中含有碳酸氢钠、氯化钙和氯化钠;
如果稀盐酸过量时,废液中含有氯化钙、氯化钠和氯化氢;
如果物质之间恰好完全反应时,废液中含有氯化钙和氯化钠;
【实验与结论】根据实验现象可以判断废液中溶质的组合情况;
【交流与反思】在化学实验中,很难做到反应物刚好完全反应,因此反应结束后反应物是否有剩余是需要研究和讨论的一个问题。
【解答】【观察与讨论1】
甲同学在做实验时观察到的明显现象是悬浊液变澄清;
【猜想与假设】
猜想1:废液中含有NaHCO3、CaCl2、NaCl三种溶质;
猜想2:废液中含有CaCl2、NaCl、HCl三种溶质;
猜想3:废液中含有CaCl2、NaCl;
【实验与结论】
甲同学实验:取少量废液于试管中,向其中滴加盐酸,有气泡产生,说明溶液中含有碳酸氢钠;
乙同学实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变蓝色,说明溶液中不含有氯化氢。
因此猜想1正确。
【交流与反思】在分析化学反应后所得物质时,除考虑生成物外,还需要考虑反应物是否有剩余。
三、填空题
14.【答案】 (1)Zn(或Fe等活泼金属)
(2)H2SO4+2NaOH=Na2SO4+2H2O
【解析】【分析】根据酸能与金属活动性顺序中排在氢前的金属反应、能与金属氧化的反应、能与盐反、能与碱反应分析。
【解答】(1) X是金属单质, 则为在金属活动性顺序中排在氢前的金属,如锌或铁等;
(2)Y属于碱类物质,如氢氧化钠,氢氧化钠与硫酸反应的方程式为 H2SO4+2NaOH=Na2SO4+2H2O 。
故答案为:(1) Zn(或Fe等活泼金属) ;(2) H2SO4+2NaOH=Na2SO4+2H2O 。
15.【答案】 (1)吸水性
(2)浓硫酸;水;玻璃棒
(3)②③
【解析】【分析】(1)根据浓硫酸的物理性质解答;
(2)根据浓硫酸的稀释方法解答;
(3)根据反应产物进行分析判断。
【解答】(1) 浓硫酸在实验室常用作干燥剂,是因为浓硫酸具有吸水性;
(2) 98%的浓硫酸稀释为稀硫酸时,一定要将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,并用玻璃棒搅拌。
(3)①氧化铁和稀盐酸反应生成氯化铁和水, 与稀硫酸反应生成硫酸铁和水,因此两种酸都可以除去铁锈,故①不合题意;
②锌和稀硫酸反应生成硫酸锌而不是氯化锌,故②符合题意;
③稀硫酸与氢氧化钠反应生成硫酸钠和水,引入新的杂质,故③符合题意。
故选②③。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
