2012高二物理课件:第三章 第二节 热力学第一定律(粤教版选修3-3)
文档属性
| 名称 | 2012高二物理课件:第三章 第二节 热力学第一定律(粤教版选修3-3) |

|
|
| 格式 | zip | ||
| 文件大小 | 207.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 物理 | ||
| 更新时间 | 2012-08-30 00:00:00 | ||
图片预览





文档简介
(共12张PPT)
第二节 热力学第一定律
一、热力学第一定律
1.内容:系统的内能增量等于外界向它传递的热量与
和
外界对它所做的功的________.
2.表达式:ΔU=W+Q
做功 W 热量 Q 内能的
改变ΔU
取正值
“+” 外界对系
统做功 系统从外界
吸收热量 系统的
内能增加
取负值
“-” 系统对外
界做功 系统向外界
放出热量 系统的
内能减少
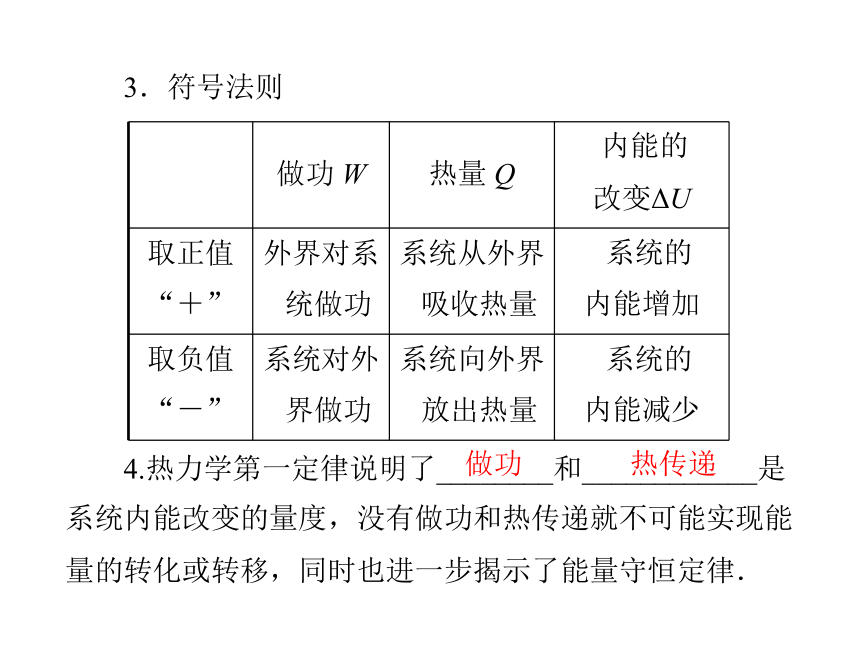
3.符号法则
做功
热传递
4.热力学第一定律说明了________和____________是
系统内能改变的量度,没有做功和热传递就不可能实现能
量的转化或转移,同时也进一步揭示了能量守恒定律.
一、应用热力学第一定律解题的一般步骤
1.根据符号法则写出各已知量(W、Q、ΔU)的正、负;
2.根据方程ΔU=W+Q 求出未知量;
3.再根据未知量结果的正、负来确定吸热、放热情况
或做功情况.
二、热力学第一定律的应用
第一定律,Q=ΔU-W<0,气体对外界放热,放出的热量
等于外界对气体做的功和气体温度降低所减少的内能之和.
2.等容过程
气体等容变化时,气体没有推动活塞对外界做功,W
=0.根据热力学第一定律有ΔU=Q.在等容过程中,气体吸
收的热量全部用于增加内能,温度升高;反之,气体放出
的热量是以减小内能为代价的,温度降低.
3.等温过程
理想气体在等温过程中内能保持不变,ΔU=0,由热
力学第一定律,W=-Q,如果气体被等温压缩,则 W>0,
Q<0, 气体对外界放热,外界对理想气体所做的功全部转换
为传给外界的热量.如果气体等温膨胀,气体从外界吸取
的热量全部转换为对外所做的功.
热力学第一定律的理解
[例 1]下列说法中正确的是(
)
A.物体吸收热量,其内能必增加
B.外界对物体做功,物体内能必增加
C.物体吸收热量,同时对外做功,其内能可能减少
D.物体温度不变,其内能也一定不变
解析:由ΔU=W+Q 知,内能的变化量由外界对物体
做的功和物体从外界吸收的热量共同决定,故 A、B 说法
错误.温度不变,只能说明分子平均动能不变,而分子势
能不能确定.故 D 说法错误.在分析该问题时,既要考虑
到内能包括分子动能和分子势能,又要考虑到改变内能也
有两种方式:做功和热传递.
答案:C
利用热力学第一定律计算
[例 2]一定量的气体从外界吸收了 2.6×105 J 的热量,
内能增加了 4.2×105 J.外界对气体做了多少功?
解: 由ΔU=W+Q 得:
W=ΔU-Q
=4.2×105 J-2.6×105 J
=1.6×105 J
外界对气体做的功是 1.6×105 J.
上题中,如果气体吸收的热量仍为 2.6×105 J,但是内
能只增加了 1.6×105 J,计算结果 W 将为负值.怎样解释
这个结果?一般地讲,ΔU、Q、W 的正值和负值各代表什
么物理意义?
解:根据热力学第一定律:ΔU=W+Q 则:
W=ΔU-Q=1.6×105 J-2.6×105 J=-1.0×105 J
表示气体对外界做功 1.0×105 J.
由以上可以看出,外界对气体做功 W 取正值,气体对
外界做功 W 取负值.
返回
第二节 热力学第一定律
一、热力学第一定律
1.内容:系统的内能增量等于外界向它传递的热量与
和
外界对它所做的功的________.
2.表达式:ΔU=W+Q
做功 W 热量 Q 内能的
改变ΔU
取正值
“+” 外界对系
统做功 系统从外界
吸收热量 系统的
内能增加
取负值
“-” 系统对外
界做功 系统向外界
放出热量 系统的
内能减少
3.符号法则
做功
热传递
4.热力学第一定律说明了________和____________是
系统内能改变的量度,没有做功和热传递就不可能实现能
量的转化或转移,同时也进一步揭示了能量守恒定律.
一、应用热力学第一定律解题的一般步骤
1.根据符号法则写出各已知量(W、Q、ΔU)的正、负;
2.根据方程ΔU=W+Q 求出未知量;
3.再根据未知量结果的正、负来确定吸热、放热情况
或做功情况.
二、热力学第一定律的应用
第一定律,Q=ΔU-W<0,气体对外界放热,放出的热量
等于外界对气体做的功和气体温度降低所减少的内能之和.
2.等容过程
气体等容变化时,气体没有推动活塞对外界做功,W
=0.根据热力学第一定律有ΔU=Q.在等容过程中,气体吸
收的热量全部用于增加内能,温度升高;反之,气体放出
的热量是以减小内能为代价的,温度降低.
3.等温过程
理想气体在等温过程中内能保持不变,ΔU=0,由热
力学第一定律,W=-Q,如果气体被等温压缩,则 W>0,
Q<0, 气体对外界放热,外界对理想气体所做的功全部转换
为传给外界的热量.如果气体等温膨胀,气体从外界吸取
的热量全部转换为对外所做的功.
热力学第一定律的理解
[例 1]下列说法中正确的是(
)
A.物体吸收热量,其内能必增加
B.外界对物体做功,物体内能必增加
C.物体吸收热量,同时对外做功,其内能可能减少
D.物体温度不变,其内能也一定不变
解析:由ΔU=W+Q 知,内能的变化量由外界对物体
做的功和物体从外界吸收的热量共同决定,故 A、B 说法
错误.温度不变,只能说明分子平均动能不变,而分子势
能不能确定.故 D 说法错误.在分析该问题时,既要考虑
到内能包括分子动能和分子势能,又要考虑到改变内能也
有两种方式:做功和热传递.
答案:C
利用热力学第一定律计算
[例 2]一定量的气体从外界吸收了 2.6×105 J 的热量,
内能增加了 4.2×105 J.外界对气体做了多少功?
解: 由ΔU=W+Q 得:
W=ΔU-Q
=4.2×105 J-2.6×105 J
=1.6×105 J
外界对气体做的功是 1.6×105 J.
上题中,如果气体吸收的热量仍为 2.6×105 J,但是内
能只增加了 1.6×105 J,计算结果 W 将为负值.怎样解释
这个结果?一般地讲,ΔU、Q、W 的正值和负值各代表什
么物理意义?
解:根据热力学第一定律:ΔU=W+Q 则:
W=ΔU-Q=1.6×105 J-2.6×105 J=-1.0×105 J
表示气体对外界做功 1.0×105 J.
由以上可以看出,外界对气体做功 W 取正值,气体对
外界做功 W 取负值.
返回
同课章节目录
