化学能与电能
图片预览



文档简介
(共19张PPT)
§3.4 原电池原理及其应用
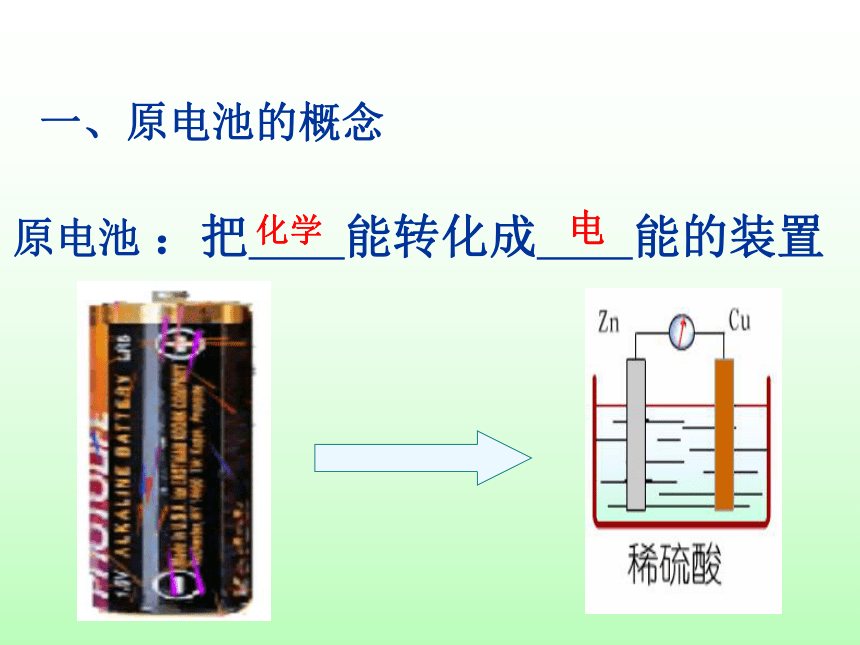
:把 能转化成 能的装置
化学
电
原电池
一、原电池的概念
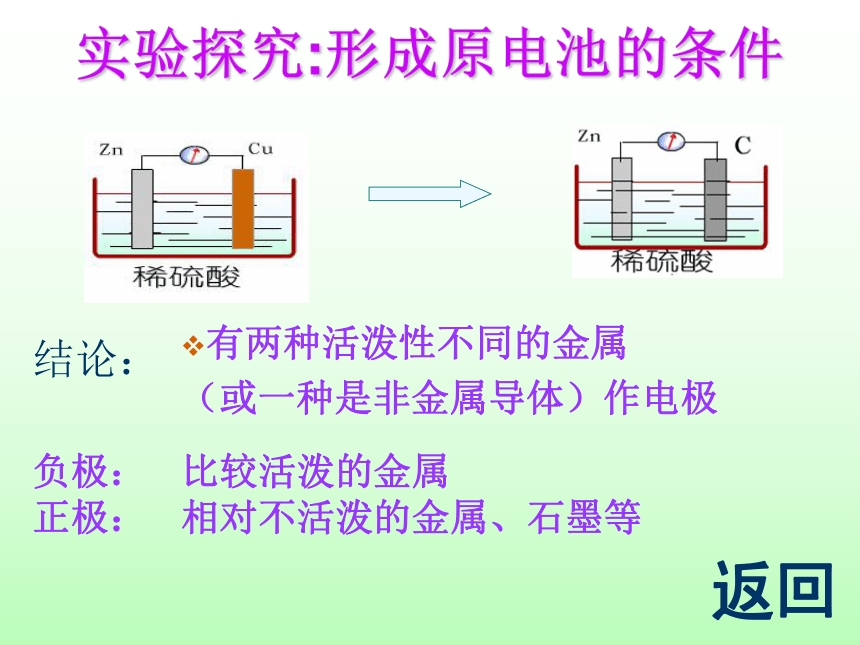
实验探究:形成原电池的条件
实验探究:形成原电池的条件
结论:
有两种活动性不同的金属作电极
返回
实验探究:形成原电池的条件
返回
结论:
有两种活泼性不同的金属
(或一种是非金属导体)作电极
负极:
正极:
比较活泼的金属
相对不活泼的金属、石墨等
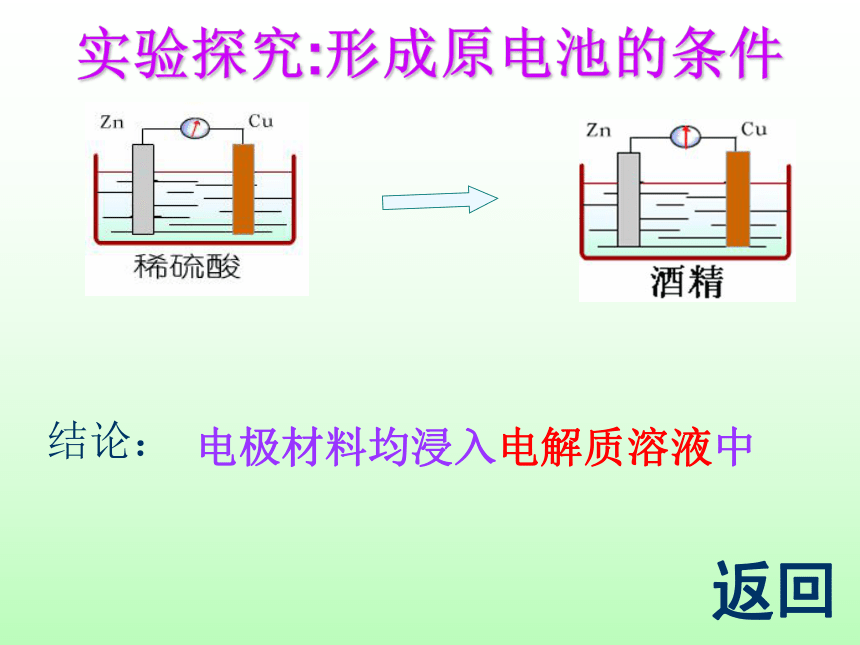
实验探究:形成原电池的条件
返回
结论:
电极材料均浸入电解质溶液中
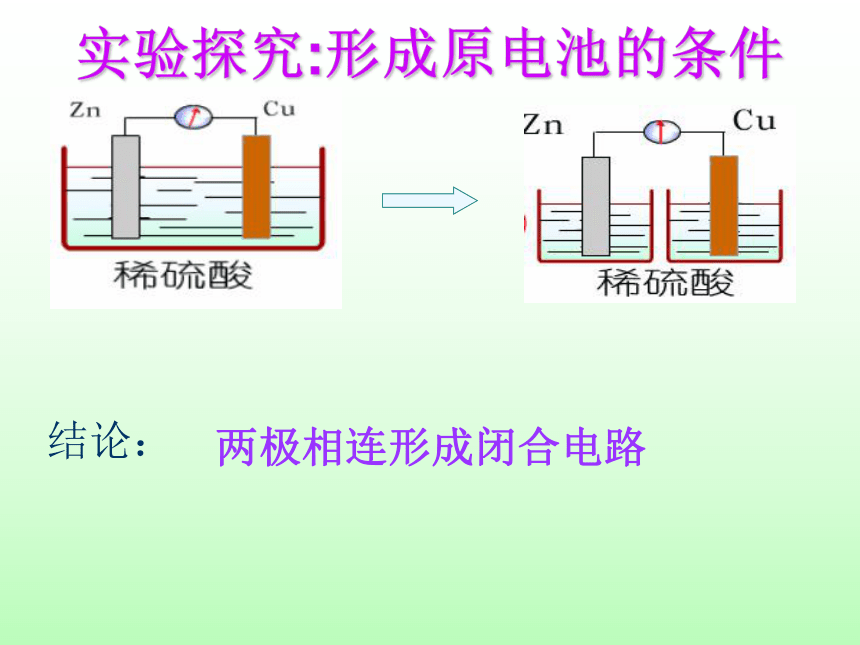
实验探究:形成原电池的条件
结论:
两极相连形成闭合电路
理论探究:形成原电池的条件
结论:
一个自发进行的氧化还原反应
u
组成原电池的条件
有两种活泼性不同的金属(或一种是非金属导体)作电极
电极材料均浸入电解质溶液中
两极相连形成闭合电路
一个自发进行的氧化还原反应
*下列哪几个装置能形成原电池?
A
B
C
D
E
√
√
现在,我们知道了什么?还想知道哪些?
实验探究:原电池的工作原理
实验步骤 现象 结论或解释
锌片上有气泡
锌与稀硫酸反应
铜片上有气泡
铜与稀硫酸不反应
铜片上无气泡
原电池的工作原理
锌(负极):
电子流向与电流方向
总反应方程式:
铜(正极):
电子流向:负极(Zn) 导线 正极(Cu)
电流方向:正极(Cu) 导线 负极(Zn)
Zn - 2e-=Zn2+ (锌板溶解,发生氧化反应 )
2H+ + 2e- = H2 (铜板上有气泡,发生还原反应)
Zn+2H+=Zn2++H2 (氧化还原反应)
Cu
Zn
硫酸
A
e
e
1. X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示:
则四种金属的活泼性由强到弱的顺序为_________________
Z>Y>X>W
想一想、比一比、练一练
H2SO4 (aq)
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
2、请说出电子的流动方向和电流方向,
并判断正负极,写出电极反应式和总反应式.
Ag
Fe
负极( ): .
正极( ): .
总反应式: .
想一想、练一练
有下列材料:
Zn片(2片)、Cu片(2片)导线、西红柿、电流计。请设计一个水果电池
想一想、试一试
Zn
§3.4 原电池原理及其应用
:把 能转化成 能的装置
化学
电
原电池
一、原电池的概念
实验探究:形成原电池的条件
实验探究:形成原电池的条件
结论:
有两种活动性不同的金属作电极
返回
实验探究:形成原电池的条件
返回
结论:
有两种活泼性不同的金属
(或一种是非金属导体)作电极
负极:
正极:
比较活泼的金属
相对不活泼的金属、石墨等
实验探究:形成原电池的条件
返回
结论:
电极材料均浸入电解质溶液中
实验探究:形成原电池的条件
结论:
两极相连形成闭合电路
理论探究:形成原电池的条件
结论:
一个自发进行的氧化还原反应
u
组成原电池的条件
有两种活泼性不同的金属(或一种是非金属导体)作电极
电极材料均浸入电解质溶液中
两极相连形成闭合电路
一个自发进行的氧化还原反应
*下列哪几个装置能形成原电池?
A
B
C
D
E
√
√
现在,我们知道了什么?还想知道哪些?
实验探究:原电池的工作原理
实验步骤 现象 结论或解释
锌片上有气泡
锌与稀硫酸反应
铜片上有气泡
铜与稀硫酸不反应
铜片上无气泡
原电池的工作原理
锌(负极):
电子流向与电流方向
总反应方程式:
铜(正极):
电子流向:负极(Zn) 导线 正极(Cu)
电流方向:正极(Cu) 导线 负极(Zn)
Zn - 2e-=Zn2+ (锌板溶解,发生氧化反应 )
2H+ + 2e- = H2 (铜板上有气泡,发生还原反应)
Zn+2H+=Zn2++H2 (氧化还原反应)
Cu
Zn
硫酸
A
e
e
1. X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示:
则四种金属的活泼性由强到弱的顺序为_________________
Z>Y>X>W
想一想、比一比、练一练
H2SO4 (aq)
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
2、请说出电子的流动方向和电流方向,
并判断正负极,写出电极反应式和总反应式.
Ag
Fe
负极( ): .
正极( ): .
总反应式: .
想一想、练一练
有下列材料:
Zn片(2片)、Cu片(2片)导线、西红柿、电流计。请设计一个水果电池
想一想、试一试
Zn
