人教版(2019)化学必修一 主题3 离子反应 同步课件(20张PPT)
文档属性
| 名称 | 人教版(2019)化学必修一 主题3 离子反应 同步课件(20张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-27 00:00:00 | ||
图片预览






文档简介
(共22张PPT)
人教版 必修1
知识清单
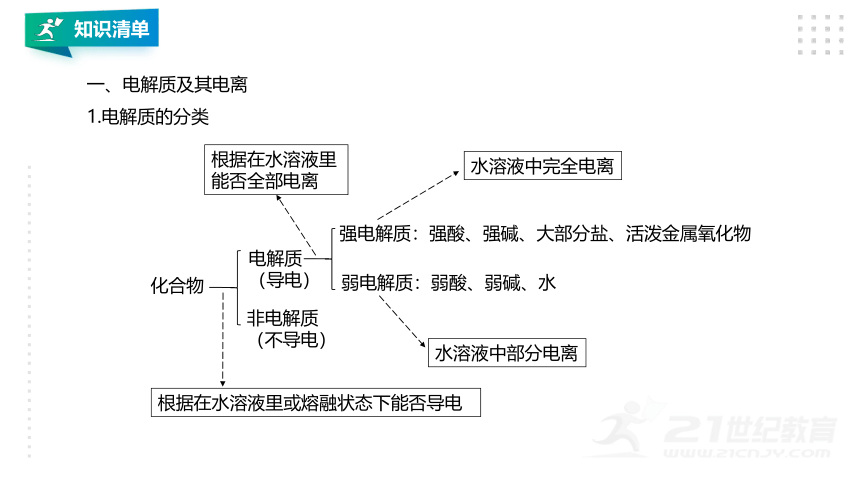
一、电解质及其电离
1.电解质的分类
化合物
非电解质
(不导电)
电解质
(导电)
弱电解质:弱酸、弱碱、水
强电解质:强酸、强碱、大部分盐、活泼金属氧化物
根据在水溶液里或熔融状态下能否导电
根据在水溶液里
能否全部电离
水溶液中完全电离
水溶液中部分电离
知识清单
2.电离
(1)概念:电解质在水溶液中或熔融状态下,离解成自由移动的离子的过程。
(2)电离条件:酸溶于水,盐和碱溶于水或熔融。
①电解质和非电解质都属于化合物,单质、混合物既不是电解质,也不是非电解质。
②有些化合物的水溶液能导电,但属于非电解质,因为溶液中导电的离子不是其自身电离产生的,如SO2、NH3等。
③电解质的强弱与物质溶解性无关,如BaSO4、AgCl等在水溶液中溶解度很小,但溶解部分完全电离,因此属于强电解质。
提
示
知识清单
3.电离方程式的书写
电离方程式书写格式及实例
强电解质 ①用“===”连接,如 Na2SO4===2Na++SO42-
②强酸酸式盐中的离子全部电离,如 NaHSO4===Na++H++SO42-
③弱酸酸式盐中的阴离子部分电离,如NaHCO3===Na++HCO3-、HCO3- H++CO32-
弱电解质 ①用“ ”连接,如 HClO H++ClO-
②多元弱酸的电离分布书写,如 H2CO3:H2CO3 H++HCO3-、HCO3- H++CO32-
③多元弱碱的电离一步写完,如 Fe(OH)3:Fe(OH)3 Fe3++3OH-
知识清单
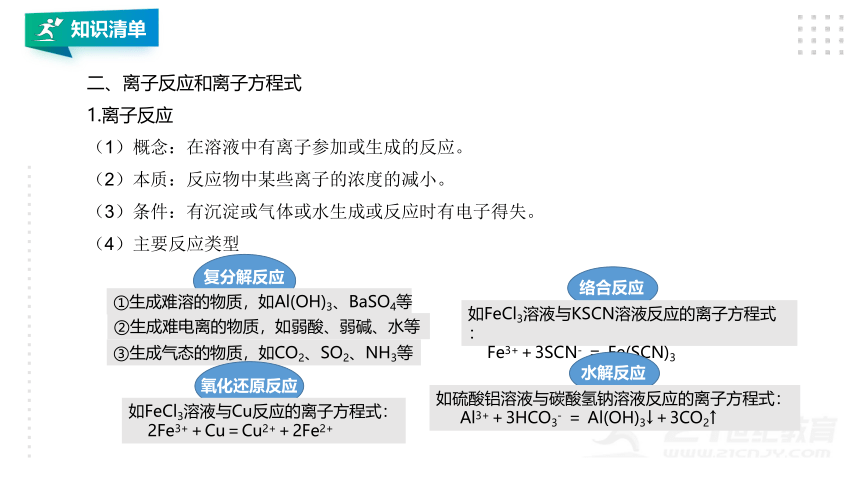
二、离子反应和离子方程式
1.离子反应
(1)概念:在溶液中有离子参加或生成的反应。
(2)本质:反应物中某些离子的浓度的减小。
(3)条件:有沉淀或气体或水生成或反应时有电子得失。
(4)主要反应类型
复分解反应
①生成难溶的物质,如Al(OH)3、BaSO4等
②生成难电离的物质,如弱酸、弱碱、水等
③生成气态的物质,如CO2、SO2、NH3等
氧化还原反应
如FeCl3溶液与Cu反应的离子方程式:
2Fe3++Cu=Cu2++2Fe2+
络合反应
如FeCl3溶液与KSCN溶液反应的离子方程式:
Fe3++3SCN- = Fe(SCN)3
水解反应
如硫酸铝溶液与碳酸氢钠溶液反应的离子方程式:
Al3++3HCO3- = Al(OH)3↓+3CO2↑
知识清单
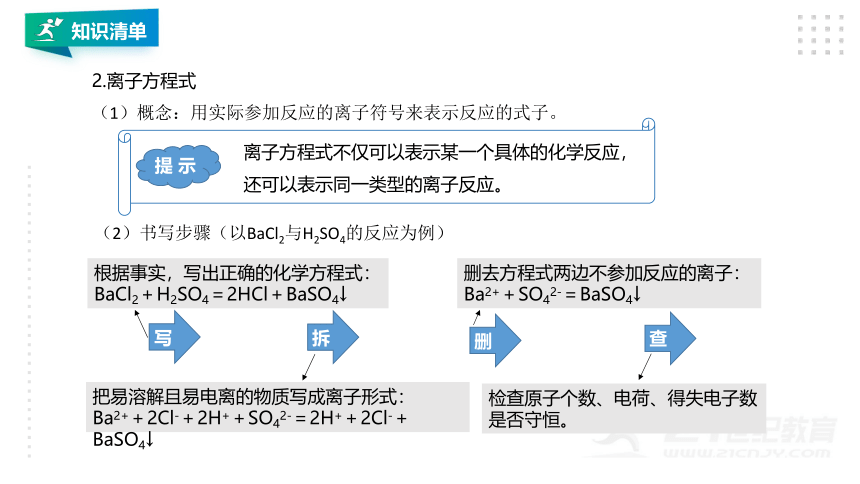
2.离子方程式
(1)概念:用实际参加反应的离子符号来表示反应的式子。
离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应。
提 示
(2)书写步骤(以BaCl2与H2SO4的反应为例)
写
拆
删
查
根据事实,写出正确的化学方程式:BaCl2+H2SO4=2HCl+BaSO4↓
把易溶解且易电离的物质写成离子形式:
Ba2++2Cl-+2H++SO42-=2H++2Cl-+BaSO4↓
删去方程式两边不参加反应的离子:
Ba2++SO42-=BaSO4↓
检查原子个数、电荷、得失电子数
是否守恒。
知识清单
(3)物质的拆分原则
一般,书写离子方程式时,氧化物、弱电解质(弱酸、弱碱、水)、沉淀、气体、单质、多元弱酸的酸根离子等均不能拆分。
常见弱酸:
常见弱碱:
常见沉淀:
常见弱酸的酸式酸根离子:
H2CO3、H2SiO3、CH3COOH、H2C2O4、HClO、HF、H2S、H2SO3等
NH3·H2O、Mg(OH)2、Fe(OH)3、Al(OH)3、Cu(OH)2等
CaCO3、BaSO4、BaCO3、AgCl、Mg(OH)2、Fe(OH)3等
HCO3-、HS-、HSO3-等
知识清单
①微溶物在离子方程式中的书写原则:若微溶物为反应物,澄清溶液可拆,悬浊液不可拆;若微溶物为生成物,则不可拆,当沉淀处理。如澄清石灰水与盐酸反应的离子方程式为H++OH-=H2O;用石灰乳制漂白粉的离子方程式为Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O。
②氨水作为反应物,书写成NH3·H2O;氨水作为生成物,若有加热条件或在浓溶液中生成,则书写成NH3↑+H2O,若无加热条件或在稀溶液中生成,则书写成NH3·H2O。
提
示
知识清单
(4)离子方程式的正误判断
是否符合反应事实
反应条件、连接符号、“↓”“↑”是否使用恰当
电解质拆分是否正确
是否漏掉离子反应
是否符合质量守恒、电荷守恒、得失电子守恒
是否符合离子配比
反应物的用量
如铁与稀硫酸(或稀盐酸)反应生成Fe2+而不生成Fe3+。
易溶于水的强电解质拆写成离子形式。
如Ba(OH)2溶液与CuSO4溶液反应,既要写Ba2+与SO42-生成BaSO4沉淀,又不能漏掉Cu2+与OH-生成Cu(OH)2沉淀。
如H2SO4溶液与Ba(OH)2溶液反应,注意H+与SO42-的配比,以及OH-与
Ba2+的配比均为2:1,正确为2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓。
如过量、少量、足量、等物质的量等。
HCO3-、HS-、HSO3-、
HPO42-、H2PO4-
AlO2-、S2-、SO32-、CO32-、
SiO32-、ClO-、CH3COO-
NH4+、Mg2+、Al3+、
Cu2+ 、Fe2+、Fe3+
S2-(HS-)、SO32-(HSO3-)、
I-、Br-、Cl-、Fe2+
ClO-、MnO4-、NO3-(H+)
、Fe3+、Cr2O72-
MnO4-(紫红)、Cu2+(蓝)、Fe2+(浅绿)、Fe3+(棕黄)
知识清单
三、离子共存与离子检验
1.离子共存
(1)含义:几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
(2)常见离子的性质
颜色
氧化性
水解显酸性
还原性
水解显碱性
酸式酸根离子
知识清单
提 示
①有色离子在无色溶液中不能存在,在透明溶液中可能存在。
②既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。
(3)常见“双水解”反应的离子
①Al3+—CO32-、HCO3-、S2-、HS-、AlO2-、ClO-、SiO32-
②Fe3+—CO32-、HCO3-、AlO2-
2.常见离子的检验方法
根据离子性质不同而在实验中所表现出的现象不同,可以把检验离子的方法归纳为三种类型:生成沉淀;生成气体;显现特殊颜色。
知识清单
基础一练
1
【答案】C
下列叙述中正确的是( )
A.物质的溶解过程,实质上就是其电离过程
B.H2SO4 溶于水能导电,液态 H2SO4 不导电,故 H2SO4 不是电解质
C.1 L 0.1 mol·L-1 的 H2SO4 溶液中含有 0.2 mol H+
D.1 L 0.1 mol·L-1 的 HClO 溶液中含有 0.1 mol H+
解析 不是所有物质溶解过程都存在电离,比如非电解质溶解时不存在电离的过程,A项错误。H2SO4溶于水电离出自由移动的H+和SO42-,能导电,H2SO4属于电解质,B项错误。H2SO4是强电解质,能完全电离,所以 0.1 mol 的 H2SO4 溶液中含有 0.2 mol H+ ;而HClO是弱电解质,只能部分电离,所以 0.1 mol 的HClO溶液中含有 的 n(H+)小于 0.1 mol ,C项正确、D项错误。
基础一练
2
下列物质在熔融状态下不导电的是( )
A.NaOH B.CaCl2 C.HCl D.K2SO4
解析 导电是因为有自由移动的离子,而HCl只有在水溶液中才能电离出自由移动的离子( H+、Cl- ),在熔融状态下不能电离出自由移动的离子,不导电。故选C。
【答案】C
3
在含有大量 H+、Fe3+、SO42-的溶液中,还能大量共存的离子是( )
A.CO32- B.Ba2+ C.SCN- D.NH4+
解析 CO32- 与H+能反应生成气体(CO2) 和水,不能共存; Ba2+与SO42-能反应生成沉淀(BaSO4)不能共存; SCN-与Fe3+ 能反应生成络合物[Fe(SCN)3] ,不能共存 。故选C。
【答案】C
基础一练
4
水溶液中能大量共存的一组离子是 ( )
A.NH4+ 、 Ba2+ 、Br- 、 CO32-
B.Cl- 、SO32- 、Fe2+ 、H+
C.K+ 、Na+ 、SO42- 、MnO4-
D.Na+ 、H+ 、NO3- 、HCO3-
【答案】C
解析 A项, Ba2+与CO32-能反应生成沉淀BaCO3,不能共存;B项, SO32-与H+能反应生成气体(SO2)和水,不能共存; C项,这四种离子间互不反应,能大量共存;D项, H+与HCO3-能反应生成气体(CO2)和水,不能共存 。故选C。
基础一练
5
【答案】D
在下图点滴板上有四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )
解析 A项,电荷不守恒,应为2Fe2++2H++H2O2=2Fe3++2H2O;B项,书写不完整,应为HCO3-+NH4++2OH-=CO32-+NH3↑+2H2O;C项,CH3COOH为弱电解质,书写离子方程式中为分子式,应为CH3COOH+OH-=CH3COO-+H2O。故选D。
基础一练
6
【答案】B
下列关于物质或离子检验的叙述正确的是( )
A. 向某溶液中加入KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B. 气体通过无水CuSO4粉末,粉末变蓝,证明原气体中含有水蒸气
C. 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+、无K+
D. 将某气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
解析 A项,根据实验现象只能证明原溶液中一定有Fe3+,可能有Fe2+ ,错误;B项,无水CuSO4粉末遇水变蓝,正确;C项,根据实验现象只能证明原粉末中一定有Na+,可能有K+,检验K+ 要透过蓝色钴玻璃,错误;D项,能使澄清石灰水变浑浊的气体可能是CO2,也可能是SO2等,错误。
真题小试
7
(2021·浙江)下列物质属于强电解质的是 ( )
A.KOH B.H3PO4
C.SO3 D.CH3CHO
【答案】A
解析 强电解质是指在水溶液中能完全电离的化合物,一般包括强酸、强碱、大部分盐、活泼金属氧化物。A项,KOH在水溶液中完全电离生成K+和OH-,属于强电解质,正确;B项,H3PO4在水溶液中的电离方程式为H3PO4 H++ H2PO4- ,属于弱电解质,错误;C项,SO3在水溶液中,与水反应生成的H2SO4完全电离,但自身不能电离,属于非电解质,错误;D项,CH3CHO不溶于水,属于非电解质,错误。
真题小试
8
(2021·广东)宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是( )
A. Na2O2 放入水中:
B. H2O(g) 通过灼热铁粉:
C. 铜丝插入热的浓硫酸中:
D. SO2通入酸性KMnO4溶液中:
解析 A项,根据实验现象只能证明原溶液中一定有Fe3+,可能有Fe2+ ,错误;B项,无水CuSO4粉末遇水变蓝,正确;C项,根据实验现象只能证明原粉末中一定有Na+,可能有K+,检验K+ 要透过蓝色钴玻璃,错误;D项,能使澄清石灰水变浑浊的气体可能是CO2,也可能是SO2等,错误。
【答案】B
真题小试
9
【答案】A
(2021·全国乙)下列过程中的化学反应,相应的离子方程式正确的是( )
A. 用碳酸钠溶液处理水垢中的硫酸钙:
B. 过量铁粉加入稀硝酸中:
C. 硫酸铝溶液中滴加少量氢氧化钾溶液:
D. 氯化铜溶液中通入硫化氢:
解析 A项,硫酸钙微溶,碳酸钙难溶,书写离子方程式时均为分子式,正确;B项,过量的铁粉与稀硝酸反应生成硝酸铁,应为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,错误;C项,硫酸铝溶液与少量氢氧化钾溶液反应生成氢氧化铝沉淀,应为Al3++3OH-=Al(OH)3↓,错误;D项,硫化氢为弱电解质,书写离子方程式为分子式,应为 ,错误。
https://www.21cnjy.com/help/help_extract.php
人教版 必修1
知识清单
一、电解质及其电离
1.电解质的分类
化合物
非电解质
(不导电)
电解质
(导电)
弱电解质:弱酸、弱碱、水
强电解质:强酸、强碱、大部分盐、活泼金属氧化物
根据在水溶液里或熔融状态下能否导电
根据在水溶液里
能否全部电离
水溶液中完全电离
水溶液中部分电离
知识清单
2.电离
(1)概念:电解质在水溶液中或熔融状态下,离解成自由移动的离子的过程。
(2)电离条件:酸溶于水,盐和碱溶于水或熔融。
①电解质和非电解质都属于化合物,单质、混合物既不是电解质,也不是非电解质。
②有些化合物的水溶液能导电,但属于非电解质,因为溶液中导电的离子不是其自身电离产生的,如SO2、NH3等。
③电解质的强弱与物质溶解性无关,如BaSO4、AgCl等在水溶液中溶解度很小,但溶解部分完全电离,因此属于强电解质。
提
示
知识清单
3.电离方程式的书写
电离方程式书写格式及实例
强电解质 ①用“===”连接,如 Na2SO4===2Na++SO42-
②强酸酸式盐中的离子全部电离,如 NaHSO4===Na++H++SO42-
③弱酸酸式盐中的阴离子部分电离,如NaHCO3===Na++HCO3-、HCO3- H++CO32-
弱电解质 ①用“ ”连接,如 HClO H++ClO-
②多元弱酸的电离分布书写,如 H2CO3:H2CO3 H++HCO3-、HCO3- H++CO32-
③多元弱碱的电离一步写完,如 Fe(OH)3:Fe(OH)3 Fe3++3OH-
知识清单
二、离子反应和离子方程式
1.离子反应
(1)概念:在溶液中有离子参加或生成的反应。
(2)本质:反应物中某些离子的浓度的减小。
(3)条件:有沉淀或气体或水生成或反应时有电子得失。
(4)主要反应类型
复分解反应
①生成难溶的物质,如Al(OH)3、BaSO4等
②生成难电离的物质,如弱酸、弱碱、水等
③生成气态的物质,如CO2、SO2、NH3等
氧化还原反应
如FeCl3溶液与Cu反应的离子方程式:
2Fe3++Cu=Cu2++2Fe2+
络合反应
如FeCl3溶液与KSCN溶液反应的离子方程式:
Fe3++3SCN- = Fe(SCN)3
水解反应
如硫酸铝溶液与碳酸氢钠溶液反应的离子方程式:
Al3++3HCO3- = Al(OH)3↓+3CO2↑
知识清单
2.离子方程式
(1)概念:用实际参加反应的离子符号来表示反应的式子。
离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应。
提 示
(2)书写步骤(以BaCl2与H2SO4的反应为例)
写
拆
删
查
根据事实,写出正确的化学方程式:BaCl2+H2SO4=2HCl+BaSO4↓
把易溶解且易电离的物质写成离子形式:
Ba2++2Cl-+2H++SO42-=2H++2Cl-+BaSO4↓
删去方程式两边不参加反应的离子:
Ba2++SO42-=BaSO4↓
检查原子个数、电荷、得失电子数
是否守恒。
知识清单
(3)物质的拆分原则
一般,书写离子方程式时,氧化物、弱电解质(弱酸、弱碱、水)、沉淀、气体、单质、多元弱酸的酸根离子等均不能拆分。
常见弱酸:
常见弱碱:
常见沉淀:
常见弱酸的酸式酸根离子:
H2CO3、H2SiO3、CH3COOH、H2C2O4、HClO、HF、H2S、H2SO3等
NH3·H2O、Mg(OH)2、Fe(OH)3、Al(OH)3、Cu(OH)2等
CaCO3、BaSO4、BaCO3、AgCl、Mg(OH)2、Fe(OH)3等
HCO3-、HS-、HSO3-等
知识清单
①微溶物在离子方程式中的书写原则:若微溶物为反应物,澄清溶液可拆,悬浊液不可拆;若微溶物为生成物,则不可拆,当沉淀处理。如澄清石灰水与盐酸反应的离子方程式为H++OH-=H2O;用石灰乳制漂白粉的离子方程式为Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O。
②氨水作为反应物,书写成NH3·H2O;氨水作为生成物,若有加热条件或在浓溶液中生成,则书写成NH3↑+H2O,若无加热条件或在稀溶液中生成,则书写成NH3·H2O。
提
示
知识清单
(4)离子方程式的正误判断
是否符合反应事实
反应条件、连接符号、“↓”“↑”是否使用恰当
电解质拆分是否正确
是否漏掉离子反应
是否符合质量守恒、电荷守恒、得失电子守恒
是否符合离子配比
反应物的用量
如铁与稀硫酸(或稀盐酸)反应生成Fe2+而不生成Fe3+。
易溶于水的强电解质拆写成离子形式。
如Ba(OH)2溶液与CuSO4溶液反应,既要写Ba2+与SO42-生成BaSO4沉淀,又不能漏掉Cu2+与OH-生成Cu(OH)2沉淀。
如H2SO4溶液与Ba(OH)2溶液反应,注意H+与SO42-的配比,以及OH-与
Ba2+的配比均为2:1,正确为2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓。
如过量、少量、足量、等物质的量等。
HCO3-、HS-、HSO3-、
HPO42-、H2PO4-
AlO2-、S2-、SO32-、CO32-、
SiO32-、ClO-、CH3COO-
NH4+、Mg2+、Al3+、
Cu2+ 、Fe2+、Fe3+
S2-(HS-)、SO32-(HSO3-)、
I-、Br-、Cl-、Fe2+
ClO-、MnO4-、NO3-(H+)
、Fe3+、Cr2O72-
MnO4-(紫红)、Cu2+(蓝)、Fe2+(浅绿)、Fe3+(棕黄)
知识清单
三、离子共存与离子检验
1.离子共存
(1)含义:几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
(2)常见离子的性质
颜色
氧化性
水解显酸性
还原性
水解显碱性
酸式酸根离子
知识清单
提 示
①有色离子在无色溶液中不能存在,在透明溶液中可能存在。
②既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。
(3)常见“双水解”反应的离子
①Al3+—CO32-、HCO3-、S2-、HS-、AlO2-、ClO-、SiO32-
②Fe3+—CO32-、HCO3-、AlO2-
2.常见离子的检验方法
根据离子性质不同而在实验中所表现出的现象不同,可以把检验离子的方法归纳为三种类型:生成沉淀;生成气体;显现特殊颜色。
知识清单
基础一练
1
【答案】C
下列叙述中正确的是( )
A.物质的溶解过程,实质上就是其电离过程
B.H2SO4 溶于水能导电,液态 H2SO4 不导电,故 H2SO4 不是电解质
C.1 L 0.1 mol·L-1 的 H2SO4 溶液中含有 0.2 mol H+
D.1 L 0.1 mol·L-1 的 HClO 溶液中含有 0.1 mol H+
解析 不是所有物质溶解过程都存在电离,比如非电解质溶解时不存在电离的过程,A项错误。H2SO4溶于水电离出自由移动的H+和SO42-,能导电,H2SO4属于电解质,B项错误。H2SO4是强电解质,能完全电离,所以 0.1 mol 的 H2SO4 溶液中含有 0.2 mol H+ ;而HClO是弱电解质,只能部分电离,所以 0.1 mol 的HClO溶液中含有 的 n(H+)小于 0.1 mol ,C项正确、D项错误。
基础一练
2
下列物质在熔融状态下不导电的是( )
A.NaOH B.CaCl2 C.HCl D.K2SO4
解析 导电是因为有自由移动的离子,而HCl只有在水溶液中才能电离出自由移动的离子( H+、Cl- ),在熔融状态下不能电离出自由移动的离子,不导电。故选C。
【答案】C
3
在含有大量 H+、Fe3+、SO42-的溶液中,还能大量共存的离子是( )
A.CO32- B.Ba2+ C.SCN- D.NH4+
解析 CO32- 与H+能反应生成气体(CO2) 和水,不能共存; Ba2+与SO42-能反应生成沉淀(BaSO4)不能共存; SCN-与Fe3+ 能反应生成络合物[Fe(SCN)3] ,不能共存 。故选C。
【答案】C
基础一练
4
水溶液中能大量共存的一组离子是 ( )
A.NH4+ 、 Ba2+ 、Br- 、 CO32-
B.Cl- 、SO32- 、Fe2+ 、H+
C.K+ 、Na+ 、SO42- 、MnO4-
D.Na+ 、H+ 、NO3- 、HCO3-
【答案】C
解析 A项, Ba2+与CO32-能反应生成沉淀BaCO3,不能共存;B项, SO32-与H+能反应生成气体(SO2)和水,不能共存; C项,这四种离子间互不反应,能大量共存;D项, H+与HCO3-能反应生成气体(CO2)和水,不能共存 。故选C。
基础一练
5
【答案】D
在下图点滴板上有四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )
解析 A项,电荷不守恒,应为2Fe2++2H++H2O2=2Fe3++2H2O;B项,书写不完整,应为HCO3-+NH4++2OH-=CO32-+NH3↑+2H2O;C项,CH3COOH为弱电解质,书写离子方程式中为分子式,应为CH3COOH+OH-=CH3COO-+H2O。故选D。
基础一练
6
【答案】B
下列关于物质或离子检验的叙述正确的是( )
A. 向某溶液中加入KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B. 气体通过无水CuSO4粉末,粉末变蓝,证明原气体中含有水蒸气
C. 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+、无K+
D. 将某气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
解析 A项,根据实验现象只能证明原溶液中一定有Fe3+,可能有Fe2+ ,错误;B项,无水CuSO4粉末遇水变蓝,正确;C项,根据实验现象只能证明原粉末中一定有Na+,可能有K+,检验K+ 要透过蓝色钴玻璃,错误;D项,能使澄清石灰水变浑浊的气体可能是CO2,也可能是SO2等,错误。
真题小试
7
(2021·浙江)下列物质属于强电解质的是 ( )
A.KOH B.H3PO4
C.SO3 D.CH3CHO
【答案】A
解析 强电解质是指在水溶液中能完全电离的化合物,一般包括强酸、强碱、大部分盐、活泼金属氧化物。A项,KOH在水溶液中完全电离生成K+和OH-,属于强电解质,正确;B项,H3PO4在水溶液中的电离方程式为H3PO4 H++ H2PO4- ,属于弱电解质,错误;C项,SO3在水溶液中,与水反应生成的H2SO4完全电离,但自身不能电离,属于非电解质,错误;D项,CH3CHO不溶于水,属于非电解质,错误。
真题小试
8
(2021·广东)宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是( )
A. Na2O2 放入水中:
B. H2O(g) 通过灼热铁粉:
C. 铜丝插入热的浓硫酸中:
D. SO2通入酸性KMnO4溶液中:
解析 A项,根据实验现象只能证明原溶液中一定有Fe3+,可能有Fe2+ ,错误;B项,无水CuSO4粉末遇水变蓝,正确;C项,根据实验现象只能证明原粉末中一定有Na+,可能有K+,检验K+ 要透过蓝色钴玻璃,错误;D项,能使澄清石灰水变浑浊的气体可能是CO2,也可能是SO2等,错误。
【答案】B
真题小试
9
【答案】A
(2021·全国乙)下列过程中的化学反应,相应的离子方程式正确的是( )
A. 用碳酸钠溶液处理水垢中的硫酸钙:
B. 过量铁粉加入稀硝酸中:
C. 硫酸铝溶液中滴加少量氢氧化钾溶液:
D. 氯化铜溶液中通入硫化氢:
解析 A项,硫酸钙微溶,碳酸钙难溶,书写离子方程式时均为分子式,正确;B项,过量的铁粉与稀硝酸反应生成硝酸铁,应为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,错误;C项,硫酸铝溶液与少量氢氧化钾溶液反应生成氢氧化铝沉淀,应为Al3++3OH-=Al(OH)3↓,错误;D项,硫化氢为弱电解质,书写离子方程式为分子式,应为 ,错误。
https://www.21cnjy.com/help/help_extract.php
