化学八年级鲁教版(五四学制)4我们周围的空气复习课件
文档属性
| 名称 | 化学八年级鲁教版(五四学制)4我们周围的空气复习课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 437.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-30 00:00:00 | ||
图片预览






文档简介
(共28张PPT)
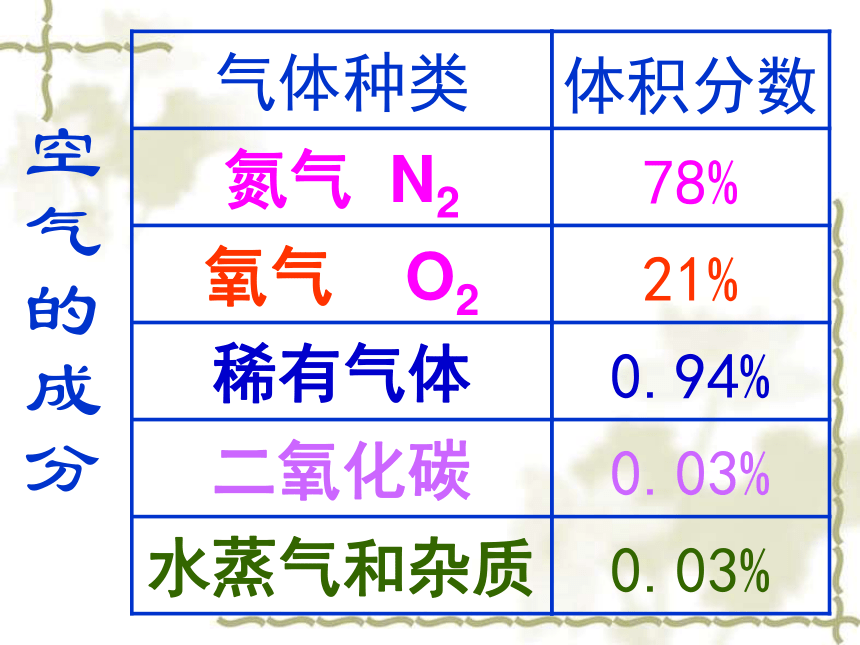
空气的成分
一、空气的组成
(78%)
(21%)
(0.94%)
(0.03%)
(0.03%)
(1%)
空气的成分
(体积分数)
空气的成分
气体种类
氮气 N2
氧气 O2
稀有气体
二氧化碳
水蒸气和杂质
体积分数
78%
21%
0.94%
0.03%
0.03%
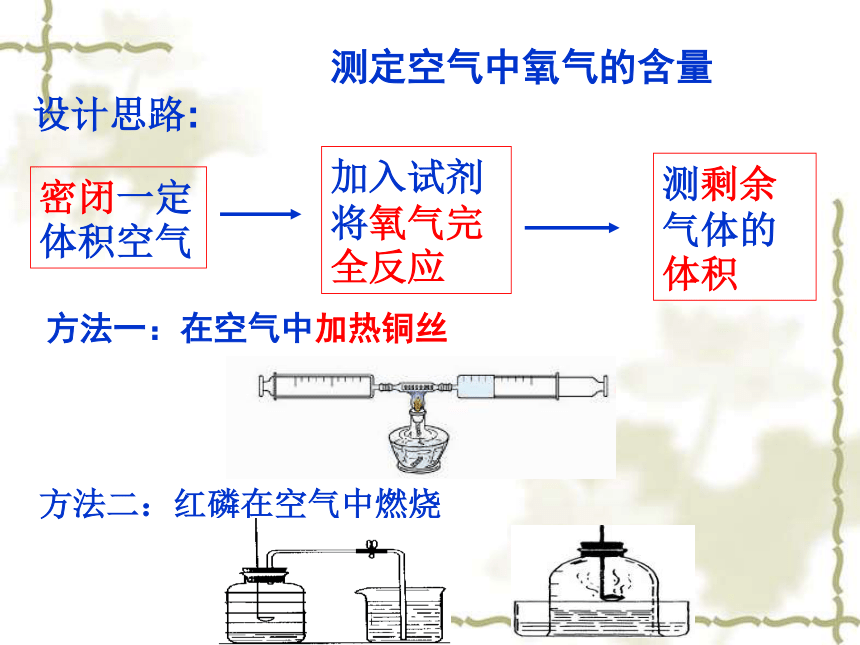
设计思路:
密闭一定体积空气
加入试剂将氧气完全反应
测剩余气体的体积
测定空气中氧气的含量
方法一:在空气中加热铜丝
方法二:红磷在空气中燃烧
关注空气质量
1.空气质量报告内容包括
2.空气污染指数的项目暂定为:
首要污染物
空气质量级别
空气污染指数
空气质量状况
一氧化碳
二氧化氮
二氧化硫
可吸入颗粒物
播放视频
防治空气污染的建议:
1.植树造林 2.不烧散煤,改烧型煤
3.将煤进行脱硫处理。不产生二氧化硫。 4.对工厂产生的废气处理后再排放。 5.使用洁净能源。例如:太阳能、水能、潮汐能、电能、地热能、风能 ………
一、氧气的实验室制法
(一)药品
过氧化氢 ( H2O2 )和二氧化锰
(二)原理
过氧化氢
水 + 氧气
催化剂
1.定义: 能改变其他物质的化学反应速率,本身的质量和化学性质在反应前后不变的物质
催化剂
2.作用:催化作用。(加快过氧化氢的分解速率)
MnO2
2H2O2
2H2O + O2↑
氧气的制法和性质
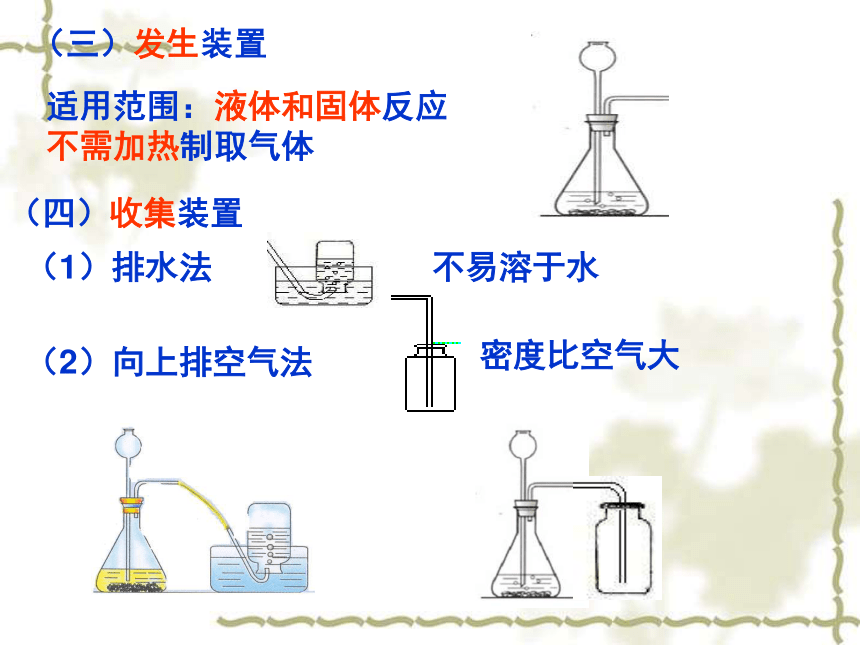
(三)发生装置
适用范围:液体和固体反应不需加热制取气体
(四)收集装置
(1)排水法
(2)向上排空气法
不易溶于水
密度比空气大
(五)操作步骤(排水法)
1、组装仪器,检验装置的气密性
2、将集气瓶装满水倒放入水槽中
3、加入药品
4、气泡连续而均匀时收集氧气
5、盖好玻璃片,将集气瓶正放
(先加二氧化锰后加过氧化氢)
检验: 将带火星的木条放在集气瓶内,木条复燃,说明是氧气。
验满: 将带火星的木条放在集气瓶口,木条复燃,说明已经满了。
(六)检验
(七)注意事项
1、长颈漏斗末端要伸入液面以下
2、锥形瓶中的导管稍露出橡皮塞
4、当气泡连续而均匀地冒出时,开始收集
3、向上排空气法收集氧气时,导管应伸到集气瓶底部
5、 充满氧气的集气瓶应正放在实验台上
防止气体沿长颈漏斗逸出
使发生装置的氧气全部排出
二、氧气的性质
(一)氧气的物理性质
1、无色、无味的气体
2、密度比空气大
3、氧气不易溶于水
4、熔点: -218℃
沸点: -183℃ (液氧为淡蓝色)
向上排空气法
排水法
(二)氧气的化学性质
氧化性
C + O2 CO2
点燃
木炭在空气(氧气)中燃烧
4P + 5O2 2 P2O5
点燃
红磷在空气中燃烧
2H2 + O2 2 H2O
点燃
氢气在空气中燃烧
2Mg + O2 2MgO
点燃
镁条在空气中燃烧
3Fe + 2O2 Fe3O4
点燃
铁丝在氧气中燃烧
2Cu + O2 2CuO
△
在空气中加热铜丝
石蜡 + O2 CO2 + H2O
点燃
蜡烛在空气(氧气)中燃烧
物质
混合物
纯净物
单质
化合物
三、物质的分类
组成物质的种类
组成元素的种类
氧化物
纯净物是由一种物质组成的物质。
混合物是由多种物质组成的物质
单质是由一种元素组成的纯净物
化合物是由两种或两种以上元素组成的纯净物
氧化物是由两种元素组成的,其中一种是氧元素的化合物
(一)元素
1、定义:具有相同核电荷数(质子数)的一类原子的总称
2、含量(在地壳上):氧O、硅Si、铝Al、铁Fe、钙Ca
3、分类:
元素
金属元素
非金属元素
四、物质组成的表示
4、元素与原子的关系
元素(宏观) 原子(微观)
区别 只讲种类
不讲个数 既讲种类
又讲个数
联系 同一类原子总称为元素
1、元素符号
2、写法:
“一大 二小”法
3、元素符号的意义:
(1)一种元素
(2)这种元素的一个原子
(二)元素符号
国际上表示元素的统一符号
氢 H 氧O 碳 C 铁 Fe 镁Mg
H
(1)氢元素
(2)一个氢原子
注意:元素符号前面加数字只表示几个原子
2H
2个氢原子
4、离子符号
元素符号
离子符号
右上角加电荷数与符号
阳离子
阴离子
钠离子 Na+
氯离子 Cl-
钙离子 Ca2+
氧离子 O2-
氧离子 O2- 中的“2”的意义:
一个氧离子带两个单位负电荷
2O2- 中的“2”的意义:
两个氧离子
(2)离子符号的意义
(1)离子符号的写法
(3)离子符号中数字的意义
O2-
一个氧离子
离子带的电荷数等于化合价数
二、化学式的意义
化学式
1、定义:
用元素符号表示物质组成的式子
水的化学式 H2O
2、化学式的意义
①表示一种物质
②表示物质的一个分子
①水
②一个水分子
注意:化学式前面的数字只表示几个分子
2H2O
2个水分子
③表示该物质的组成元素
④表示物质的分子构成
③水由氢氧元素组成
④一个水分子由两个氢原子和一个氧原子构成
3、化学式的写法
(1)单质化学式的写法
①单质的化学式就是它的元素符号
②四种单质的化学式是元素符号右下角加2
氧气 氢气 氮气 氯气
(O2、 H2、 N2 、 Cl2 )
1)金 2)镁条 3)铜丝(4)金刚石(5)氦气(6)氖气
(1)Au(2)Mg(3)Cu(7)C(8)He(9)Ne
(2)化合物化学式的写法:
化合物化学式的书写根据名称和化合价
(1)二氧化碳(2)氧化镁(3)氧化铜(4)氯化钠(5)二氧化硫(6)一氧化碳(7)二氧化氮
化合物化学式的读法:
从右往左,单价的读“某化某”
变价的读 “几某化几某”
P2O5
NaCl
五氧化二磷
氯化钠
(1)CO2(2)MgO(3)CuO(4)NaCl
(5)SO2(6)CO(7)NO2
+2价的Fe读“亚铁”
+3价的Fe读“铁”
FeO 氧化亚铁 FeCl2氯化亚铁
Fe2O3 氧化铁
三、化学式与化合价
(一)元素的化合价:原子得失电子的数目
化合价规则:在化合物中元素的正负化合价代数和为0
(二)化合价与化学式的关系
1、根据化学式求元素的化合价
2、根据元素的化合价写化学式
3、判断化学式的正误
三、原子团的化合价
根的名称 根的符号 常见化合价
氢氧根 OH -1
硝酸根 NO3 -1
硫酸根 SO4 -2
碳酸根 CO3 -2
铵根 NH4 +1
第三节 物质组成的表示
三、化合价与化学式
原子得失电子的数目。
1、定义:
化合价标在元素符号正上方:先写正负号,再写数值
2、化合价的表示:
H2 O
-2
4、原子团的化合价
氢氧根 硝酸根 硫酸根 碳酸根 铵根
-1 -1 -2 -2 +1
OH NO3 SO4 CO3 NH4
3、化合价规则:化合物中元素的正负化合价代数和为0
5、化合价的规律:
(1)化合价有正价和负价。
(6)单质里元素的化合价为零。
(4)一些元素有可变化合价(变价)。
(5)在化合物中元素的正负化合价代数和为0
(化合价法则:正价总数+负价总数 = 0)
(3)金属元素通常显正价;非金属元素既显负价,又显 正价。
(2)氧元素通常显-2价,氢元素通常显+1。
5、化合价的口诀:
一价氯 氢 钾 钠 银
二价氧 钡 钙 镁 锌
三铝、四硅、五价磷
二、三铁,二、四碳
硫有负二、正四、六
铜、汞二价最常见
元素的变价分不清
代数和为零来计算
(二)化合价与化学式的关系
1、根据化学式求化合价
2、根据化合价写化学式
a.正价在左,负价在右
b.标出各元素的化合价
c.化合价的绝对值先约分再交叉
3、判断化学式的正误
依据:化合价的代数和=0
四、物质组成的定量表示
1、相对分子质量
化学式中各原子的相对原子质量的总和
2、化合物中各元素的质量比
元素的质量比=各原子的相对原子质量(总和)之比
3、化合物中某元素的质量分数
元素的质量分数=
相对分子质量
X100%
元素的相对原子质量×原子个数
4、化合物中元素的质量
元素的质量=化合物的质量×元素的质量分数
四、物质组成的定量表示
1、相对分子质量
(根据化学式的计算)
化学式中各原子的相对原子质量的总和
H2 O的相对分子质量
= 1 ×2+16 = 18
H2 O中氢元素和氧元素的质量比
= 1 ×2 ∶ 16 = 1 ∶8
2、化合物中各元素的质量比
元素的质量比=各原子的相对原子质量(总和)之比
H2 O中 H∶ O
3、化合物中某元素的质量分数
元素的质量分数=
H2 O中氢元素质量分数 =
H2 O中 H% =
1×2+16
X100%
1×2
≈11.1%
化合物相对分子质量
X100%
元素的相对原子质量×原子个数
4、化合物中元素的质量
元素的质量=化合物的质量×元素的质量分数
硝酸铵(NH4NO3)
(1)氮元素的质量分数
(2)80g硝酸铵含氮元素的质量
(3)多少克硝酸铵中氮元素的质量为70克
元素的质量分数的意义
硝酸铵(NH4NO3)中 N%=35% 35%的意义:
100g硝酸铵中含氮元素35g
(2)氮元素的质量= 80g × 35% = 28g
(3)硝酸铵的质量= 70g ÷ 35% = 200g
空气的成分
一、空气的组成
(78%)
(21%)
(0.94%)
(0.03%)
(0.03%)
(1%)
空气的成分
(体积分数)
空气的成分
气体种类
氮气 N2
氧气 O2
稀有气体
二氧化碳
水蒸气和杂质
体积分数
78%
21%
0.94%
0.03%
0.03%
设计思路:
密闭一定体积空气
加入试剂将氧气完全反应
测剩余气体的体积
测定空气中氧气的含量
方法一:在空气中加热铜丝
方法二:红磷在空气中燃烧
关注空气质量
1.空气质量报告内容包括
2.空气污染指数的项目暂定为:
首要污染物
空气质量级别
空气污染指数
空气质量状况
一氧化碳
二氧化氮
二氧化硫
可吸入颗粒物
播放视频
防治空气污染的建议:
1.植树造林 2.不烧散煤,改烧型煤
3.将煤进行脱硫处理。不产生二氧化硫。 4.对工厂产生的废气处理后再排放。 5.使用洁净能源。例如:太阳能、水能、潮汐能、电能、地热能、风能 ………
一、氧气的实验室制法
(一)药品
过氧化氢 ( H2O2 )和二氧化锰
(二)原理
过氧化氢
水 + 氧气
催化剂
1.定义: 能改变其他物质的化学反应速率,本身的质量和化学性质在反应前后不变的物质
催化剂
2.作用:催化作用。(加快过氧化氢的分解速率)
MnO2
2H2O2
2H2O + O2↑
氧气的制法和性质
(三)发生装置
适用范围:液体和固体反应不需加热制取气体
(四)收集装置
(1)排水法
(2)向上排空气法
不易溶于水
密度比空气大
(五)操作步骤(排水法)
1、组装仪器,检验装置的气密性
2、将集气瓶装满水倒放入水槽中
3、加入药品
4、气泡连续而均匀时收集氧气
5、盖好玻璃片,将集气瓶正放
(先加二氧化锰后加过氧化氢)
检验: 将带火星的木条放在集气瓶内,木条复燃,说明是氧气。
验满: 将带火星的木条放在集气瓶口,木条复燃,说明已经满了。
(六)检验
(七)注意事项
1、长颈漏斗末端要伸入液面以下
2、锥形瓶中的导管稍露出橡皮塞
4、当气泡连续而均匀地冒出时,开始收集
3、向上排空气法收集氧气时,导管应伸到集气瓶底部
5、 充满氧气的集气瓶应正放在实验台上
防止气体沿长颈漏斗逸出
使发生装置的氧气全部排出
二、氧气的性质
(一)氧气的物理性质
1、无色、无味的气体
2、密度比空气大
3、氧气不易溶于水
4、熔点: -218℃
沸点: -183℃ (液氧为淡蓝色)
向上排空气法
排水法
(二)氧气的化学性质
氧化性
C + O2 CO2
点燃
木炭在空气(氧气)中燃烧
4P + 5O2 2 P2O5
点燃
红磷在空气中燃烧
2H2 + O2 2 H2O
点燃
氢气在空气中燃烧
2Mg + O2 2MgO
点燃
镁条在空气中燃烧
3Fe + 2O2 Fe3O4
点燃
铁丝在氧气中燃烧
2Cu + O2 2CuO
△
在空气中加热铜丝
石蜡 + O2 CO2 + H2O
点燃
蜡烛在空气(氧气)中燃烧
物质
混合物
纯净物
单质
化合物
三、物质的分类
组成物质的种类
组成元素的种类
氧化物
纯净物是由一种物质组成的物质。
混合物是由多种物质组成的物质
单质是由一种元素组成的纯净物
化合物是由两种或两种以上元素组成的纯净物
氧化物是由两种元素组成的,其中一种是氧元素的化合物
(一)元素
1、定义:具有相同核电荷数(质子数)的一类原子的总称
2、含量(在地壳上):氧O、硅Si、铝Al、铁Fe、钙Ca
3、分类:
元素
金属元素
非金属元素
四、物质组成的表示
4、元素与原子的关系
元素(宏观) 原子(微观)
区别 只讲种类
不讲个数 既讲种类
又讲个数
联系 同一类原子总称为元素
1、元素符号
2、写法:
“一大 二小”法
3、元素符号的意义:
(1)一种元素
(2)这种元素的一个原子
(二)元素符号
国际上表示元素的统一符号
氢 H 氧O 碳 C 铁 Fe 镁Mg
H
(1)氢元素
(2)一个氢原子
注意:元素符号前面加数字只表示几个原子
2H
2个氢原子
4、离子符号
元素符号
离子符号
右上角加电荷数与符号
阳离子
阴离子
钠离子 Na+
氯离子 Cl-
钙离子 Ca2+
氧离子 O2-
氧离子 O2- 中的“2”的意义:
一个氧离子带两个单位负电荷
2O2- 中的“2”的意义:
两个氧离子
(2)离子符号的意义
(1)离子符号的写法
(3)离子符号中数字的意义
O2-
一个氧离子
离子带的电荷数等于化合价数
二、化学式的意义
化学式
1、定义:
用元素符号表示物质组成的式子
水的化学式 H2O
2、化学式的意义
①表示一种物质
②表示物质的一个分子
①水
②一个水分子
注意:化学式前面的数字只表示几个分子
2H2O
2个水分子
③表示该物质的组成元素
④表示物质的分子构成
③水由氢氧元素组成
④一个水分子由两个氢原子和一个氧原子构成
3、化学式的写法
(1)单质化学式的写法
①单质的化学式就是它的元素符号
②四种单质的化学式是元素符号右下角加2
氧气 氢气 氮气 氯气
(O2、 H2、 N2 、 Cl2 )
1)金 2)镁条 3)铜丝(4)金刚石(5)氦气(6)氖气
(1)Au(2)Mg(3)Cu(7)C(8)He(9)Ne
(2)化合物化学式的写法:
化合物化学式的书写根据名称和化合价
(1)二氧化碳(2)氧化镁(3)氧化铜(4)氯化钠(5)二氧化硫(6)一氧化碳(7)二氧化氮
化合物化学式的读法:
从右往左,单价的读“某化某”
变价的读 “几某化几某”
P2O5
NaCl
五氧化二磷
氯化钠
(1)CO2(2)MgO(3)CuO(4)NaCl
(5)SO2(6)CO(7)NO2
+2价的Fe读“亚铁”
+3价的Fe读“铁”
FeO 氧化亚铁 FeCl2氯化亚铁
Fe2O3 氧化铁
三、化学式与化合价
(一)元素的化合价:原子得失电子的数目
化合价规则:在化合物中元素的正负化合价代数和为0
(二)化合价与化学式的关系
1、根据化学式求元素的化合价
2、根据元素的化合价写化学式
3、判断化学式的正误
三、原子团的化合价
根的名称 根的符号 常见化合价
氢氧根 OH -1
硝酸根 NO3 -1
硫酸根 SO4 -2
碳酸根 CO3 -2
铵根 NH4 +1
第三节 物质组成的表示
三、化合价与化学式
原子得失电子的数目。
1、定义:
化合价标在元素符号正上方:先写正负号,再写数值
2、化合价的表示:
H2 O
-2
4、原子团的化合价
氢氧根 硝酸根 硫酸根 碳酸根 铵根
-1 -1 -2 -2 +1
OH NO3 SO4 CO3 NH4
3、化合价规则:化合物中元素的正负化合价代数和为0
5、化合价的规律:
(1)化合价有正价和负价。
(6)单质里元素的化合价为零。
(4)一些元素有可变化合价(变价)。
(5)在化合物中元素的正负化合价代数和为0
(化合价法则:正价总数+负价总数 = 0)
(3)金属元素通常显正价;非金属元素既显负价,又显 正价。
(2)氧元素通常显-2价,氢元素通常显+1。
5、化合价的口诀:
一价氯 氢 钾 钠 银
二价氧 钡 钙 镁 锌
三铝、四硅、五价磷
二、三铁,二、四碳
硫有负二、正四、六
铜、汞二价最常见
元素的变价分不清
代数和为零来计算
(二)化合价与化学式的关系
1、根据化学式求化合价
2、根据化合价写化学式
a.正价在左,负价在右
b.标出各元素的化合价
c.化合价的绝对值先约分再交叉
3、判断化学式的正误
依据:化合价的代数和=0
四、物质组成的定量表示
1、相对分子质量
化学式中各原子的相对原子质量的总和
2、化合物中各元素的质量比
元素的质量比=各原子的相对原子质量(总和)之比
3、化合物中某元素的质量分数
元素的质量分数=
相对分子质量
X100%
元素的相对原子质量×原子个数
4、化合物中元素的质量
元素的质量=化合物的质量×元素的质量分数
四、物质组成的定量表示
1、相对分子质量
(根据化学式的计算)
化学式中各原子的相对原子质量的总和
H2 O的相对分子质量
= 1 ×2+16 = 18
H2 O中氢元素和氧元素的质量比
= 1 ×2 ∶ 16 = 1 ∶8
2、化合物中各元素的质量比
元素的质量比=各原子的相对原子质量(总和)之比
H2 O中 H∶ O
3、化合物中某元素的质量分数
元素的质量分数=
H2 O中氢元素质量分数 =
H2 O中 H% =
1×2+16
X100%
1×2
≈11.1%
化合物相对分子质量
X100%
元素的相对原子质量×原子个数
4、化合物中元素的质量
元素的质量=化合物的质量×元素的质量分数
硝酸铵(NH4NO3)
(1)氮元素的质量分数
(2)80g硝酸铵含氮元素的质量
(3)多少克硝酸铵中氮元素的质量为70克
元素的质量分数的意义
硝酸铵(NH4NO3)中 N%=35% 35%的意义:
100g硝酸铵中含氮元素35g
(2)氮元素的质量= 80g × 35% = 28g
(3)硝酸铵的质量= 70g ÷ 35% = 200g
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
