化学九年级鲁教版(五四学制)3.2金属的化学性质
文档属性
| 名称 | 化学九年级鲁教版(五四学制)3.2金属的化学性质 |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-30 19:30:43 | ||
图片预览











文档简介
(共48张PPT)
第二节 金属的化学性质
【回顾思考1】镁条在空气中点燃有什么现象?
镁条燃烧,发出耀眼的白光,生成白色粉末氧化镁。
2Mg+O2===2MgO
点燃
金属的化学性质
铁丝在氧气中燃烧
【回顾思考2】铁丝在高温时与氧气的反应
3Fe + 2O2 === Fe3O4
点燃
2Cu + O2 2CuO
铁在氧气中剧烈燃烧,火星四射,生成黑色固体四氧化三铁。
在高温时铜也可以在氧气中燃烧
【活动天地】用滤纸卷上少量铝粉,在酒精灯上点燃,迅速插入盛有氧气的集气瓶中观察有什么现象?
铝粉能在氧气中剧烈燃烧,生成白色粉末氧化铝 。
4Al+3O2===2Al2O3
点燃
【思考讨论1】俗话说“真金不怕火炼”,这说明了什么事实?
在高温条件下金不能和氧气反应。
Au + O2≠
高 温 炼 金
(1) 4Al+3O2=2Al2O3 (2)2Cu+O2 2CuO
(3) 2Mg+O2 == 2MgO (4)Au + O2 →不反应
(5) 3Fe+2O2 == Fe3O4
点燃
【思考讨论2】从以下方程式你能得到哪些信息?
点燃
实验表明,大多数金属都能与氧气发生反应,生成相应的金属氧化物,但反应的难易和剧烈程度是不相同的。
一、金属与氧气的反应
1.常温下易与氧气反应: 以 、 为代表。
2.加热时能与氧气反应:以 、 为代表。
3.高温下也不能与氧气反应:以 为代表。
Mg
Al
Fe
Cu
Au
【结论】金属活动性:
Mg、Al>Fe、Cu>Au
【活动与探究1】探究镁、锌、铁、铜的活动性顺序
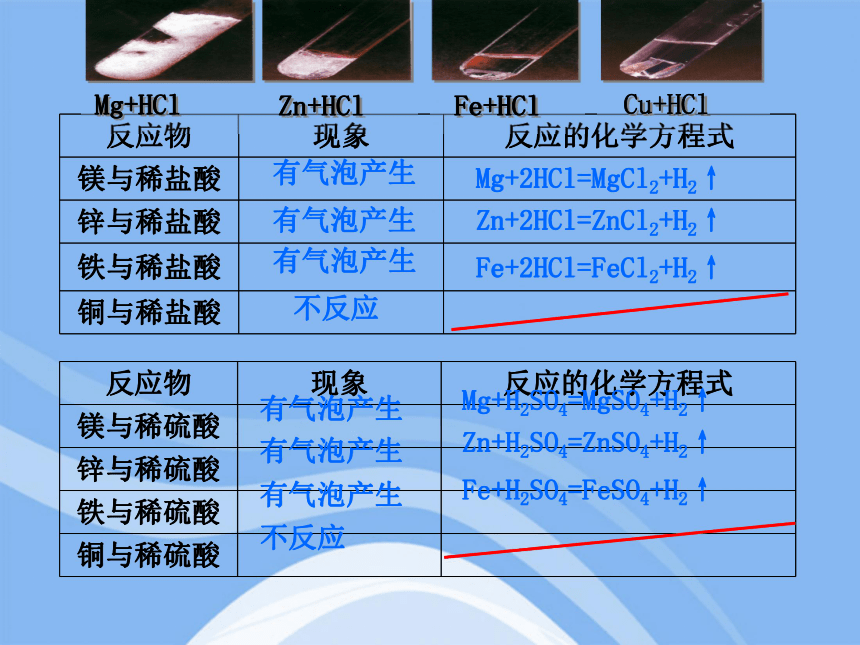
很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,也可反映出金属的活泼程度。
A组:把镁、锌、铁、铜分别放入稀盐酸中。
B组:把镁、锌、铁、铜分别放入稀硫酸中。
二、金属与酸的反应
金属活动顺序
反应物 现象 反应的化学方程式
镁与稀盐酸
锌与稀盐酸
铁与稀盐酸
铜与稀盐酸
反应物 现象 反应的化学方程式
镁与稀硫酸
锌与稀硫酸
铁与稀硫酸
铜与稀硫酸
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
不反应
有气泡产生
有气泡产生
有气泡产生
不反应
有气泡产生
有气泡产生
有气泡产生
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
Mg+HCl
Zn+HCl
Fe+HCl
Cu+HCl
金属与酸的反应的剧烈程度
【实验现象】
铜与酸:不反应
铁与酸: 缓慢
锌与酸: 迅速
镁与酸: 剧烈
【探究结论】
1、 并不是所有的金属都能与酸反应,而且反应的剧烈程度也不相同。
2、金属活动性: 。
Mg> Zn> Fe> Cu
二、金属与酸的反应
金属活动性顺序
金属活动性顺序的理解
(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
(2)在金属活动性顺序里,排在氢前面的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。
符号:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
名称:
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢)铜 汞 银 铂 金
挑战自我
【问题1 】 :下列化学反应能发生吗?
Cu + HCl —— CuCl2 + H2↑
Mg + HCl —— MgCl2 + H2↑
Al + HCl —— AlCl3 + H2↑
【问题2 】 :下列化学反应正确吗?
(1)铁 + 盐酸 —— 氯化铁 + 氢气
(2)锌 + 硝酸 —— 硝酸锌 + 氢气
×
应生成氯化亚铁
硝酸具有氧化性,与金属反应不生成氢气。
√
√
×
×
【活动天地】完成下列反应的化学方程式
Fe + HCl
Fe + H2SO4
Al + HCl
Al + H2SO4
2
6
FeCl2 + H2↑
2
FeSO4 + H2 ↑
2AlCl3 + 3H2↑
Al2(SO4)3 + 3H2 ↑
2
3
观察上述反应的化学方程式,分析这些反应有什么共同特点?
单质
化合物
单质
化合物
【置换反应】一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
置换反应特点:A+BC=B+AC
置换反应
二、金属与酸的反应
CO2
C +
O2
点燃
Fe3O4
3Fe +
2O2
点燃
H2O
2H2 +
O2
点燃
2
KClO3 KCl+ O2
2
2
3
↑
MnO2
△
2H2O +
2H2O2
O2↑
MnO2
2Hg +
2HgO
O2↑
△
化合反应
特点:A+B=AB
分解反应
特点:AB=A+B
【复习巩固比较】
CaO + 2HCl = CaCl2 + H2O
NaOH + HCl = NaCl + H2O
Na2CO3 + 2HCl = 2NaCl+CO2↑+H2O
2NaOH + CuCl2 = Cu(OH)2↓+2NaCl
NaCl + AgNO3 = AgCl↓ + NaNO3
复分解反应
复分解反应的特点:AB + CD = CB + AD
【活动天地】
练习1:下列盐能由金属与酸发生置换反应制得的是
( )
A. CuSO4 B. MgCl2
C. FeCl3 D. ZnSO4
练习2:不能由金属跟稀硫酸直接反应而制得的物质是:
( )
A、MgSO4 B、 CuSO4
C、FeSO4 D、Al2(SO4)3
B D
B
【课堂练习】判断下列反应的基本反应类型
1、2Mg+O2==2MgO
2、C+O2==CO2
3、2KClO3 == 2KCl+3O2 ↑
4、Fe+CuSO4 == FeSO4+Cu
5、2H2+O2 == 2H2O
6、H2+CuO == Cu+H2O
7、CuO+H2SO4=CuSO4+H2O
点燃
加热
点燃
点燃
催化剂
加热
化合反应
化合反应
化合反应
分解反应
置换反应
置换反应
复分解反应
【课堂练习】 <综合能力提高>
1、用5.6g不纯的铁(只含一种杂质)跟足量盐酸充分反应,生成0.3g氢气。此不纯铁中含有的杂质可能是
( )
A、镁 B、锌 C、铜 D、银
A
杂质推断题
提示:根据化学方程式计算,可以用平均值方法。
2、在天平两边的烧杯中,分别放入相同质量的稀硫酸,调至平衡,再分别向两边烧杯中各加入等质量的镁和铁(均为不足量),金属完全反应后,天平指针
( )
A 保持平衡,指针不动 B 偏向放镁的一边
C 偏向放铁的一边 D 无法判断
有关天平平衡问题
C
1)、金属与氧气的反应
2)、金属与稀盐酸、稀硫酸的反应
1、金属的化学性质
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
2、金属的活动性顺序
3、置换反应
小 结
【提出问题 】除了金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,可比较金属的活动性以外,还有其他方法吗
三、金属与盐溶液的反应
活动性较强的金属能与酸溶液中的氢离子发生置换反应,NaCl、CaCl2、CuSO4、AgNO3这些盐的溶液中都含有金属离子,这些离子能否与金属发生置换反应呢?
通过盐与金属是否发生置换反应我们也可以比较金属的化学活动性强弱。
【活动与探究2】
探究钠、锌、铁、铜、银的活动性顺序
实验方案 现象 活动性 有关化学方程式
锌片浸入硫酸铜溶液中
锌片浸入硝酸银溶液中
锌片浸入氯化钠溶液中
锌片表面有紫红色物质析出
锌片表面有银白色物质析出
不反应
Zn>Cu
Zn>Ag
Na>Zn
Zn + CuSO4
= ZnSO4 + Cu
Zn+2AgNO3
= Zn(NO3)2+2Ag
实验方案 现象 活动性 有关化学方程式
铁丝浸入硫酸铜溶液中
铁丝浸入硝酸银溶液中
铁丝浸入氯化钠溶液中
铁丝表面有紫红色物质析出
铁丝表面有银白色物质析出
不反应
Fe>Cu
Fe>Ag
Fe + CuSO4
= Fe SO4 + Cu
Fe +2AgNO3
= Fe (NO3)2+2Ag
Na> Fe
实验方案 现象 活动性 反应的化学方程式
铜丝浸入硝酸银溶液中
铜丝浸入氯化钠溶液中
铜丝表面有银白色物质析出
不反应
Cu>Ag
Cu +2AgNO3
= Cu (NO3)2+2Ag
Na>Cu
符号:
K Ca Na Mg AI Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
名称:
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢)铜 汞 银 铂 金
金属活动性顺序的理解
(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强;
(2)在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢 ;
(3)在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。
(K、Ca、Na除外!)
1、金属活动性是指金属原子在水溶液中失去电子的能力,金属的位置越靠前,金属在水溶液中就越容易失去电子变成离子,它的活动性就越强。
2、排在氢前面的金属能置换出酸(盐酸、稀硫酸)中的氢,排在氢后面的金属不能置换出酸中的氢;排在前面的金属能将排在后面的金属从它们的盐溶液里置换出来。
金属活动性顺序规律注意事项:
3、K、Ca、Na太活泼,与水反应,不能把排在后面的金属从它们的盐溶液置换出来。
4、Fe若参与反应,一定生成二价铁离子(亚铁离子)
5、在金属活动顺序中距离远的优先置换(例:将铁放在硝酸铜和硝酸银混合溶液中,铁先置换出银)。
通过本课题的学习,我们知道了多数金属能与氧气发生反应,且不同金属的活动性 ;根据金属与酸反应是否有 生成或一种金属能否把另一种金属从它的化合物的溶液中 出来,可以判断出金属活动性的相对强弱。同时,我们也认识了一种新的化学反应类型 。
不同
氢气
置换
置换反应
小 结
一. 金属与氧气的反应
二.金属与稀盐酸、稀硫酸反应( 置换反应 )
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4== FeSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4+ H2 ↑
Mg + 2HCl == MgCl2 + H2 ↑
Mg + H2SO4==MgSO4 + H2 ↑
4Al+3O2=2Al2O3
2Mg+O2=2MgO
3Fe+2 O2 点燃 Fe3O4
===
2Al+3CuSO4==Al2(SO4)3+3Cu
Cu+2AgNO3== Cu(NO3)2+2Ag
三.金属与盐溶液反应
( 置换反应)
四.置换反应:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应
五.金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性,由强逐渐减弱。
【例1】下列化学方程式书写不正确的是( )
A. 4Al+3O2=2Al2O3
B. Cu+ZnSO4=CuSO4+Zn
C. 2Fe+6HCl=2FeCl3+3H2↑
D. Al+3AgNO3=Al(NO3)3+3Ag
【课堂练习】
B C
【例2】如何除去铜粉中混有的少量铁粉?
【解答】方法1.用磁铁吸引,除去铁粉。
方法2.向混合物中加入足量的稀硫酸,待充分反应后过滤,滤出的固体洗涤并干燥,便得到纯净的铜。
Fe+H2SO4=FeSO4+H2↑
方法3.向混合物中加入足量的硫酸铜溶液,待充分反应后过滤,滤出的固体洗涤并干燥,便得到纯净的铜。
Fe+CuSO4=FeSO4+Cu
【例3】有X、Y、Z三种金属,将Y、Z分别放入稀硫酸
中,Y溶解、Z不溶解;将 Z 放入XSO4的溶液里,Z 的
表面有 X 析出。则X、Y、Z三种金属的活动性由强到弱
的顺序是 ( )
A. X>Y>Z B. Y>Z>X
C. Y>X>Z D. X>Z>Y
B
【例4】1.金属X、Y、Z分别是Fe、Al、Cu、Ag中的一种。其中 X 能与稀 H2SO4 反应生成 X2(SO4)3,而 Y、Z 不能与稀H2SO4 反应;Y 能与 AgNO3 溶液反应,而 Z 不能与溶液 AgNO3 反应。则X、Y、Z 依次为( )
A. Fe、Ag、Cu B. Fe、Cu、Ag
C. Al、Cu、Ag D. Al、Ag 、Cu
C
【例5】 2. 要验证镁、铁、铜三种金属的活动性顺序,可用于进行实验的物质( )
A. 铁、铜、氯化镁溶液
B. 铁、氯化铜溶液、氯化镁溶液
C. 镁、铜、氯化亚铁溶液
D. 镁、氯化铜溶液、氯化亚铁溶液
B C
【例6】用实验验证银、铁、铜三种金属的活动性顺序,请写出几种可行方案所需试剂的名称。
方案一:铁、银、硫酸铜溶液
方案二:铜、硫酸亚铁溶液、硝酸银溶液
【思考并讨论】
【例7】把足量的铁粉分别放入到含下列各组物质的
溶液中,充分反应后过滤,滤液中只有一种溶质的
是 ( )
A. ZnSO4、CuSO4 B. H2SO4、CuSO4
C. HCl、 CuSO4 D. AgNO3、Al(NO3)3
B
【例8】在AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有少量金属析出,过滤后向溶液中滴加盐酸时,有白色沉淀生成,则析出的少量金属是 。
Ag
【例1】波尔多液(主要成分为硫酸铜)能否用铁桶或铝桶盛装?
铁或铝都能置换出硫酸铜中的铜,若用铝、铁容器盛装农药波尔多液,会使容器腐蚀,波尔多液农药失效。
Fe+CuSO4=FeSO4+Cu
2Al + 3CuSO4 =Al2(SO4)3+3Cu
<综合能力提高>
【例2】 将铁丝伸入到下列溶液中,金属的质量增重的是 ,溶液的质量增重的是 。
A H2SO4 B HCl C CuSO4 D AgNO3
CD
AB
溶液(或金属)质量增减题
1、等质量的镁、铁、锌,分别放入足量的盐酸中,产生氢气的质量( 纵坐标)与消耗金属的质量(横坐标)之间关系正确的是( )
Zn
Mg
Fe
Zn
Fe
Mg
Mg
Zn
Fe
Zn
Fe
Mg
A
B
C
D
C
图象题
2、等质量的锌和铁分别与足量的稀硫酸反应,能正确表示生成H2的质量(纵坐标)与时间(横坐标)的关系的图象是 ( )
Zn
Zn
Zn
Zn
Fe
Fe
Fe
Fe
A B C D
C
3、等质量的M、N两种金属,分别与相同质量分数的足量
稀盐酸反应(已知M、N在生成物中均为+2价),生成氢
气的质量和反应时间的关系如图所示,M、N两种金属中
较活泼的是 ,相对原子质量较大的是 。
m
N
M
时间 t
(氢气)
M
N
0
在线测试1-3题
挑战自我1-4题
第二节 金属的化学性质
【回顾思考1】镁条在空气中点燃有什么现象?
镁条燃烧,发出耀眼的白光,生成白色粉末氧化镁。
2Mg+O2===2MgO
点燃
金属的化学性质
铁丝在氧气中燃烧
【回顾思考2】铁丝在高温时与氧气的反应
3Fe + 2O2 === Fe3O4
点燃
2Cu + O2 2CuO
铁在氧气中剧烈燃烧,火星四射,生成黑色固体四氧化三铁。
在高温时铜也可以在氧气中燃烧
【活动天地】用滤纸卷上少量铝粉,在酒精灯上点燃,迅速插入盛有氧气的集气瓶中观察有什么现象?
铝粉能在氧气中剧烈燃烧,生成白色粉末氧化铝 。
4Al+3O2===2Al2O3
点燃
【思考讨论1】俗话说“真金不怕火炼”,这说明了什么事实?
在高温条件下金不能和氧气反应。
Au + O2≠
高 温 炼 金
(1) 4Al+3O2=2Al2O3 (2)2Cu+O2 2CuO
(3) 2Mg+O2 == 2MgO (4)Au + O2 →不反应
(5) 3Fe+2O2 == Fe3O4
点燃
【思考讨论2】从以下方程式你能得到哪些信息?
点燃
实验表明,大多数金属都能与氧气发生反应,生成相应的金属氧化物,但反应的难易和剧烈程度是不相同的。
一、金属与氧气的反应
1.常温下易与氧气反应: 以 、 为代表。
2.加热时能与氧气反应:以 、 为代表。
3.高温下也不能与氧气反应:以 为代表。
Mg
Al
Fe
Cu
Au
【结论】金属活动性:
Mg、Al>Fe、Cu>Au
【活动与探究1】探究镁、锌、铁、铜的活动性顺序
很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,也可反映出金属的活泼程度。
A组:把镁、锌、铁、铜分别放入稀盐酸中。
B组:把镁、锌、铁、铜分别放入稀硫酸中。
二、金属与酸的反应
金属活动顺序
反应物 现象 反应的化学方程式
镁与稀盐酸
锌与稀盐酸
铁与稀盐酸
铜与稀盐酸
反应物 现象 反应的化学方程式
镁与稀硫酸
锌与稀硫酸
铁与稀硫酸
铜与稀硫酸
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
不反应
有气泡产生
有气泡产生
有气泡产生
不反应
有气泡产生
有气泡产生
有气泡产生
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
Mg+HCl
Zn+HCl
Fe+HCl
Cu+HCl
金属与酸的反应的剧烈程度
【实验现象】
铜与酸:不反应
铁与酸: 缓慢
锌与酸: 迅速
镁与酸: 剧烈
【探究结论】
1、 并不是所有的金属都能与酸反应,而且反应的剧烈程度也不相同。
2、金属活动性: 。
Mg> Zn> Fe> Cu
二、金属与酸的反应
金属活动性顺序
金属活动性顺序的理解
(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
(2)在金属活动性顺序里,排在氢前面的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。
符号:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
名称:
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢)铜 汞 银 铂 金
挑战自我
【问题1 】 :下列化学反应能发生吗?
Cu + HCl —— CuCl2 + H2↑
Mg + HCl —— MgCl2 + H2↑
Al + HCl —— AlCl3 + H2↑
【问题2 】 :下列化学反应正确吗?
(1)铁 + 盐酸 —— 氯化铁 + 氢气
(2)锌 + 硝酸 —— 硝酸锌 + 氢气
×
应生成氯化亚铁
硝酸具有氧化性,与金属反应不生成氢气。
√
√
×
×
【活动天地】完成下列反应的化学方程式
Fe + HCl
Fe + H2SO4
Al + HCl
Al + H2SO4
2
6
FeCl2 + H2↑
2
FeSO4 + H2 ↑
2AlCl3 + 3H2↑
Al2(SO4)3 + 3H2 ↑
2
3
观察上述反应的化学方程式,分析这些反应有什么共同特点?
单质
化合物
单质
化合物
【置换反应】一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
置换反应特点:A+BC=B+AC
置换反应
二、金属与酸的反应
CO2
C +
O2
点燃
Fe3O4
3Fe +
2O2
点燃
H2O
2H2 +
O2
点燃
2
KClO3 KCl+ O2
2
2
3
↑
MnO2
△
2H2O +
2H2O2
O2↑
MnO2
2Hg +
2HgO
O2↑
△
化合反应
特点:A+B=AB
分解反应
特点:AB=A+B
【复习巩固比较】
CaO + 2HCl = CaCl2 + H2O
NaOH + HCl = NaCl + H2O
Na2CO3 + 2HCl = 2NaCl+CO2↑+H2O
2NaOH + CuCl2 = Cu(OH)2↓+2NaCl
NaCl + AgNO3 = AgCl↓ + NaNO3
复分解反应
复分解反应的特点:AB + CD = CB + AD
【活动天地】
练习1:下列盐能由金属与酸发生置换反应制得的是
( )
A. CuSO4 B. MgCl2
C. FeCl3 D. ZnSO4
练习2:不能由金属跟稀硫酸直接反应而制得的物质是:
( )
A、MgSO4 B、 CuSO4
C、FeSO4 D、Al2(SO4)3
B D
B
【课堂练习】判断下列反应的基本反应类型
1、2Mg+O2==2MgO
2、C+O2==CO2
3、2KClO3 == 2KCl+3O2 ↑
4、Fe+CuSO4 == FeSO4+Cu
5、2H2+O2 == 2H2O
6、H2+CuO == Cu+H2O
7、CuO+H2SO4=CuSO4+H2O
点燃
加热
点燃
点燃
催化剂
加热
化合反应
化合反应
化合反应
分解反应
置换反应
置换反应
复分解反应
【课堂练习】 <综合能力提高>
1、用5.6g不纯的铁(只含一种杂质)跟足量盐酸充分反应,生成0.3g氢气。此不纯铁中含有的杂质可能是
( )
A、镁 B、锌 C、铜 D、银
A
杂质推断题
提示:根据化学方程式计算,可以用平均值方法。
2、在天平两边的烧杯中,分别放入相同质量的稀硫酸,调至平衡,再分别向两边烧杯中各加入等质量的镁和铁(均为不足量),金属完全反应后,天平指针
( )
A 保持平衡,指针不动 B 偏向放镁的一边
C 偏向放铁的一边 D 无法判断
有关天平平衡问题
C
1)、金属与氧气的反应
2)、金属与稀盐酸、稀硫酸的反应
1、金属的化学性质
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
2、金属的活动性顺序
3、置换反应
小 结
【提出问题 】除了金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,可比较金属的活动性以外,还有其他方法吗
三、金属与盐溶液的反应
活动性较强的金属能与酸溶液中的氢离子发生置换反应,NaCl、CaCl2、CuSO4、AgNO3这些盐的溶液中都含有金属离子,这些离子能否与金属发生置换反应呢?
通过盐与金属是否发生置换反应我们也可以比较金属的化学活动性强弱。
【活动与探究2】
探究钠、锌、铁、铜、银的活动性顺序
实验方案 现象 活动性 有关化学方程式
锌片浸入硫酸铜溶液中
锌片浸入硝酸银溶液中
锌片浸入氯化钠溶液中
锌片表面有紫红色物质析出
锌片表面有银白色物质析出
不反应
Zn>Cu
Zn>Ag
Na>Zn
Zn + CuSO4
= ZnSO4 + Cu
Zn+2AgNO3
= Zn(NO3)2+2Ag
实验方案 现象 活动性 有关化学方程式
铁丝浸入硫酸铜溶液中
铁丝浸入硝酸银溶液中
铁丝浸入氯化钠溶液中
铁丝表面有紫红色物质析出
铁丝表面有银白色物质析出
不反应
Fe>Cu
Fe>Ag
Fe + CuSO4
= Fe SO4 + Cu
Fe +2AgNO3
= Fe (NO3)2+2Ag
Na> Fe
实验方案 现象 活动性 反应的化学方程式
铜丝浸入硝酸银溶液中
铜丝浸入氯化钠溶液中
铜丝表面有银白色物质析出
不反应
Cu>Ag
Cu +2AgNO3
= Cu (NO3)2+2Ag
Na>Cu
符号:
K Ca Na Mg AI Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
名称:
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢)铜 汞 银 铂 金
金属活动性顺序的理解
(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强;
(2)在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢 ;
(3)在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。
(K、Ca、Na除外!)
1、金属活动性是指金属原子在水溶液中失去电子的能力,金属的位置越靠前,金属在水溶液中就越容易失去电子变成离子,它的活动性就越强。
2、排在氢前面的金属能置换出酸(盐酸、稀硫酸)中的氢,排在氢后面的金属不能置换出酸中的氢;排在前面的金属能将排在后面的金属从它们的盐溶液里置换出来。
金属活动性顺序规律注意事项:
3、K、Ca、Na太活泼,与水反应,不能把排在后面的金属从它们的盐溶液置换出来。
4、Fe若参与反应,一定生成二价铁离子(亚铁离子)
5、在金属活动顺序中距离远的优先置换(例:将铁放在硝酸铜和硝酸银混合溶液中,铁先置换出银)。
通过本课题的学习,我们知道了多数金属能与氧气发生反应,且不同金属的活动性 ;根据金属与酸反应是否有 生成或一种金属能否把另一种金属从它的化合物的溶液中 出来,可以判断出金属活动性的相对强弱。同时,我们也认识了一种新的化学反应类型 。
不同
氢气
置换
置换反应
小 结
一. 金属与氧气的反应
二.金属与稀盐酸、稀硫酸反应( 置换反应 )
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4== FeSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4+ H2 ↑
Mg + 2HCl == MgCl2 + H2 ↑
Mg + H2SO4==MgSO4 + H2 ↑
4Al+3O2=2Al2O3
2Mg+O2=2MgO
3Fe+2 O2 点燃 Fe3O4
===
2Al+3CuSO4==Al2(SO4)3+3Cu
Cu+2AgNO3== Cu(NO3)2+2Ag
三.金属与盐溶液反应
( 置换反应)
四.置换反应:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应
五.金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性,由强逐渐减弱。
【例1】下列化学方程式书写不正确的是( )
A. 4Al+3O2=2Al2O3
B. Cu+ZnSO4=CuSO4+Zn
C. 2Fe+6HCl=2FeCl3+3H2↑
D. Al+3AgNO3=Al(NO3)3+3Ag
【课堂练习】
B C
【例2】如何除去铜粉中混有的少量铁粉?
【解答】方法1.用磁铁吸引,除去铁粉。
方法2.向混合物中加入足量的稀硫酸,待充分反应后过滤,滤出的固体洗涤并干燥,便得到纯净的铜。
Fe+H2SO4=FeSO4+H2↑
方法3.向混合物中加入足量的硫酸铜溶液,待充分反应后过滤,滤出的固体洗涤并干燥,便得到纯净的铜。
Fe+CuSO4=FeSO4+Cu
【例3】有X、Y、Z三种金属,将Y、Z分别放入稀硫酸
中,Y溶解、Z不溶解;将 Z 放入XSO4的溶液里,Z 的
表面有 X 析出。则X、Y、Z三种金属的活动性由强到弱
的顺序是 ( )
A. X>Y>Z B. Y>Z>X
C. Y>X>Z D. X>Z>Y
B
【例4】1.金属X、Y、Z分别是Fe、Al、Cu、Ag中的一种。其中 X 能与稀 H2SO4 反应生成 X2(SO4)3,而 Y、Z 不能与稀H2SO4 反应;Y 能与 AgNO3 溶液反应,而 Z 不能与溶液 AgNO3 反应。则X、Y、Z 依次为( )
A. Fe、Ag、Cu B. Fe、Cu、Ag
C. Al、Cu、Ag D. Al、Ag 、Cu
C
【例5】 2. 要验证镁、铁、铜三种金属的活动性顺序,可用于进行实验的物质( )
A. 铁、铜、氯化镁溶液
B. 铁、氯化铜溶液、氯化镁溶液
C. 镁、铜、氯化亚铁溶液
D. 镁、氯化铜溶液、氯化亚铁溶液
B C
【例6】用实验验证银、铁、铜三种金属的活动性顺序,请写出几种可行方案所需试剂的名称。
方案一:铁、银、硫酸铜溶液
方案二:铜、硫酸亚铁溶液、硝酸银溶液
【思考并讨论】
【例7】把足量的铁粉分别放入到含下列各组物质的
溶液中,充分反应后过滤,滤液中只有一种溶质的
是 ( )
A. ZnSO4、CuSO4 B. H2SO4、CuSO4
C. HCl、 CuSO4 D. AgNO3、Al(NO3)3
B
【例8】在AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有少量金属析出,过滤后向溶液中滴加盐酸时,有白色沉淀生成,则析出的少量金属是 。
Ag
【例1】波尔多液(主要成分为硫酸铜)能否用铁桶或铝桶盛装?
铁或铝都能置换出硫酸铜中的铜,若用铝、铁容器盛装农药波尔多液,会使容器腐蚀,波尔多液农药失效。
Fe+CuSO4=FeSO4+Cu
2Al + 3CuSO4 =Al2(SO4)3+3Cu
<综合能力提高>
【例2】 将铁丝伸入到下列溶液中,金属的质量增重的是 ,溶液的质量增重的是 。
A H2SO4 B HCl C CuSO4 D AgNO3
CD
AB
溶液(或金属)质量增减题
1、等质量的镁、铁、锌,分别放入足量的盐酸中,产生氢气的质量( 纵坐标)与消耗金属的质量(横坐标)之间关系正确的是( )
Zn
Mg
Fe
Zn
Fe
Mg
Mg
Zn
Fe
Zn
Fe
Mg
A
B
C
D
C
图象题
2、等质量的锌和铁分别与足量的稀硫酸反应,能正确表示生成H2的质量(纵坐标)与时间(横坐标)的关系的图象是 ( )
Zn
Zn
Zn
Zn
Fe
Fe
Fe
Fe
A B C D
C
3、等质量的M、N两种金属,分别与相同质量分数的足量
稀盐酸反应(已知M、N在生成物中均为+2价),生成氢
气的质量和反应时间的关系如图所示,M、N两种金属中
较活泼的是 ,相对原子质量较大的是 。
m
N
M
时间 t
(氢气)
M
N
0
在线测试1-3题
挑战自我1-4题
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
