4.4化学式与化合价练习题--2021-2022学年九年级化学人教版上册(含解析)
文档属性
| 名称 | 4.4化学式与化合价练习题--2021-2022学年九年级化学人教版上册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 234.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-26 21:51:47 | ||
图片预览



文档简介
绝密★启用前
4.4化学式与化合价
未命名
考试时间:60分钟;命题人:吴华
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
未命名
一、单选题
1.在N2、N2O(俗称笑气)、N2H4(中文名为肼,又称联氨、二铵)三种物质中,都含有
A.两个氮原子 B.一个氮分子 C.氮元素 D.氮气
2.下列化学符号与含义相符的是
A.5SO3——5个三氧化硫分子 B.4OH-1——4个氢氧根离子
C.KCl2——氯化钾 D.Cl2——两个氯原子
3.下列有关尿素[CO(NH2)2]的说法,错误的是
A.它是一种化合物
B.尿素分子中碳、氢原子个数比为1:4
C.尿素由碳、氧、氮、氢四种元素组成
D.尿素中氮元素的质量分数
4.下列化学用语中,正确的是
A.两个氢原子H2 B.氧化钠:Na2O
C.2个硫酸根离子: D.+2价的铁元素:Fe2+
5.化学符号是学习化学的重要工具。下列对①~⑥所示化学符号的意义叙述正确的是
①Ne ②Fe ③Fe2+ ④H2O2 ⑤NaCl ⑥
A.④表示H2O2分子中含有氢分子和氧分子
B.能表示一个原子的是①②,表示一个分子的是④⑤
C.②和③属于同种元素,但是它们的化学性质不同
D.③⑥表示离子,其中③表示亚铁离子,⑥表示三氧化硫离子
6.甲醛(HCHO)是一种无色,有强烈刺激性气味的气体,具有致癌性、属于高毒物,易溶于水,35%~40%的甲醛水溶液叫福尔马林。下列有关甲醛的说法正确的是
A.甲醛分子中碳、氧、氢原子的个数比为1:2:1
B.甲醛分子中碳、氧元素的质量比为3:4
C.甲醛是由C、H、O三种原子构成的化合物
D.甲醛分子中的质子和电子数目相等
7.下列有关化学用语中,数字“2”的说法正确的是
①2Al ②3Zn2+③H2O ④ ⑤2O3⑥3 ⑦N2O5
A.表示分子个数的是①⑤ B.表示离子个数的是②⑥
C.表示分子中原子个数的③⑦ D.表示离子所带电荷数的是④⑥
8.有趣的“纳米小人”是一系列结构式与人体相似的有机分子(化学式C39H42O2),是由莱斯大学的詹姆斯 托尔等人设计并合成分子,用于对年轻学生的化学教育,下列关于它的说法中正确的是
A.“纳米小人”属于氧化物
B.“纳米小人”是由碳、氢两个元素组成的
C.“纳米小人”中氢、氧元素的质量比为21:16
D.“纳米小人”的相对分子质量为542g
9.尿素是氮肥中最主要的一种,其化学式为CO(NH2)2.下列关于尿素的说法正确的是
A.尿素是氧化物
B.尿素中含有一氧化碳分子
C.尿素分子由四种元素组成
D.尿素分子中碳、氢、氧、氮的原子个数比为1∶4∶1∶2
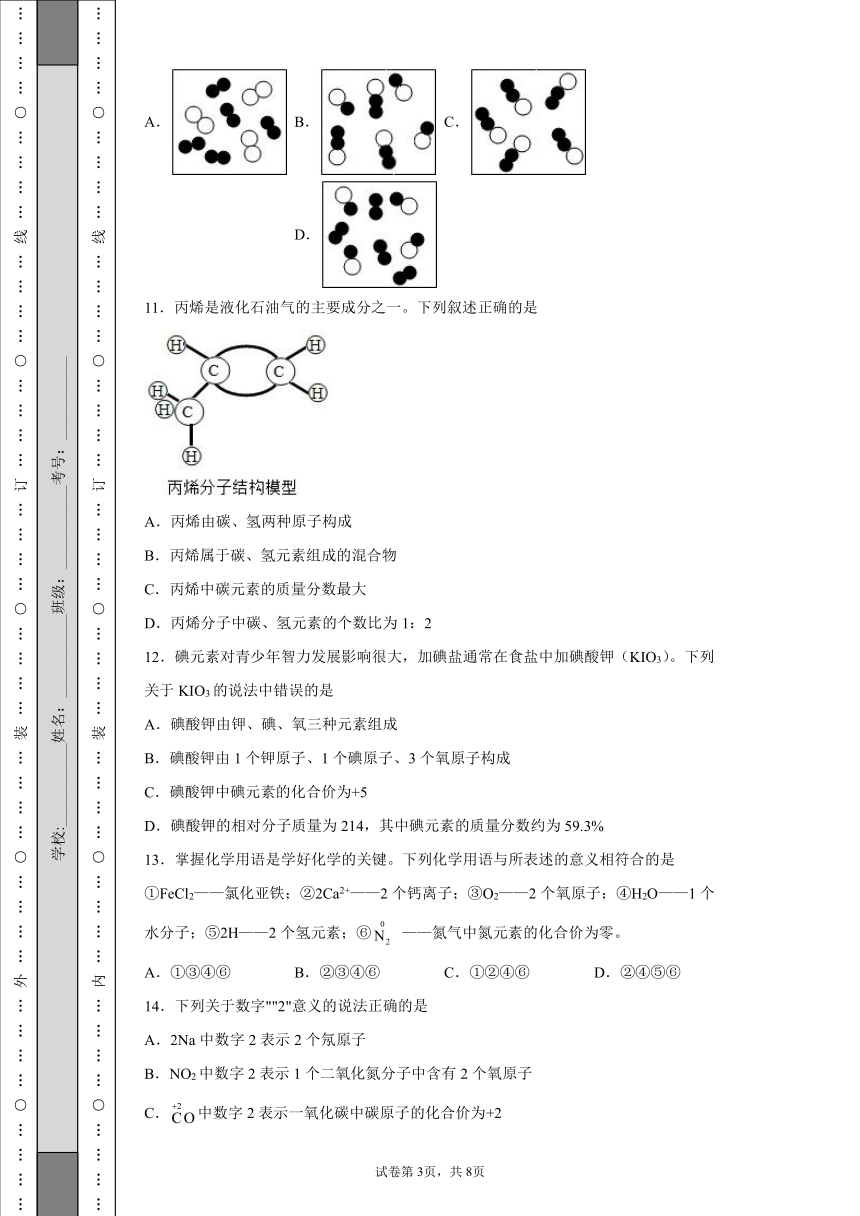
10.下列各图中“○”和“●”分别表示两种质子数不同的原子,其中能表示由两种化合物组成的混合物的图是
A. B. C. D.
11.丙烯是液化石油气的主要成分之一。下列叙述正确的是
A.丙烯由碳、氢两种原子构成
B.丙烯属于碳、氢元素组成的混合物
C.丙烯中碳元素的质量分数最大
D.丙烯分子中碳、氢元素的个数比为1:2
12.碘元素对青少年智力发展影响很大,加碘盐通常在食盐中加碘酸钾(KIO3)。下列关于KIO3的说法中错误的是
A.碘酸钾由钾、碘、氧三种元素组成
B.碘酸钾由1个钾原子、1个碘原子、3个氧原子构成
C.碘酸钾中碘元素的化合价为+5
D.碘酸钾的相对分子质量为214,其中碘元素的质量分数约为59.3%
13.掌握化学用语是学好化学的关键。下列化学用语与所表述的意义相符合的是
①FeCl2——氯化亚铁;②2Ca2+——2个钙离子;③O2——2个氧原子;④H2O——1个水分子;⑤2H——2个氢元素;⑥ ——氮气中氮元素的化合价为零。
A.①③④⑥ B.②③④⑥ C.①②④⑥ D.②④⑤⑥
14.下列关于数字""2"意义的说法正确的是
A.2Na中数字2表示2个氖原子
B.NO2中数字2表示1个二氧化氮分子中含有2个氧原子
C.中数字2表示一氧化碳中碳原子的化合价为+2
D.S2-中数字2表示是硫离子带2个负电荷
第II卷(非选择题)
未命名
二、填空题
15.说出下列化学符号所表示的意义
(1)2N______;
(2)______;
(3)______;
(4)SiO2______。
16.请结合化学式的意义,将对“SO2”的认识填写完整:①②③④
①_________;
②___________;
③_________ ;
④________。
17.生活离不开化学,学好基础是进入化学大门的钥匙。
(1)用化学符号填空:
①地壳中含量最高的非金属元素_______;②3个铁原子_______;
③n个铝离子_______;④氩元素_______;
⑤2个氧气分子_______;⑥空气中含量最高的气体_______;
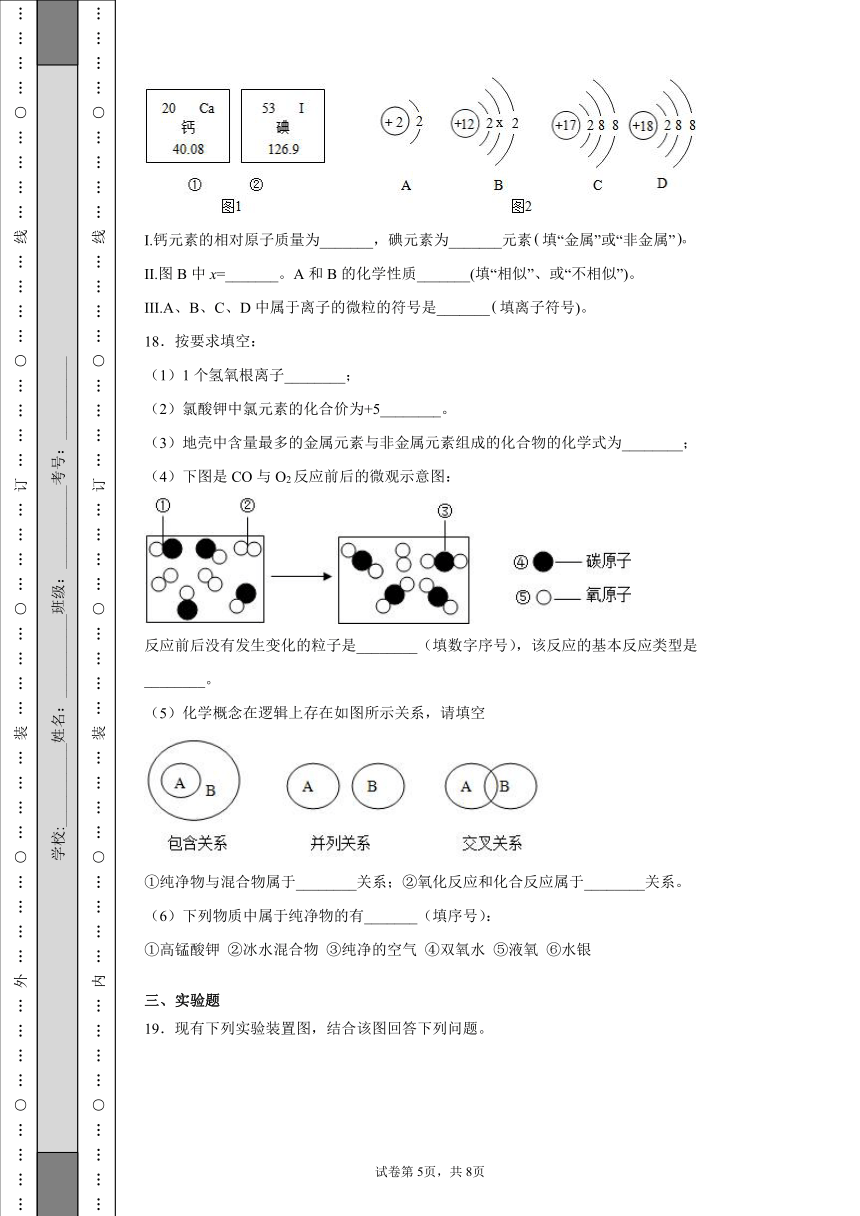
(2)图①、②是钙元素、碘元素在元素周期表中的信息,A B C D是四种粒子的结构示意图。
I.钙元素的相对原子质量为_______,碘元素为_______元素填“金属”或“非金属”
II.图B中x=_______。A和B的化学性质_______(填“相似”、或“不相似”)。
III.A、B、C、D中属于离子的微粒的符号是_______填离子符号)。
18.按要求填空:
(1)1个氢氧根离子________;
(2)氯酸钾中氯元素的化合价为+5________。
(3)地壳中含量最多的金属元素与非金属元素组成的化合物的化学式为________;
(4)下图是CO与O2反应前后的微观示意图:
反应前后没有发生变化的粒子是________(填数字序号),该反应的基本反应类型是________。
(5)化学概念在逻辑上存在如图所示关系,请填空
①纯净物与混合物属于________关系;②氧化反应和化合反应属于________关系。
(6)下列物质中属于纯净物的有_______(填序号):
①高锰酸钾 ②冰水混合物 ③纯净的空气 ④双氧水 ⑤液氧 ⑥水银
三、实验题
19.现有下列实验装置图,结合该图回答下列问题。
(1)写出图中标号仪器的名称:①_______;②_______;③_______;
(2)实验室若用分解过氧化氢溶液的方法来制取氧气,可以选用的发生装置为_______(填装置序号);若用F装置装满水来收集氧气,氧气应该从_______(填“a”或“b”)端通入。
(3)若用加热高锰酸钾的方法制取氧气,反应的符号表达式_______,则可选用的发生和收集装置组合为_______(填装置序号),试管口放一团棉花,是为了防止加热时试管内_______进入导管;
(4)查阅资料得知:氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,其水溶液称为氨水;实验室用加热氯化铵和氢氧化钙两种固体混合物来制备氨气。则实验室制取氨气的装置组合可以选用_______(填装置序号)。
20.探究氧气的实验室制取和性质。
(1)图2是实验室制取气体的部分装置。
①实验室用高锰酸钾制氧气的发生装置是_____(填字母序号),试管口还要放一团棉花,目的是_______。还可用过氧化氢溶液和二氧化锰制氧气,选择的发生装置是______,反应的文字表达式为_______。
②收集较纯净的氧气可选用装置_______,选择F装置收集氧气,氧气从_______(选填a或者b)进入。
③氨气极易溶于水,且密度比空气小,实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,选用的发生装置是_______,收集装置是_______;
④注射器可用于检查装置B的气密性,步骤如下:向锥形瓶中加入少量水至_______,将注射器连接到装置B的导管口处,缓慢拉动注射器的活塞,观察到_______,表示装置B的气密性良好。
(2)如图1是硫在氧气中燃烧的实验。
①反应的符号表达式为______;②集气瓶底加水的作用是______。
四、推断题
21.已知A、B、C、D、E是初中化学常见的五种不同物质,其中A在空气中的含量为,B、D在常温下均为液体,且组成元素相同,C是密度最小的气体,反应会发出明亮的淡蓝色火焰,E是一种刺激性气味的气体。说明:“”表示可以发生反应,“”表示可以转化。根据如图所示关系,回答下列问题:
(1)写出有关物质的化学式:D______E______。
(2)写出AE的符号表达式______。
(3)C→B的符号表达式______,基本反应类型为______,C作为燃料的优点是______。
22.如图是一些常见物质之间的转化关系,其中A是能使带火星木条复燃的气体;B在反应前后其质量和化学性质都不发生变化;E是生活中常见的金属单质,E在气体A中的燃烧时火星四射,生成黑色固体。
请回忆所学内容,回答下列问题:
(1)写出物质:M(化学式)______;N(名称)________。
(2)写出反应③的符号表达式:__________。
(3)化合物D是由____(填“分子”、“原子”、“离子”)构成的。
(4)反应____(填序号①~⑤)在实验室常用来验证某气体是否为二氧化碳。
(5)实际上Fe3O4中铁元素呈+2、+3价,我们可以将Fe3O4写成 FeO. Fe2O3;以后我们还会知道,Fe3O4也可以写(Fe(Fe2O4)),则在()中,带“△”号的Fe的化合价为________价。
五、计算题
23.青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物主要是尿素[CO(NH2)2]。若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g。计算:
(1)尿素中氮元素的质量分数______。
(2)30g尿素中含氮元素的质量______。
(3)已知蛋白质中氮元素的平均质量分数为16%,则每人每天至少应从食物里摄取的蛋白质为______克。
试卷第2页,共2页
试卷第1页,共1页
参考答案
1.C
【详解】
物质由元素组成,N2、N2O、N2H4都含氮元素,故选C。
2.A
【详解】
A、5SO3表示三氧化硫分子,正确。
B、4个氢氧根离子表示为4OH-,错误。
C、氯化钾的化学式是KCl,错误。
D、Cl2是氯气的化学式,可以表示氯气,1个氯气分子。错误。
故选A。
【点睛】
3.D
【详解】
A、尿素[CO(NH2)2]是由多种元素组成的纯净物,属于化合物,故选项说法正确;
B、由尿素的化学式可知,一个尿素分子中含有1个碳原子、4个氢原子,则尿素分子中碳、氢原子个数比为1:4,故选项说法正确;
C、由尿素的化学式可知,尿素由碳、氧、氮、氢四种元素组成,故选项说法正确。
D、尿素中氮元素的质量分数为,故选项说法错误。
故选:D。
4.B
【详解】
A、原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故2个氢原子可表示为:2H,故选项错误;
B、氧化钠是由钠离子和阳离子构成的,化学式为Na2O,故选项正确;
C、离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,故2个硫酸根离子可表示为:2SO42-,故选项错误;
D、由化合价的表示方法可知,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故+2价的铁元素可表示为: ,故选项错误。
故选B。
5.C
【详解】
A、④表示分子中有氢原子和氧原子,故A错误;
B、⑤氯化钠是由离子构成的,所以不能用来表示一个分子,故B错误;
C、②和③都是铁元素,但是它们的化合价不一样,最外层电子数不同,所以它们的化学性质也不同,故C正确;
D、⑥表示的是亚硫酸根离子,故D错误;
故选C。
6.D
【详解】
A、由甲醛化学式可知,1个甲醛分子由1个碳原子、1个氧原子和2个氢原子构成,所以甲醛分子中碳、氧、氢原子的个数比为1:1:2,选项说法不正确;
B、分子是微观概念,元素是宏观概念,不能用宏观来解释微观,选项说法不正确;
C、甲醛是由分子构成的,不是由原子直接构成的,选项说法不正确;
D、由甲醛的化学式HCHO可知,一个甲醛分子中含有1×2+6+8=16个质子,也有16个电子,选项说法正确。
故选D。
7.C
【分析】
①元素符号前面的数字表示原子个数,故2Al表示2个铝原子;
②位于离子符号中元素或原子团的右上角,表示一个离子所带的电荷数。故3Zn2+中的“2”表示1个锌离子带2个单位的正电荷;
③位于化学式中元素符号(或原子团)的右下角,表示一个分子中所含的原子或原子团的个数。故H2O中的“2”表示1个水分子中含有2个氢原子;
④位于元素或原子团的正上方,表示元素或原子团的化合价,故中的“2”表示氧化镁中镁元素的化合价为+2价;
⑤化学式前面的数字表示分子个数,故2O3表示2个臭氧分子;
⑥位于离子符号中元素或原子团的右上角,表示一个离子所带的电荷数。故3中的“2”表示1个硫酸根离子带2个单位的负电荷;
⑦位于化学式中元素符号(或原子团)的右下角,表示一个分子中所含的原子或原子团的个数。故N2O5中的“2”表示1个五氧化二氮分子中含2个氮原子。
【详解】
A、由分析可知,表示分子个数的是⑤,不符合题意;
B、由分析可知,②⑥中的“2”表示的是1个离子所带的电荷数,不符合题意;
C、由分析可知,表示分子中原子个数的③⑦,符合题意;
D、由分析可知,表示离子所带电荷数的是②⑥,不符合题意。
故选C。
8.C
【详解】
A、“纳米小人”是由三种元素组成,不属于氧化物,故选项说法错误;
B、“纳米小人”是由碳、氢两种元素组成的,元素只讲种类、不讲个数,故选项说法错误;
C、“纳米小人”中氢、氧元素的质量比为(1×42):(16×2)=21:16,故选项说法正确;
D、“纳米小人”的相对分子质量为12×39+1×42+16×2=542,其单位为“1”,不是质量的单位,故选项说法错误。
故选:C。
9.D
【详解】
A、氧化物是含有两种元素一种为氧元素的化合物;尿素中含有三种元素,不是氧化物,错误;
B、尿素是由尿素分子构成的,不含一氧化碳分子,错误;
C、尿素分子是由原子构成的,错误;
D、尿素分子中碳、氢、氧、氮的原子个数比为1∶(1×2×2)∶1∶(1×2)=1∶4∶1∶2,正确。
故选D。
10.B
【详解】
A、由图可知,该物质由两种分子构成,属于混合物,且这两种分子均由同种原子构成,均属于单质,不符合题意;
B、由图可知,该物质由两种分子构成,属于混合物,且这两种分子均由两种原子构成,均属于化合物,符合题意;
C、由图可知,该物质由同种分子构成,属于纯净物,不符合题意;
D、由图可知,该物质由两种分子构成,且其中一种分子由同种原子构成,属于单质,其中一种分子由两种原子构成,属于化合物,不符合题意。
故选B。
11.C
【详解】
由所给结构模型可知丙烯的分子式为C3H6
A.由化学式可知,丙烯由碳、氢两种元素组成,选项A错误;
B.由化学式可知,丙烯由碳、氢两种元素组成纯净物,选项B错误;
C.由分子式算出丙烯中碳元素和氢元素的质量之比为(12×3):(1×6)=6:1,则碳原子的质量分数最大,选项C正确;
D.丙烯分子中碳原子和氢原子的个数之比为1:2,而不是碳元素和氢元素的个数比。元素属于宏观概念,元素不讲个数。选项D错误。
故选C。
12.B
【详解】
A.由碘酸钾的化学式知:碘酸钾由钾、碘、氧三种元素组成,说法正确,故不符合题意;
B.一个碘酸钾分子是由1个钾原子、1个碘原子、3个氧原子构成,原说法错误,故符合题意;
C.由化学式再根据钾元素显+1价,氧元素显-2价,可利用化合物中各元素化合价代数和为0求出碘元素的化合价为+5价,说法正确,故不符合题意;
D.因碘酸钾的相对分子质量为214,其中碘元素的质量分数为×100%≈59.3%,说法正确,故不符合题意。
故选B。
13.C
【详解】
①FeCl2中Fe显+2价是亚铁离子,所以其名称是氯化亚铁,正确;
②Ca2+表示钙离子,前面加上2表示2个钙离子,正确;
③O2表示1个氧分子或氧气,不能表示2个氧原子,错误;
④H2O表示1个水分子或水,正确;
⑤2H表示2个氢原子,元素不分个数,只分种类,不能表示2个氢元素,错误;
⑥化合价标注在对应元素符号上方,所以表示氮分子中氮元素显0价,正确。
正确的有①②④⑥,故选C。
14.B
【详解】
A.2Na中数字2表示2个钠原子,选项A错;
B.NO2中数字2表示1个二氧化氮分子中含有2个氧原子,选项B正确;
C.中数字2表示一氧化碳中碳元素的化合价为+2,不是碳原子,选项C错;
D.S2-中数字2表示是一个硫离子带2个单位的负电荷,选项D错;
故选B
15.
(1)2个氮原子
(2)1个铵根离子
(3)硫元素的化合价为-2价
(4)二氧化硅
【解析】
(1)
元素符号前面的数字表示原子个数,2N表示2个氮原子,故填:2个氮原子;
(2)
由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,故可表示为1个铵根离子,故填:1个铵根离子;
(3)
由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,1不能省略,故可表示为硫元素的化合价为-2价,故填:硫元素的化合价为-2价;
(4)
SiO2从右读到左,读作二氧化硅,故填:二氧化硅。
16.二氧化硫 二氧化硫分子 硫元素和氧元素 一个硫原子和两个氧原子
【分析】
根据化学式的意义:从宏观的角度分析,可以表示为一种物质;表示该物质的元素组成;从微观角度分析:表示该物质的一个分子;表示该物质的分子构成。
【详解】
①SO2表示为二氧化硫这种物质,故填:二氧化硫;
②SO2表示为一个二氧化硫分子,故填:二氧化硫分子;
③SO2表示为二氧化硫由硫元素和氧元素组成,故填:硫元素和氧元素;
④SO2表示为一个二氧化硫由一个硫原子和两个氧原子构成,故填:一个硫原子和两个氧原子。
17.
(1) O 3Fe nAl3+ Ar 2O2 N2
(2) 40.08 非金属 8 不相似 Cl-
【分析】
(1)
①地壳中含量前四位的元素依次为氧、硅、铝、铁,则含量最高的非金属元素是氧元素,故填O;
②几个某微粒在微粒前加数字,故填3Fe;
③几个某微粒在微粒前加数字,故填nAl3+;
④元素用元素符号表示,故填Ar;
⑤几个某微粒在微粒前加数字,故填2O2;
⑥空气中按体积计算氮气约为78%,氧气约为21%,稀有气体约为0.94%,二氧化碳及其它各约为0.03%,故空气中含量最高的气体为氮气,故填N2。
(2)
Ⅰ从元素周期表中的信息可知,钙元素的相对原子质量为40.08,故填40.08;
碘元素为非金属元素,故选非金属。
Ⅱ原子结构示意图核外电子分层排布,由里向外第一层最多排2个电子,第二层最多排8个电子,最外层不超过8个电子,x处于第二层,故x=8;
最外层电子数决定元素原子的化学性质,A和B最外层虽然都是2个电子,但A只有一个电子层,是相对稳定结构,B不是相对稳定结构,所以A和B的化学性质不相似,故选不相似。
Ⅲ离子是带电的原子,所以正电荷数不等于负电荷数,C中正电荷数小于负电荷数,故C属于氯离子,其离子符号为Cl-。
18.
(1)OH-
(2)
(3)Al2O3
(4) ④⑤ 化合反应
(5) 并列 交叉
(6)①②⑤⑥
【分析】
(1)
离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个该离子,就在其元素符号前加上相应的数字,故一个氢氧根离子可表示为:OH-;
(2)
元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氯酸钾中氯元素的化合价为+5价,故可表示为:
(3)
地壳中含量最多的金属元素是铝元素,非金属元素是氧元素,组成的化合物的氧化铝,化学式为:Al2O3;
(4)
分解微观示意图可知,反应前后没有发生变化的是碳原子和氧原子,故填:④⑤,该反应生两种物质生成另外一种物质的反应,属于化合反应;
(5)
①纯净物只含有1种物质,混合物含有多种物质,属于并列关系;
②氧化反应是物质与氧发生的反应,化合反应是多种物质生成1种物质的反应,属于交叉关系;
(6)
①高锰酸钾是由一种物质组成的,属于纯净物, ②冰水混合物中只含有一种物质水分子,属于纯净物, ③纯净的空气中含有氧气、氮气、二氧化氮等,属于混合物, ④双氧水是由过氧化氢和水混合而成的,属于混合物, ⑤液氧是由一种物质氧气组成的,属于纯净物, ⑥水银是由一种物质组成的,属于纯净物,故填:①②⑤⑥。
【点睛】
19.
(1) 铁架台 水槽 集气瓶
(2) A a
(3) KMnO4K2MnO4+MnO2+O2 BD或BE或BF 粉末状物质
(4)BC或BF
【分析】
(1)
由图可知,仪器①的名称为铁架台,仪器②的名称为水槽,仪器③的名称为集气瓶,故填:铁架台;水槽;集气瓶;
(2)
用分解过氧化氢溶液的方法来制取氧气,属于固液常温型,选择的发生装置为A,氧气的密度比水小,若用F装置装满水来收集氧气,氧气应该从a端通入,故填:A;a;
(3)
高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的符号表达式为KMnO4K2MnO4+MnO2+O2,该反应属于固-固加热型,选择的发生装置为B,氧气不易溶于水,密度比空气大,可采用排水法或向上排空气法收集,选择的收集装置为D或E或F;试管口放一团棉花,是为了防止加热时试管内粉末状物质进入导管,故填:KMnO4K2MnO4+MnO2+O2;BD或BE或BF;粉末状物质;
(4)
实验室用加热氯化铵和氢氧化钙两种固体混合物来制备氨气,属于固固加热型,选择的发生装置为B,氨气密度比空气小,极易溶于水,只能用向下排空气法收集,选择的收集装置为C或F,故填:BC或BF。
20.
(1) A 防止加热时,试管内粉末状物质随气流进入导管 B
C b A E 浸没长颈漏斗下端管口, 长颈漏斗下端有气泡冒出
(2)
吸收二氧化硫,防止污染空气
【分析】
(1)
①实验室用高锰酸钾制氧气,属于固体加热反应,发生装置可选A;
试管口还要放一团棉花,目的是:防止加热时,高锰酸钾粉末随气流进入导管;
用过氧化氢溶液和二氧化锰制氧气,属于固液不加热反应,发生装置可选B;
过氧化氢在二氧化锰的催化下分解为水和氧气,该反应的文字表达式为:;
②氧气不易溶于水,密度比空气大,可用排水法或向上排空气法收集,排水法收集的氧气比较纯净,故收集装置可选C;
氧气的密度比空气大,选择F装置收集氧气,氧气从b进入;
③实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,属于固体加热反应,发生装置可选A;氨气极易溶于水,且密度比空气小,可用向下排空气法收集,收集装置可选E;
④向锥形瓶中加入少量水至浸没长颈漏斗下端管口,将注射器连接到装置B的导管口处,缓慢拉动注射器的活塞,装置内压强减小,故观察到长颈漏斗下端有气泡冒出,表示装置B的气密性良好;
(2)
①硫在氧气中燃烧生成二氧化硫,该反应的符号表达式为:;
②硫在氧气中燃烧生成二氧化硫,二氧化硫有毒,散逸到空气中,会污染空气,二氧化硫能与水反应,故水的作用是:吸收二氧化硫,防止污染空气。
21.
(1) H2O2 SO2
(2)S+O2SO2
(3) H2+O2H2O(或H2+CuOCu+H2O) 化合反应(或置换反应) 热值高(或无污染)
【分析】
A在空气中的含量为,B、D在常温下均为液体,且组成元素相同,C是密度最小的气体,过氧化氢在二氧化锰的催化作用下生成水和氧气,则A为氧气,B为水,C为氢气,D为过氧化氢;反应会发出明亮的淡蓝色火焰,E是一种刺激性气味的气体,则E为二氧化硫,代入检验,验证合理;
(1)
由分析可知,D为过氧化氢,其化学式为H2O2,E为二氧化硫,其化学式为SO2,故填:H2O2;SO2;
(2)
A→E,即硫与空气中燃烧生成二氧化硫,反应的符号表达式为S+O2SO2,故填:S+O2SO2;
(3)
C→B,即氢气与氧气在点燃的条件下生成水(或氢气与氧化铜在加热的条件下生成铜和水),反应的符号表达式为H2+O2H2O(或H2+CuOCu+H2O),该反应符合“多变一”的特点(或符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的特点),属于化合反应(或置换反应),氢气本身无毒,完全燃烧放出的热量 约为同质量甲烷的两倍多,且燃烧后的产物是水,不污染空气,故填:H2+O2H2O(或H2+CuOCu+H2O);化合反应(或置换反应);热值高(或无污染)。
22.
(1) KMnO4 氯酸钾
(2)
(3)离子
(4)⑤
(5)+3
【分析】
A是能使带火星木条复燃的气体,则A是氧气,E是生活中常见的金属单质,E在气体氧气中的燃烧时火星四射,生成黑色固体,则E是铁,I是四氧化三铁;H能使澄清石灰水变浑浊,则H是二氧化碳,F与氧气在点燃的条件下生成二氧化碳,则F可以是碳,B在反应前后其质量和化学性质都不发生变化,N和B加热会生成氧气,所以B是二氧化锰,N是氯酸钾,D是氯化钾,M加热会生成二氧化锰和氧气,所以M是高锰酸钾,C是锰酸钾,经过验证,推导正确。
(1)
由上述分析可知,M是高锰酸钾,其化学式为KMnO4,N是氯酸钾,故填:KMnO4;氯酸钾;
(2)
反应③即铁在氧气燃烧生成四氧化三铁,反应的符号表达式,故填:;
(3)
由上述分析可知,化合物D是KCl,是由钾离子和氯离子构成,故填:离子;
(4)
实验室检验二氧化碳是利用二氧化碳能使澄清的石灰水变浑浊,故反应⑤在实验室常用来验证某气体是否为二氧化碳,故填:⑤;
(5)
Fe3O4中氧元素化合价为-2价,根据化合物中各元素化合价代数和为0,则在【】中带“△”的Fe的化合价与Fe2O3中铁元素化合价相同,故化合价为+3价,故填:+3。
23.
(1) 46.7%;
(2)30g×=14g;
(3)解:设每人每天至少应从食物里摄取的蛋白质的质量为x
x×16%=14g,
x=87.5g,
答:每人每天至少应从食物里摄取的蛋白质为87.5克。
【分析】
(1)
见答案。
(2)
见答案。
(3)
见答案。答案第1页,共2页
答案第1页,共2页
4.4化学式与化合价
未命名
考试时间:60分钟;命题人:吴华
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
未命名
一、单选题
1.在N2、N2O(俗称笑气)、N2H4(中文名为肼,又称联氨、二铵)三种物质中,都含有
A.两个氮原子 B.一个氮分子 C.氮元素 D.氮气
2.下列化学符号与含义相符的是
A.5SO3——5个三氧化硫分子 B.4OH-1——4个氢氧根离子
C.KCl2——氯化钾 D.Cl2——两个氯原子
3.下列有关尿素[CO(NH2)2]的说法,错误的是
A.它是一种化合物
B.尿素分子中碳、氢原子个数比为1:4
C.尿素由碳、氧、氮、氢四种元素组成
D.尿素中氮元素的质量分数
4.下列化学用语中,正确的是
A.两个氢原子H2 B.氧化钠:Na2O
C.2个硫酸根离子: D.+2价的铁元素:Fe2+
5.化学符号是学习化学的重要工具。下列对①~⑥所示化学符号的意义叙述正确的是
①Ne ②Fe ③Fe2+ ④H2O2 ⑤NaCl ⑥
A.④表示H2O2分子中含有氢分子和氧分子
B.能表示一个原子的是①②,表示一个分子的是④⑤
C.②和③属于同种元素,但是它们的化学性质不同
D.③⑥表示离子,其中③表示亚铁离子,⑥表示三氧化硫离子
6.甲醛(HCHO)是一种无色,有强烈刺激性气味的气体,具有致癌性、属于高毒物,易溶于水,35%~40%的甲醛水溶液叫福尔马林。下列有关甲醛的说法正确的是
A.甲醛分子中碳、氧、氢原子的个数比为1:2:1
B.甲醛分子中碳、氧元素的质量比为3:4
C.甲醛是由C、H、O三种原子构成的化合物
D.甲醛分子中的质子和电子数目相等
7.下列有关化学用语中,数字“2”的说法正确的是
①2Al ②3Zn2+③H2O ④ ⑤2O3⑥3 ⑦N2O5
A.表示分子个数的是①⑤ B.表示离子个数的是②⑥
C.表示分子中原子个数的③⑦ D.表示离子所带电荷数的是④⑥
8.有趣的“纳米小人”是一系列结构式与人体相似的有机分子(化学式C39H42O2),是由莱斯大学的詹姆斯 托尔等人设计并合成分子,用于对年轻学生的化学教育,下列关于它的说法中正确的是
A.“纳米小人”属于氧化物
B.“纳米小人”是由碳、氢两个元素组成的
C.“纳米小人”中氢、氧元素的质量比为21:16
D.“纳米小人”的相对分子质量为542g
9.尿素是氮肥中最主要的一种,其化学式为CO(NH2)2.下列关于尿素的说法正确的是
A.尿素是氧化物
B.尿素中含有一氧化碳分子
C.尿素分子由四种元素组成
D.尿素分子中碳、氢、氧、氮的原子个数比为1∶4∶1∶2
10.下列各图中“○”和“●”分别表示两种质子数不同的原子,其中能表示由两种化合物组成的混合物的图是
A. B. C. D.
11.丙烯是液化石油气的主要成分之一。下列叙述正确的是
A.丙烯由碳、氢两种原子构成
B.丙烯属于碳、氢元素组成的混合物
C.丙烯中碳元素的质量分数最大
D.丙烯分子中碳、氢元素的个数比为1:2
12.碘元素对青少年智力发展影响很大,加碘盐通常在食盐中加碘酸钾(KIO3)。下列关于KIO3的说法中错误的是
A.碘酸钾由钾、碘、氧三种元素组成
B.碘酸钾由1个钾原子、1个碘原子、3个氧原子构成
C.碘酸钾中碘元素的化合价为+5
D.碘酸钾的相对分子质量为214,其中碘元素的质量分数约为59.3%
13.掌握化学用语是学好化学的关键。下列化学用语与所表述的意义相符合的是
①FeCl2——氯化亚铁;②2Ca2+——2个钙离子;③O2——2个氧原子;④H2O——1个水分子;⑤2H——2个氢元素;⑥ ——氮气中氮元素的化合价为零。
A.①③④⑥ B.②③④⑥ C.①②④⑥ D.②④⑤⑥
14.下列关于数字""2"意义的说法正确的是
A.2Na中数字2表示2个氖原子
B.NO2中数字2表示1个二氧化氮分子中含有2个氧原子
C.中数字2表示一氧化碳中碳原子的化合价为+2
D.S2-中数字2表示是硫离子带2个负电荷
第II卷(非选择题)
未命名
二、填空题
15.说出下列化学符号所表示的意义
(1)2N______;
(2)______;
(3)______;
(4)SiO2______。
16.请结合化学式的意义,将对“SO2”的认识填写完整:①②③④
①_________;
②___________;
③_________ ;
④________。
17.生活离不开化学,学好基础是进入化学大门的钥匙。
(1)用化学符号填空:
①地壳中含量最高的非金属元素_______;②3个铁原子_______;
③n个铝离子_______;④氩元素_______;
⑤2个氧气分子_______;⑥空气中含量最高的气体_______;
(2)图①、②是钙元素、碘元素在元素周期表中的信息,A B C D是四种粒子的结构示意图。
I.钙元素的相对原子质量为_______,碘元素为_______元素填“金属”或“非金属”
II.图B中x=_______。A和B的化学性质_______(填“相似”、或“不相似”)。
III.A、B、C、D中属于离子的微粒的符号是_______填离子符号)。
18.按要求填空:
(1)1个氢氧根离子________;
(2)氯酸钾中氯元素的化合价为+5________。
(3)地壳中含量最多的金属元素与非金属元素组成的化合物的化学式为________;
(4)下图是CO与O2反应前后的微观示意图:
反应前后没有发生变化的粒子是________(填数字序号),该反应的基本反应类型是________。
(5)化学概念在逻辑上存在如图所示关系,请填空
①纯净物与混合物属于________关系;②氧化反应和化合反应属于________关系。
(6)下列物质中属于纯净物的有_______(填序号):
①高锰酸钾 ②冰水混合物 ③纯净的空气 ④双氧水 ⑤液氧 ⑥水银
三、实验题
19.现有下列实验装置图,结合该图回答下列问题。
(1)写出图中标号仪器的名称:①_______;②_______;③_______;
(2)实验室若用分解过氧化氢溶液的方法来制取氧气,可以选用的发生装置为_______(填装置序号);若用F装置装满水来收集氧气,氧气应该从_______(填“a”或“b”)端通入。
(3)若用加热高锰酸钾的方法制取氧气,反应的符号表达式_______,则可选用的发生和收集装置组合为_______(填装置序号),试管口放一团棉花,是为了防止加热时试管内_______进入导管;
(4)查阅资料得知:氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,其水溶液称为氨水;实验室用加热氯化铵和氢氧化钙两种固体混合物来制备氨气。则实验室制取氨气的装置组合可以选用_______(填装置序号)。
20.探究氧气的实验室制取和性质。
(1)图2是实验室制取气体的部分装置。
①实验室用高锰酸钾制氧气的发生装置是_____(填字母序号),试管口还要放一团棉花,目的是_______。还可用过氧化氢溶液和二氧化锰制氧气,选择的发生装置是______,反应的文字表达式为_______。
②收集较纯净的氧气可选用装置_______,选择F装置收集氧气,氧气从_______(选填a或者b)进入。
③氨气极易溶于水,且密度比空气小,实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,选用的发生装置是_______,收集装置是_______;
④注射器可用于检查装置B的气密性,步骤如下:向锥形瓶中加入少量水至_______,将注射器连接到装置B的导管口处,缓慢拉动注射器的活塞,观察到_______,表示装置B的气密性良好。
(2)如图1是硫在氧气中燃烧的实验。
①反应的符号表达式为______;②集气瓶底加水的作用是______。
四、推断题
21.已知A、B、C、D、E是初中化学常见的五种不同物质,其中A在空气中的含量为,B、D在常温下均为液体,且组成元素相同,C是密度最小的气体,反应会发出明亮的淡蓝色火焰,E是一种刺激性气味的气体。说明:“”表示可以发生反应,“”表示可以转化。根据如图所示关系,回答下列问题:
(1)写出有关物质的化学式:D______E______。
(2)写出AE的符号表达式______。
(3)C→B的符号表达式______,基本反应类型为______,C作为燃料的优点是______。
22.如图是一些常见物质之间的转化关系,其中A是能使带火星木条复燃的气体;B在反应前后其质量和化学性质都不发生变化;E是生活中常见的金属单质,E在气体A中的燃烧时火星四射,生成黑色固体。
请回忆所学内容,回答下列问题:
(1)写出物质:M(化学式)______;N(名称)________。
(2)写出反应③的符号表达式:__________。
(3)化合物D是由____(填“分子”、“原子”、“离子”)构成的。
(4)反应____(填序号①~⑤)在实验室常用来验证某气体是否为二氧化碳。
(5)实际上Fe3O4中铁元素呈+2、+3价,我们可以将Fe3O4写成 FeO. Fe2O3;以后我们还会知道,Fe3O4也可以写(Fe(Fe2O4)),则在()中,带“△”号的Fe的化合价为________价。
五、计算题
23.青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物主要是尿素[CO(NH2)2]。若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g。计算:
(1)尿素中氮元素的质量分数______。
(2)30g尿素中含氮元素的质量______。
(3)已知蛋白质中氮元素的平均质量分数为16%,则每人每天至少应从食物里摄取的蛋白质为______克。
试卷第2页,共2页
试卷第1页,共1页
参考答案
1.C
【详解】
物质由元素组成,N2、N2O、N2H4都含氮元素,故选C。
2.A
【详解】
A、5SO3表示三氧化硫分子,正确。
B、4个氢氧根离子表示为4OH-,错误。
C、氯化钾的化学式是KCl,错误。
D、Cl2是氯气的化学式,可以表示氯气,1个氯气分子。错误。
故选A。
【点睛】
3.D
【详解】
A、尿素[CO(NH2)2]是由多种元素组成的纯净物,属于化合物,故选项说法正确;
B、由尿素的化学式可知,一个尿素分子中含有1个碳原子、4个氢原子,则尿素分子中碳、氢原子个数比为1:4,故选项说法正确;
C、由尿素的化学式可知,尿素由碳、氧、氮、氢四种元素组成,故选项说法正确。
D、尿素中氮元素的质量分数为,故选项说法错误。
故选:D。
4.B
【详解】
A、原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故2个氢原子可表示为:2H,故选项错误;
B、氧化钠是由钠离子和阳离子构成的,化学式为Na2O,故选项正确;
C、离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,故2个硫酸根离子可表示为:2SO42-,故选项错误;
D、由化合价的表示方法可知,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故+2价的铁元素可表示为: ,故选项错误。
故选B。
5.C
【详解】
A、④表示分子中有氢原子和氧原子,故A错误;
B、⑤氯化钠是由离子构成的,所以不能用来表示一个分子,故B错误;
C、②和③都是铁元素,但是它们的化合价不一样,最外层电子数不同,所以它们的化学性质也不同,故C正确;
D、⑥表示的是亚硫酸根离子,故D错误;
故选C。
6.D
【详解】
A、由甲醛化学式可知,1个甲醛分子由1个碳原子、1个氧原子和2个氢原子构成,所以甲醛分子中碳、氧、氢原子的个数比为1:1:2,选项说法不正确;
B、分子是微观概念,元素是宏观概念,不能用宏观来解释微观,选项说法不正确;
C、甲醛是由分子构成的,不是由原子直接构成的,选项说法不正确;
D、由甲醛的化学式HCHO可知,一个甲醛分子中含有1×2+6+8=16个质子,也有16个电子,选项说法正确。
故选D。
7.C
【分析】
①元素符号前面的数字表示原子个数,故2Al表示2个铝原子;
②位于离子符号中元素或原子团的右上角,表示一个离子所带的电荷数。故3Zn2+中的“2”表示1个锌离子带2个单位的正电荷;
③位于化学式中元素符号(或原子团)的右下角,表示一个分子中所含的原子或原子团的个数。故H2O中的“2”表示1个水分子中含有2个氢原子;
④位于元素或原子团的正上方,表示元素或原子团的化合价,故中的“2”表示氧化镁中镁元素的化合价为+2价;
⑤化学式前面的数字表示分子个数,故2O3表示2个臭氧分子;
⑥位于离子符号中元素或原子团的右上角,表示一个离子所带的电荷数。故3中的“2”表示1个硫酸根离子带2个单位的负电荷;
⑦位于化学式中元素符号(或原子团)的右下角,表示一个分子中所含的原子或原子团的个数。故N2O5中的“2”表示1个五氧化二氮分子中含2个氮原子。
【详解】
A、由分析可知,表示分子个数的是⑤,不符合题意;
B、由分析可知,②⑥中的“2”表示的是1个离子所带的电荷数,不符合题意;
C、由分析可知,表示分子中原子个数的③⑦,符合题意;
D、由分析可知,表示离子所带电荷数的是②⑥,不符合题意。
故选C。
8.C
【详解】
A、“纳米小人”是由三种元素组成,不属于氧化物,故选项说法错误;
B、“纳米小人”是由碳、氢两种元素组成的,元素只讲种类、不讲个数,故选项说法错误;
C、“纳米小人”中氢、氧元素的质量比为(1×42):(16×2)=21:16,故选项说法正确;
D、“纳米小人”的相对分子质量为12×39+1×42+16×2=542,其单位为“1”,不是质量的单位,故选项说法错误。
故选:C。
9.D
【详解】
A、氧化物是含有两种元素一种为氧元素的化合物;尿素中含有三种元素,不是氧化物,错误;
B、尿素是由尿素分子构成的,不含一氧化碳分子,错误;
C、尿素分子是由原子构成的,错误;
D、尿素分子中碳、氢、氧、氮的原子个数比为1∶(1×2×2)∶1∶(1×2)=1∶4∶1∶2,正确。
故选D。
10.B
【详解】
A、由图可知,该物质由两种分子构成,属于混合物,且这两种分子均由同种原子构成,均属于单质,不符合题意;
B、由图可知,该物质由两种分子构成,属于混合物,且这两种分子均由两种原子构成,均属于化合物,符合题意;
C、由图可知,该物质由同种分子构成,属于纯净物,不符合题意;
D、由图可知,该物质由两种分子构成,且其中一种分子由同种原子构成,属于单质,其中一种分子由两种原子构成,属于化合物,不符合题意。
故选B。
11.C
【详解】
由所给结构模型可知丙烯的分子式为C3H6
A.由化学式可知,丙烯由碳、氢两种元素组成,选项A错误;
B.由化学式可知,丙烯由碳、氢两种元素组成纯净物,选项B错误;
C.由分子式算出丙烯中碳元素和氢元素的质量之比为(12×3):(1×6)=6:1,则碳原子的质量分数最大,选项C正确;
D.丙烯分子中碳原子和氢原子的个数之比为1:2,而不是碳元素和氢元素的个数比。元素属于宏观概念,元素不讲个数。选项D错误。
故选C。
12.B
【详解】
A.由碘酸钾的化学式知:碘酸钾由钾、碘、氧三种元素组成,说法正确,故不符合题意;
B.一个碘酸钾分子是由1个钾原子、1个碘原子、3个氧原子构成,原说法错误,故符合题意;
C.由化学式再根据钾元素显+1价,氧元素显-2价,可利用化合物中各元素化合价代数和为0求出碘元素的化合价为+5价,说法正确,故不符合题意;
D.因碘酸钾的相对分子质量为214,其中碘元素的质量分数为×100%≈59.3%,说法正确,故不符合题意。
故选B。
13.C
【详解】
①FeCl2中Fe显+2价是亚铁离子,所以其名称是氯化亚铁,正确;
②Ca2+表示钙离子,前面加上2表示2个钙离子,正确;
③O2表示1个氧分子或氧气,不能表示2个氧原子,错误;
④H2O表示1个水分子或水,正确;
⑤2H表示2个氢原子,元素不分个数,只分种类,不能表示2个氢元素,错误;
⑥化合价标注在对应元素符号上方,所以表示氮分子中氮元素显0价,正确。
正确的有①②④⑥,故选C。
14.B
【详解】
A.2Na中数字2表示2个钠原子,选项A错;
B.NO2中数字2表示1个二氧化氮分子中含有2个氧原子,选项B正确;
C.中数字2表示一氧化碳中碳元素的化合价为+2,不是碳原子,选项C错;
D.S2-中数字2表示是一个硫离子带2个单位的负电荷,选项D错;
故选B
15.
(1)2个氮原子
(2)1个铵根离子
(3)硫元素的化合价为-2价
(4)二氧化硅
【解析】
(1)
元素符号前面的数字表示原子个数,2N表示2个氮原子,故填:2个氮原子;
(2)
由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,故可表示为1个铵根离子,故填:1个铵根离子;
(3)
由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,1不能省略,故可表示为硫元素的化合价为-2价,故填:硫元素的化合价为-2价;
(4)
SiO2从右读到左,读作二氧化硅,故填:二氧化硅。
16.二氧化硫 二氧化硫分子 硫元素和氧元素 一个硫原子和两个氧原子
【分析】
根据化学式的意义:从宏观的角度分析,可以表示为一种物质;表示该物质的元素组成;从微观角度分析:表示该物质的一个分子;表示该物质的分子构成。
【详解】
①SO2表示为二氧化硫这种物质,故填:二氧化硫;
②SO2表示为一个二氧化硫分子,故填:二氧化硫分子;
③SO2表示为二氧化硫由硫元素和氧元素组成,故填:硫元素和氧元素;
④SO2表示为一个二氧化硫由一个硫原子和两个氧原子构成,故填:一个硫原子和两个氧原子。
17.
(1) O 3Fe nAl3+ Ar 2O2 N2
(2) 40.08 非金属 8 不相似 Cl-
【分析】
(1)
①地壳中含量前四位的元素依次为氧、硅、铝、铁,则含量最高的非金属元素是氧元素,故填O;
②几个某微粒在微粒前加数字,故填3Fe;
③几个某微粒在微粒前加数字,故填nAl3+;
④元素用元素符号表示,故填Ar;
⑤几个某微粒在微粒前加数字,故填2O2;
⑥空气中按体积计算氮气约为78%,氧气约为21%,稀有气体约为0.94%,二氧化碳及其它各约为0.03%,故空气中含量最高的气体为氮气,故填N2。
(2)
Ⅰ从元素周期表中的信息可知,钙元素的相对原子质量为40.08,故填40.08;
碘元素为非金属元素,故选非金属。
Ⅱ原子结构示意图核外电子分层排布,由里向外第一层最多排2个电子,第二层最多排8个电子,最外层不超过8个电子,x处于第二层,故x=8;
最外层电子数决定元素原子的化学性质,A和B最外层虽然都是2个电子,但A只有一个电子层,是相对稳定结构,B不是相对稳定结构,所以A和B的化学性质不相似,故选不相似。
Ⅲ离子是带电的原子,所以正电荷数不等于负电荷数,C中正电荷数小于负电荷数,故C属于氯离子,其离子符号为Cl-。
18.
(1)OH-
(2)
(3)Al2O3
(4) ④⑤ 化合反应
(5) 并列 交叉
(6)①②⑤⑥
【分析】
(1)
离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个该离子,就在其元素符号前加上相应的数字,故一个氢氧根离子可表示为:OH-;
(2)
元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氯酸钾中氯元素的化合价为+5价,故可表示为:
(3)
地壳中含量最多的金属元素是铝元素,非金属元素是氧元素,组成的化合物的氧化铝,化学式为:Al2O3;
(4)
分解微观示意图可知,反应前后没有发生变化的是碳原子和氧原子,故填:④⑤,该反应生两种物质生成另外一种物质的反应,属于化合反应;
(5)
①纯净物只含有1种物质,混合物含有多种物质,属于并列关系;
②氧化反应是物质与氧发生的反应,化合反应是多种物质生成1种物质的反应,属于交叉关系;
(6)
①高锰酸钾是由一种物质组成的,属于纯净物, ②冰水混合物中只含有一种物质水分子,属于纯净物, ③纯净的空气中含有氧气、氮气、二氧化氮等,属于混合物, ④双氧水是由过氧化氢和水混合而成的,属于混合物, ⑤液氧是由一种物质氧气组成的,属于纯净物, ⑥水银是由一种物质组成的,属于纯净物,故填:①②⑤⑥。
【点睛】
19.
(1) 铁架台 水槽 集气瓶
(2) A a
(3) KMnO4K2MnO4+MnO2+O2 BD或BE或BF 粉末状物质
(4)BC或BF
【分析】
(1)
由图可知,仪器①的名称为铁架台,仪器②的名称为水槽,仪器③的名称为集气瓶,故填:铁架台;水槽;集气瓶;
(2)
用分解过氧化氢溶液的方法来制取氧气,属于固液常温型,选择的发生装置为A,氧气的密度比水小,若用F装置装满水来收集氧气,氧气应该从a端通入,故填:A;a;
(3)
高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的符号表达式为KMnO4K2MnO4+MnO2+O2,该反应属于固-固加热型,选择的发生装置为B,氧气不易溶于水,密度比空气大,可采用排水法或向上排空气法收集,选择的收集装置为D或E或F;试管口放一团棉花,是为了防止加热时试管内粉末状物质进入导管,故填:KMnO4K2MnO4+MnO2+O2;BD或BE或BF;粉末状物质;
(4)
实验室用加热氯化铵和氢氧化钙两种固体混合物来制备氨气,属于固固加热型,选择的发生装置为B,氨气密度比空气小,极易溶于水,只能用向下排空气法收集,选择的收集装置为C或F,故填:BC或BF。
20.
(1) A 防止加热时,试管内粉末状物质随气流进入导管 B
C b A E 浸没长颈漏斗下端管口, 长颈漏斗下端有气泡冒出
(2)
吸收二氧化硫,防止污染空气
【分析】
(1)
①实验室用高锰酸钾制氧气,属于固体加热反应,发生装置可选A;
试管口还要放一团棉花,目的是:防止加热时,高锰酸钾粉末随气流进入导管;
用过氧化氢溶液和二氧化锰制氧气,属于固液不加热反应,发生装置可选B;
过氧化氢在二氧化锰的催化下分解为水和氧气,该反应的文字表达式为:;
②氧气不易溶于水,密度比空气大,可用排水法或向上排空气法收集,排水法收集的氧气比较纯净,故收集装置可选C;
氧气的密度比空气大,选择F装置收集氧气,氧气从b进入;
③实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,属于固体加热反应,发生装置可选A;氨气极易溶于水,且密度比空气小,可用向下排空气法收集,收集装置可选E;
④向锥形瓶中加入少量水至浸没长颈漏斗下端管口,将注射器连接到装置B的导管口处,缓慢拉动注射器的活塞,装置内压强减小,故观察到长颈漏斗下端有气泡冒出,表示装置B的气密性良好;
(2)
①硫在氧气中燃烧生成二氧化硫,该反应的符号表达式为:;
②硫在氧气中燃烧生成二氧化硫,二氧化硫有毒,散逸到空气中,会污染空气,二氧化硫能与水反应,故水的作用是:吸收二氧化硫,防止污染空气。
21.
(1) H2O2 SO2
(2)S+O2SO2
(3) H2+O2H2O(或H2+CuOCu+H2O) 化合反应(或置换反应) 热值高(或无污染)
【分析】
A在空气中的含量为,B、D在常温下均为液体,且组成元素相同,C是密度最小的气体,过氧化氢在二氧化锰的催化作用下生成水和氧气,则A为氧气,B为水,C为氢气,D为过氧化氢;反应会发出明亮的淡蓝色火焰,E是一种刺激性气味的气体,则E为二氧化硫,代入检验,验证合理;
(1)
由分析可知,D为过氧化氢,其化学式为H2O2,E为二氧化硫,其化学式为SO2,故填:H2O2;SO2;
(2)
A→E,即硫与空气中燃烧生成二氧化硫,反应的符号表达式为S+O2SO2,故填:S+O2SO2;
(3)
C→B,即氢气与氧气在点燃的条件下生成水(或氢气与氧化铜在加热的条件下生成铜和水),反应的符号表达式为H2+O2H2O(或H2+CuOCu+H2O),该反应符合“多变一”的特点(或符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的特点),属于化合反应(或置换反应),氢气本身无毒,完全燃烧放出的热量 约为同质量甲烷的两倍多,且燃烧后的产物是水,不污染空气,故填:H2+O2H2O(或H2+CuOCu+H2O);化合反应(或置换反应);热值高(或无污染)。
22.
(1) KMnO4 氯酸钾
(2)
(3)离子
(4)⑤
(5)+3
【分析】
A是能使带火星木条复燃的气体,则A是氧气,E是生活中常见的金属单质,E在气体氧气中的燃烧时火星四射,生成黑色固体,则E是铁,I是四氧化三铁;H能使澄清石灰水变浑浊,则H是二氧化碳,F与氧气在点燃的条件下生成二氧化碳,则F可以是碳,B在反应前后其质量和化学性质都不发生变化,N和B加热会生成氧气,所以B是二氧化锰,N是氯酸钾,D是氯化钾,M加热会生成二氧化锰和氧气,所以M是高锰酸钾,C是锰酸钾,经过验证,推导正确。
(1)
由上述分析可知,M是高锰酸钾,其化学式为KMnO4,N是氯酸钾,故填:KMnO4;氯酸钾;
(2)
反应③即铁在氧气燃烧生成四氧化三铁,反应的符号表达式,故填:;
(3)
由上述分析可知,化合物D是KCl,是由钾离子和氯离子构成,故填:离子;
(4)
实验室检验二氧化碳是利用二氧化碳能使澄清的石灰水变浑浊,故反应⑤在实验室常用来验证某气体是否为二氧化碳,故填:⑤;
(5)
Fe3O4中氧元素化合价为-2价,根据化合物中各元素化合价代数和为0,则在【】中带“△”的Fe的化合价与Fe2O3中铁元素化合价相同,故化合价为+3价,故填:+3。
23.
(1) 46.7%;
(2)30g×=14g;
(3)解:设每人每天至少应从食物里摄取的蛋白质的质量为x
x×16%=14g,
x=87.5g,
答:每人每天至少应从食物里摄取的蛋白质为87.5克。
【分析】
(1)
见答案。
(2)
见答案。
(3)
见答案。答案第1页,共2页
答案第1页,共2页
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
