第七单元燃料及其利用测试题-2021-2022学年九年级化学人教版上册(word版含答案)
文档属性
| 名称 | 第七单元燃料及其利用测试题-2021-2022学年九年级化学人教版上册(word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 203.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-27 07:00:18 | ||
图片预览


文档简介
第七单元《燃料及其利用》测试题
一、单选题
1.下列灭火的方法错误的是
A.做实验时不慎碰倒酒精灯,酒精在桌面上燃烧起来——用湿抹布扑盖
B.由于吸烟,不慎引燃被褥——用水灭火
C.由于电线老化短路而起火一—用水扑灭
D.炒菜时油锅着火——用锅盖盖灭
2.下列关于能源的说法错误的是
A.风能、太阳能都是新能源
B.化石能源包括煤、石油和氢气
C.化学电池可以将化学能转化为电能
D.对能源要进行合理开发和利用
3.氢气是未来最理想的能源之一。下列关于氢气的叙述中不合理的是
A.电解水制取氢气,方便快捷、成本较低
B.氢气燃烧产物只有水,可以循环使用
C.实验室可用金属锌与稀硫酸反应制取氢气
D.氢气是最轻的气体,可以用来填充气球
4.以下燃料燃烧,排放的物质对环境影响最小的是
A.天然气 B.氢气 C.石蜡 D.煤
5.燃料和能源与生活息息相关,下列说法正确的是
A.炒菜时油锅着火,应立即用水浇灭
B.从环境保护角度考虑,最理想的燃料是汽油
C.“钻木取火”的原理是通过摩擦生热提高木材的着火点
D.燃气灶火焰出现黄色,锅底出现黑色时,可增大灶具进风口
6.下列措施与理由之间的因果关系错误的是
A.白磷保存在水中--防止自燃 B.设置森林隔离带--隔离可燃物
C.加油站严禁烟火--防止爆炸 D.用扇子扇煤炉火--降低可燃物的着火点
7.下列宏观事实的微观解释错误的是
A.化学反应遵循质量守恒定律——化学反应前后原子的种类和数目不变
B.石蜡在氧气中燃烧比在空气中更剧烈——前者单位体积里氧分子的数目多,微粒接触几率大
C.氧气加压降温变为液态氧——分子本身发生改变
D.不纯氢气点燃发生爆炸——大量的氢分子与氧分子同时接触,瞬间释放大量的热
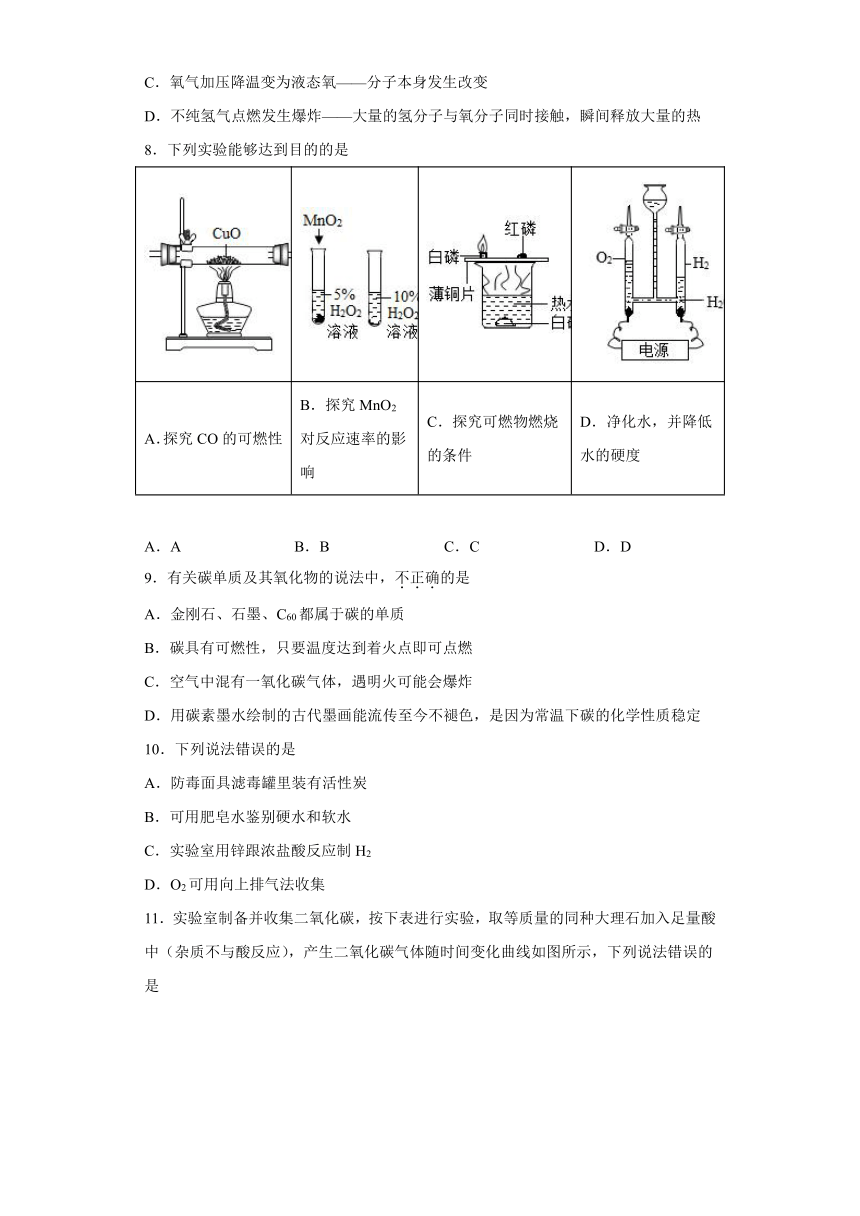
8.下列实验能够达到目的的是
A.探究CO的可燃性 B.探究MnO2对反应速率的影响 C.探究可燃物燃烧的条件 D.净化水,并降低水的硬度
A.A B.B C.C D.D
9.有关碳单质及其氧化物的说法中,不正确的是
A.金刚石、石墨、C60都属于碳的单质
B.碳具有可燃性,只要温度达到着火点即可点燃
C.空气中混有一氧化碳气体,遇明火可能会爆炸
D.用碳素墨水绘制的古代墨画能流传至今不褪色,是因为常温下碳的化学性质稳定
10.下列说法错误的是
A.防毒面具滤毒罐里装有活性炭
B.可用肥皂水鉴别硬水和软水
C.实验室用锌跟浓盐酸反应制H2
D.O2可用向上排气法收集
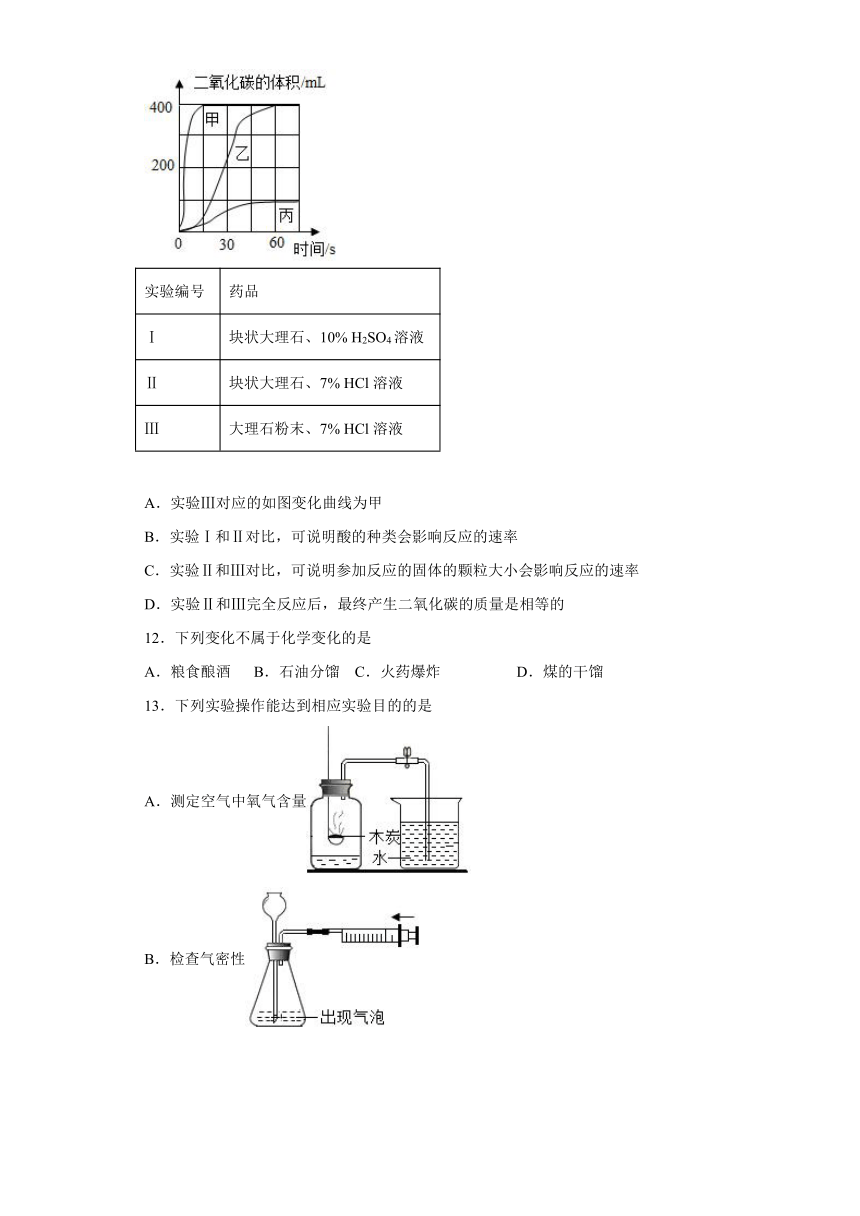
11.实验室制备并收集二氧化碳,按下表进行实验,取等质量的同种大理石加入足量酸中(杂质不与酸反应),产生二氧化碳气体随时间变化曲线如图所示,下列说法错误的是
实验编号 药品
Ⅰ 块状大理石、10% H2SO4溶液
Ⅱ 块状大理石、7% HCl溶液
Ⅲ 大理石粉末、7% HCl溶液
A.实验Ⅲ对应的如图变化曲线为甲
B.实验Ⅰ和Ⅱ对比,可说明酸的种类会影响反应的速率
C.实验Ⅱ和Ⅲ对比,可说明参加反应的固体的颗粒大小会影响反应的速率
D.实验Ⅱ和Ⅲ完全反应后,最终产生二氧化碳的质量是相等的
12.下列变化不属于化学变化的是
A.粮食酿酒 B.石油分馏 C.火药爆炸 D.煤的干馏
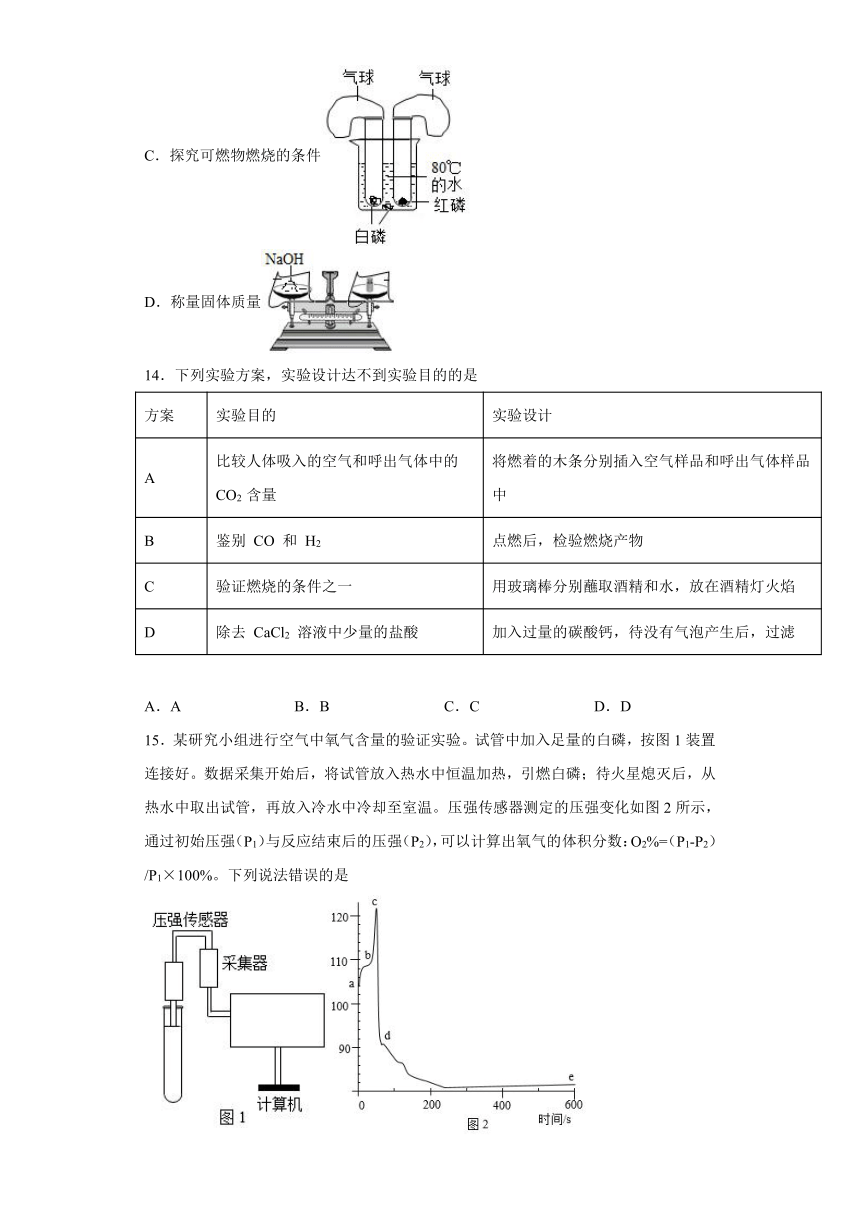
13.下列实验操作能达到相应实验目的的是
A.测定空气中氧气含量
B.检查气密性
C.探究可燃物燃烧的条件
D.称量固体质量
14.下列实验方案,实验设计达不到实验目的的是
方案 实验目的 实验设计
A 比较人体吸入的空气和呼出气体中的 CO2 含量 将燃着的木条分别插入空气样品和呼出气体样品中
B 鉴别 CO 和 H2 点燃后,检验燃烧产物
C 验证燃烧的条件之一 用玻璃棒分别蘸取酒精和水,放在酒精灯火焰
D 除去 CaCl2 溶液中少量的盐酸 加入过量的碳酸钙,待没有气泡产生后,过滤
A.A B.B C.C D.D
15.某研究小组进行空气中氧气含量的验证实验。试管中加入足量的白磷,按图1装置连接好。数据采集开始后,将试管放入热水中恒温加热,引燃白磷;待火星熄灭后,从热水中取出试管,再放入冷水中冷却至室温。压强传感器测定的压强变化如图2所示,通过初始压强(P1)与反应结束后的压强(P2),可以计算出氧气的体积分数:O2%=(P1-P2)/P1×100%。下列说法错误的是
A.a~b段,说明试管放入热水中,空气受热,压强变大
B.c点时,压强最大,白磷停止燃烧,已消耗全部的氧气
C.d~e段,说明的是试管从热水中取出后,放入冷水中冷却的过程
D.P1和P2的压强分别为a和e所对应的压强
二、填空题
16.碳元素是组成许多物质的基本元素。
(1)化石燃料主要包括煤、___________和天然气,它们都含有碳元素。天然气的主要成分是甲烷(CH4),它是一种“清洁能源”。甲烷在空气中燃烧生成二氧化碳和水,写出甲烷燃烧的化学方程式___________。
(2)很多天然矿石中含有碳元素,菱锰矿的主要成分是碳酸锰(MnCO3),其中锰元素的化合价为___________。
(3)在440℃和高压条件下,金属钠与二氧化碳反应能生成金刚石(C)和碳酸钠,该反应的化学方程式为___________。
(4)炭雕是活性炭成型技术与传统雕刻工艺的完美结合,因为活性炭有疏松多孔的结构,具有___________能力,所以,炭雕即可以净化室内空气,又可以美化居住环境。
(5)实验室制取氢气的化学方程式___________
17.2021年4月29日,搭载着中国空间站“天和号”核心舱的长征五号B遥二运载火箭,在我国海南文昌航天发射场点火升空,并稳稳入轨。紧接着,将用长征七号遥三、长征二号F遥12运载火箭发射“天舟”货运飞船和“神舟十二号”载人飞船,航天员会进入空间站执行建造和科研任务。
(1)长征五号B遥二运载火箭中含有液氢的燃烧剂箱和液氧的氧化剂箱。氢气是公认最清洁燃料,理由是___________,氢氧发动机具有二次启动能力,液氧与液氢反应的化学方程式为___________。
(2)长征五号的遥测系统能够实现远距离测量,硅材料在其中扮演着重要的角色。工业生产中制备高纯硅的反应微观示意图如下:
图中反应的化学方程式为___________,其基本反应类型是___________。
(3)长征二号F遥12运载火箭助推器以偏二甲肼(C2H8N2)和氧化剂四氧化二氮为燃料。四氧化二氮中氮元素的化合价为___________,偏二甲肼中氮元素的质量分数为___________(保留一位小数)。
18.能源、环境和安全已成为人类日益关注的问题。请回答下列问题。
(1)化石燃料是重要的能源,但在使用过程中会造成环境污染,如______(填化学式)的排放会形成酸雨;
(2)2020年6月23日,北斗三号最后一颗全球组网卫星发射成功。此次卫星发射用的火箭推进剂为液氢和液氧,其反应产物无污染。氢气在氧气中燃烧的化学方程式为______;
(3)燃料的充分燃烧对于节约能源、减少环境污染非常重要。汽车化油器将汽油喷成雾状进入内燃机气缸,使汽油充分燃烧,这是通过______的方法使汽油充分燃烧;
(4)加油站、化工厂、面粉厂等场所的空气中含有较多可燃性气体或粉尘,因此这些场所一定要禁止烟火,防止发生______;
(5)硝酸工厂排放的尾气中含有NO、NO2等有害气体,可用氢氧化钠溶液来吸收: NO+NO2+2NaOH=2X+H2O,则工业用盐X的化学式为______。
19.牛眠山上,三角梅向阳绽放,匝道间的山头满眼绿意;闽江上,连绵桥跨穿越,湿地如翡翠般点缀……这是行驶在北园互通立交和三江口大桥上看到的寻常景色。围绕“山水林田湖草”是一个生命共同体理念,福州市全力推动建设项目生态环境保护修复。依托国内首部专门针对建设开发项目的生态环境保护修复技术导则《福州市城乡建设项目生态环境保护修复技术导则(试行)》,去年至今,全市173个竣工项目已完成山体植被修复面积2191241.85平方米,实现“一个项目一片景”。
(1)梅花向阳绽放,并能闻到梅花的香味,从微观角度,能说明分子的性质是_______。
(2)林业发展在生态建设中具有重要的意义。植树造林,可以有效减少空气中_______的含量,从而可以有效的减少_______(填“白色污染”或“温室效应”)。
(3)酸雨也是重要的环境问题之一、酸雨的pH_______5.6(填“>”“<”或“=”),形成酸雨的主要物质是含硫煤燃烧所产生的_______气体(填化学式)。
(4)催化还原法是消除大气中氮氧化物污染的新工艺,主要的微观示意图如下图。
①请写出该反应的化学方程式:_______。
②参加反应的甲烷、二氧化氮的微粒个数比为:_______。
③参加反应的甲烷和生成的二氧化碳的质量比为_______。
三、推断题
20.图中A~E是操作化学常见的物质,已知A和E都可以作燃料,其中A是天然气的主要成分,请分析回答:
(1)反应①的化学方程式为________;
(2)反应②中的产物B通常用________检验;
(3)E物质作燃料的优点是_______(答一条即可)。
21.A、B、C、D为常见的物质,四种物质之间会发生如下反应: ,已知D是相对分子质量最小的氧化物,请回答下列问题。
(1)若A为密度最小的气体,B的相对分子质量为80,则B的化学式为________________________,反应的化学方程式为________________________。
(2)若A由两种元素组成,C可用于灭火,且反应中生成C和D的质量比为11:9,则B的化学式为________________________,反应的化学方程式为________________________。
四、实验题
22.我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物。Ca(OH)2、K2CO3和KOH的部分溶解度如下表:
温度/℃ 0 10 20 30 50
溶解度/g Ca(OH)2 0.18 0.17 0.16 0.15 0.14
K2CO3 107 109 110 114 121
KOH 97 103 112 126 140
(1)50℃时,55%的KOH溶液属于______溶液(填“饱和”或“不饱和”);
(2)某温度时,向一定量的饱和氢氧化钙溶液中加入极少量生石灰,恢复到原温度,某些量随时间变化的关系如图所示。则纵坐标可能表示的是______(填字母);
a.氢氧化钙的溶解度 b.溶质的质量 c.溶质的质量分数 d.溶剂的质量 e.溶液的质量
(3)20℃时,将1.38 gK2CO3固体放入100g水中,并加入一定量的氢氧化钙固体,搅拌充分反应,恢复到原温度,过滤,得到1.5g的固体。所得滤渣的主要成分是______。
23.下列装置常用于气体的实验室制取,根据给出的装置回答下列问题:
(1)写出图片中标有字母的仪器名称:a______。
(2)实验室利用高锰酸钾通过A装置制取氧气的化学方程式为______,该装置中存在的错误是______;可以通过选用装置E收集氧气的理由是______;收集满时可看到______现象。
(3)若用大理石和稀盐酸制取二氧化碳,并能随时控制反应的发生和停止,应选用的发生装置是______(填写字母);若用D装置收集该气体,则气体应从______端进入(填“①”或“②”)。通常用______来检验二氧化碳,其原理是______(用化学方程式表示)。
(4)实验室用锌粒与稀硫酸制取氢气的化学方程式为______。为探究影响锌粒与稀硫酸反应快慢的因素,进行以下三组实验。室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mLH2(通常情况)所需的时间,下表为实验数据:
实验编号 硫酸的质量分数/% 硫酸的体积/mL 锌粒的质量/g 时间/s
1 10 10 1 78
2 10 10 2 57
3 40 10 1 9
①比较实验1、2的数据,可以得出的结论是______。
②由实验数据可知,该实验中对锌粒与稀硫酸反应快慢影响较大的因素是______。
③比较不同条件下锌粒与稀硫酸反应的快慢由不同的方法,除测量产生相同体积的H2所需的时间,还可采用的测量方法是______(写出一种)。
五、计算题
24.某市冬天取暖主要以煤为燃料。已知原煤中含硫1%,若燃烧1000 t这样的原煤可以产生二氧化硫________t,这些原煤中的硫元素全部转化成硫酸( S→H2SO4),可生产0.05%的硫酸溶液_________t,通过以上信息你得到哪些启示?(答出两点即可)________
25.某工业生产流程如图所示:
每生成1t 产品,需要通入含有0.2%(体积分数,下同)的惰性杂质CH4的新鲜原料气2800m3。
经分离器分离产品后,剩余气体中含有大量未充分反应的原料与 3%的CH4。在连续生产的条件下,可对剩余气体采用部分循环、部分移走的操作,一方面能提高原料的利用率,节省成本,另一方面也避免装置中CH4越来越多而对生产造成不利影响。已知在此生产条件下,CH4在每吨产品中的溶解量为2.3m3,。计算每生产 1t 产品需要移走气体的体积。
参考答案
1.C 2.B 3.A 4.B 5.D 6.D 7.C 8.C 9.B 10.C 11.B 12.B 13.C 14.A 15.B
16.(1) 石油 CH4 + 2O2CO2 + 2H2O
(2)+2
(3)4Na + 3CO2 C +2Na2CO3
(4)吸附
(5)Zn +H2SO4 =ZnSO4 + H2↑
17.燃烧产物是水,无污染 置换反应 +4 46.7%
18.SO2(或NO2)
增大与氧气的接触面积 爆炸 NaNO2
19.
(1)分子在不停运动
(2) 二氧化碳 温室效应
(3) < SO2
(4) 1:2 4:11
20.CH4+2O2CO2+2H2O 带火星的木条 产物无污染、热值大
21.CuO CuO;CuO+H2Cu+H2O; O2
22.
(1)不饱和
(2)be
(3)碳酸钙和氢氧化钙
23.锥形瓶 2KMnO4K2MnO4+MnO2+O2↑ 未在试管口放置一团棉花 氧气不易溶于水,且不与水反应 有大量气泡外溢 C ① 澄清石灰水 Ca(OH)2+CO2=CaCO3↓+H2O Zn+H2SO4=ZnSO4+H2↑ 其他条件相同时锌粒的质量越大氢气产生的越快 硫酸的质量分数 测量相同时间内产生氢气的体积
24.(1)20 (2)6.125×105(3)酸雨会给人类生活和生态带来严重危窖(如酸雨腐蚀大理石雕像、金属建筑物、破坏森林、酸化土壤等);使用脱硫煤;开发新能源代替现有的化石燃料等。
25.110m3
一、单选题
1.下列灭火的方法错误的是
A.做实验时不慎碰倒酒精灯,酒精在桌面上燃烧起来——用湿抹布扑盖
B.由于吸烟,不慎引燃被褥——用水灭火
C.由于电线老化短路而起火一—用水扑灭
D.炒菜时油锅着火——用锅盖盖灭
2.下列关于能源的说法错误的是
A.风能、太阳能都是新能源
B.化石能源包括煤、石油和氢气
C.化学电池可以将化学能转化为电能
D.对能源要进行合理开发和利用
3.氢气是未来最理想的能源之一。下列关于氢气的叙述中不合理的是
A.电解水制取氢气,方便快捷、成本较低
B.氢气燃烧产物只有水,可以循环使用
C.实验室可用金属锌与稀硫酸反应制取氢气
D.氢气是最轻的气体,可以用来填充气球
4.以下燃料燃烧,排放的物质对环境影响最小的是
A.天然气 B.氢气 C.石蜡 D.煤
5.燃料和能源与生活息息相关,下列说法正确的是
A.炒菜时油锅着火,应立即用水浇灭
B.从环境保护角度考虑,最理想的燃料是汽油
C.“钻木取火”的原理是通过摩擦生热提高木材的着火点
D.燃气灶火焰出现黄色,锅底出现黑色时,可增大灶具进风口
6.下列措施与理由之间的因果关系错误的是
A.白磷保存在水中--防止自燃 B.设置森林隔离带--隔离可燃物
C.加油站严禁烟火--防止爆炸 D.用扇子扇煤炉火--降低可燃物的着火点
7.下列宏观事实的微观解释错误的是
A.化学反应遵循质量守恒定律——化学反应前后原子的种类和数目不变
B.石蜡在氧气中燃烧比在空气中更剧烈——前者单位体积里氧分子的数目多,微粒接触几率大
C.氧气加压降温变为液态氧——分子本身发生改变
D.不纯氢气点燃发生爆炸——大量的氢分子与氧分子同时接触,瞬间释放大量的热
8.下列实验能够达到目的的是
A.探究CO的可燃性 B.探究MnO2对反应速率的影响 C.探究可燃物燃烧的条件 D.净化水,并降低水的硬度
A.A B.B C.C D.D
9.有关碳单质及其氧化物的说法中,不正确的是
A.金刚石、石墨、C60都属于碳的单质
B.碳具有可燃性,只要温度达到着火点即可点燃
C.空气中混有一氧化碳气体,遇明火可能会爆炸
D.用碳素墨水绘制的古代墨画能流传至今不褪色,是因为常温下碳的化学性质稳定
10.下列说法错误的是
A.防毒面具滤毒罐里装有活性炭
B.可用肥皂水鉴别硬水和软水
C.实验室用锌跟浓盐酸反应制H2
D.O2可用向上排气法收集
11.实验室制备并收集二氧化碳,按下表进行实验,取等质量的同种大理石加入足量酸中(杂质不与酸反应),产生二氧化碳气体随时间变化曲线如图所示,下列说法错误的是
实验编号 药品
Ⅰ 块状大理石、10% H2SO4溶液
Ⅱ 块状大理石、7% HCl溶液
Ⅲ 大理石粉末、7% HCl溶液
A.实验Ⅲ对应的如图变化曲线为甲
B.实验Ⅰ和Ⅱ对比,可说明酸的种类会影响反应的速率
C.实验Ⅱ和Ⅲ对比,可说明参加反应的固体的颗粒大小会影响反应的速率
D.实验Ⅱ和Ⅲ完全反应后,最终产生二氧化碳的质量是相等的
12.下列变化不属于化学变化的是
A.粮食酿酒 B.石油分馏 C.火药爆炸 D.煤的干馏
13.下列实验操作能达到相应实验目的的是
A.测定空气中氧气含量
B.检查气密性
C.探究可燃物燃烧的条件
D.称量固体质量
14.下列实验方案,实验设计达不到实验目的的是
方案 实验目的 实验设计
A 比较人体吸入的空气和呼出气体中的 CO2 含量 将燃着的木条分别插入空气样品和呼出气体样品中
B 鉴别 CO 和 H2 点燃后,检验燃烧产物
C 验证燃烧的条件之一 用玻璃棒分别蘸取酒精和水,放在酒精灯火焰
D 除去 CaCl2 溶液中少量的盐酸 加入过量的碳酸钙,待没有气泡产生后,过滤
A.A B.B C.C D.D
15.某研究小组进行空气中氧气含量的验证实验。试管中加入足量的白磷,按图1装置连接好。数据采集开始后,将试管放入热水中恒温加热,引燃白磷;待火星熄灭后,从热水中取出试管,再放入冷水中冷却至室温。压强传感器测定的压强变化如图2所示,通过初始压强(P1)与反应结束后的压强(P2),可以计算出氧气的体积分数:O2%=(P1-P2)/P1×100%。下列说法错误的是
A.a~b段,说明试管放入热水中,空气受热,压强变大
B.c点时,压强最大,白磷停止燃烧,已消耗全部的氧气
C.d~e段,说明的是试管从热水中取出后,放入冷水中冷却的过程
D.P1和P2的压强分别为a和e所对应的压强
二、填空题
16.碳元素是组成许多物质的基本元素。
(1)化石燃料主要包括煤、___________和天然气,它们都含有碳元素。天然气的主要成分是甲烷(CH4),它是一种“清洁能源”。甲烷在空气中燃烧生成二氧化碳和水,写出甲烷燃烧的化学方程式___________。
(2)很多天然矿石中含有碳元素,菱锰矿的主要成分是碳酸锰(MnCO3),其中锰元素的化合价为___________。
(3)在440℃和高压条件下,金属钠与二氧化碳反应能生成金刚石(C)和碳酸钠,该反应的化学方程式为___________。
(4)炭雕是活性炭成型技术与传统雕刻工艺的完美结合,因为活性炭有疏松多孔的结构,具有___________能力,所以,炭雕即可以净化室内空气,又可以美化居住环境。
(5)实验室制取氢气的化学方程式___________
17.2021年4月29日,搭载着中国空间站“天和号”核心舱的长征五号B遥二运载火箭,在我国海南文昌航天发射场点火升空,并稳稳入轨。紧接着,将用长征七号遥三、长征二号F遥12运载火箭发射“天舟”货运飞船和“神舟十二号”载人飞船,航天员会进入空间站执行建造和科研任务。
(1)长征五号B遥二运载火箭中含有液氢的燃烧剂箱和液氧的氧化剂箱。氢气是公认最清洁燃料,理由是___________,氢氧发动机具有二次启动能力,液氧与液氢反应的化学方程式为___________。
(2)长征五号的遥测系统能够实现远距离测量,硅材料在其中扮演着重要的角色。工业生产中制备高纯硅的反应微观示意图如下:
图中反应的化学方程式为___________,其基本反应类型是___________。
(3)长征二号F遥12运载火箭助推器以偏二甲肼(C2H8N2)和氧化剂四氧化二氮为燃料。四氧化二氮中氮元素的化合价为___________,偏二甲肼中氮元素的质量分数为___________(保留一位小数)。
18.能源、环境和安全已成为人类日益关注的问题。请回答下列问题。
(1)化石燃料是重要的能源,但在使用过程中会造成环境污染,如______(填化学式)的排放会形成酸雨;
(2)2020年6月23日,北斗三号最后一颗全球组网卫星发射成功。此次卫星发射用的火箭推进剂为液氢和液氧,其反应产物无污染。氢气在氧气中燃烧的化学方程式为______;
(3)燃料的充分燃烧对于节约能源、减少环境污染非常重要。汽车化油器将汽油喷成雾状进入内燃机气缸,使汽油充分燃烧,这是通过______的方法使汽油充分燃烧;
(4)加油站、化工厂、面粉厂等场所的空气中含有较多可燃性气体或粉尘,因此这些场所一定要禁止烟火,防止发生______;
(5)硝酸工厂排放的尾气中含有NO、NO2等有害气体,可用氢氧化钠溶液来吸收: NO+NO2+2NaOH=2X+H2O,则工业用盐X的化学式为______。
19.牛眠山上,三角梅向阳绽放,匝道间的山头满眼绿意;闽江上,连绵桥跨穿越,湿地如翡翠般点缀……这是行驶在北园互通立交和三江口大桥上看到的寻常景色。围绕“山水林田湖草”是一个生命共同体理念,福州市全力推动建设项目生态环境保护修复。依托国内首部专门针对建设开发项目的生态环境保护修复技术导则《福州市城乡建设项目生态环境保护修复技术导则(试行)》,去年至今,全市173个竣工项目已完成山体植被修复面积2191241.85平方米,实现“一个项目一片景”。
(1)梅花向阳绽放,并能闻到梅花的香味,从微观角度,能说明分子的性质是_______。
(2)林业发展在生态建设中具有重要的意义。植树造林,可以有效减少空气中_______的含量,从而可以有效的减少_______(填“白色污染”或“温室效应”)。
(3)酸雨也是重要的环境问题之一、酸雨的pH_______5.6(填“>”“<”或“=”),形成酸雨的主要物质是含硫煤燃烧所产生的_______气体(填化学式)。
(4)催化还原法是消除大气中氮氧化物污染的新工艺,主要的微观示意图如下图。
①请写出该反应的化学方程式:_______。
②参加反应的甲烷、二氧化氮的微粒个数比为:_______。
③参加反应的甲烷和生成的二氧化碳的质量比为_______。
三、推断题
20.图中A~E是操作化学常见的物质,已知A和E都可以作燃料,其中A是天然气的主要成分,请分析回答:
(1)反应①的化学方程式为________;
(2)反应②中的产物B通常用________检验;
(3)E物质作燃料的优点是_______(答一条即可)。
21.A、B、C、D为常见的物质,四种物质之间会发生如下反应: ,已知D是相对分子质量最小的氧化物,请回答下列问题。
(1)若A为密度最小的气体,B的相对分子质量为80,则B的化学式为________________________,反应的化学方程式为________________________。
(2)若A由两种元素组成,C可用于灭火,且反应中生成C和D的质量比为11:9,则B的化学式为________________________,反应的化学方程式为________________________。
四、实验题
22.我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物。Ca(OH)2、K2CO3和KOH的部分溶解度如下表:
温度/℃ 0 10 20 30 50
溶解度/g Ca(OH)2 0.18 0.17 0.16 0.15 0.14
K2CO3 107 109 110 114 121
KOH 97 103 112 126 140
(1)50℃时,55%的KOH溶液属于______溶液(填“饱和”或“不饱和”);
(2)某温度时,向一定量的饱和氢氧化钙溶液中加入极少量生石灰,恢复到原温度,某些量随时间变化的关系如图所示。则纵坐标可能表示的是______(填字母);
a.氢氧化钙的溶解度 b.溶质的质量 c.溶质的质量分数 d.溶剂的质量 e.溶液的质量
(3)20℃时,将1.38 gK2CO3固体放入100g水中,并加入一定量的氢氧化钙固体,搅拌充分反应,恢复到原温度,过滤,得到1.5g的固体。所得滤渣的主要成分是______。
23.下列装置常用于气体的实验室制取,根据给出的装置回答下列问题:
(1)写出图片中标有字母的仪器名称:a______。
(2)实验室利用高锰酸钾通过A装置制取氧气的化学方程式为______,该装置中存在的错误是______;可以通过选用装置E收集氧气的理由是______;收集满时可看到______现象。
(3)若用大理石和稀盐酸制取二氧化碳,并能随时控制反应的发生和停止,应选用的发生装置是______(填写字母);若用D装置收集该气体,则气体应从______端进入(填“①”或“②”)。通常用______来检验二氧化碳,其原理是______(用化学方程式表示)。
(4)实验室用锌粒与稀硫酸制取氢气的化学方程式为______。为探究影响锌粒与稀硫酸反应快慢的因素,进行以下三组实验。室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mLH2(通常情况)所需的时间,下表为实验数据:
实验编号 硫酸的质量分数/% 硫酸的体积/mL 锌粒的质量/g 时间/s
1 10 10 1 78
2 10 10 2 57
3 40 10 1 9
①比较实验1、2的数据,可以得出的结论是______。
②由实验数据可知,该实验中对锌粒与稀硫酸反应快慢影响较大的因素是______。
③比较不同条件下锌粒与稀硫酸反应的快慢由不同的方法,除测量产生相同体积的H2所需的时间,还可采用的测量方法是______(写出一种)。
五、计算题
24.某市冬天取暖主要以煤为燃料。已知原煤中含硫1%,若燃烧1000 t这样的原煤可以产生二氧化硫________t,这些原煤中的硫元素全部转化成硫酸( S→H2SO4),可生产0.05%的硫酸溶液_________t,通过以上信息你得到哪些启示?(答出两点即可)________
25.某工业生产流程如图所示:
每生成1t 产品,需要通入含有0.2%(体积分数,下同)的惰性杂质CH4的新鲜原料气2800m3。
经分离器分离产品后,剩余气体中含有大量未充分反应的原料与 3%的CH4。在连续生产的条件下,可对剩余气体采用部分循环、部分移走的操作,一方面能提高原料的利用率,节省成本,另一方面也避免装置中CH4越来越多而对生产造成不利影响。已知在此生产条件下,CH4在每吨产品中的溶解量为2.3m3,。计算每生产 1t 产品需要移走气体的体积。
参考答案
1.C 2.B 3.A 4.B 5.D 6.D 7.C 8.C 9.B 10.C 11.B 12.B 13.C 14.A 15.B
16.(1) 石油 CH4 + 2O2CO2 + 2H2O
(2)+2
(3)4Na + 3CO2 C +2Na2CO3
(4)吸附
(5)Zn +H2SO4 =ZnSO4 + H2↑
17.燃烧产物是水,无污染 置换反应 +4 46.7%
18.SO2(或NO2)
增大与氧气的接触面积 爆炸 NaNO2
19.
(1)分子在不停运动
(2) 二氧化碳 温室效应
(3) < SO2
(4) 1:2 4:11
20.CH4+2O2CO2+2H2O 带火星的木条 产物无污染、热值大
21.CuO CuO;CuO+H2Cu+H2O; O2
22.
(1)不饱和
(2)be
(3)碳酸钙和氢氧化钙
23.锥形瓶 2KMnO4K2MnO4+MnO2+O2↑ 未在试管口放置一团棉花 氧气不易溶于水,且不与水反应 有大量气泡外溢 C ① 澄清石灰水 Ca(OH)2+CO2=CaCO3↓+H2O Zn+H2SO4=ZnSO4+H2↑ 其他条件相同时锌粒的质量越大氢气产生的越快 硫酸的质量分数 测量相同时间内产生氢气的体积
24.(1)20 (2)6.125×105(3)酸雨会给人类生活和生态带来严重危窖(如酸雨腐蚀大理石雕像、金属建筑物、破坏森林、酸化土壤等);使用脱硫煤;开发新能源代替现有的化石燃料等。
25.110m3
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
