第三单元物质构成的奥秘单元测试卷-2021-2022学年九年级化学人教版上册(word版 含解析)
文档属性
| 名称 | 第三单元物质构成的奥秘单元测试卷-2021-2022学年九年级化学人教版上册(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 107.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-28 17:20:10 | ||
图片预览




文档简介
第三单元 物质构成的奥秘单元测试
一、单选题(每空2分,共18小题)
1.近年来,我国的航空航天技术迅速发展,建立了多个太空空间实验站。空间站中的氧气源自电解水,所得的H2和CO2反应生成了H2O和 CH4,该反应的微观示意图如下,下列说法错误的是
A.反应前后分子种类没变 B.反应前后原子种类没变
C.反应中分子可分 D.原子可以构成分子
2.为了预防新型冠状肺炎的传播,学校采用喷洒酒精消毒,喷洒后教室内会充满了酒精味,这说明
A.分子之间有间隔 B.分子的体积很小
C.分子可以再分 D.分子是不断运动的?
3.下列相关说法用粒子的知识解释错误的是
相关说法 解释
A 车胎受热膨胀 分子体积增大
B 酒精和水混合后体积小于二者之和 分子之间有间隔
C 品红在水中扩散 分子不断运动
D 一氧化碳和二氧化碳化学性质不同 分子构成不同
A.A B.B C.C D.D
4.以下事实对应的解释错误的是
A.氧气分子加压间隔变小,所以6000L 氧气加压后能装入40L的钢瓶中
B.用隧道扫描显微镜才能观察到苯分子——分子很小
C.水通电生成氢气和氧气——化学反应中分子发生了改变
D.氧气具有可燃性,所以可作为燃料
5.下列各图中“”和“”分别表示两种不同的原子,其中属于纯净物的是
A. B.
C. D.
6.原子核由什么组成的
A.电子和质子构成 B.质子和中子构成
C.电子和中子构成 D.质子、中子和电子构成
7.1854年法国化学家德维尔在实验室中意外地发现一种新原子。已知该原子的原子核中含有40个微粒,其中14个微粒不带电,则该原子的核外电子数为
A.13 B.14 C.26 D.40
8.下列物质由分子构成的是
A.氯化钠 B.铝 C.金刚石 D.水
9.下面说法正确的是
A.分子是构成物质的最小粒子 B.原子是最小粒子
C.分子是化学变化中的最小粒子 D.原子在化学变化中不能再分
10.下列各组物质中,都由离子构成的一组是
A.氯化钾、硝酸铵 B.氯化氢、硫酸镁
C.甲烷、干冰 D.钠、钾
11.具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质,下列四组粒子中属于等电子体的共有
①NO和O2②CO和N2③SO2和CO2④和。
A.1组 B.2组 C.3组 D.4组
12.下列结构示意图所表示的微粒,属于同种元素的是
A.①② B.②③ C.③④ D.①④
13.不稳定的原子得、失电子形成离子后,一定不会引起变化的是
①元素种类 ②化学性质 ③相对原子质量 ④微粒的电性 ⑤原子核 ⑥电子层数 ⑦最外层电子数 ⑧核外电子总数
A.①③⑤ B.②④⑥⑧ C.②⑤ D.①⑤
14.下列有关钴元素的说法不正确的是
A.原子序数是27 B.Co既表示一个钴元素又表示一氧化碳
C.元素符号是Co D.2Co表示2个钴原子
15.地壳中含量最多的金属元素是
A.Si B.Fe C.O D.Al
16.日常生活中常接触到的“高钙奶”、“加碘盐”等食品中,“钙”、“碘”指的是
A.原子 B.离子 C.元素 D.分子
17.下列有关空气的说法错误的是
A.空气的成分按体积计算,氮气约78%,氧气约21%
B.组成混合物的各种成分保持着它们各自的性质
C.工业利用空气制氧气属于物理变化
D.空气质量指数越高,空气质量越好,可吸入颗粒物、PM2.5都是造成空气污染的主要污染物
18.下列粒子结构示意图,表示阳离子的是
A. B. C. D.
二、填空题(第19和20题每空1分,其余每空2分,共9小题)
19.用微粒的观点解释下列现象∶
(1)水变成水蒸气,体积变大是因为∶______;
(2)水在加热后比常温下蒸发的更快∶______;
(3)过氧化氢和水的组成元素相同但化学性质不同∶______;
(4)空气是混合物,而氧气是纯净物∶______。
20.学好化学不仅能感受到化学之美,还能形成一些合理的化学观念。以氧气为例回答下列问题:
(1)物质的多样性:人们发现和合成的物质已有上亿种。氧气属于_____(填“混合物”或“纯净物”)。
(2)物质是变化的:氧气降温后可变成液氧,该变化的微观过程是_____。
(3)物质间可以转化。氧气可转化为二氧化碳,其转化的文字表达式为_____。
21.氧是地壳中含量最多的元素,氧及其化合物是化学学习和研究的重要内容。
(1)如图氧原子结构示意图获得的信息,正确的是______(填标号)。
a.表示原子核,带8个单位正电荷
b.氧原子核外有2个电子层,有8个电子在核外作高速运动
c.氧原子在化学反应中易失去电子形成离子(O2-)
(2)氧气经降温和加压变为液态氧后体积变小,用微粒的观点解释:__________。
(3)生活在小河中的鱼儿能够呼吸,主要是由于河水中含有______(填标号)。
A.氧元素 B.氧分子 C.水分子 D.氧原子
22.已知一个碳原子(质子数、中子数均为6)的质量为a kg,一个R原子的质量为b kg,则R原子的相对原子质量为______(用含a、b的代数式表示,下同),若R原子的质子数比中子数少2,则R原子的质子数为______。
23.原子由质子、中子、电子等粒子构成,若以“〇”“”“”分别代表电子、中子、质子,如图为各微粒的结构示意图,其中属于同种元素的是______,带正电的是______。
24.用质子数、中子数、原子核、电子数、最外层电子数等填空。(每空只填一项)
(1)决定原子种类的是______;
(2)决定原子质量的是______;
(3)决定原子化学性质的是原子的______;
(4)决定元素种类的是______。
25.按要求填空。
(1)用化学符号表示:
①保持氧气化学性质的最小粒子是______;
②过氧化氢分解过程中的最小粒子______;
③构成氯化钠的粒子______。
(2)简答。
①用量筒测量液体体积,读数时视线应______;
②将浑浊的河水过滤后,滤液依然是浑浊的原因可能是______;(只需答出一点即可)
③小华同学想用已经调节平衡的托盘天平称取7.5g高锰酸钾粉末,在称量过程中他发现天平指针向左偏移,接下来他应该进行的操作是______。
26.在分子、原子、原子核、质子、中子、电子等粒子中找出符合下列条件的粒子填空。
(1)能直接构成纯净物的是______;
(2)质量最小的是______;
(3)化学变化中最小的粒子是______;
(4)带正电荷的是______;
(5)不显电性的是______。
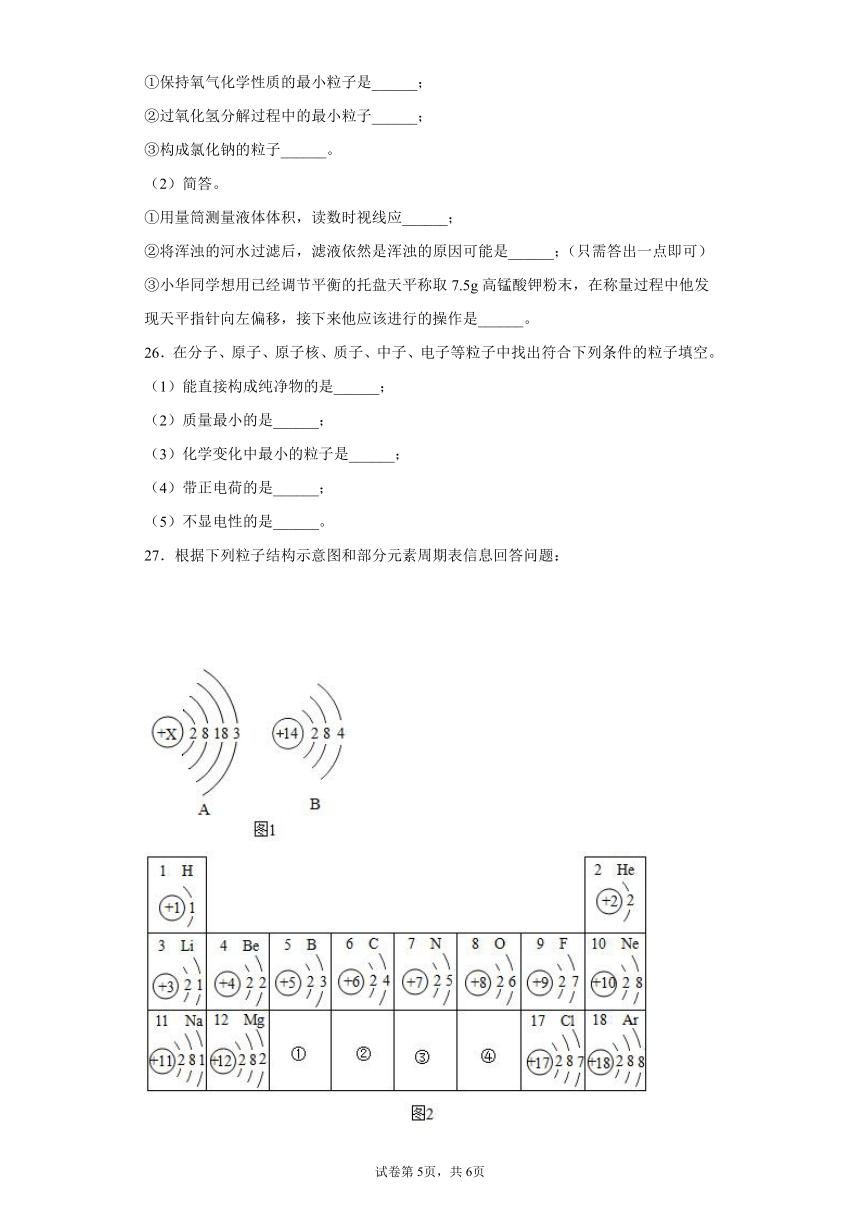
27.根据下列粒子结构示意图和部分元素周期表信息回答问题:
(1)图1中A是镓元素的原子结构示意图,其中x的值为______。属于______元素(填“金属”或“非金属”),在元素周期表中应属于第______周期。
(2)图1中B是某元素的原子结构示意图。写出该元素在图2中的位置:______(选填①--④中的合适的序号,下同)。
(3)镓元素广泛应用于第三代半导体材料中,它的化学性质与图2中______(填序号)位置的元素相似。
(4)某粒子的结构示意图为,当x-y=8时,该粒子的符号为______。
试卷第2页,共2页
试卷第1页,共1页
参考答案
1.A
【详解】
A、由图可知,反应前的分子有氢分子和二氧化碳分子,反应后的新分子是水分子和甲烷分子,即反应前后分子的种类发生了变化,选项错误;
B、由图可知,反应前的分子中共含有氢原子、碳原子和氧原子三种原子,反应后的分子中也含有氢原子、碳原子和氧原子三种原子,即反应前后原子的种类没有变化,选项正确;
C、由图可知,反应前的分子有氢分子和二氧化碳分子,反应后的新分子是水分子和甲烷分子,即反应前后分子发生了变化,选项正确;
D、由图可知,图中的氢分子由氢原子构成,二氧化碳分子由碳原子和氧原子构成,水分子由氢原子和氧原子构成,甲烷分子由碳原子和氢原子构成,即原子构成分子,选项正确,故选A。
2.D
【详解】
喷洒酒精消毒,喷洒后教室内会充满了酒精味,说明分子在不断运动,不能说明分子之间有间隔,分子的体积小,也不能说明分子可以再分。
故选D。
3.A
【详解】
A、车胎受热膨胀,是因为温度升高,分子之间的间隔变大,分子的体积不变,符合题意;
B、酒精和水混合后体积小于二者之和,是因为分子之间有间隔,水分子和酒精分子互相跑到了对方的间隔中去,不符合题意;
C、品红在水中扩散,是因为分子在不断运动,不符合题意;
D、分子是保持物质化学性质的最小粒子,一氧化碳和二氧化碳化学性质不同,是因为分子构成不同,不符合题意。
故选A。
4.D
【详解】
A、分子之间的间隔随温度升高而增大,随压强的增大而减小,氧气分子加压间隔变小,所以6000L 氧气加压后能装入40L的钢瓶中,选项正确,不符合题意;
B、用隧道扫描显微镜才能观察到苯分子说明分子体积很小,选项正确,不符合题意;
C、水通电生成氢气和氧气,即水分子变成氧气分子和氢气分子,故化学反应中分子发生了改变,选项正确,不符合题意;
D、氧气具有助燃性,所以可帮助物质燃烧更旺,更充分,选项错误,符合题意。
故选D。
5.B
【分析】
由一种物质组成的物质叫纯净物。由两种或两种以上混合而成的物质是混合物。
【详解】
A、图中有两种分子,是混合物;
B、图中有一种分子,是纯净物;
C、图中有两种分子,是混合物;
D、图中有两种分子,是混合物。
故选B。
6.B
【详解】
原子核一般是由质子和中子构成的,电子在原子核外;故选B。
7.C
【详解】
原子一般是由质子、中子、电子构成的,其中中子不带电,一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,已知该元素的一个原子原子核中14个微粒不带电,也就是说有14个中子,质子数40﹣14=26,原子中电子数=质子数,故核外电子数为26,故选:C。
8.D
【详解】
A、氯化钠是由钠离子和氯离子构成的,故A错误;
B、铝是由铝原子直接构成的,故B错误;
C、金刚石是由碳原子直接构成,故C错误;
D、水是由水分子直接构成的,故D正确。
故选:D。
9.D
【分析】
构成物质的微粒有分子、原子和离子,分子由原子构成,原子得失电子变成离子,离子得失电子也可变成原子。
【详解】
A、构成物质的微粒有分子、原子和离子,分子由原子构成,所以分子并不是构成物质的最小粒子,选项错误,不符合题意;
B、原子由居于原子中心的原子核和核外电子构成,所以原子不是最小粒子,选项错误,不符合题意;
C、原子是化学变化中的最小粒子,分子是保持物质化学性质的最小粒子,选项错误,不符合题意;
D、原子是化学变化中的最小粒子,所以原子在化学变化中不能再分,选项正确,符合题意。
故选D。
10.A
【分析】
分子、原子或离子都可以构成物质,大多数固态非金属单质、金属和稀有气体是由原子直接构成的,气态的非金属单质和由非金属元素组成的化合物是由分子构成的,一般含有金属元素和非金属元素的化合物是由离子构成的。
【详解】
A、氯化钾是由钾离子、氯离子构成的,硝酸铵是由铵根离子、硝酸根离子构成的,符合题意;
B、氯化氢是由氯化氢分子构成的,硫酸镁是由镁离子、硫酸根离子构成的,不符合题意;
C、甲烷、干冰都是由分子构成的,不符合题意;
D、钠、钾都属于金属,都是由原子构成的,不符合题意;
故选A。
11.B
【分析】
【详解】
①原子中质子数=核外电子数。1个NO分子有2个原子,15个电子,O2有2个原子16个电子,不是等电子体。
②1个CO分子有2个原子14个电子。1个N2分子有2个原子14个电子,是等电子体。
③1个SO2分子有3个原子32个电子。1个CO2分子有3个原子22个电子,不是等电子体。
④1个有5个原子,47+3=50个电子, 1个有5个原子,48+2=50个电子,是等电子体。
所以有2组等电子体,故选B。
12.B
【详解】
元素是具有相同质子数(或核电荷数)的一类原子的总称,同种元素的质子数即核电荷数相同,②③核电荷数均为11,所以②③为同种元素;
故选B。
13.A
【详解】
①原子得、失电子后,质子数不变,元素种类不变,正确;
②原子得、失电子后,最外层电子数发生了改变,化学性质发生了改变,错误;
③相对原子质量=质子数+中子数,原子得、失电子后,质子数和中子数不变,相对原子质量不变,正确;
④原子不带电,原子得失电子后,带负电或正电,微粒的电性发生了改变,错误;
⑤原子核是由质子和中子构成,没有发生改变,正确;
⑥原子得失电子后,电子层数可能改变,如钠原子失去电子形成钠离子,电子层数发生了改变,错误;
⑦原子得失电子后,最外层电子数一定发生了改变,错误;
⑧原子得失电子后,核外电子总数一定发生了改变,错误。
故不会引起变化的是①③⑤。
故选A。
14.B
【详解】
A、由元素周期表小方格可知,左上角数字表示原子序数,故原子素数是27,A正确。
B、Co可以表示钴元素,不能表示一氧化碳,B错误。
C、元素周期表小方格右上角符号表示元素符号,C正确。
D、元素符号前面数字,表示原子个数,D正确。
故选:B。
15.D
【详解】
地壳中元素含量由多到少的顺序是:氧、硅、铝、铁等,则地壳中含量最多的金属元素是铝,故选D。
16.C
【详解】
物质是由元素组成的,这里的“钙”、“碘”指的是物质的组成,应用元素来描述,故选C。
17.D
【详解】
A、按体积计算,空气中含有氮气约78%,氧气约21%,说法正确。
B、混合物,各成分保持着它们各自的性质,说法正确。
C、工业上分离液态空气制氧气,是利用物质沸点的差异进行分离,没有新物质生成,属于物理变化,说法正确。
D、可吸入颗粒物、PM2.5都是造成空气污染的主要污染物,但空气质量指数越高,说明空气质量越差,说法错误。
故选:D。
18.B
【分析】
【详解】
A、质子数(9)<电子数(10),是阴离子。
B、质子数(12)>电子数(10),是阳离子。
C、质子数(10)=电子数(10),是原子。
D、质子数(17)<电子数(18),是阴离子。
故选B。
【点睛】
19.
(1)分子间隔变大
(2)温度升高分子运动速率加快
(3)分子的构成不同
(4)空气由氧分子、氮分子、二氧化碳分子等构成,氧气由氧分子一种粒子构成
【分析】
(1)
水变成水蒸气,是液态变为气态,体积变大是因为分子间隔变大;
(2)
水在加热后比常温下蒸发的更快,是因为温度升高分子运动速率加快;
(3)
由分子构成的物质,分子是保持物质化学性质的最小微粒,过氧化氢和水的组成元素相同但化学性质不同,原因是分子的构成不同;
(4)
空气由氧分子、氮分子、二氧化碳分子等构成,所以空气是混合物,而氧气由氧分子一种粒子构成,所以氧气是纯净物。
20.
(1)纯净物
(2)温度降低,氧分子间间隔减小
(3)木炭+氧气二氧化碳
【分析】
(1)
氧气是由一种物质组成的,是纯净物。故答案为:纯净物。
(2)
氧气降温后可变成液氧,该变化的微观过程是温度降低,氧分子间间隔减小。故答案为:温度降低,氧分子间间隔减小。
(3)
碳燃烧生成二氧化碳,其转化的文字表达式为:木炭+氧气二氧化碳。故答案为:木炭+氧气二氧化碳。
21.
(1)ab
(2)氧分子之间有间隔,在受压时间隔变小
(3)B
【分析】
(1)
a、根据氧原子的结构示意图可知,圆圈代表原子核,圆圈内的数字代表质子数,质子数为8,带8个单位正电荷,说法正确;
b、由氧原子的结构示意图可知,氧原子核外有2个电子层,有8个电子在核外作高速运动,说法正确;
c、氧原子最外层电子数为6,大于4,在化学反应中易得到电子形成氧离子(O2-),说法不正确;
故选ab;
(2)
氧气经降温和加压变为液态氧后体积变小,由于氧分子之间有间隔,在受压时间隔变小,故填:氧分子之间有间隔,在受压时间隔变小;
(3)
氧气能供给呼吸,氧气是由氧分子构成,生活在小河中的鱼儿能够呼吸,主要是由于河水中含有氧分子;
故选B。
22.12b/a 6b/a-1或(6b-a)/a
【详解】
R原子的相对原子质量为= ,设质子数为x,故x+2+x=,x=6b/a-1或(6b-a)/a,故填:12b/a;6b/a-1或(6b-a)/a。
23.AD C
【详解】
元素是质子数相同的一类原子的总称,AD质子数相同,属于同种元素;
A、质子数=核外电子数,不带电,不符合题意;
B、质子数=核外电子数,不带电,不符合题意;
C、质子数大于核外电子数,带正电,符合题意;
D、质子数小于核外电子数,带负电,不符合题意。
故选C。
24.
(1)质子数
(2)原子核
(3)最外层电子数
(4)质子数
【分析】
(1)
决定原子种类的是质子数;
(2)
原子由原子核和核外电子构成,电子的质量很小,可忽略不计,故决定原子质量的是原子核;
(3)
决定原子化学性质的是原子的最外层电子数,最外层电子数相同,化学性质相似;
(4)
元素是质子数相同的一类原子的总称,故决定元素种类的是质子数。
25.
(1) O2 O、H Na+、Cl﹣
(2) 与凹液面最低处保持水平 滤纸破损(或液面高于滤纸的边缘、盛接滤液的烧杯不干净等) 取出少量高锰酸钾,直到天平平衡
【分析】
(1)
①氧气由氧分子构成,氧气的化学性质由氧分子保持,分子用化学式表示,氧分子表示为O2;
②原子是化学变化中的最小粒子,过氧化氢分解过程中的最小粒子是氧原子和氢原子,表示为O、H;
③氯化钠由钠离子和氯离子构成,钠离子和氯离子分别表示为Na+、Cl﹣;
故填:O2;O、H;Na+、Cl﹣。
(2)
①用量筒测量液体体积,读数时视线应与凹液面最低处保持水平;
②将浑浊的河水过滤后,滤液依然是浑浊的原因可能是滤纸破损(会使得液体中的不溶物进入下面的烧杯,从而使得滤液浑浊)、液面高于滤纸的边缘(会使部分液体未经过滤纸的过滤直接流下,该操作会使滤液仍然浑浊)或盛接滤液的烧杯不干净等;
③用已经调节平衡的托盘天平称取7.5g高锰酸钾粉末,在称量过程中天平指针向左偏移,说明高锰酸钾取多了,应该取出少量高锰酸钾,直到天平平衡。
故填:与凹液面最低处保持水平;滤纸破损(或液面高于滤纸的边缘、盛接滤液的烧杯不干净等);取出少量高锰酸钾,直到天平平衡。
26.
(1)分子、原子
(2)电子
(3)原子
(4)原子核、质子
(5)分子、原子、中子
【分析】
(1)
分子、原子能直接构成纯净物,故填:分子、原子。
(2)
电子质量最小,可忽略不计,故填:电子。
(3)
化学变化中最小的粒子是原子,故填:原子。
(4)
原子核和质子带正电,故填:原子核、质子。
(5)
分子、原子、中子不显电性,故填:分子、原子、中子。
27.
(1) 31 金属 四(或4)
(2)②
(3)①
(4)S2-
【分析】
(1)
原子中,核电荷数=核外电子数,x=2+8+18+3=31,镓带“钅”属于金属元素,核外四个电子层,属于第四周期元素,故填:31;金属;四(或4)。
(2)
B是14号元素,位于②位置,故填:②。
(3)
最外层电子数相同,化学性质相似,镓元素它的化学性质与图2中①位置的元素相似,故填:①。
(4)
当x-y=8时,核电荷数小于核外电子数,属于阴离子,并且是得到了两个电子,为硫离子,故填:S2-。答案第1页,共2页
答案第1页,共2页
一、单选题(每空2分,共18小题)
1.近年来,我国的航空航天技术迅速发展,建立了多个太空空间实验站。空间站中的氧气源自电解水,所得的H2和CO2反应生成了H2O和 CH4,该反应的微观示意图如下,下列说法错误的是
A.反应前后分子种类没变 B.反应前后原子种类没变
C.反应中分子可分 D.原子可以构成分子
2.为了预防新型冠状肺炎的传播,学校采用喷洒酒精消毒,喷洒后教室内会充满了酒精味,这说明
A.分子之间有间隔 B.分子的体积很小
C.分子可以再分 D.分子是不断运动的?
3.下列相关说法用粒子的知识解释错误的是
相关说法 解释
A 车胎受热膨胀 分子体积增大
B 酒精和水混合后体积小于二者之和 分子之间有间隔
C 品红在水中扩散 分子不断运动
D 一氧化碳和二氧化碳化学性质不同 分子构成不同
A.A B.B C.C D.D
4.以下事实对应的解释错误的是
A.氧气分子加压间隔变小,所以6000L 氧气加压后能装入40L的钢瓶中
B.用隧道扫描显微镜才能观察到苯分子——分子很小
C.水通电生成氢气和氧气——化学反应中分子发生了改变
D.氧气具有可燃性,所以可作为燃料
5.下列各图中“”和“”分别表示两种不同的原子,其中属于纯净物的是
A. B.
C. D.
6.原子核由什么组成的
A.电子和质子构成 B.质子和中子构成
C.电子和中子构成 D.质子、中子和电子构成
7.1854年法国化学家德维尔在实验室中意外地发现一种新原子。已知该原子的原子核中含有40个微粒,其中14个微粒不带电,则该原子的核外电子数为
A.13 B.14 C.26 D.40
8.下列物质由分子构成的是
A.氯化钠 B.铝 C.金刚石 D.水
9.下面说法正确的是
A.分子是构成物质的最小粒子 B.原子是最小粒子
C.分子是化学变化中的最小粒子 D.原子在化学变化中不能再分
10.下列各组物质中,都由离子构成的一组是
A.氯化钾、硝酸铵 B.氯化氢、硫酸镁
C.甲烷、干冰 D.钠、钾
11.具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质,下列四组粒子中属于等电子体的共有
①NO和O2②CO和N2③SO2和CO2④和。
A.1组 B.2组 C.3组 D.4组
12.下列结构示意图所表示的微粒,属于同种元素的是
A.①② B.②③ C.③④ D.①④
13.不稳定的原子得、失电子形成离子后,一定不会引起变化的是
①元素种类 ②化学性质 ③相对原子质量 ④微粒的电性 ⑤原子核 ⑥电子层数 ⑦最外层电子数 ⑧核外电子总数
A.①③⑤ B.②④⑥⑧ C.②⑤ D.①⑤
14.下列有关钴元素的说法不正确的是
A.原子序数是27 B.Co既表示一个钴元素又表示一氧化碳
C.元素符号是Co D.2Co表示2个钴原子
15.地壳中含量最多的金属元素是
A.Si B.Fe C.O D.Al
16.日常生活中常接触到的“高钙奶”、“加碘盐”等食品中,“钙”、“碘”指的是
A.原子 B.离子 C.元素 D.分子
17.下列有关空气的说法错误的是
A.空气的成分按体积计算,氮气约78%,氧气约21%
B.组成混合物的各种成分保持着它们各自的性质
C.工业利用空气制氧气属于物理变化
D.空气质量指数越高,空气质量越好,可吸入颗粒物、PM2.5都是造成空气污染的主要污染物
18.下列粒子结构示意图,表示阳离子的是
A. B. C. D.
二、填空题(第19和20题每空1分,其余每空2分,共9小题)
19.用微粒的观点解释下列现象∶
(1)水变成水蒸气,体积变大是因为∶______;
(2)水在加热后比常温下蒸发的更快∶______;
(3)过氧化氢和水的组成元素相同但化学性质不同∶______;
(4)空气是混合物,而氧气是纯净物∶______。
20.学好化学不仅能感受到化学之美,还能形成一些合理的化学观念。以氧气为例回答下列问题:
(1)物质的多样性:人们发现和合成的物质已有上亿种。氧气属于_____(填“混合物”或“纯净物”)。
(2)物质是变化的:氧气降温后可变成液氧,该变化的微观过程是_____。
(3)物质间可以转化。氧气可转化为二氧化碳,其转化的文字表达式为_____。
21.氧是地壳中含量最多的元素,氧及其化合物是化学学习和研究的重要内容。
(1)如图氧原子结构示意图获得的信息,正确的是______(填标号)。
a.表示原子核,带8个单位正电荷
b.氧原子核外有2个电子层,有8个电子在核外作高速运动
c.氧原子在化学反应中易失去电子形成离子(O2-)
(2)氧气经降温和加压变为液态氧后体积变小,用微粒的观点解释:__________。
(3)生活在小河中的鱼儿能够呼吸,主要是由于河水中含有______(填标号)。
A.氧元素 B.氧分子 C.水分子 D.氧原子
22.已知一个碳原子(质子数、中子数均为6)的质量为a kg,一个R原子的质量为b kg,则R原子的相对原子质量为______(用含a、b的代数式表示,下同),若R原子的质子数比中子数少2,则R原子的质子数为______。
23.原子由质子、中子、电子等粒子构成,若以“〇”“”“”分别代表电子、中子、质子,如图为各微粒的结构示意图,其中属于同种元素的是______,带正电的是______。
24.用质子数、中子数、原子核、电子数、最外层电子数等填空。(每空只填一项)
(1)决定原子种类的是______;
(2)决定原子质量的是______;
(3)决定原子化学性质的是原子的______;
(4)决定元素种类的是______。
25.按要求填空。
(1)用化学符号表示:
①保持氧气化学性质的最小粒子是______;
②过氧化氢分解过程中的最小粒子______;
③构成氯化钠的粒子______。
(2)简答。
①用量筒测量液体体积,读数时视线应______;
②将浑浊的河水过滤后,滤液依然是浑浊的原因可能是______;(只需答出一点即可)
③小华同学想用已经调节平衡的托盘天平称取7.5g高锰酸钾粉末,在称量过程中他发现天平指针向左偏移,接下来他应该进行的操作是______。
26.在分子、原子、原子核、质子、中子、电子等粒子中找出符合下列条件的粒子填空。
(1)能直接构成纯净物的是______;
(2)质量最小的是______;
(3)化学变化中最小的粒子是______;
(4)带正电荷的是______;
(5)不显电性的是______。
27.根据下列粒子结构示意图和部分元素周期表信息回答问题:
(1)图1中A是镓元素的原子结构示意图,其中x的值为______。属于______元素(填“金属”或“非金属”),在元素周期表中应属于第______周期。
(2)图1中B是某元素的原子结构示意图。写出该元素在图2中的位置:______(选填①--④中的合适的序号,下同)。
(3)镓元素广泛应用于第三代半导体材料中,它的化学性质与图2中______(填序号)位置的元素相似。
(4)某粒子的结构示意图为,当x-y=8时,该粒子的符号为______。
试卷第2页,共2页
试卷第1页,共1页
参考答案
1.A
【详解】
A、由图可知,反应前的分子有氢分子和二氧化碳分子,反应后的新分子是水分子和甲烷分子,即反应前后分子的种类发生了变化,选项错误;
B、由图可知,反应前的分子中共含有氢原子、碳原子和氧原子三种原子,反应后的分子中也含有氢原子、碳原子和氧原子三种原子,即反应前后原子的种类没有变化,选项正确;
C、由图可知,反应前的分子有氢分子和二氧化碳分子,反应后的新分子是水分子和甲烷分子,即反应前后分子发生了变化,选项正确;
D、由图可知,图中的氢分子由氢原子构成,二氧化碳分子由碳原子和氧原子构成,水分子由氢原子和氧原子构成,甲烷分子由碳原子和氢原子构成,即原子构成分子,选项正确,故选A。
2.D
【详解】
喷洒酒精消毒,喷洒后教室内会充满了酒精味,说明分子在不断运动,不能说明分子之间有间隔,分子的体积小,也不能说明分子可以再分。
故选D。
3.A
【详解】
A、车胎受热膨胀,是因为温度升高,分子之间的间隔变大,分子的体积不变,符合题意;
B、酒精和水混合后体积小于二者之和,是因为分子之间有间隔,水分子和酒精分子互相跑到了对方的间隔中去,不符合题意;
C、品红在水中扩散,是因为分子在不断运动,不符合题意;
D、分子是保持物质化学性质的最小粒子,一氧化碳和二氧化碳化学性质不同,是因为分子构成不同,不符合题意。
故选A。
4.D
【详解】
A、分子之间的间隔随温度升高而增大,随压强的增大而减小,氧气分子加压间隔变小,所以6000L 氧气加压后能装入40L的钢瓶中,选项正确,不符合题意;
B、用隧道扫描显微镜才能观察到苯分子说明分子体积很小,选项正确,不符合题意;
C、水通电生成氢气和氧气,即水分子变成氧气分子和氢气分子,故化学反应中分子发生了改变,选项正确,不符合题意;
D、氧气具有助燃性,所以可帮助物质燃烧更旺,更充分,选项错误,符合题意。
故选D。
5.B
【分析】
由一种物质组成的物质叫纯净物。由两种或两种以上混合而成的物质是混合物。
【详解】
A、图中有两种分子,是混合物;
B、图中有一种分子,是纯净物;
C、图中有两种分子,是混合物;
D、图中有两种分子,是混合物。
故选B。
6.B
【详解】
原子核一般是由质子和中子构成的,电子在原子核外;故选B。
7.C
【详解】
原子一般是由质子、中子、电子构成的,其中中子不带电,一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,已知该元素的一个原子原子核中14个微粒不带电,也就是说有14个中子,质子数40﹣14=26,原子中电子数=质子数,故核外电子数为26,故选:C。
8.D
【详解】
A、氯化钠是由钠离子和氯离子构成的,故A错误;
B、铝是由铝原子直接构成的,故B错误;
C、金刚石是由碳原子直接构成,故C错误;
D、水是由水分子直接构成的,故D正确。
故选:D。
9.D
【分析】
构成物质的微粒有分子、原子和离子,分子由原子构成,原子得失电子变成离子,离子得失电子也可变成原子。
【详解】
A、构成物质的微粒有分子、原子和离子,分子由原子构成,所以分子并不是构成物质的最小粒子,选项错误,不符合题意;
B、原子由居于原子中心的原子核和核外电子构成,所以原子不是最小粒子,选项错误,不符合题意;
C、原子是化学变化中的最小粒子,分子是保持物质化学性质的最小粒子,选项错误,不符合题意;
D、原子是化学变化中的最小粒子,所以原子在化学变化中不能再分,选项正确,符合题意。
故选D。
10.A
【分析】
分子、原子或离子都可以构成物质,大多数固态非金属单质、金属和稀有气体是由原子直接构成的,气态的非金属单质和由非金属元素组成的化合物是由分子构成的,一般含有金属元素和非金属元素的化合物是由离子构成的。
【详解】
A、氯化钾是由钾离子、氯离子构成的,硝酸铵是由铵根离子、硝酸根离子构成的,符合题意;
B、氯化氢是由氯化氢分子构成的,硫酸镁是由镁离子、硫酸根离子构成的,不符合题意;
C、甲烷、干冰都是由分子构成的,不符合题意;
D、钠、钾都属于金属,都是由原子构成的,不符合题意;
故选A。
11.B
【分析】
【详解】
①原子中质子数=核外电子数。1个NO分子有2个原子,15个电子,O2有2个原子16个电子,不是等电子体。
②1个CO分子有2个原子14个电子。1个N2分子有2个原子14个电子,是等电子体。
③1个SO2分子有3个原子32个电子。1个CO2分子有3个原子22个电子,不是等电子体。
④1个有5个原子,47+3=50个电子, 1个有5个原子,48+2=50个电子,是等电子体。
所以有2组等电子体,故选B。
12.B
【详解】
元素是具有相同质子数(或核电荷数)的一类原子的总称,同种元素的质子数即核电荷数相同,②③核电荷数均为11,所以②③为同种元素;
故选B。
13.A
【详解】
①原子得、失电子后,质子数不变,元素种类不变,正确;
②原子得、失电子后,最外层电子数发生了改变,化学性质发生了改变,错误;
③相对原子质量=质子数+中子数,原子得、失电子后,质子数和中子数不变,相对原子质量不变,正确;
④原子不带电,原子得失电子后,带负电或正电,微粒的电性发生了改变,错误;
⑤原子核是由质子和中子构成,没有发生改变,正确;
⑥原子得失电子后,电子层数可能改变,如钠原子失去电子形成钠离子,电子层数发生了改变,错误;
⑦原子得失电子后,最外层电子数一定发生了改变,错误;
⑧原子得失电子后,核外电子总数一定发生了改变,错误。
故不会引起变化的是①③⑤。
故选A。
14.B
【详解】
A、由元素周期表小方格可知,左上角数字表示原子序数,故原子素数是27,A正确。
B、Co可以表示钴元素,不能表示一氧化碳,B错误。
C、元素周期表小方格右上角符号表示元素符号,C正确。
D、元素符号前面数字,表示原子个数,D正确。
故选:B。
15.D
【详解】
地壳中元素含量由多到少的顺序是:氧、硅、铝、铁等,则地壳中含量最多的金属元素是铝,故选D。
16.C
【详解】
物质是由元素组成的,这里的“钙”、“碘”指的是物质的组成,应用元素来描述,故选C。
17.D
【详解】
A、按体积计算,空气中含有氮气约78%,氧气约21%,说法正确。
B、混合物,各成分保持着它们各自的性质,说法正确。
C、工业上分离液态空气制氧气,是利用物质沸点的差异进行分离,没有新物质生成,属于物理变化,说法正确。
D、可吸入颗粒物、PM2.5都是造成空气污染的主要污染物,但空气质量指数越高,说明空气质量越差,说法错误。
故选:D。
18.B
【分析】
【详解】
A、质子数(9)<电子数(10),是阴离子。
B、质子数(12)>电子数(10),是阳离子。
C、质子数(10)=电子数(10),是原子。
D、质子数(17)<电子数(18),是阴离子。
故选B。
【点睛】
19.
(1)分子间隔变大
(2)温度升高分子运动速率加快
(3)分子的构成不同
(4)空气由氧分子、氮分子、二氧化碳分子等构成,氧气由氧分子一种粒子构成
【分析】
(1)
水变成水蒸气,是液态变为气态,体积变大是因为分子间隔变大;
(2)
水在加热后比常温下蒸发的更快,是因为温度升高分子运动速率加快;
(3)
由分子构成的物质,分子是保持物质化学性质的最小微粒,过氧化氢和水的组成元素相同但化学性质不同,原因是分子的构成不同;
(4)
空气由氧分子、氮分子、二氧化碳分子等构成,所以空气是混合物,而氧气由氧分子一种粒子构成,所以氧气是纯净物。
20.
(1)纯净物
(2)温度降低,氧分子间间隔减小
(3)木炭+氧气二氧化碳
【分析】
(1)
氧气是由一种物质组成的,是纯净物。故答案为:纯净物。
(2)
氧气降温后可变成液氧,该变化的微观过程是温度降低,氧分子间间隔减小。故答案为:温度降低,氧分子间间隔减小。
(3)
碳燃烧生成二氧化碳,其转化的文字表达式为:木炭+氧气二氧化碳。故答案为:木炭+氧气二氧化碳。
21.
(1)ab
(2)氧分子之间有间隔,在受压时间隔变小
(3)B
【分析】
(1)
a、根据氧原子的结构示意图可知,圆圈代表原子核,圆圈内的数字代表质子数,质子数为8,带8个单位正电荷,说法正确;
b、由氧原子的结构示意图可知,氧原子核外有2个电子层,有8个电子在核外作高速运动,说法正确;
c、氧原子最外层电子数为6,大于4,在化学反应中易得到电子形成氧离子(O2-),说法不正确;
故选ab;
(2)
氧气经降温和加压变为液态氧后体积变小,由于氧分子之间有间隔,在受压时间隔变小,故填:氧分子之间有间隔,在受压时间隔变小;
(3)
氧气能供给呼吸,氧气是由氧分子构成,生活在小河中的鱼儿能够呼吸,主要是由于河水中含有氧分子;
故选B。
22.12b/a 6b/a-1或(6b-a)/a
【详解】
R原子的相对原子质量为= ,设质子数为x,故x+2+x=,x=6b/a-1或(6b-a)/a,故填:12b/a;6b/a-1或(6b-a)/a。
23.AD C
【详解】
元素是质子数相同的一类原子的总称,AD质子数相同,属于同种元素;
A、质子数=核外电子数,不带电,不符合题意;
B、质子数=核外电子数,不带电,不符合题意;
C、质子数大于核外电子数,带正电,符合题意;
D、质子数小于核外电子数,带负电,不符合题意。
故选C。
24.
(1)质子数
(2)原子核
(3)最外层电子数
(4)质子数
【分析】
(1)
决定原子种类的是质子数;
(2)
原子由原子核和核外电子构成,电子的质量很小,可忽略不计,故决定原子质量的是原子核;
(3)
决定原子化学性质的是原子的最外层电子数,最外层电子数相同,化学性质相似;
(4)
元素是质子数相同的一类原子的总称,故决定元素种类的是质子数。
25.
(1) O2 O、H Na+、Cl﹣
(2) 与凹液面最低处保持水平 滤纸破损(或液面高于滤纸的边缘、盛接滤液的烧杯不干净等) 取出少量高锰酸钾,直到天平平衡
【分析】
(1)
①氧气由氧分子构成,氧气的化学性质由氧分子保持,分子用化学式表示,氧分子表示为O2;
②原子是化学变化中的最小粒子,过氧化氢分解过程中的最小粒子是氧原子和氢原子,表示为O、H;
③氯化钠由钠离子和氯离子构成,钠离子和氯离子分别表示为Na+、Cl﹣;
故填:O2;O、H;Na+、Cl﹣。
(2)
①用量筒测量液体体积,读数时视线应与凹液面最低处保持水平;
②将浑浊的河水过滤后,滤液依然是浑浊的原因可能是滤纸破损(会使得液体中的不溶物进入下面的烧杯,从而使得滤液浑浊)、液面高于滤纸的边缘(会使部分液体未经过滤纸的过滤直接流下,该操作会使滤液仍然浑浊)或盛接滤液的烧杯不干净等;
③用已经调节平衡的托盘天平称取7.5g高锰酸钾粉末,在称量过程中天平指针向左偏移,说明高锰酸钾取多了,应该取出少量高锰酸钾,直到天平平衡。
故填:与凹液面最低处保持水平;滤纸破损(或液面高于滤纸的边缘、盛接滤液的烧杯不干净等);取出少量高锰酸钾,直到天平平衡。
26.
(1)分子、原子
(2)电子
(3)原子
(4)原子核、质子
(5)分子、原子、中子
【分析】
(1)
分子、原子能直接构成纯净物,故填:分子、原子。
(2)
电子质量最小,可忽略不计,故填:电子。
(3)
化学变化中最小的粒子是原子,故填:原子。
(4)
原子核和质子带正电,故填:原子核、质子。
(5)
分子、原子、中子不显电性,故填:分子、原子、中子。
27.
(1) 31 金属 四(或4)
(2)②
(3)①
(4)S2-
【分析】
(1)
原子中,核电荷数=核外电子数,x=2+8+18+3=31,镓带“钅”属于金属元素,核外四个电子层,属于第四周期元素,故填:31;金属;四(或4)。
(2)
B是14号元素,位于②位置,故填:②。
(3)
最外层电子数相同,化学性质相似,镓元素它的化学性质与图2中①位置的元素相似,故填:①。
(4)
当x-y=8时,核电荷数小于核外电子数,属于阴离子,并且是得到了两个电子,为硫离子,故填:S2-。答案第1页,共2页
答案第1页,共2页
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
