1.1 溶液的形成(课件)(26张PPT)
文档属性
| 名称 | 1.1 溶液的形成(课件)(26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-29 00:00:00 | ||
图片预览






文档简介
(共26张PPT)
课题1 溶液的形成
第一单元 溶液
鲁教版(五四制) 化学 九年级
在一只盛有约50mL水的小烧杯中,加入一小匙食盐(主要成分是氯化钠),用玻璃棒搅拌。仔细观察发 生的变化,直至食盐颗粒在水中消失。触摸烧杯,感受温度变化。
思考:
1.食盐颗粒为什么不见了?
2.想一想,这杯食盐水的上部、中部、下部,任一处,是否一样咸?
3.如果把得到的食盐水密封,保存一个月,一年,两年……你猜测会不会从中析出食盐颗粒来?
活动天地
溶解的过程
01
(一)溶液
2、溶液的特性
由一种或几种物质分散到另一种物质里形成均一、稳定的混合物。
一、溶解的过程
均一、稳定,混合物。
1、定义
均一是指溶液中任意一部分的组成和性质完全相同。
稳定是指外界条件不变时(温度、溶剂量、气体压强等),溶质不会从溶剂中分离出来。
溶 质
溶 剂
溶解的过程
(一)溶液
一、溶解的过程
3、溶液的组成
溶液
溶剂
溶质
被溶解的物质叫溶质(可是气体、液体、固体)
起溶解作用的物质叫溶剂(水是最常见的溶剂)
溶液质量=溶质质量+溶剂质量
溶液体积≠溶质体积+溶剂体积
溶解的过程
讨论:溶液中溶质和溶剂是如何确定的
体系 溶质 溶剂
气+液
固+液
液+液 无水
有水
气体
液体
固体
液体
量少
量多
非水物
水
溶解的过程
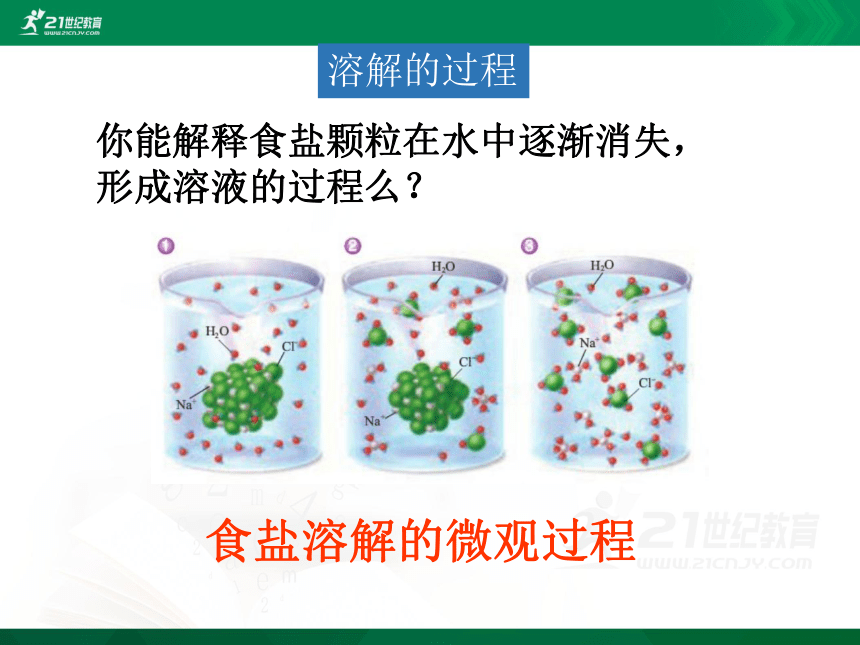
食盐溶解的微观过程
你能解释食盐颗粒在水中逐渐消失,形成溶液的过程么?
溶解的过程
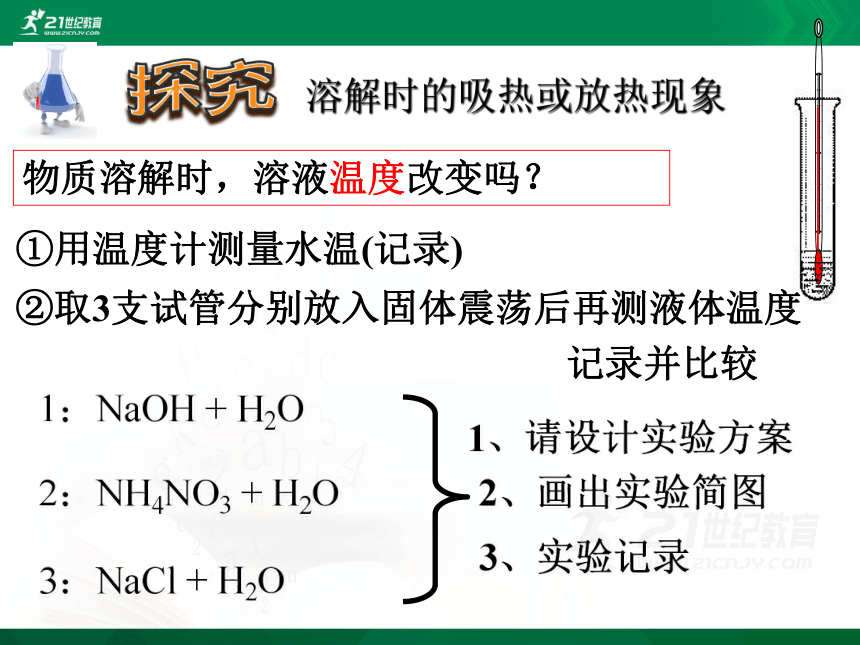
1:NaOH + H2O
2:NH4NO3 + H2O
3:NaCl + H2O
1、请设计实验方案
2、画出实验简图
3、实验记录
①用温度计测量水温(记录)
②取3支试管分别放入固体震荡后再测液体温度
记录并比较
物质溶解时,溶液温度改变吗?
溶解时的吸热或放热现象
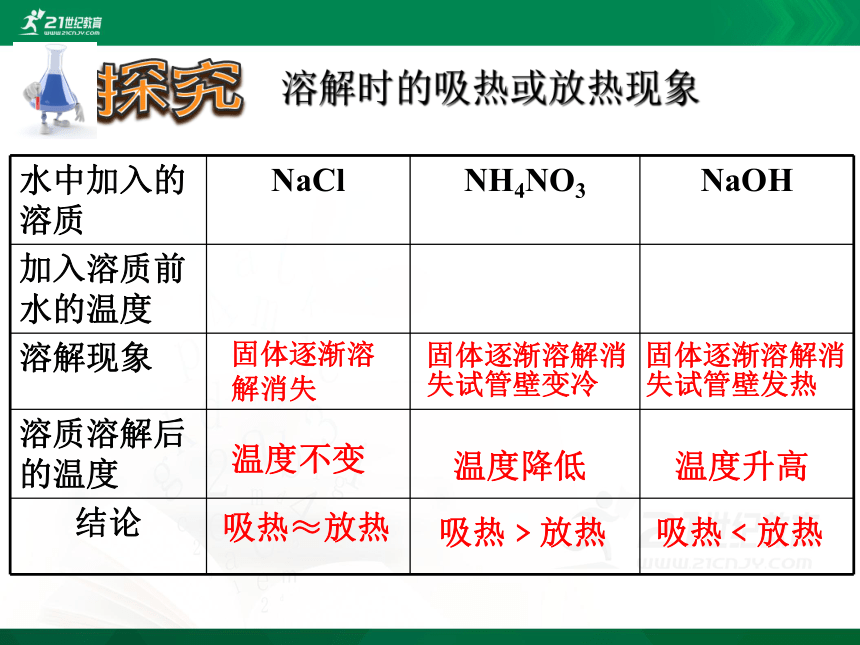
探究
水中加入的溶质 NaCl NH4NO3 NaOH
加入溶质前水的温度
溶解现象
溶质溶解后的温度
结论
吸热﹤放热
吸热≈放热
吸热﹥放热
固体逐渐溶解消失
固体逐渐溶解消失试管壁变冷
固体逐渐溶解消失试管壁发热
温度不变
温度降低
温度升高
溶解时的吸热或放热现象
探究
1、溶质分子(离子)向水中扩散:物理变化---吸热
2、溶质分子(离子)与水分子作用,生成水合分子
(水合离子): 化学变化---放热
这两种变化在溶质的溶解过程中是同时存在的。
吸热﹤ 放热:
溶液温度上升
如1:NaOH + H2O
吸热﹥ 放热:
溶液温度降低
如2:NH4NO3+H2O
吸热 ≈ 放热:
溶液温度变化不大
如3:NaCl + H2O
(二)溶解时的吸热或放热现象
溶解的过程
溶质在溶液中分散成分子或离子,大大增加接触面积,使反应加快。若是药品或营养品变成溶液也更易吸收。
溶液的用途
在溶液里进行的化学反应,通常是较快的。
溶解的过程
乳化现象
02
衣服和餐具上的油污,用水洗不掉。为什么在水中加入洗涤剂就能洗掉呢?
中考热点:
汽油洗油和洗涤剂洗油的原理是否相同?
思考
1、向一只试管中加约1/3体积的水,然后加入两滴食用油,用力振荡,现象是___________________________ 。再静置现象是_________________________。
2、向一只试管中加约1/3体积的汽油,然后加入两滴食用油,振荡,现象是________________________。再静置现象是_________________________。
3、向1中的试管中加入几滴洗洁精,振荡,现象是___________________________ 。
食用油不溶解,水中有大颗粒油珠
食用油与水分层
食用油溶解于汽油
食用油与汽油不分层
食用油以极小的颗粒分散在水中
溶解
乳化
探究
乳浊液
乳化现象
滴加乳化剂
振 荡
静 置
液体分层
振 荡
静 置
植物油有没有溶解在水中
探究
像洗洁精、洗衣粉和洗发液等物质可以使食用油以细小的液滴的形态分散在水中,形成不易分层、比较稳定的混合物,这种现象叫做乳化现象。
这是洗涤剂能去油污的原理。
二、乳化现象
乳化现象
一般来说洗涤剂、洗洁精、洗发水中都有乳化剂,能将大的油污变成细小的油滴。
洗洁精等常见乳化剂
乳化现象
饱和溶液与
不饱和溶液
03
在一杯水中是不是可以无限地溶解溶质呢?
操作 向20mL水中 加入5gKNO3搅拌 再加入5gKNO3搅拌 再加入10mL水搅拌
现象
结论
分析 全部溶解
部分未溶KNO3又溶解
部分不溶
①5gKNO3能溶解在20mL水中
②10gKNO3不能全部溶解在20mL水中,杯底有少许固体NaCl
③再加入10mL水可以把未溶的KNO3又全部溶解
KNO3不能无限制地溶解在一定量水中
1.在一杯水中是不是可以无限地溶解KNO3呢?
探究
操作 现象 结论
加入5gKNO3搅拌
再加入5gKNO3搅拌 …… …… 加热 再加入5gKNO3搅拌 冷却 全部溶解
有晶体析出
2.改变温度,杯底没溶的KNO3固体能否继续溶解呢?
探究
温度可以影响KNO3的溶解能力
全部溶解
部分不溶
部分未溶KNO3又溶解
物质无法在一定量的溶剂里无限制地溶解。但是若改变条件(温度、溶剂的量等)可以使物质继续溶解。
1.饱和溶液:
在一定温度下,在一定量的溶剂里,不能再继续溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
不饱和溶液:
在一定温度下,在一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
三、饱和溶液与不饱和溶液
饱和溶液与不饱和溶液
室温,5gKNO3在20mL
水中得到不饱和溶液
↓
+5gNaCl
室温,10gKNO3在20mL水中得到
饱和溶液和少许NaCl固体
+ 5mL水
↓
室温,10gKNO3在25mL水中得到
不饱和溶液
室温,5gKNO3在20mL
水中得到不饱和溶液
室温,10gKNO3在20mL水中得到
饱和溶液和少许KNO3固体
升高温度下,10gKNO3在20mL水中得到不饱和溶液
↓
+5gKNO3
升高温度
↓
结论:饱和与不饱和是相对而言的,在一定条件下它们是互相转变的。只有在指明“一定量的溶剂里”和“一定温度下”,“饱和”和“不饱和”才有确定的意义。
饱和溶液 的二要素: “一定量的溶剂里”和“一定温度下” 。
饱和溶液与不饱和溶液
2.固体物质的饱和溶液与不饱和溶液在一定条件下可以互相转化(大多数物质)
不饱和
溶液
饱和
溶液
增加溶剂或升高温度
增加溶质或降低温度或蒸发溶剂
饱和溶液与不饱和溶液
3.确定某种溶液是否饱和的方法
一般来说,要确定某一溶液是否饱和,只要看在一定温度下,有没有溶解的剩余溶质存在,如有,且溶质的量不再减少,那么这种溶液就是饱和溶液。
饱和溶液与不饱和溶液
谢谢聆听
课题1 溶液的形成
第一单元 溶液
鲁教版(五四制) 化学 九年级
在一只盛有约50mL水的小烧杯中,加入一小匙食盐(主要成分是氯化钠),用玻璃棒搅拌。仔细观察发 生的变化,直至食盐颗粒在水中消失。触摸烧杯,感受温度变化。
思考:
1.食盐颗粒为什么不见了?
2.想一想,这杯食盐水的上部、中部、下部,任一处,是否一样咸?
3.如果把得到的食盐水密封,保存一个月,一年,两年……你猜测会不会从中析出食盐颗粒来?
活动天地
溶解的过程
01
(一)溶液
2、溶液的特性
由一种或几种物质分散到另一种物质里形成均一、稳定的混合物。
一、溶解的过程
均一、稳定,混合物。
1、定义
均一是指溶液中任意一部分的组成和性质完全相同。
稳定是指外界条件不变时(温度、溶剂量、气体压强等),溶质不会从溶剂中分离出来。
溶 质
溶 剂
溶解的过程
(一)溶液
一、溶解的过程
3、溶液的组成
溶液
溶剂
溶质
被溶解的物质叫溶质(可是气体、液体、固体)
起溶解作用的物质叫溶剂(水是最常见的溶剂)
溶液质量=溶质质量+溶剂质量
溶液体积≠溶质体积+溶剂体积
溶解的过程
讨论:溶液中溶质和溶剂是如何确定的
体系 溶质 溶剂
气+液
固+液
液+液 无水
有水
气体
液体
固体
液体
量少
量多
非水物
水
溶解的过程
食盐溶解的微观过程
你能解释食盐颗粒在水中逐渐消失,形成溶液的过程么?
溶解的过程
1:NaOH + H2O
2:NH4NO3 + H2O
3:NaCl + H2O
1、请设计实验方案
2、画出实验简图
3、实验记录
①用温度计测量水温(记录)
②取3支试管分别放入固体震荡后再测液体温度
记录并比较
物质溶解时,溶液温度改变吗?
溶解时的吸热或放热现象
探究
水中加入的溶质 NaCl NH4NO3 NaOH
加入溶质前水的温度
溶解现象
溶质溶解后的温度
结论
吸热﹤放热
吸热≈放热
吸热﹥放热
固体逐渐溶解消失
固体逐渐溶解消失试管壁变冷
固体逐渐溶解消失试管壁发热
温度不变
温度降低
温度升高
溶解时的吸热或放热现象
探究
1、溶质分子(离子)向水中扩散:物理变化---吸热
2、溶质分子(离子)与水分子作用,生成水合分子
(水合离子): 化学变化---放热
这两种变化在溶质的溶解过程中是同时存在的。
吸热﹤ 放热:
溶液温度上升
如1:NaOH + H2O
吸热﹥ 放热:
溶液温度降低
如2:NH4NO3+H2O
吸热 ≈ 放热:
溶液温度变化不大
如3:NaCl + H2O
(二)溶解时的吸热或放热现象
溶解的过程
溶质在溶液中分散成分子或离子,大大增加接触面积,使反应加快。若是药品或营养品变成溶液也更易吸收。
溶液的用途
在溶液里进行的化学反应,通常是较快的。
溶解的过程
乳化现象
02
衣服和餐具上的油污,用水洗不掉。为什么在水中加入洗涤剂就能洗掉呢?
中考热点:
汽油洗油和洗涤剂洗油的原理是否相同?
思考
1、向一只试管中加约1/3体积的水,然后加入两滴食用油,用力振荡,现象是___________________________ 。再静置现象是_________________________。
2、向一只试管中加约1/3体积的汽油,然后加入两滴食用油,振荡,现象是________________________。再静置现象是_________________________。
3、向1中的试管中加入几滴洗洁精,振荡,现象是___________________________ 。
食用油不溶解,水中有大颗粒油珠
食用油与水分层
食用油溶解于汽油
食用油与汽油不分层
食用油以极小的颗粒分散在水中
溶解
乳化
探究
乳浊液
乳化现象
滴加乳化剂
振 荡
静 置
液体分层
振 荡
静 置
植物油有没有溶解在水中
探究
像洗洁精、洗衣粉和洗发液等物质可以使食用油以细小的液滴的形态分散在水中,形成不易分层、比较稳定的混合物,这种现象叫做乳化现象。
这是洗涤剂能去油污的原理。
二、乳化现象
乳化现象
一般来说洗涤剂、洗洁精、洗发水中都有乳化剂,能将大的油污变成细小的油滴。
洗洁精等常见乳化剂
乳化现象
饱和溶液与
不饱和溶液
03
在一杯水中是不是可以无限地溶解溶质呢?
操作 向20mL水中 加入5gKNO3搅拌 再加入5gKNO3搅拌 再加入10mL水搅拌
现象
结论
分析 全部溶解
部分未溶KNO3又溶解
部分不溶
①5gKNO3能溶解在20mL水中
②10gKNO3不能全部溶解在20mL水中,杯底有少许固体NaCl
③再加入10mL水可以把未溶的KNO3又全部溶解
KNO3不能无限制地溶解在一定量水中
1.在一杯水中是不是可以无限地溶解KNO3呢?
探究
操作 现象 结论
加入5gKNO3搅拌
再加入5gKNO3搅拌 …… …… 加热 再加入5gKNO3搅拌 冷却 全部溶解
有晶体析出
2.改变温度,杯底没溶的KNO3固体能否继续溶解呢?
探究
温度可以影响KNO3的溶解能力
全部溶解
部分不溶
部分未溶KNO3又溶解
物质无法在一定量的溶剂里无限制地溶解。但是若改变条件(温度、溶剂的量等)可以使物质继续溶解。
1.饱和溶液:
在一定温度下,在一定量的溶剂里,不能再继续溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
不饱和溶液:
在一定温度下,在一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
三、饱和溶液与不饱和溶液
饱和溶液与不饱和溶液
室温,5gKNO3在20mL
水中得到不饱和溶液
↓
+5gNaCl
室温,10gKNO3在20mL水中得到
饱和溶液和少许NaCl固体
+ 5mL水
↓
室温,10gKNO3在25mL水中得到
不饱和溶液
室温,5gKNO3在20mL
水中得到不饱和溶液
室温,10gKNO3在20mL水中得到
饱和溶液和少许KNO3固体
升高温度下,10gKNO3在20mL水中得到不饱和溶液
↓
+5gKNO3
升高温度
↓
结论:饱和与不饱和是相对而言的,在一定条件下它们是互相转变的。只有在指明“一定量的溶剂里”和“一定温度下”,“饱和”和“不饱和”才有确定的意义。
饱和溶液 的二要素: “一定量的溶剂里”和“一定温度下” 。
饱和溶液与不饱和溶液
2.固体物质的饱和溶液与不饱和溶液在一定条件下可以互相转化(大多数物质)
不饱和
溶液
饱和
溶液
增加溶剂或升高温度
增加溶质或降低温度或蒸发溶剂
饱和溶液与不饱和溶液
3.确定某种溶液是否饱和的方法
一般来说,要确定某一溶液是否饱和,只要看在一定温度下,有没有溶解的剩余溶质存在,如有,且溶质的量不再减少,那么这种溶液就是饱和溶液。
饱和溶液与不饱和溶液
谢谢聆听
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
