化学高中人教版选修四4.1原电池1
文档属性
| 名称 | 化学高中人教版选修四4.1原电池1 |
|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-02 00:00:00 | ||
图片预览








文档简介
(共30张PPT)
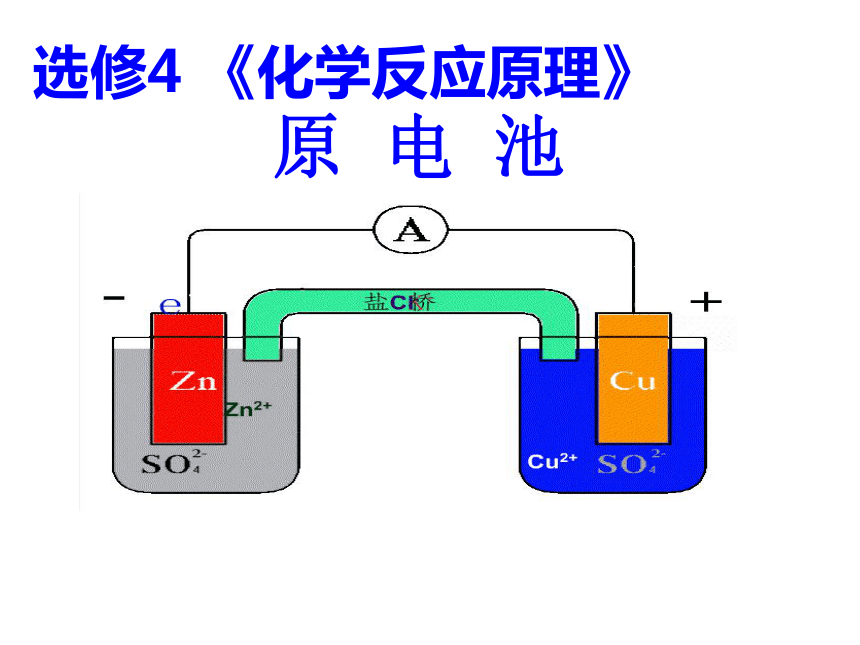
选修4 《化学反应原理》
原 电 池
普通干电池
手机电池
钮扣电池
笔记本电脑
专用电池
摄像机
专用电池
“神七”用
太阳能电池
化学能 电能
装置
过程
效率
电化学
电化学过程
产生电流的反应
借助电流而发生的反应
第四章 电化学基础
第一节 原电池
学习目标:
1、体验化学能转化为电能的探究过程
2、进一步了解原电池的工作原理和构成 原 电池的条件
3、能够写出电极反应式和电池反应方程式.
回顾旧知
1、原电池是 的装置。
原电池反应的本质是发生_____ ________反应。
2、原电池正、负极规律
①负极——电子 的极。通常是活泼性 的金属,发生 反应
②正极——电子 的极。通常是活泼性 的金属或非金属导体,发生 反应
流出
较强
氧化
流入
较弱
还原
将化学能转变为电能
氧化还原
3 、组成原电池的条件
(1)有两种活泼性不同的金属(或一种是 非金属单质或金属氧化物)作电极。
(2)电极材料均插入电解质溶液中。
(3)两极相连形成闭合电路。
(4)能自发进行氧化还原反应
3 、组成原电池的条件
两极一液成回路,氧化还原是中心
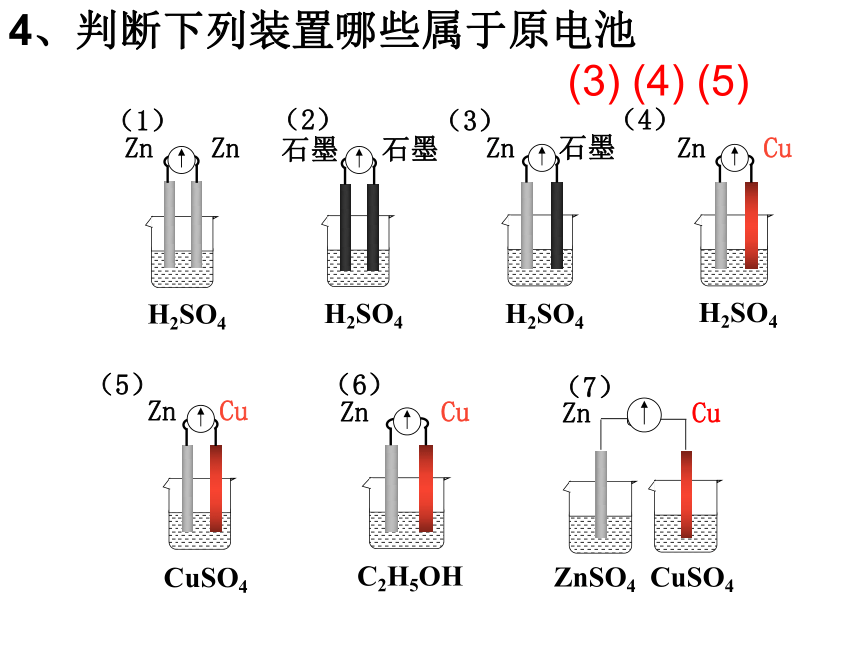
4、判断下列装置哪些属于原电池
H2SO4
Zn Zn
(1)
石墨
石墨
H2SO4
(2)
H2SO4
Zn 石墨
(3)
Zn Cu
H2SO4
(4)
CuSO4
Zn Cu
(5)
C2H5OH
Zn Cu
(6)
Zn Cu
ZnSO4 CuSO4
(7)
(3) (4) (5)
<实验探究一>
内 容:将锌片与铜片分别通过导线与电流表连接,再同时平行浸入盛有CuSO4溶液的烧杯中。
要 求:
1. 观察并记录实验现象
2. 实验完成后,用滤纸吸干电极表面的溶液。
现象:
电流表指针发生偏转
铜片表面有铜析出
锌片表面有铜析出
随着时间的延续,电流减小,电流不稳定.
思考与交流:
1.为什么电流会逐渐减小?
2.能否阻止Cu2+在锌片表面还原为铜?
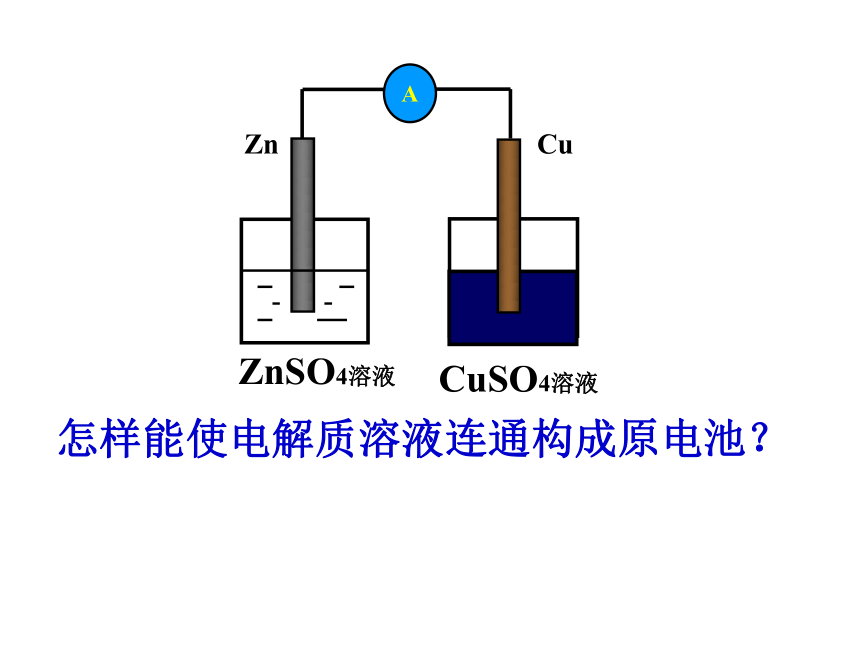
A
CuSO4溶液
ZnSO4溶液
Zn Cu
怎样能使电解质溶液连通构成原电池?
盐桥
盐桥中一般装有饱和的KCl溶液和琼脂制成的胶冻;
胶冻的作用是防止管中溶液流出;
K+和Cl-能在胶冻内自由移动。
<实验探究二>
内容:用盐桥将置有锌片的ZnSO4溶液和置有铜片的CuSO4溶液的烧杯连接起来,然后将锌片和铜片分别用导线与电流表相连。
要 求:
1. 观察并记录实验现象
2. 实验完成后,用滤纸吸干电极表面的溶液。
现象:
有盐桥存在时电流表指针偏转
铜片表面有铜析出
随着时间的延续,能产生持续稳定的电流
取出盐桥无电流产生
此原电池的优点:
能产生持续、稳定的电流。
判断电子的流动路线及溶液中阴、阳离子移动趋势?
(参考课本72页)
K+
Cl—
mA
Cu
Zn2+
Cu2+
SO4 2-
SO4 2-
Zn
K+
Cl-
Zn2+
mA
Zn-2e-=Zn2+
Cu2++2e-=Cu
离子通道
离子库
外电路
内电路
-
氧化
反应
盐
桥
还原
反应
+
负极
正极
微观模拟
工作原理
外电路:
Zn失去电子沿导线通过电流表进入铜片
内电路:
Zn原子失去电子成为Zn2+进入溶液,使ZnSO4溶液因Zn2+增加而带正电,盐桥中的Cl—会移向ZnSO4溶液;同时Cu2+获得电子成为金属沉淀在铜片上,使CuSO4溶液因SO42—相对增加而带负电,盐桥中的K+移向CuSO4溶液,从而形成闭合回路。
②使两个烧杯中的溶液连成一个通路
盐桥的作用
①让溶液始终保持电中性使电极反应得以继续进行
参考课本 72页
该原电池的组成:
两个半电池
盐桥
此原电池是由两个半电池组成的(锌和锌盐溶液构成锌半电池,铜和铜盐溶液构成铜半电池);半电池中的反应就是半反应,即电极反应。
Zn——负极
电极反应
Cu——正极
Zn - 2e- = Zn2+
Zn+Cu2+=Zn2++Cu
Cu2+ + 2e- = Cu
Zn+CuSO4=ZnSO4+Cu
确定该原电池的正、负极,并写出原电池中的两个电极反应和电池反应方程式。
电池反应方程式:
(总反应方程式)
自主活动
请利用:Cu+2AgNO3 = Cu(NO3)2+2Ag 的反应原理,设计一个能持续产生电流的原电池装置,并写出两个电极上的电极反应。
Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag
化合价升高失2e-
化合价降低得2e-
电极:负极是Cu,正极可以是Ag或C等。
负极:Cu – 2e- = Cu2+ 正极:2Ag+ + 2e- = 2 Ag
电解质溶液: Cu(NO3)2 、AgNO3
1、根据氧化还原反应电子转移判断电极反应。
2、根据电极反应确定合适的电极材料和电解质溶液
AgNO3
Cu(NO3)2
C
Cu
负极
正极
Ag或
<实验探究三>
按以下要求设计原电池:
正极: Cu
负极:分别选用 Al 、Zn、 Fe
电解质溶液:CuSO4溶液
要求:
1、观察电流表指针变化,找出哪两种金属组成原电池时,产生的电流强度较大?
2、实验完成后,用滤纸吸干电极表面的溶液。
小
Cu--- Al
Cu--- Zn
Cu ---Fe
大
思考交流
原电池的电流强度大小与哪些因素有关?
反应物的氧化还原能力
电池装置设计的合理性
影响电极反应的条件
课堂小结
通过本节课学习你有哪些收获??
练习 (07年海南高考)依据氧化还原反应:
2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)
设计的原电池如图所示,请回答下列问题:
(1)电极X的材料是 ;
电解质溶液Y是 ;
(2)银电极为电池的 极,
发生的电极反应为
X电极上发生的电极反应为
;
(3)外电路中的电子是从 电极
流向 电极。
Cu
AgNO3
正
X
Ag
Cu – 2e- = Cu2+
2Ag+ + 2e- = 2 Ag
课后习题
谢谢指导!
选修4 《化学反应原理》
原 电 池
普通干电池
手机电池
钮扣电池
笔记本电脑
专用电池
摄像机
专用电池
“神七”用
太阳能电池
化学能 电能
装置
过程
效率
电化学
电化学过程
产生电流的反应
借助电流而发生的反应
第四章 电化学基础
第一节 原电池
学习目标:
1、体验化学能转化为电能的探究过程
2、进一步了解原电池的工作原理和构成 原 电池的条件
3、能够写出电极反应式和电池反应方程式.
回顾旧知
1、原电池是 的装置。
原电池反应的本质是发生_____ ________反应。
2、原电池正、负极规律
①负极——电子 的极。通常是活泼性 的金属,发生 反应
②正极——电子 的极。通常是活泼性 的金属或非金属导体,发生 反应
流出
较强
氧化
流入
较弱
还原
将化学能转变为电能
氧化还原
3 、组成原电池的条件
(1)有两种活泼性不同的金属(或一种是 非金属单质或金属氧化物)作电极。
(2)电极材料均插入电解质溶液中。
(3)两极相连形成闭合电路。
(4)能自发进行氧化还原反应
3 、组成原电池的条件
两极一液成回路,氧化还原是中心
4、判断下列装置哪些属于原电池
H2SO4
Zn Zn
(1)
石墨
石墨
H2SO4
(2)
H2SO4
Zn 石墨
(3)
Zn Cu
H2SO4
(4)
CuSO4
Zn Cu
(5)
C2H5OH
Zn Cu
(6)
Zn Cu
ZnSO4 CuSO4
(7)
(3) (4) (5)
<实验探究一>
内 容:将锌片与铜片分别通过导线与电流表连接,再同时平行浸入盛有CuSO4溶液的烧杯中。
要 求:
1. 观察并记录实验现象
2. 实验完成后,用滤纸吸干电极表面的溶液。
现象:
电流表指针发生偏转
铜片表面有铜析出
锌片表面有铜析出
随着时间的延续,电流减小,电流不稳定.
思考与交流:
1.为什么电流会逐渐减小?
2.能否阻止Cu2+在锌片表面还原为铜?
A
CuSO4溶液
ZnSO4溶液
Zn Cu
怎样能使电解质溶液连通构成原电池?
盐桥
盐桥中一般装有饱和的KCl溶液和琼脂制成的胶冻;
胶冻的作用是防止管中溶液流出;
K+和Cl-能在胶冻内自由移动。
<实验探究二>
内容:用盐桥将置有锌片的ZnSO4溶液和置有铜片的CuSO4溶液的烧杯连接起来,然后将锌片和铜片分别用导线与电流表相连。
要 求:
1. 观察并记录实验现象
2. 实验完成后,用滤纸吸干电极表面的溶液。
现象:
有盐桥存在时电流表指针偏转
铜片表面有铜析出
随着时间的延续,能产生持续稳定的电流
取出盐桥无电流产生
此原电池的优点:
能产生持续、稳定的电流。
判断电子的流动路线及溶液中阴、阳离子移动趋势?
(参考课本72页)
K+
Cl—
mA
Cu
Zn2+
Cu2+
SO4 2-
SO4 2-
Zn
K+
Cl-
Zn2+
mA
Zn-2e-=Zn2+
Cu2++2e-=Cu
离子通道
离子库
外电路
内电路
-
氧化
反应
盐
桥
还原
反应
+
负极
正极
微观模拟
工作原理
外电路:
Zn失去电子沿导线通过电流表进入铜片
内电路:
Zn原子失去电子成为Zn2+进入溶液,使ZnSO4溶液因Zn2+增加而带正电,盐桥中的Cl—会移向ZnSO4溶液;同时Cu2+获得电子成为金属沉淀在铜片上,使CuSO4溶液因SO42—相对增加而带负电,盐桥中的K+移向CuSO4溶液,从而形成闭合回路。
②使两个烧杯中的溶液连成一个通路
盐桥的作用
①让溶液始终保持电中性使电极反应得以继续进行
参考课本 72页
该原电池的组成:
两个半电池
盐桥
此原电池是由两个半电池组成的(锌和锌盐溶液构成锌半电池,铜和铜盐溶液构成铜半电池);半电池中的反应就是半反应,即电极反应。
Zn——负极
电极反应
Cu——正极
Zn - 2e- = Zn2+
Zn+Cu2+=Zn2++Cu
Cu2+ + 2e- = Cu
Zn+CuSO4=ZnSO4+Cu
确定该原电池的正、负极,并写出原电池中的两个电极反应和电池反应方程式。
电池反应方程式:
(总反应方程式)
自主活动
请利用:Cu+2AgNO3 = Cu(NO3)2+2Ag 的反应原理,设计一个能持续产生电流的原电池装置,并写出两个电极上的电极反应。
Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag
化合价升高失2e-
化合价降低得2e-
电极:负极是Cu,正极可以是Ag或C等。
负极:Cu – 2e- = Cu2+ 正极:2Ag+ + 2e- = 2 Ag
电解质溶液: Cu(NO3)2 、AgNO3
1、根据氧化还原反应电子转移判断电极反应。
2、根据电极反应确定合适的电极材料和电解质溶液
AgNO3
Cu(NO3)2
C
Cu
负极
正极
Ag或
<实验探究三>
按以下要求设计原电池:
正极: Cu
负极:分别选用 Al 、Zn、 Fe
电解质溶液:CuSO4溶液
要求:
1、观察电流表指针变化,找出哪两种金属组成原电池时,产生的电流强度较大?
2、实验完成后,用滤纸吸干电极表面的溶液。
小
Cu--- Al
Cu--- Zn
Cu ---Fe
大
思考交流
原电池的电流强度大小与哪些因素有关?
反应物的氧化还原能力
电池装置设计的合理性
影响电极反应的条件
课堂小结
通过本节课学习你有哪些收获??
练习 (07年海南高考)依据氧化还原反应:
2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)
设计的原电池如图所示,请回答下列问题:
(1)电极X的材料是 ;
电解质溶液Y是 ;
(2)银电极为电池的 极,
发生的电极反应为
X电极上发生的电极反应为
;
(3)外电路中的电子是从 电极
流向 电极。
Cu
AgNO3
正
X
Ag
Cu – 2e- = Cu2+
2Ag+ + 2e- = 2 Ag
课后习题
谢谢指导!
