化学高中人教版选修四4.1原电池2
文档属性
| 名称 | 化学高中人教版选修四4.1原电池2 |  | |
| 格式 | zip | ||
| 文件大小 | 7.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-02 14:56:39 | ||
图片预览





文档简介
(共23张PPT)
第四章 电化学基础
第一节 原电池
学习目标
1.进一步了解原电池的工作原理和构成原电池的条件。
2.能写出原电池的电极反应和电池反应方程式。
3.体验化学能与电能转化的探究过程。
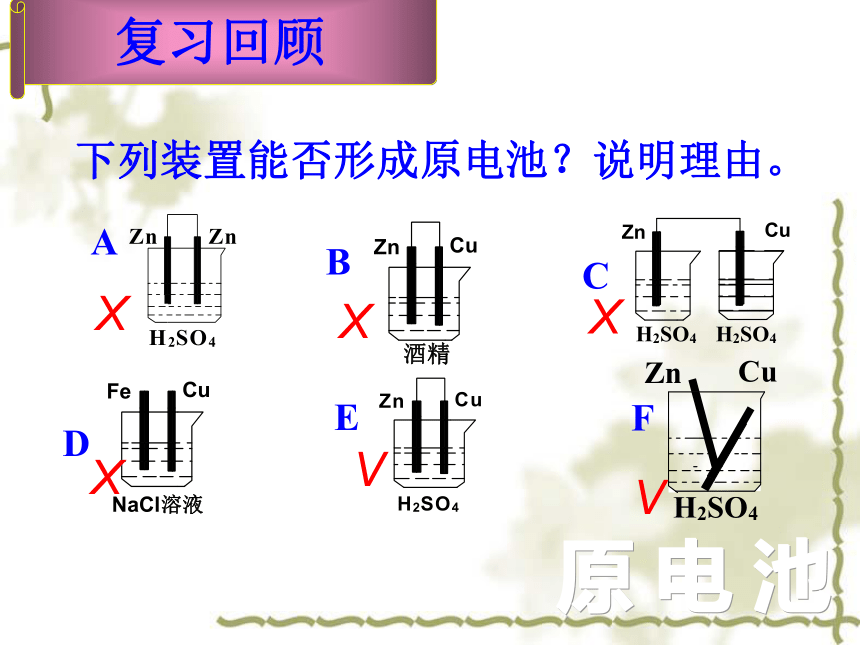
复习回顾
下列装置能否形成原电池?说明理由。
E
A
B
D
C
F
V
X
X
X
X
V
一、构成条件
2、有两种活动性不同的金属(或一种是非金属单质或金属氧化物)作电极。
3、电极材料均插入电解质溶液中。
4、两极相连形成闭合电路。
1、有自发的氧化还原反应(内部条件)。
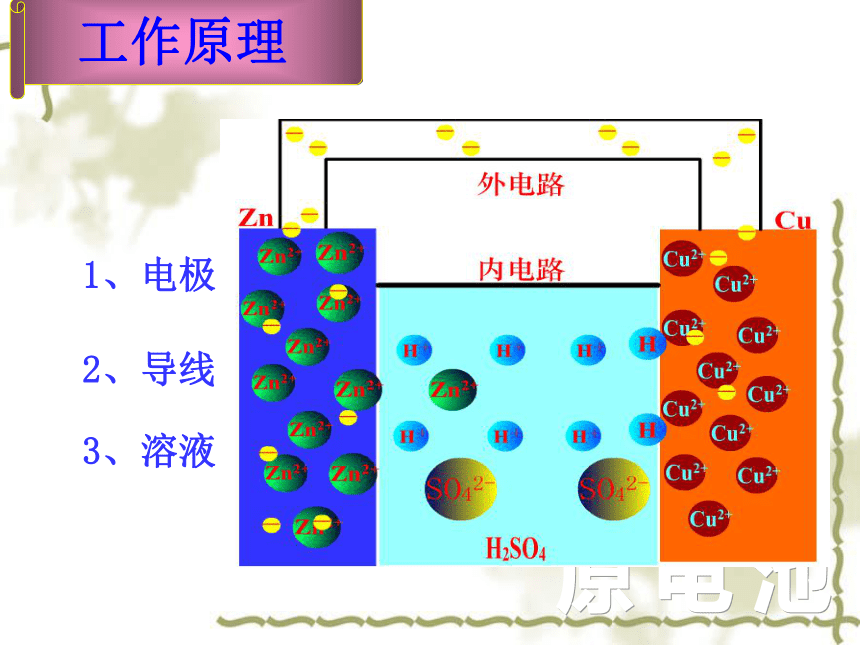
1、电极
工作原理
2、导线
3、溶液
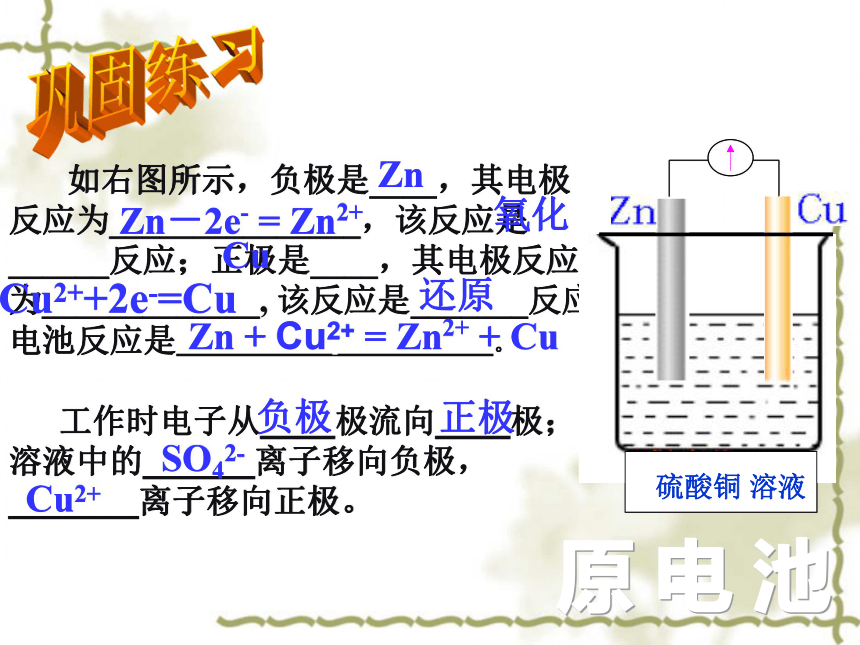
如右图所示,负极是____,其电极反应为_______________,该反应是______反应;正极是____,其电极反应为_____________, 该反应是_______反应。电池反应是_____________ _____________。
工作时电子从____极流向____极;溶液中的______离子移向负极,_______离子移向正极。
Zn
Zn-2e- = Zn2+
氧化
Cu
Cu2++2e-=Cu
还原
硫酸铜 溶液
Zn + Cu2+ = Zn2+ + Cu
负极
正极
SO42-
Cu2+
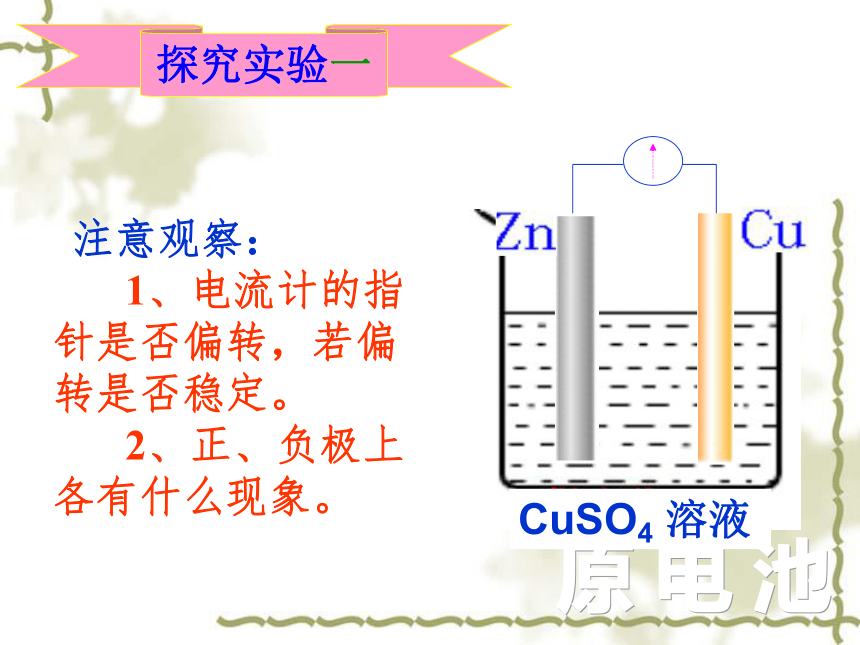
探究实验一
注意观察:
1、电流计的指针是否偏转,若偏转是否稳定。
2、正、负极上各有什么现象。
CuSO4 溶液
在锌片表面怎么会有铜析出呢?
想一想
由于锌片与CuSO4溶液直接接触,发生了置换反应: Zn + Cu2+ = Zn2+ + Cu。
电流表的读数为何趋于零?
想一想
一旦有少量铜在锌片表面析出,导致向外输出的电流强度减弱,当锌片表面完全被铜覆盖后,反应就终止了,也就无电流再产生。
如何让原电池产生持续稳定的电流?
设 疑
自主实验探究二
探究目的:
1、电流计的指针偏转后是否稳定。
2、负极上有何现象。
1、电极
2、导线
3、盐桥
CuSO4 溶液
三、装置模型
两种模型的主要特点是什么?
前者不能产生持续稳定的电流;后者有盐桥,可以产生持续稳定的流。
(07海南)依据氧化还原反应:
2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)
设计的原电池如图所示。
⑴电极X的材料是 ;电解质溶液Y是 ;
⑵银电极为电池的; 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
⑶外电路中的电子是从 电极
流向 电极。
Cu
AgNO3
正
2Ag+ + 2e- = 2Ag
Cu - 2e- = Cu2+
Cu
Ag
根据下式所表示的氧化还原反应设计一个原电池:Zn(s)+Fe2+(aq)=Zn2+(aq)+Fe(s)
⑴ 装置可采用烧杯和盐桥,画出此原电池的装置简图;
⑵ 注明原电池的正极和负极;
⑶ 注明外电路中电子的流向;
⑷ 写出两个电极上的电极反应。
负极:Zn-2e- =Zn2+
正极:Fe2+ + 2e- = Fe
Fe
Zn
盐桥
ZnSO4
FeSO4
(—)
(+)
e-
联系生活
四、电流强度
花同样的钱,你愿意选择南孚电池还是选择华太电池?为什么?
科学探究
Zn + 2H+ = Zn2+ + H2↑
Zn + Cu2+ = Zn2+ + Cu
CuSO4 溶液
CuSO4 溶液
H2SO4 溶液
CuSO4 溶液
科学探究
CuSO4 溶液
Al
Zn + Cu2+ = Zn2+ + Cu
2Al + 3Cu2+ = 2Al3+ + 3Cu
首先,取决于组成原电池的反应物的氧化还原能力;同时,装置设计的合理性以及影响电极反应的条件也很重要。
小 结
四、电流强度
课堂总结
装置模型
构成条件
主要特点
工作原理
CuSO4
2、有两种活动性不同的电极
3、电极均插入电解质溶液中。
4、两个半电池用盐桥相连形成闭合电路。
1、有自发的氧化还原反应。
2、有两种活动性不同的电极
3、电极均插入电解质溶液中。
1、有自发的氧化还原反应。
4、两极相连形成闭合电路。
2、电子由负极流向正极。
1、负极发生氧化反应;正极发
生还原反应。
3、溶液中阴离子移向负极,阳
离子移向正极。
2、电子由负极流向正极。
1、负极发生氧化反应;正极发生还原反应。
3、盐桥中阴离子移向负极,阳离子移向正极。
能产生持续、稳定的电流
不能产生持续、稳 定的电流
1、如果让你研发一种新型的电池,你应注意哪些问题?课下通过上网查询、小组研讨等方式,把研讨结果发到我的邮箱 sdjnyczjq@。
2、完成《同步学案---原电池》。
第四章 电化学基础
第一节 原电池
学习目标
1.进一步了解原电池的工作原理和构成原电池的条件。
2.能写出原电池的电极反应和电池反应方程式。
3.体验化学能与电能转化的探究过程。
复习回顾
下列装置能否形成原电池?说明理由。
E
A
B
D
C
F
V
X
X
X
X
V
一、构成条件
2、有两种活动性不同的金属(或一种是非金属单质或金属氧化物)作电极。
3、电极材料均插入电解质溶液中。
4、两极相连形成闭合电路。
1、有自发的氧化还原反应(内部条件)。
1、电极
工作原理
2、导线
3、溶液
如右图所示,负极是____,其电极反应为_______________,该反应是______反应;正极是____,其电极反应为_____________, 该反应是_______反应。电池反应是_____________ _____________。
工作时电子从____极流向____极;溶液中的______离子移向负极,_______离子移向正极。
Zn
Zn-2e- = Zn2+
氧化
Cu
Cu2++2e-=Cu
还原
硫酸铜 溶液
Zn + Cu2+ = Zn2+ + Cu
负极
正极
SO42-
Cu2+
探究实验一
注意观察:
1、电流计的指针是否偏转,若偏转是否稳定。
2、正、负极上各有什么现象。
CuSO4 溶液
在锌片表面怎么会有铜析出呢?
想一想
由于锌片与CuSO4溶液直接接触,发生了置换反应: Zn + Cu2+ = Zn2+ + Cu。
电流表的读数为何趋于零?
想一想
一旦有少量铜在锌片表面析出,导致向外输出的电流强度减弱,当锌片表面完全被铜覆盖后,反应就终止了,也就无电流再产生。
如何让原电池产生持续稳定的电流?
设 疑
自主实验探究二
探究目的:
1、电流计的指针偏转后是否稳定。
2、负极上有何现象。
1、电极
2、导线
3、盐桥
CuSO4 溶液
三、装置模型
两种模型的主要特点是什么?
前者不能产生持续稳定的电流;后者有盐桥,可以产生持续稳定的流。
(07海南)依据氧化还原反应:
2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)
设计的原电池如图所示。
⑴电极X的材料是 ;电解质溶液Y是 ;
⑵银电极为电池的; 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
⑶外电路中的电子是从 电极
流向 电极。
Cu
AgNO3
正
2Ag+ + 2e- = 2Ag
Cu - 2e- = Cu2+
Cu
Ag
根据下式所表示的氧化还原反应设计一个原电池:Zn(s)+Fe2+(aq)=Zn2+(aq)+Fe(s)
⑴ 装置可采用烧杯和盐桥,画出此原电池的装置简图;
⑵ 注明原电池的正极和负极;
⑶ 注明外电路中电子的流向;
⑷ 写出两个电极上的电极反应。
负极:Zn-2e- =Zn2+
正极:Fe2+ + 2e- = Fe
Fe
Zn
盐桥
ZnSO4
FeSO4
(—)
(+)
e-
联系生活
四、电流强度
花同样的钱,你愿意选择南孚电池还是选择华太电池?为什么?
科学探究
Zn + 2H+ = Zn2+ + H2↑
Zn + Cu2+ = Zn2+ + Cu
CuSO4 溶液
CuSO4 溶液
H2SO4 溶液
CuSO4 溶液
科学探究
CuSO4 溶液
Al
Zn + Cu2+ = Zn2+ + Cu
2Al + 3Cu2+ = 2Al3+ + 3Cu
首先,取决于组成原电池的反应物的氧化还原能力;同时,装置设计的合理性以及影响电极反应的条件也很重要。
小 结
四、电流强度
课堂总结
装置模型
构成条件
主要特点
工作原理
CuSO4
2、有两种活动性不同的电极
3、电极均插入电解质溶液中。
4、两个半电池用盐桥相连形成闭合电路。
1、有自发的氧化还原反应。
2、有两种活动性不同的电极
3、电极均插入电解质溶液中。
1、有自发的氧化还原反应。
4、两极相连形成闭合电路。
2、电子由负极流向正极。
1、负极发生氧化反应;正极发
生还原反应。
3、溶液中阴离子移向负极,阳
离子移向正极。
2、电子由负极流向正极。
1、负极发生氧化反应;正极发生还原反应。
3、盐桥中阴离子移向负极,阳离子移向正极。
能产生持续、稳定的电流
不能产生持续、稳 定的电流
1、如果让你研发一种新型的电池,你应注意哪些问题?课下通过上网查询、小组研讨等方式,把研讨结果发到我的邮箱 sdjnyczjq@。
2、完成《同步学案---原电池》。
