2021-2022学年高二化学人教版(2019)选择性必修一2.2.4 化学平衡有关图像 课件(36张ppt)
文档属性
| 名称 | 2021-2022学年高二化学人教版(2019)选择性必修一2.2.4 化学平衡有关图像 课件(36张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-29 00:00:00 | ||
图片预览


文档简介
(共36张PPT)
第二章 化学反应速率和化学平衡
2019人教版选择性必修一
第二节 化学平衡
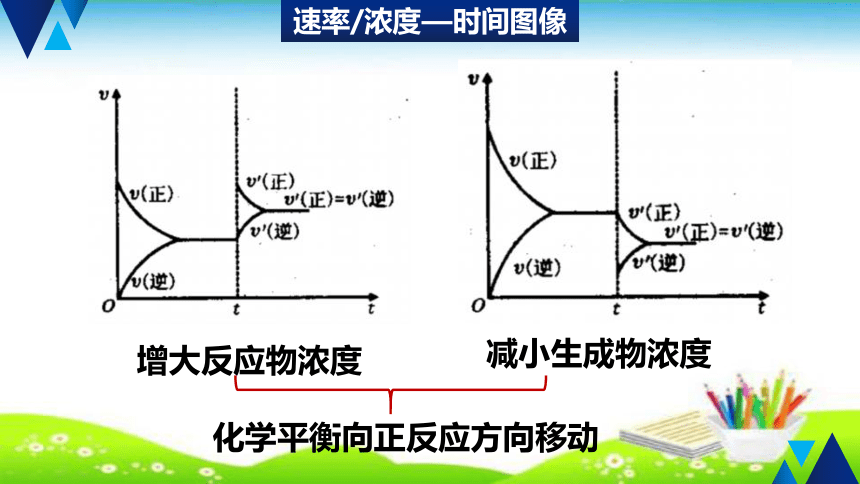
速率/浓度—时间图像
增大反应物浓度
减小生成物浓度
化学平衡向正反应方向移动
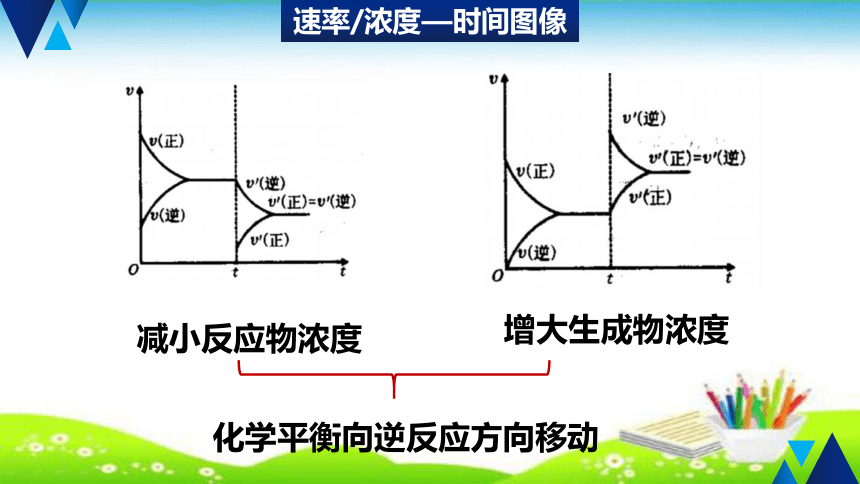
速率/浓度—时间图像
减小反应物浓度
增大生成物浓度
化学平衡向逆反应方向移动
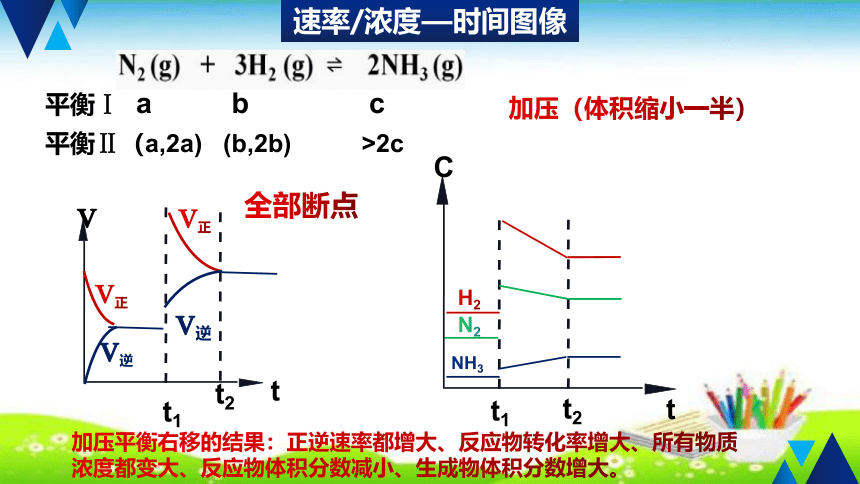
速率/浓度—时间图像
平衡Ⅰ a b c
平衡Ⅱ(a,2a) (b,2b) >2c
加压(体积缩小一半)
t
v
t1
t2
v正
v正
v逆
v逆
t
H2
t2
t1
N2
NH3
全部断点
加压平衡右移的结果:正逆速率都增大、反应物转化率增大、所有物质浓度都变大、反应物体积分数减小、生成物体积分数增大。
C
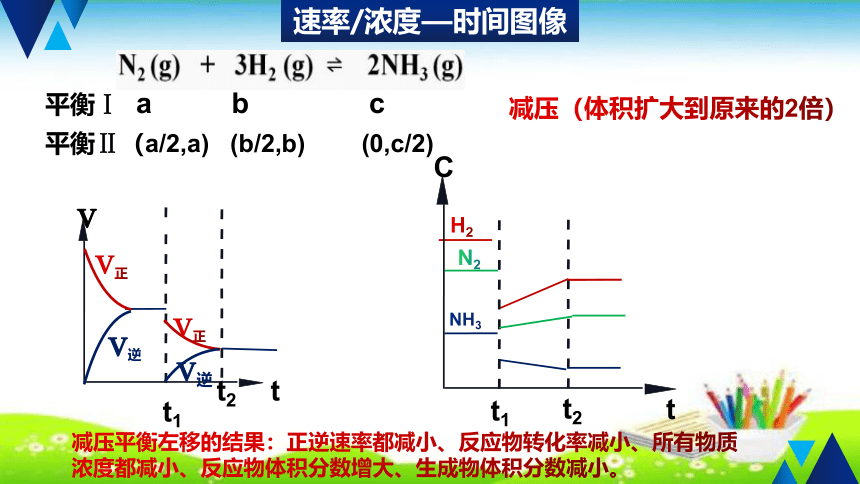
速率/浓度—时间图像
平衡Ⅰ a b c
平衡Ⅱ(a/2,a) (b/2,b) (0,c/2)
减压(体积扩大到原来的2倍)
t
v
t1
t2
v正
v正
v逆
v逆
t
H2
t2
t1
N2
NH3
减压平衡左移的结果:正逆速率都减小、反应物转化率减小、所有物质浓度都减小、反应物体积分数增大、生成物体积分数减小。
C
速率/浓度—时间图像
平衡Ⅰ a b c
加压(体积缩小一半)
平衡Ⅱ 2a 2b 2c
t
v
v正
v逆
t1
加压的结果:正逆速率同等倍数增大、平衡不移动、反应物转化率不变、所有物质浓度同等倍数增大、体积分数不变。
速率/浓度—时间图像
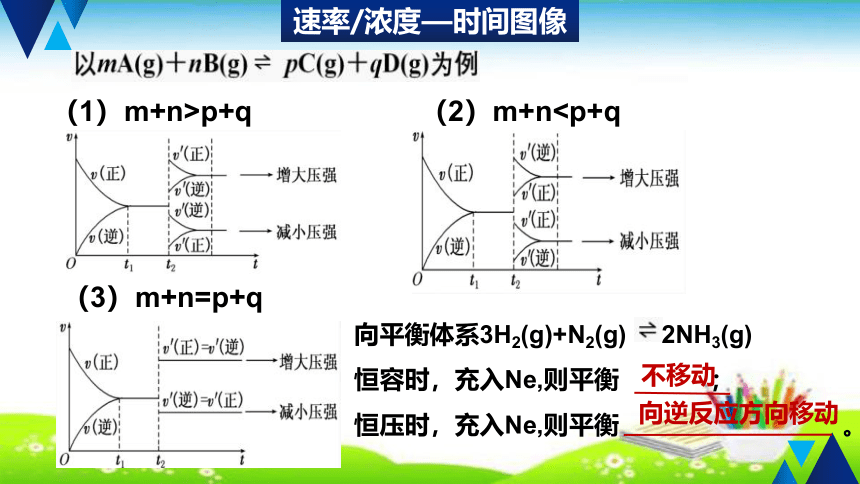
(1)m+n>p+q
(2)m+n(3)m+n=p+q
向平衡体系3H2(g)+N2(g) 2NH3(g)
恒容时,充入Ne,则平衡 ;
恒压时,充入Ne,则平衡 。
不移动
向逆反应方向移动
速率/浓度—时间图像
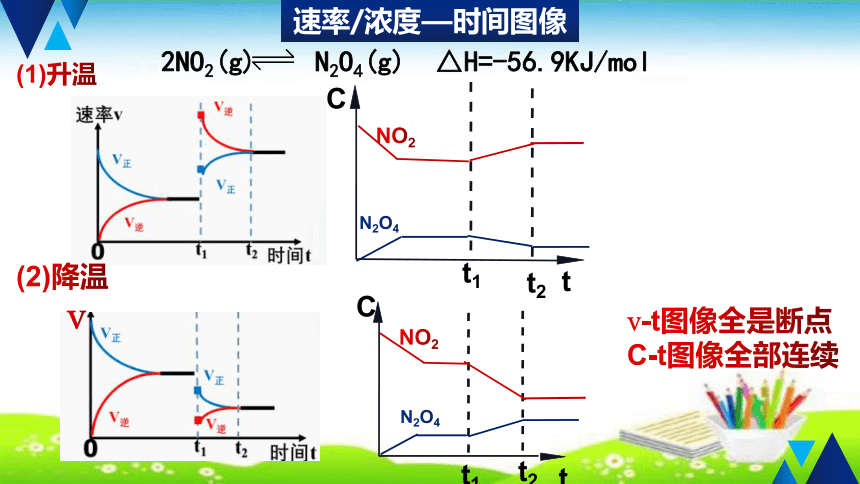
2NO2(g) N2O4(g) △H=-56.9KJ/mol
t1
t2
t1
t2
v-t图像全是断点
C-t图像全部连续
(1)升温
(2)降温
v
t
NO2
N2O4
C
C
t
N2O4
NO2
速率/浓度—时间图像
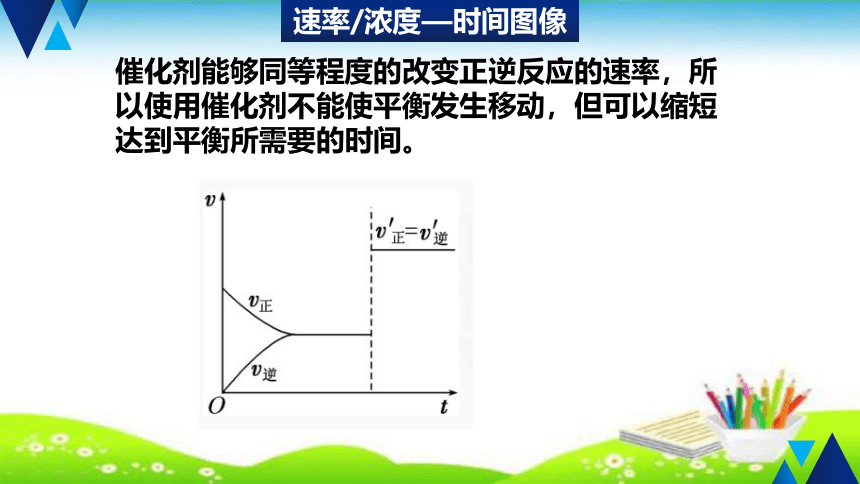
催化剂能够同等程度的改变正逆反应的速率,所以使用催化剂不能使平衡发生移动,但可以缩短达到平衡所需要的时间。
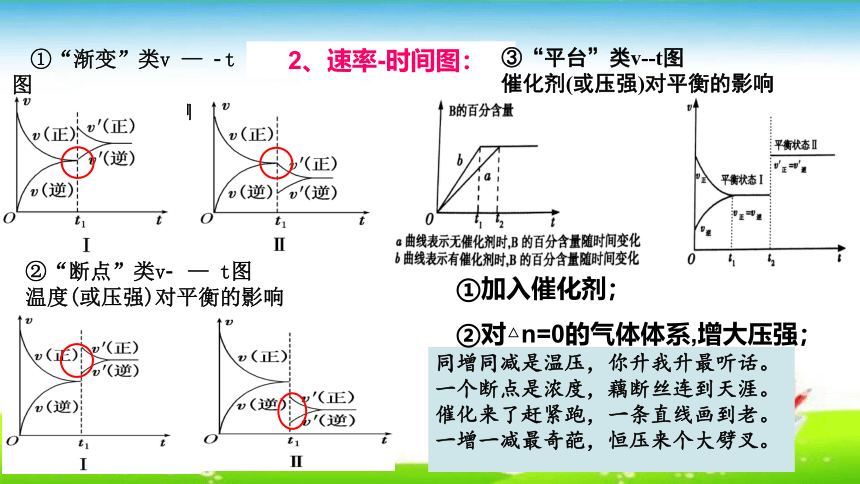
①“渐变”类v — t图
浓度对平衡的影响
②“断点”类v — t图
温度(或压强)对平衡的影响
同增同减是温压,你升我升最听话。
一个断点是浓度,藕断丝连到天涯。
催化来了赶紧跑,一条直线画到老。
一增一减最奇葩,恒压来个大劈叉。
2、速率-时间图:
③“平台”类v- t图
催化剂(或压强)对平衡的影响
①加入催化剂;
②对△n=0的气体体系,增大压强;
速率/浓度—时间图像
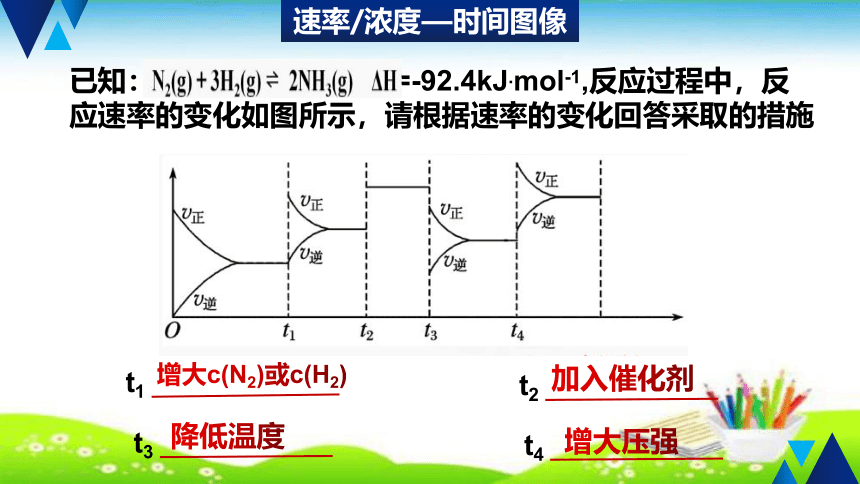
已知: =-92.4kJ.mol-1,反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施
增大c(N2)或c(H2)
加入催化剂
降低温度
增大压强
t3
t4
t1
t2
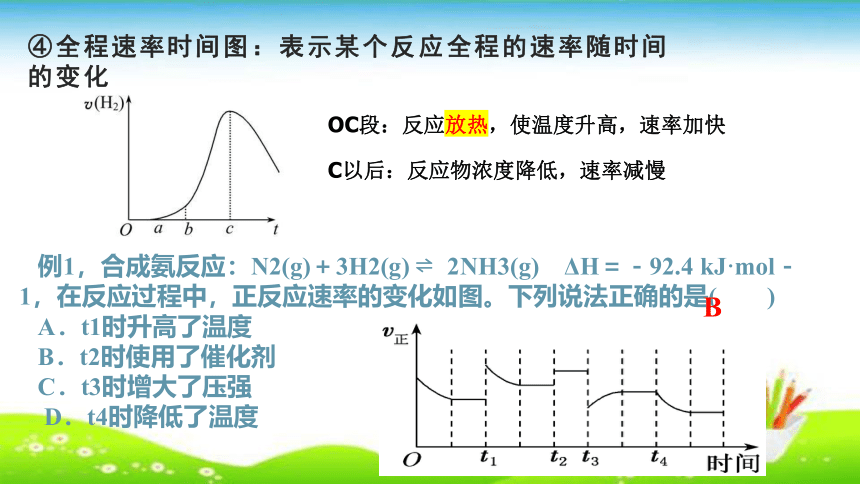
④全程速率时间图:表示某个反应全程的速率随时间的变化
OC段:反应放热,使温度升高,速率加快
C以后:反应物浓度降低,速率减慢
例1,合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图。下列说法正确的是( )
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
B
【典例2】某温度下,2SO2(g)+O2(g) 2SO3(g) ΔH<0已达到平衡,保持其他条件不变,只改变其中一个条件,v(正)、v(逆)的变化如图所示。下列判断正确的是( )
A.①图可能是加压引起的
B.②图可能是恒压通O2引起的
C.③图可能是升高温度引起的
D.④图是移走部分SO3引起的
D
mA(g)+nB(g) pC(g)+qD(g)
研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系
t
1.01 107Pa
1.01 106Pa
m+n = p+q
0
转化率
t2
t1
转化率
0
m+n < p+q
t
t1
t2
P1
P2
“先拐先平数值大”
转化率(物质百分含量)—时间图像
mA(g)+nB(g) pC(g)+qD(g)
研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系
t
m+n > p+q
0
A%
t2
t1
0
m+n < p+q
t
t1
t2
P1
P2
“先拐先平数值大”
转化率(物质百分含量)—时间图像
C%
P1
P2
mA(g)+nB(g) pC(g)+qD(g)
研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系
t
0
t2
t1
0
t
t1
t2
T1
T2
“先拐先平数值大”
转化率(物质百分含量)—时间图像
C%
T1
T2
正反应放热
转化率
正反应放热
P
A%
500℃
200℃
正反应 热
m+n p+q
放
<
等压线
mA(g)+nB(g) pC(g)+qD(g) ΔH
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
正反应 热m+n p+q
吸
>
P
A%
300℃
200℃
正反应 热m+n p+q
吸
=
mA(g)+nB(g) pC(g)+qD(g)
研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系
200 C
300 C
100 C
转化率
0
P1
等压线
正反应吸热 m+n>p+q
P
T1P2
T1P1
0
t
C%
正反应放热 m+n>p+q
t1
t2
t3
等温线
平衡时转化率—压强—温度曲线
图象中有三个量时定“一”议“二”
T2P2
化学平衡图像题的解题方法
1、一看轴,即横坐标和纵坐标的意义。
2、二看点,即一些特殊点如起点、拐点、交点、终点、最高点的意义。
3、三看线即弄清图像中线的走向和变化趋势。
4、四看辅助线弄清图像斜率的大小。
5、五看量的变化如浓度、温度、转化率、物质的量斜率的变化等。
一、看图像
小结
二、想规律:依据图像信息,利用平衡移动原理,分析可逆反应的特征
三、做判断:先拐先平数值大,定一议二
解化学平衡图像题的技巧
1、交点、最高点、最低点、与x轴的平行线往往代表平衡状态
2、研究斜率比较速率大小
3、比较正逆速率大小关系、y的变化趋来判断平移动
4、多变量曲线常作垂直线形成等温线或等压线后比较
小结
0
下图是在其它条件一定时,反应2NO+O2 2NO2 △H 0 中NO 的最大转化率与温度的关系曲线。图中坐标A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
A
B
C
E
D
C点
T
转化率
线为平衡点
线外未平衡点
转化率(物质百分含量)—时间图像
mA(g)+nB(g) pC(g)+qD(g)
1.研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系
T
v
v逆
v正
T1
T2
T
v
v正
v逆
C%
450℃
P
A%
P1
正反应
★
正反应
★
正反应
★
m+n p+q
达标检测
T
吸热
放热
<
吸热
看图技巧:可逆反应的最大程度即化学平衡状态
5、其它图像
交点为平衡状态,交点左侧为达平衡过程,右侧为平衡移动过程
正反应 热
放
T
v
v逆
v正
T1
T2
正反应 热
吸
T
C%
450℃
正反应 热
放
m+n p+q
>
L线上所有的点都是平衡点。左上方(E点),A%大于此压强时平衡体系中的A%,E点必须朝正反应方向移动才能达到平衡状态,所以,E点v正>v逆;则右下方(F点)v正2.X(g)+Y(g) 2Z(g);△H<0,达平衡时,混合气体中Z的百分含量随温度变化的曲线为( )
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
D
A
B
C
D
达标检测
2.X(g)+3Y(s) 2Z(g);△H<0,达平衡时,混合气体中Z的百分含量随温度变化的曲线为( )
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
D
A
B
C
D
达标检测
3.已知某可逆反应在密闭容器中进行:
A(g)+2B(g) 3C(g)+D(s)(正反应为放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
A.增大A的浓度
B.缩小容器的容积
C.加入催化剂
D.升高温度
BC
A的转化率
t
a
b
达标检测
[例] 可逆反应: mA(s)+nB(g) ?? pC(g);△H<0,在一定温度下B的转化率与压强的关系如图所示,则下列判断正确的是( )。(双选)
A.m+n<p
B.n>p
C.x点的状态是v正>v逆
D.x点比y点的反应速度慢
α(B)
压强
0
X
Y
BD
三、平衡状态与非平衡状态的判断
4.对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示( )
P
Y
100℃
200℃
300℃
AD
A.B物质的转化率
B.正反应的速率
C.平衡体系中的A%
D.平衡体系中的C%
达标检测
对于 m A (g) + n B (g) p C (g);△H 有如图所示的变化,则:
①P1与 P2 的关系是 ;
②m + n 与p的关系是 ;
③T1 与 T2的关系是 ;
④△H与 0 的关系是 。
P2 > P 1
T2 < T1
m + n > p
ΔH<0
C%
t
0
T2 P2
T1 P2
T1 P1
【练习1】
【练习4】右图中的曲线是表示其他条件一定,
2NO+O2 2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v正 >v逆的点是( )
C
NO
转
化
率
0
a
●
●
●
●
c
b
d
温度
【练习5】对于可逆反应A2 (g) + 3B2 (g) 2AB3 (g) (正反应放热)下列图像错误的是( )
v正
v逆
v
T
A2的
转化
率
T
100atm
10atm
1atm
AB3%
P
400℃
500℃
600℃
A2%
t
100℃
200℃
A
B
C
D
D
辅助线
2.已知某可逆反应:aA(g) + bB(g) cC(g)在密闭容器中进行,在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的体积分数(B%)与反应时间(t)的关系如图所示。下列判断正确的是 ( )
A T1<T2,p1<p2,a+b>c,正反应吸热
B T1>T2,p1<p2,a+b<c,正反应吸热
C T1<T2,p1<p2,a+b<c,正反应放热
D T1>T2,p1<p2,a+b>c,正反应放热
B
t
0
B%
T2 P2
T1 P1
T1 P2
五.基本题型
题型1:由化学方程式的特点判断图像
例:可表示为可逆反应2A(g)+B(g) 2C(g) △H < 0的图象是( )
B
500 C
o
t
0
700 C
o
C%
(A)
0
v
P
V
正
逆
V
(B)
0
T
v
V
正
逆
V
(C)
0
P
10 C
o
100 C
o
A
转
化
率
(D)
练习:
A(g) + B(g) 2C + D(g) 此反应符合下列两个
B
△H =Q,
图像,下列说法正确的是( )
1.在一密闭容器中进行下列可逆反应:
A. Q <0,C为固体或液体 B. Q<0,C为气体
C. Q>0,C为气体 D. Q>0,C为固体或液体
t
P
0
D%
0
D%
200℃
600℃
题型5:化学反应速率与化学平衡的综合运用
例: mM(s) + nN(g) pQ(g) ,的可逆反应在定温时N%与压强的关系如下图,下列有关叙述正确的是( )
A
△H < 0
A. A点时,V正> V逆
B. A点比B点的反应速率快
C. n>p
D. m+ n >p
第二章 化学反应速率和化学平衡
2019人教版选择性必修一
第二节 化学平衡
速率/浓度—时间图像
增大反应物浓度
减小生成物浓度
化学平衡向正反应方向移动
速率/浓度—时间图像
减小反应物浓度
增大生成物浓度
化学平衡向逆反应方向移动
速率/浓度—时间图像
平衡Ⅰ a b c
平衡Ⅱ(a,2a) (b,2b) >2c
加压(体积缩小一半)
t
v
t1
t2
v正
v正
v逆
v逆
t
H2
t2
t1
N2
NH3
全部断点
加压平衡右移的结果:正逆速率都增大、反应物转化率增大、所有物质浓度都变大、反应物体积分数减小、生成物体积分数增大。
C
速率/浓度—时间图像
平衡Ⅰ a b c
平衡Ⅱ(a/2,a) (b/2,b) (0,c/2)
减压(体积扩大到原来的2倍)
t
v
t1
t2
v正
v正
v逆
v逆
t
H2
t2
t1
N2
NH3
减压平衡左移的结果:正逆速率都减小、反应物转化率减小、所有物质浓度都减小、反应物体积分数增大、生成物体积分数减小。
C
速率/浓度—时间图像
平衡Ⅰ a b c
加压(体积缩小一半)
平衡Ⅱ 2a 2b 2c
t
v
v正
v逆
t1
加压的结果:正逆速率同等倍数增大、平衡不移动、反应物转化率不变、所有物质浓度同等倍数增大、体积分数不变。
速率/浓度—时间图像
(1)m+n>p+q
(2)m+n
向平衡体系3H2(g)+N2(g) 2NH3(g)
恒容时,充入Ne,则平衡 ;
恒压时,充入Ne,则平衡 。
不移动
向逆反应方向移动
速率/浓度—时间图像
2NO2(g) N2O4(g) △H=-56.9KJ/mol
t1
t2
t1
t2
v-t图像全是断点
C-t图像全部连续
(1)升温
(2)降温
v
t
NO2
N2O4
C
C
t
N2O4
NO2
速率/浓度—时间图像
催化剂能够同等程度的改变正逆反应的速率,所以使用催化剂不能使平衡发生移动,但可以缩短达到平衡所需要的时间。
①“渐变”类v — t图
浓度对平衡的影响
②“断点”类v — t图
温度(或压强)对平衡的影响
同增同减是温压,你升我升最听话。
一个断点是浓度,藕断丝连到天涯。
催化来了赶紧跑,一条直线画到老。
一增一减最奇葩,恒压来个大劈叉。
2、速率-时间图:
③“平台”类v- t图
催化剂(或压强)对平衡的影响
①加入催化剂;
②对△n=0的气体体系,增大压强;
速率/浓度—时间图像
已知: =-92.4kJ.mol-1,反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施
增大c(N2)或c(H2)
加入催化剂
降低温度
增大压强
t3
t4
t1
t2
④全程速率时间图:表示某个反应全程的速率随时间的变化
OC段:反应放热,使温度升高,速率加快
C以后:反应物浓度降低,速率减慢
例1,合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图。下列说法正确的是( )
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
B
【典例2】某温度下,2SO2(g)+O2(g) 2SO3(g) ΔH<0已达到平衡,保持其他条件不变,只改变其中一个条件,v(正)、v(逆)的变化如图所示。下列判断正确的是( )
A.①图可能是加压引起的
B.②图可能是恒压通O2引起的
C.③图可能是升高温度引起的
D.④图是移走部分SO3引起的
D
mA(g)+nB(g) pC(g)+qD(g)
研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系
t
1.01 107Pa
1.01 106Pa
m+n = p+q
0
转化率
t2
t1
转化率
0
m+n < p+q
t
t1
t2
P1
P2
“先拐先平数值大”
转化率(物质百分含量)—时间图像
mA(g)+nB(g) pC(g)+qD(g)
研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系
t
m+n > p+q
0
A%
t2
t1
0
m+n < p+q
t
t1
t2
P1
P2
“先拐先平数值大”
转化率(物质百分含量)—时间图像
C%
P1
P2
mA(g)+nB(g) pC(g)+qD(g)
研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系
t
0
t2
t1
0
t
t1
t2
T1
T2
“先拐先平数值大”
转化率(物质百分含量)—时间图像
C%
T1
T2
正反应放热
转化率
正反应放热
P
A%
500℃
200℃
正反应 热
m+n p+q
放
<
等压线
mA(g)+nB(g) pC(g)+qD(g) ΔH
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
正反应 热m+n p+q
吸
>
P
A%
300℃
200℃
正反应 热m+n p+q
吸
=
mA(g)+nB(g) pC(g)+qD(g)
研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系
200 C
300 C
100 C
转化率
0
P1
等压线
正反应吸热 m+n>p+q
P
T1P2
T1P1
0
t
C%
正反应放热 m+n>p+q
t1
t2
t3
等温线
平衡时转化率—压强—温度曲线
图象中有三个量时定“一”议“二”
T2P2
化学平衡图像题的解题方法
1、一看轴,即横坐标和纵坐标的意义。
2、二看点,即一些特殊点如起点、拐点、交点、终点、最高点的意义。
3、三看线即弄清图像中线的走向和变化趋势。
4、四看辅助线弄清图像斜率的大小。
5、五看量的变化如浓度、温度、转化率、物质的量斜率的变化等。
一、看图像
小结
二、想规律:依据图像信息,利用平衡移动原理,分析可逆反应的特征
三、做判断:先拐先平数值大,定一议二
解化学平衡图像题的技巧
1、交点、最高点、最低点、与x轴的平行线往往代表平衡状态
2、研究斜率比较速率大小
3、比较正逆速率大小关系、y的变化趋来判断平移动
4、多变量曲线常作垂直线形成等温线或等压线后比较
小结
0
下图是在其它条件一定时,反应2NO+O2 2NO2 △H 0 中NO 的最大转化率与温度的关系曲线。图中坐标A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
A
B
C
E
D
C点
T
转化率
线为平衡点
线外未平衡点
转化率(物质百分含量)—时间图像
mA(g)+nB(g) pC(g)+qD(g)
1.研究下列图像,分析对应可逆反应焓变特点、计量数m+n和p+q的大小关系
T
v
v逆
v正
T1
T2
T
v
v正
v逆
C%
450℃
P
A%
P1
正反应
★
正反应
★
正反应
★
m+n p+q
达标检测
T
吸热
放热
<
吸热
看图技巧:可逆反应的最大程度即化学平衡状态
5、其它图像
交点为平衡状态,交点左侧为达平衡过程,右侧为平衡移动过程
正反应 热
放
T
v
v逆
v正
T1
T2
正反应 热
吸
T
C%
450℃
正反应 热
放
m+n p+q
>
L线上所有的点都是平衡点。左上方(E点),A%大于此压强时平衡体系中的A%,E点必须朝正反应方向移动才能达到平衡状态,所以,E点v正>v逆;则右下方(F点)v正
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
D
A
B
C
D
达标检测
2.X(g)+3Y(s) 2Z(g);△H<0,达平衡时,混合气体中Z的百分含量随温度变化的曲线为( )
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
Z%
T
10kpa
100kpa
D
A
B
C
D
达标检测
3.已知某可逆反应在密闭容器中进行:
A(g)+2B(g) 3C(g)+D(s)(正反应为放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
A.增大A的浓度
B.缩小容器的容积
C.加入催化剂
D.升高温度
BC
A的转化率
t
a
b
达标检测
[例] 可逆反应: mA(s)+nB(g) ?? pC(g);△H<0,在一定温度下B的转化率与压强的关系如图所示,则下列判断正确的是( )。(双选)
A.m+n<p
B.n>p
C.x点的状态是v正>v逆
D.x点比y点的反应速度慢
α(B)
压强
0
X
Y
BD
三、平衡状态与非平衡状态的判断
4.对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示( )
P
Y
100℃
200℃
300℃
AD
A.B物质的转化率
B.正反应的速率
C.平衡体系中的A%
D.平衡体系中的C%
达标检测
对于 m A (g) + n B (g) p C (g);△H 有如图所示的变化,则:
①P1与 P2 的关系是 ;
②m + n 与p的关系是 ;
③T1 与 T2的关系是 ;
④△H与 0 的关系是 。
P2 > P 1
T2 < T1
m + n > p
ΔH<0
C%
t
0
T2 P2
T1 P2
T1 P1
【练习1】
【练习4】右图中的曲线是表示其他条件一定,
2NO+O2 2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v正 >v逆的点是( )
C
NO
转
化
率
0
a
●
●
●
●
c
b
d
温度
【练习5】对于可逆反应A2 (g) + 3B2 (g) 2AB3 (g) (正反应放热)下列图像错误的是( )
v正
v逆
v
T
A2的
转化
率
T
100atm
10atm
1atm
AB3%
P
400℃
500℃
600℃
A2%
t
100℃
200℃
A
B
C
D
D
辅助线
2.已知某可逆反应:aA(g) + bB(g) cC(g)在密闭容器中进行,在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的体积分数(B%)与反应时间(t)的关系如图所示。下列判断正确的是 ( )
A T1<T2,p1<p2,a+b>c,正反应吸热
B T1>T2,p1<p2,a+b<c,正反应吸热
C T1<T2,p1<p2,a+b<c,正反应放热
D T1>T2,p1<p2,a+b>c,正反应放热
B
t
0
B%
T2 P2
T1 P1
T1 P2
五.基本题型
题型1:由化学方程式的特点判断图像
例:可表示为可逆反应2A(g)+B(g) 2C(g) △H < 0的图象是( )
B
500 C
o
t
0
700 C
o
C%
(A)
0
v
P
V
正
逆
V
(B)
0
T
v
V
正
逆
V
(C)
0
P
10 C
o
100 C
o
A
转
化
率
(D)
练习:
A(g) + B(g) 2C + D(g) 此反应符合下列两个
B
△H =Q,
图像,下列说法正确的是( )
1.在一密闭容器中进行下列可逆反应:
A. Q <0,C为固体或液体 B. Q<0,C为气体
C. Q>0,C为气体 D. Q>0,C为固体或液体
t
P
0
D%
0
D%
200℃
600℃
题型5:化学反应速率与化学平衡的综合运用
例: mM(s) + nN(g) pQ(g) ,的可逆反应在定温时N%与压强的关系如下图,下列有关叙述正确的是( )
A
△H < 0
A. A点时,V正> V逆
B. A点比B点的反应速率快
C. n>p
D. m+ n >p
