第一章 水和水的溶液 单元试卷(含解析)
文档属性
| 名称 | 第一章 水和水的溶液 单元试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 247.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-29 21:04:26 | ||
图片预览



文档简介
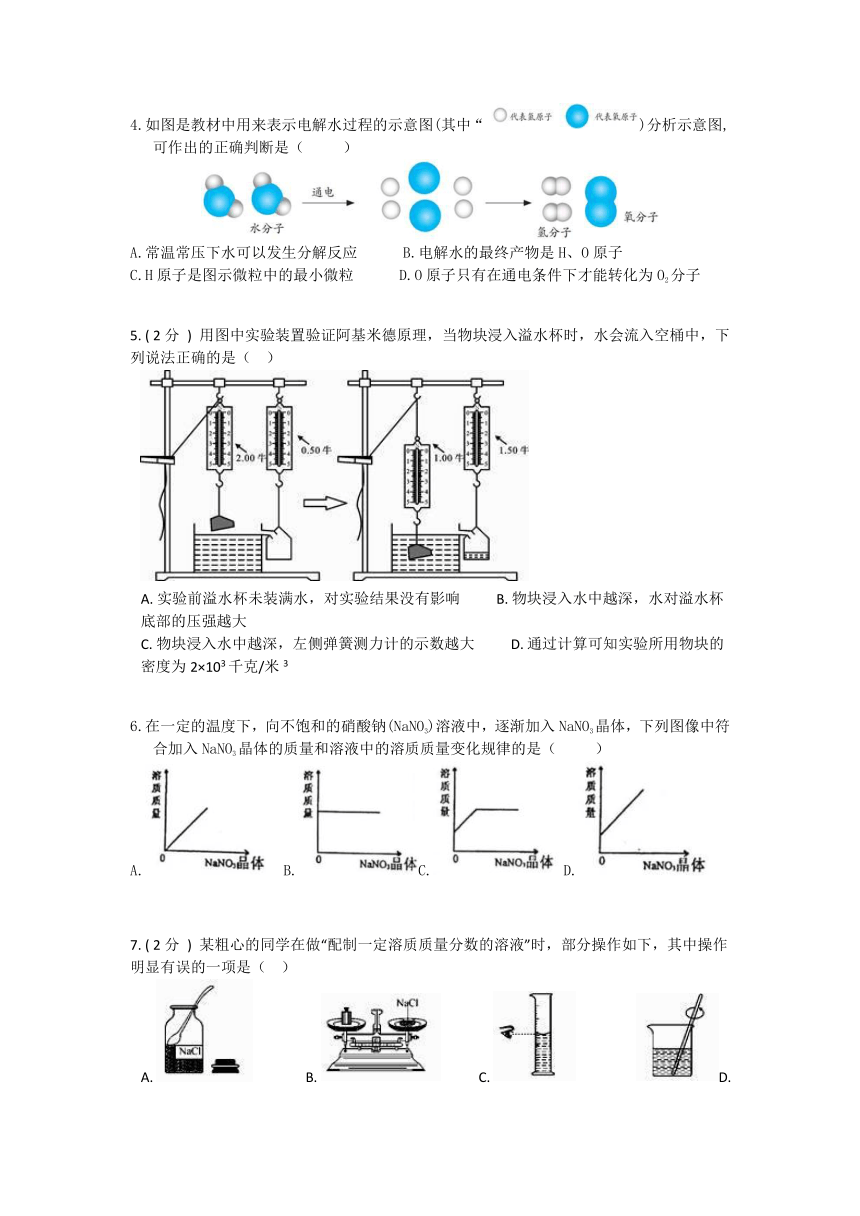
浙教版科学八年级上学期第一章 水和水的溶液 单元试卷
姓名 班级
单项选择
1. ( 2分 ) 关于电解水实验的叙述错误的是( )
A. 电解水时正极上产生的气体能使带火星的木条复燃 B. 电解水时两个电极上都有气泡产生
C. 电解水时产生的氢气体积小于氧气体积 D. 电解水证明水由氢和氧组成
2.如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
A.砂糖水颜色很深 B.砂糖水味道很甜 C.砂糖溶解得很快 D.砂糖固体有剩余
3. ( 2分 ) 如图所示,将一个小球先后放入甲、乙两个盛满不同液体的溢水杯中,小球在甲杯中漂浮,在乙杯中沉底,甲、乙两杯中溢出液体的重力分别为0.5牛和0.4牛,则下列说法正确的是( )
A. 小球在甲杯中受到浮力作用,在乙杯中不受浮力作用 B. 小球在甲杯中受到的浮力为0.5牛,在乙杯中受到的浮力小于0.4牛
C. 小球的质量为50克 D. 甲杯液体的密度小于乙杯液体的密度
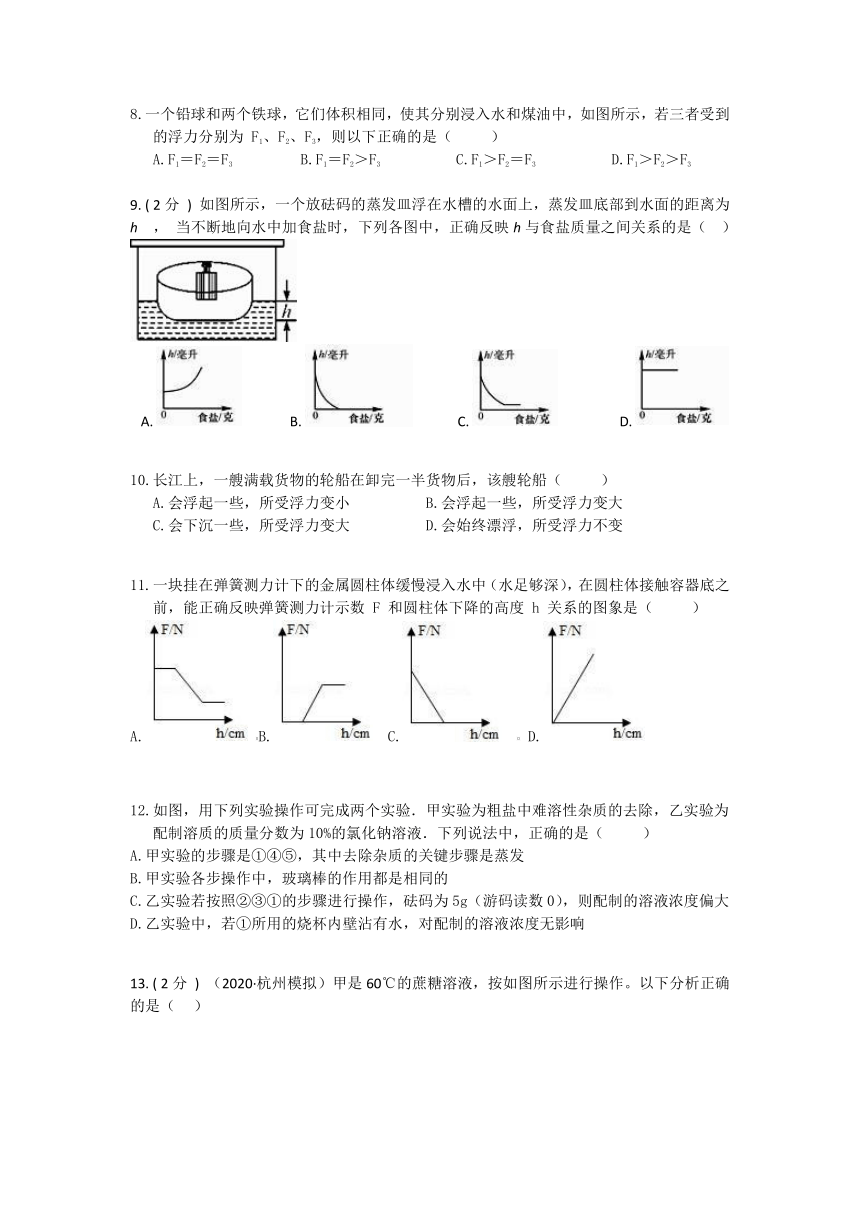
4.如图是教材中用来表示电解水过程的示意图(其中“ )分析示意图,可作出的正确判断是( )
A.常温常压下水可以发生分解反应 B.电解水的最终产物是H、O原子
C.H原子是图示微粒中的最小微粒 D.O原子只有在通电条件下才能转化为O2分子
5. ( 2分 ) 用图中实验装置验证阿基米德原理,当物块浸入溢水杯时,水会流入空桶中,下列说法正确的是( )
A. 实验前溢水杯未装满水,对实验结果没有影响 B. 物块浸入水中越深,水对溢水杯底部的压强越大
C. 物块浸入水中越深,左侧弹簧测力计的示数越大 D. 通过计算可知实验所用物块的密度为2×103千克/米3
6.在一定的温度下,向不饱和的硝酸钠(NaNO3)溶液中,逐渐加入NaNO3晶体,下列图像中符合加入NaNO3晶体的质量和溶液中的溶质质量变化规律的是( )
A. B.C.D.
7. ( 2分 ) 某粗心的同学在做“配制一定溶质质量分数的溶液”时,部分操作如下,其中操作明显有误的一项是( )
A. B. C. D.
8.一个铅球和两个铁球,它们体积相同,使其分别浸入水和煤油中,如图所示,若三者受到的浮力分别为 F1、F2、F3,则以下正确的是( )
A.F1=F2=F3 B.F1=F2>F3 C.F1>F2=F3 D.F1>F2>F3
9. ( 2分 ) 如图所示,一个放砝码的蒸发皿浮在水槽的水面上,蒸发皿底部到水面的距离为h , 当不断地向水中加食盐时,下列各图中,正确反映h与食盐质量之间关系的是( )
A. B. C. D.
10.长江上,一艘满载货物的轮船在卸完一半货物后,该艘轮船( )
A.会浮起一些,所受浮力变小 B.会浮起一些,所受浮力变大
C.会下沉一些,所受浮力变大 D.会始终漂浮,所受浮力不变
11.一块挂在弹簧测力计下的金属圆柱体缓慢浸入水中(水足够深),在圆柱体接触容器底之前,能正确反映弹簧测力计示数 F 和圆柱体下降的高度 h 关系的图象是( )
A. B. C. D.
12.如图,用下列实验操作可完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )
A.甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B.甲实验各步操作中,玻璃棒的作用都是相同的
C.乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大
D.乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响
13. ( 2分 ) (2020·杭州模拟)甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析正确的是( )
甲可能是不饱和溶液,丙和丁一定是饱和溶液 B. 丙的溶液质量和乙的相同
C. 在甲→丙的过程中,蔗糖的溶解度先增大后减小 D. 乙的溶质质量分数比甲大
14. ( 2分 ) (2020·浙江模拟)木糖醇是一种理想的蔗糖替代产品,小陈用它和50g的水配置了一杯约为50℃的溶液给患糖尿病爷爷应用,结合表格可以得出的结论( )
温度℃ 30 50 70
溶解度/g 70 84 93
爷爷想要糖水再甜一点,小晨可以把糖水降温或加入木糖醇
B. 若想把这杯糖水配置到最甜,最多可以溶解木糖醇42g
C. 小晨又配置了70℃和50℃最甜糖水各一杯,两者溶质质量分数之比为93:84
D. 爷爷拿到糖水后发现杯底无固体,小晨判断糖水还未饱和
15. ( 2分 ) (2020·金衢模拟)如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列叙述正确的是( )
A. t1℃时,a、c两种物质饱和溶液的溶质质量分数为20%
B. 将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法
C. 将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a=c
D. 将150ga物质的饱和溶液从t3℃降温至t1℃,可析出30ga物质
填空题
16.水是生命之源。地球上的水存在于地球各处,如河流水、海洋水、冰川水、地下水、湖泊水等,其中占地球总水量最多的是________水。地球上的水通过蒸发、水汽输送、降水以及地表径流等环节在陆地、海洋、大气之间不断地循环,“南水北调工程”对我国“南方水多,北方水少”的状况有所改善,南水北调属于上述水循环中的________环节。
17.( 2分 ) “彩球温度计”是一种家居装饰品。如图所示,在圆柱形玻璃容器内装有对温度敏感的液体,将一些体积相同的小球,按照密度大小排序,依次沉入液体中,球上标有设定好的温度用来读数。当外界气温降低时,容器内液体的体积变小、密度________(填“变大”“变小”或“不变”),小球受到的浮力变大,使沉在容器底部的一些小球依次浮起,我们就用最后浮起的小球上标记的温度来表示外界的气温。根据图中小球的位置可以判断,浮起的三个小球中________(填字母)球的密度最大。
18.概念图能清晰地反映概念之间的联系,如图表示溶液中部分概念的相互联系。请回答:
(1)图中“?”是指________;
(2)将5克食盐固体放入盛有20克蒸馏水的烧杯中,充分搅拌后完全溶解。你是如何确定食盐固体“完全溶解”的?________。
19.( 3分 ) (2020·绍兴)下表是A、B、C三种固体物质在不同温度下(t1温度(℃) t1 t2 t3
物质A(克) 36.0 36.2 37.3
物质B(克) 31.6 36.2 110.0
物质C(克) 0.165 0.135 0.076
(1) ________℃时,A、B两种物质的溶解度相同。
(2)t1℃时,分别取等量的B、C饱和溶液于试管甲、乙中(如图)。将试管放入盛有水的烧杯中,向烧杯中加入一定量硝酸铵(不考虑试管中水的变化),有固体析出的试管为________(选填“甲”或“乙”)。
t2℃时,将10克A固体放入40克水中,充分搅拌后,所得溶液中溶质的质量分数为________。
20.如图所示,桌子上有一个底面积为2×10﹣2m2、内盛有某液体的圆柱形容器,密度为0.5×103kg/m3、体积为4×10﹣4m3的物块A(不吸液体)漂浮在液面上。现用力F压A,使其缓慢向下,直到恰好浸没在液体中(液体未溢出),此时液体对容器底部压强增大了80Pa,则所施加的力F为________N;该液体的密度为________kg/m3。
计算题
21.( 15分 ) (2019八上·衢州期中)下表为硫酸密度与硫酸溶液中的溶质的质量分数对照表(20℃)
密度(g/ml) 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
质量分数(%) 1 10 20 30 40 50 60 70 80 90 98
有一物块A,其体积为250cm3,密度为1.30g/cm3。一只容器中盛有某硫酸溶液5千克,将物块A放入该溶液中静止后如图所示,此时物块A有2/15的体积露出液面。
(1)求物块A静止时受到的浮力大小
(2)求这种硫酸溶液的溶质质量分数是多少
(3)要使物块A全部浸入溶液中,至少需要往容器中加水多少千克 (容器足够大,加水后溶液不溢出。)
22. ( 10分 ) (2019八上·义乌期中)已知20℃时100克水中溶解36克氯化钠恰好达到饱和,20℃时将54克氯化钠配制成400克的溶液.通过计算:
(1)溶液是否饱和?
(2)若不饱和,为了使其饱和可用下面的方法:
①蒸发溶剂法:需蒸发多少克水才能成为饱和溶液?
②加溶质法:需再加入多少克氯化钠溶液才能成为饱和溶液?
23. ( 15分 ) (2019八上·新昌期中)要配制质量分数为4%的氯化钠溶液100g来选种。如果对100g4%的氯化钠溶液进行如下处理,求所得溶液中溶质质量分数。(假设每次增加的溶质皆完全溶解,以下各题要求写出计算过程,结果精确到0.1%)
(1)蒸发10g水,所得溶液的溶质质量分数是多少?
(2)增加5g氯化钠后,所得溶液的溶质质量分数是多少?
(3)增加5g氯化钠和5g水后,所得溶液的溶质质量分数是多少?
24.在实验探究过程中,如果有多种因素同时影响某一实验结果,当我们要探究其中的一种因素时,就要保持其他因素不变,以探究此种因素对实验结果的影响。
完成实验探究:哪些因素影响固体物质在水中的溶解度
因素1:溶质的种类
在实验中要改变的因素是:溶质的种类
要保持不变的因素是:温度
操作步骤:在常温下,用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入氯化钠、硝酸钾、氢氧化钙各29,振荡,观察各物质的溶解情况。
实验现象:试管①中有少量氯化钠未溶,试管②中硝酸钾全部溶解,试管③中有多量氢氧化钙未溶。
实验结论:________
因素2:温度(以硝酸钾为例)
在实验中要改变的因素是:________
要保持不变的因素是:溶质的种类(硝酸钾)
操作步骤:用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入59硝酸钾晶体,将试管①保持在常温下,将试管②加热并保持在40"C,将试管③加热并保持在60"C,振荡,观察各试管中硝酸钾的溶解情况。
实验现象:试管①中有多量硝酸钾未溶,试管②中有少量硝酸钾未溶,试管③中硝酸钾全部溶解。
实验结论:在不同温度下,固体物质(硝酸钾)在水里的溶解度________(填“相等”或“不相等”)。
25.如图是电解水的简易装置和电解水生成气体体积与时间的关系图。试回答下列问题:
(1)若甲试管中生成气体B,则B是________气,b应接电源的________极。
(2)图中现象表明实验是“未开始”“刚开始”还是“已进行一段时间”?________。
(3)如果该实验中产生氧气的体积是8毫升,则生成氢气的体积是________毫升。
(4)该实验可以说明,水在通直流电的条件下,生成了两种不同的气体,请书写其文字表达式:________。
参考答案与解析
一、选择题
1、【答案】 C
【解析】【分析】根据电解水的现象及结论进行分析。
【解答】A.电解水时正极上产生的气体是氧气,能使带火星的木条复燃,叙述正确;
B.电解水时两个电极上都有气泡产生,叙述正确;
C.电解水时产生的氢气体积大于氧气体积,约为2:1,叙述错误;
D.电解水证明水由氢和氧元素组成,叙述正确;
故答案为:C。
2、【答案】 D
【解析】将红砂糖倒入一杯开水中,充分溶解,如果砂糖固体有剩余,说明此时的溶液再也不能溶解砂糖,即这时的砂糖水是饱和溶液,故D正确,而A、B、C错误。
3、【答案】 C
【解析】【分析】物体漂浮在液体表面,物体密度小于液体;物体下沉,则物体的密度大于液体密度。
【解答】甲和乙都在杯子中,和水接触,所以甲乙都有收到浮力。物体受到的浮力等于排开液体体积的重力,所以甲受到的浮力是0.5N,乙受到的重力是0.4N,而小球在甲中漂浮,浮力等于重力,所以甲球的重力为0.5N,质量为50克。小球在甲中漂浮,所以小球的密度小于甲液体的密度。小球在乙中下沉,所以乙的密度小于小球的密度,所以甲液体密度大于乙的密度。
4.【答案】 C
【解析】A、水在通电条件下才可分解, 错误;
B、电解水的最终产物是氢分子和氧分子,错误;
C、图示为化学变化,H原子是化学变化中的最小微粒,正确;
D、O原子能转化为O2分子 不一定是通电条件,错误。
5、【答案】 D
【解析】【分析】(1)用溢水法收集物体排开的水,将溢水杯装满水,然后将物体浸入水中,用其他容器(需先测出其重力)接住溢出的水,然后再测出装有溢出的水的容器的总重力,两者之差就是物体排开水的重力;根据所测数据计算F浮与G排并进行比较.
(2)液体内部的压强与液体深度有关,深度越大,产生的压强越大;
(3)物块完全浸没水中前,排开水的体积增大,溢出去的增多;
(4)由左侧图可知物块的重力,计算出质量;由有图可知物块浸没水中后的重力G′,根据F浮=G-G′计算出浮力,根据阿基米德原理计算出V排,即物体的体积,最后根据密度公式计算出物体的密度.
【解答】A、物体放入水中前,溢水杯应该是满水的,否则小桶内所盛的水将小于物体排开水的体积.所以应该在溢水杯中倒满水;A不符合题意;
B、物块浸没水中后,随着深度的增加,排开水的体积不变,液体的深度不变,故水对容器底部的压强不变;B不符合题意;
C、左侧实验中,在物块完全浸没水中前,随着物块浸入水中深度的增加,排开水的体积增大,溢出去的水增多,故弹簧测力计的示数变大;物块完全浸没水中,排开水的体积不变,弹簧测力计的示数不再变化;C不符合题意;
D、由测力计的示数可知,物体的重力G=2N,物体的质量m=;
物体浸没水中后的浮力F浮=G-G′=2N-1N=1N,
由阿基米德原理F浮=ρ水gV排可得,物体的体积V=V排=F浮/ρ水g==1×10-4m3 ,
物体的密度ρ==2×103m3;D符合题意.
故答案为:D.
6、【答案】 C
【解析】在一定的温度下,向不饱和的NaNO3溶液中,逐渐加入NaNO3晶体,则NaNO3溶液逐渐趋向饱和,即溶质的质量不断增大;当达到饱和以后,其溶液的质量不会变化,故C正确,而A、B、D错误。
7、【答案】 B
【解析】【分析】根据天平的正确使用方法分析;根据取用固体药品的注意事项分析;根据量筒的正确使用分析;根据配制溶液要用玻璃棒搅拌分析。
【解答】天平使用应左物右砝,B中将氯化钠放在了右盘错误;
故答案为:B。
8、【答案】 B
【解析】三个球全部浸没在液体中,因此它们排开液体的体积相同;
根据公式F浮=ρ液gV排可知,液体的密度越大,它受到的浮力越大;液体的密度相等,它们受到的浮力就相等。
因为ρ水>ρ煤油,
即F1=F2>F3。
9、【答案】 C
【解析】【分析】根据向水中不断加氯化钠时溶液密度会增大直到饱和保持不变,从而引起液体中物体所受浮力大小的变化分析。
【解答】不断地向水中加食盐时溶液密度会不断增加,蒸发皿所受浮力会不断增大,所以浸入液面的高度h不断减小,直到氯化钠溶液达到饱和时保持不变;
故答案为:C。
10、【答案】 A
【解析】这艘轮船在卸货前后始终在水面漂浮,因此它受到的浮力等于重力;
因为卸货后轮船的重力减小,所以卸货后轮船受到的浮力变小;
根据公式F浮=ρ液gV排可知,水的密度不变,那么它排开水的体积变小,即会浮起一些。
11、【答案】 A
【解析】(1)当圆柱体没有浸入水中时,它不受浮力,即F=G,这时测力计的示数保持不变;
(2)当圆柱体慢慢浸入水中时,排开水的体积增大,那么它受到的浮力增大;根据公式F=G-F浮可知,弹簧测力计的示数变小;
(3)当圆柱体全部浸没水中时,排开水的体积不变,它们它受到的浮力不变;根据公式F=G-F浮可知,弹簧测力计的示数不变。
因此测力计的示数F和圆柱体下降高度h的关系为:随着高度h的增大,测力计的示数先不变,再增大然后保持不变。
12、【答案】C
【解析】A.粗盐中难溶性杂质的去除的操作步骤是溶解、过滤、蒸发,即步骤是①④⑤,其中去除杂质的关键一步是过滤,故A错误;
B.甲实验各步操作中,溶解时玻璃棒的作用是搅拌,能够加快粗盐的溶解速率;过滤时玻璃棒的作用是引流;蒸发时玻璃棒的作用是搅拌,防止液体飞溅,因此玻璃棒的作用不相同,故B错误;
C.量取的水为42g,那么溶质质量分数= ,会导致配制的溶液浓度偏大,故C正确;
D.乙实验中,若①所用烧杯刚刚用清水洗过,会造成溶剂的质量偏大,则会导致配制的溶液浓度偏小,故D错误。
13、【答案】 D
【解析】【分析】(1)如果溶液中有晶体析出,那么肯定是饱和溶液;如果没有晶体,那么溶液可能饱和,也可能不饱和;
(2)注意丙中有晶体析出;
(3)物质的溶解度的大小与温度有关;
(4)根据公式比较溶质质量分数的大小。
【解答】A.甲溶液恒温蒸发20g水后,仍然没有晶体析出,那么甲肯定是不饱和溶液;丙和丁中,由于已经出现未溶的晶体,所以是饱和溶液,故A错误;
B.丙和乙中溶剂的质量相同,但是丙中溶质的质量小,所以丙的溶液质量小于乙,故B错误;
C.在从甲→丙的过程中,溶液的温度先不变再降低,所以蔗糖的溶解度先不变后减小,故C错误;
D.在甲和乙中,溶质的质量相同,而溶剂的质量减小,根据公式可知,乙的溶质质量分数比甲大,故D正确。
故选D。
14、【答案】 B
【解析】【分析】(1)糖的溶质质量分数越大,糖水的甜度越大;
(2)根据溶解度的概念分析;
(3)根据溶解度与饱和溶液中溶质质量分数关系解答;
(4)根据判断溶液是否饱和的方法分析。
【解答】A.把糖水降温不能增加溶液中糖的溶质质量,不能增大溶质质量分数,自然不能使糖水再甜一点;若糖水原来已经饱和,不会继续溶解糖,此时糖的溶质质量分数不变,即甜度不变,故A错误;
B.饱和糖水的溶质质量分数最大,因此糖水最甜。50℃木糖醇的溶解度是84g,50g的水中最多可以溶解木糖醇42g,故B正确;
C.配制了70℃和50℃最甜糖水各一杯,那么它们都是饱和溶液,两者溶质质量分数之比为 , 故C错误;
D.糖水下面无固体糖出现,那么糖水可能刚好饱和也可能没有饱和,故D错误。
故选B。
15、【答案】 D
【解析】【分析】(1)根据图像确定溶解度,然后根据计算即可;
(2)将不饱和溶液变为饱和溶液的方法:① 加溶质;②改变温度,注意分析是升高温度还是降低温度;
(3)物质的溶解度越大,它的溶质质量分数越大,比较三者物质的溶解度大小即可;
(4)根据图像,确定t3℃和t1℃时a物质的溶解度,然后将它们相减即可。
【解答】A.t1℃时,a、c两种物质的溶解度都是20g,它们饱和溶液的溶质质量分数=, 故A错误;
B.将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质的方法。但是由于c物质的溶解度随温度的升高而减小,因此另一种方法是升温而不是降温,故B错误;
C.a、b两种物质的溶解度都是随温度的降低而减小,因此a、b两种物质在 t2℃ 的饱和溶液降低温度到 t1℃ 时仍然为饱和溶液,但有晶体析出,此时它们的溶质质量分数由t1℃ 时的溶解度决定,即b>a;c物质的溶解度随温度的降低而增大,因此c物质在 t2℃ 的饱和溶液降低温度到 t1℃ 时变成不饱和溶液,那么它的溶质质量分数由 t2℃ 的溶解度决定,因此 t1℃ 时溶液的质量分数a>c,那么三种溶液溶质质量分数的排序是:b>a>c,故C错误;
D.将150ga物质的饱和溶液从t3℃降温至t1℃,可析出:50g-20g=30g,故D正确。
故选D。
填空题
16、【答案】海洋;地表径流
【解析】(1) 地球中的水多数存在于大气层、地面、地底、湖泊、河流及海洋中,其中海洋水所占的比例为最高。
(2)地球上的水循环是指不同的地方上的水,通过吸收太阳的能量,改变状态到地球上另外一个地方。主要通过蒸发、降水、渗透、地表径流和地底流动等方式实现。“南水北调工程”对解决我国“南方水多、北方水少”的现状有所改善,南水北调属于上述水循环中的地表径流环节。
17、【答案】 变大;C
【解析】【分析】(1)容器内的液体质量一定,体积变小,利用密度公式进行定性分析即可判断;
(2)浸没液体中的物体,如果物体的密度大于液体的密度,物体将下沉;如果物体的密度小于液体的密度,物体将上浮;如果物体的密度等于液体的密度,物体将悬浮.据此分析判断.
【解答】(1)当外界气温降低时,容器内的液体质量不变,体积变小,由ρ= 可知密度变大;
(2)当外界气温降低时,液体的密度变大,当液体的密度大于小球的密度时,小球就上浮,按小球上浮的先后顺序,先上浮的小球的密度较小,后上浮的小球的密度较大,所以浮起的三个小球中C球的密度最大.
故答案为:变大;C.
18、【答案】(1)溶剂 (2)烧杯底部观察不到食盐固体颗粒
【解析】(1)溶液由溶质和溶剂组成,所以图中“?”是指溶剂;
(2)不溶解的固体会沉积在烧杯底部,所以烧杯底部观察不到食盐固体颗粒,可以确定食盐固体“完全溶解”。
19、【答案】 (1)t2
(2)甲
(3)20%
【考点】固体溶解度的概念,溶质质量分数的简单计算
【解析】【分析】溶解度,符号S,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。溶液中溶质的质量分数是溶质质量与溶液质量之比。
【解答】(1)由表格中可知,A、B在 t2 ℃时,溶解度都是36.2g;
(2)由表格中的数据可知,物质B的溶解度随着温度的升高而增大,物质C的溶解度随着温度的升高而降低;硝酸铵溶于水吸收热量,溶液温度降低,B物质的溶解度降低,所以试管甲中有物质析出;
(3) t2℃时,A物质的溶解度为36.0g,所以40g溶剂可以溶解A的质量为:所以10gA能够完全溶解在40g水中;其溶质质量分数为;
故答案为:(1) t2;(2)甲;(3)20%。
20、【答案】1.6;0.9×103
【解析】(1)容器底部增大的压力为:△F=△pS=80Pa× 2×10﹣2m2 =1.6N;
那么物体A受到的压力:F=△F=1.6N;
(2)物体A的重力为:G=mg=ρVg= 0.5×103kg/m3 × 4×10﹣4m3 ×10N/kg=2N;
当A浸没时受到的浮力:F浮=G+F=2N+1.6N=3.6N;
那么液体的密度为:。
解答题
21、【答案】 (1)解:因为物体漂浮
所以F浮=G物=ρVg=1.30×103kg/m3×2.50×10-6m3×10N/kg=3.25N
(2)F浮=ρgV排
所以ρ液=F浮/gV排=3.25N/(10N/kg×13/15×250×10-6m3)=1.5×103kg/m3=1.5g/cm3
查表为这种硫酸溶液的溶质质量分数60%
(3)解:物块A全浸,则ρ液=ρ物=1.30g/cm3 , p%=40%
5kg×60%=(5kg+m)×40%
m=2.5kg
【考点】溶质质量分数的简单计算,阿基米德原理,物体的浮沉条件及其应用
【解析】【分析】(1)当物体漂浮时,它受到的浮力等于重力,即 F浮=G物=ρVg ;
(2)已知浮力和V排利用公式计算出硫酸溶液的密度,然后根据表格确定溶液的质量分数;
(3)首先根据浮沉条件确定物块悬浮时溶液的密度,然后根据表格确定溶液的质量分数,最后根据溶质质量相等,利用溶质质量=溶液质量×质量分数列出方程,计算加水的质量即可。
22、【答案】 (1)设400g饱和溶液中溶质氯化钠的质量为x,
;
解得:x=105.88g;
因为54g<105.88g,
所以溶液不不饱和;
(2)①设54g氯化钠饱和溶液的质量为y,
;
解得:y=204g;
那么需要蒸发掉水的质量为:400g-204g=196g;
②需要加入氯化钠的质量为:105.88g-54g=51.88g。
【解析】【分析】(1)相同温度下,同种物质的饱和溶液的溶解度相同,即溶质质量分数相同,据此计算出400g溶液中氯化钠的质量,然后与54g比较大小即可;
(2)①根据溶质质量分数相等,计算出54g氯化钠的饱和溶液的质量,而两个溶液质量的差就是蒸发水的质量;
②用400g饱和氯化钠溶液中溶质质量减去54g即可。
23、【答案】 (1)解:将100g4%的氯化钠溶液中含氯化钠的质量为100g×4%=4g,
含有水的质量为100g-4g=96g。
蒸发10g水后,溶质的质量分数为
(2)增加5g氯化钠后溶质的质量分数为
(3)增加5g氯化钠和5g水后,溶质的质量分数为
24、【答案】在温度保持不变的情况下,不同种类固体物质在水里的溶解度不相等或在温度保持不变时,溶质种类影响固体物质在水中的溶解度;温度;不相等
【解析】因素1实验:通过对以上实验的分析可知:整个过程中除了溶质种类不同以外;其他量均相同;符合单一变量原则;再通过对比发现:试管①中有少量氯化钠未溶,试管②中硝酸钾全部溶解,试管③中有多量氢氧化钙未溶;由此可知:在温度保持不变的情况下,不同种类固体物质在水里的溶解度不相等或在温度保持不变时,溶质种类影响固体物质在水中的溶解度;
因素2实验:探究的变量为温度;不变的量为溶质的种类(硝酸钾);通过对实验现象的分析:试管①保持在常温下,有多量硝酸钾未溶,试管②保持在40℃,有少量硝酸钾未溶,试管③保持在60℃,硝酸钾全部溶解;由此可知:在不同温度下,固体物质(硝酸钾)在水里的溶解度不相等。
【答案】(1)氧;正
(2)已进行一段时间
(3)16
(4)水 氢气+氧气
【解析】(1)通过图可知,甲试管中产生气体少,则B是氧气,b与电源正极相连。
(2)试管中已经有一部分气体存在,故已进行一段时间。
(3)水电解产生氢气和氧气的体积比为2∶1,产生氧气8毫升,则产生氢气16毫升。
姓名 班级
单项选择
1. ( 2分 ) 关于电解水实验的叙述错误的是( )
A. 电解水时正极上产生的气体能使带火星的木条复燃 B. 电解水时两个电极上都有气泡产生
C. 电解水时产生的氢气体积小于氧气体积 D. 电解水证明水由氢和氧组成
2.如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
A.砂糖水颜色很深 B.砂糖水味道很甜 C.砂糖溶解得很快 D.砂糖固体有剩余
3. ( 2分 ) 如图所示,将一个小球先后放入甲、乙两个盛满不同液体的溢水杯中,小球在甲杯中漂浮,在乙杯中沉底,甲、乙两杯中溢出液体的重力分别为0.5牛和0.4牛,则下列说法正确的是( )
A. 小球在甲杯中受到浮力作用,在乙杯中不受浮力作用 B. 小球在甲杯中受到的浮力为0.5牛,在乙杯中受到的浮力小于0.4牛
C. 小球的质量为50克 D. 甲杯液体的密度小于乙杯液体的密度
4.如图是教材中用来表示电解水过程的示意图(其中“ )分析示意图,可作出的正确判断是( )
A.常温常压下水可以发生分解反应 B.电解水的最终产物是H、O原子
C.H原子是图示微粒中的最小微粒 D.O原子只有在通电条件下才能转化为O2分子
5. ( 2分 ) 用图中实验装置验证阿基米德原理,当物块浸入溢水杯时,水会流入空桶中,下列说法正确的是( )
A. 实验前溢水杯未装满水,对实验结果没有影响 B. 物块浸入水中越深,水对溢水杯底部的压强越大
C. 物块浸入水中越深,左侧弹簧测力计的示数越大 D. 通过计算可知实验所用物块的密度为2×103千克/米3
6.在一定的温度下,向不饱和的硝酸钠(NaNO3)溶液中,逐渐加入NaNO3晶体,下列图像中符合加入NaNO3晶体的质量和溶液中的溶质质量变化规律的是( )
A. B.C.D.
7. ( 2分 ) 某粗心的同学在做“配制一定溶质质量分数的溶液”时,部分操作如下,其中操作明显有误的一项是( )
A. B. C. D.
8.一个铅球和两个铁球,它们体积相同,使其分别浸入水和煤油中,如图所示,若三者受到的浮力分别为 F1、F2、F3,则以下正确的是( )
A.F1=F2=F3 B.F1=F2>F3 C.F1>F2=F3 D.F1>F2>F3
9. ( 2分 ) 如图所示,一个放砝码的蒸发皿浮在水槽的水面上,蒸发皿底部到水面的距离为h , 当不断地向水中加食盐时,下列各图中,正确反映h与食盐质量之间关系的是( )
A. B. C. D.
10.长江上,一艘满载货物的轮船在卸完一半货物后,该艘轮船( )
A.会浮起一些,所受浮力变小 B.会浮起一些,所受浮力变大
C.会下沉一些,所受浮力变大 D.会始终漂浮,所受浮力不变
11.一块挂在弹簧测力计下的金属圆柱体缓慢浸入水中(水足够深),在圆柱体接触容器底之前,能正确反映弹簧测力计示数 F 和圆柱体下降的高度 h 关系的图象是( )
A. B. C. D.
12.如图,用下列实验操作可完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )
A.甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B.甲实验各步操作中,玻璃棒的作用都是相同的
C.乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大
D.乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响
13. ( 2分 ) (2020·杭州模拟)甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析正确的是( )
甲可能是不饱和溶液,丙和丁一定是饱和溶液 B. 丙的溶液质量和乙的相同
C. 在甲→丙的过程中,蔗糖的溶解度先增大后减小 D. 乙的溶质质量分数比甲大
14. ( 2分 ) (2020·浙江模拟)木糖醇是一种理想的蔗糖替代产品,小陈用它和50g的水配置了一杯约为50℃的溶液给患糖尿病爷爷应用,结合表格可以得出的结论( )
温度℃ 30 50 70
溶解度/g 70 84 93
爷爷想要糖水再甜一点,小晨可以把糖水降温或加入木糖醇
B. 若想把这杯糖水配置到最甜,最多可以溶解木糖醇42g
C. 小晨又配置了70℃和50℃最甜糖水各一杯,两者溶质质量分数之比为93:84
D. 爷爷拿到糖水后发现杯底无固体,小晨判断糖水还未饱和
15. ( 2分 ) (2020·金衢模拟)如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列叙述正确的是( )
A. t1℃时,a、c两种物质饱和溶液的溶质质量分数为20%
B. 将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法
C. 将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a=c
D. 将150ga物质的饱和溶液从t3℃降温至t1℃,可析出30ga物质
填空题
16.水是生命之源。地球上的水存在于地球各处,如河流水、海洋水、冰川水、地下水、湖泊水等,其中占地球总水量最多的是________水。地球上的水通过蒸发、水汽输送、降水以及地表径流等环节在陆地、海洋、大气之间不断地循环,“南水北调工程”对我国“南方水多,北方水少”的状况有所改善,南水北调属于上述水循环中的________环节。
17.( 2分 ) “彩球温度计”是一种家居装饰品。如图所示,在圆柱形玻璃容器内装有对温度敏感的液体,将一些体积相同的小球,按照密度大小排序,依次沉入液体中,球上标有设定好的温度用来读数。当外界气温降低时,容器内液体的体积变小、密度________(填“变大”“变小”或“不变”),小球受到的浮力变大,使沉在容器底部的一些小球依次浮起,我们就用最后浮起的小球上标记的温度来表示外界的气温。根据图中小球的位置可以判断,浮起的三个小球中________(填字母)球的密度最大。
18.概念图能清晰地反映概念之间的联系,如图表示溶液中部分概念的相互联系。请回答:
(1)图中“?”是指________;
(2)将5克食盐固体放入盛有20克蒸馏水的烧杯中,充分搅拌后完全溶解。你是如何确定食盐固体“完全溶解”的?________。
19.( 3分 ) (2020·绍兴)下表是A、B、C三种固体物质在不同温度下(t1
物质A(克) 36.0 36.2 37.3
物质B(克) 31.6 36.2 110.0
物质C(克) 0.165 0.135 0.076
(1) ________℃时,A、B两种物质的溶解度相同。
(2)t1℃时,分别取等量的B、C饱和溶液于试管甲、乙中(如图)。将试管放入盛有水的烧杯中,向烧杯中加入一定量硝酸铵(不考虑试管中水的变化),有固体析出的试管为________(选填“甲”或“乙”)。
t2℃时,将10克A固体放入40克水中,充分搅拌后,所得溶液中溶质的质量分数为________。
20.如图所示,桌子上有一个底面积为2×10﹣2m2、内盛有某液体的圆柱形容器,密度为0.5×103kg/m3、体积为4×10﹣4m3的物块A(不吸液体)漂浮在液面上。现用力F压A,使其缓慢向下,直到恰好浸没在液体中(液体未溢出),此时液体对容器底部压强增大了80Pa,则所施加的力F为________N;该液体的密度为________kg/m3。
计算题
21.( 15分 ) (2019八上·衢州期中)下表为硫酸密度与硫酸溶液中的溶质的质量分数对照表(20℃)
密度(g/ml) 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
质量分数(%) 1 10 20 30 40 50 60 70 80 90 98
有一物块A,其体积为250cm3,密度为1.30g/cm3。一只容器中盛有某硫酸溶液5千克,将物块A放入该溶液中静止后如图所示,此时物块A有2/15的体积露出液面。
(1)求物块A静止时受到的浮力大小
(2)求这种硫酸溶液的溶质质量分数是多少
(3)要使物块A全部浸入溶液中,至少需要往容器中加水多少千克 (容器足够大,加水后溶液不溢出。)
22. ( 10分 ) (2019八上·义乌期中)已知20℃时100克水中溶解36克氯化钠恰好达到饱和,20℃时将54克氯化钠配制成400克的溶液.通过计算:
(1)溶液是否饱和?
(2)若不饱和,为了使其饱和可用下面的方法:
①蒸发溶剂法:需蒸发多少克水才能成为饱和溶液?
②加溶质法:需再加入多少克氯化钠溶液才能成为饱和溶液?
23. ( 15分 ) (2019八上·新昌期中)要配制质量分数为4%的氯化钠溶液100g来选种。如果对100g4%的氯化钠溶液进行如下处理,求所得溶液中溶质质量分数。(假设每次增加的溶质皆完全溶解,以下各题要求写出计算过程,结果精确到0.1%)
(1)蒸发10g水,所得溶液的溶质质量分数是多少?
(2)增加5g氯化钠后,所得溶液的溶质质量分数是多少?
(3)增加5g氯化钠和5g水后,所得溶液的溶质质量分数是多少?
24.在实验探究过程中,如果有多种因素同时影响某一实验结果,当我们要探究其中的一种因素时,就要保持其他因素不变,以探究此种因素对实验结果的影响。
完成实验探究:哪些因素影响固体物质在水中的溶解度
因素1:溶质的种类
在实验中要改变的因素是:溶质的种类
要保持不变的因素是:温度
操作步骤:在常温下,用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入氯化钠、硝酸钾、氢氧化钙各29,振荡,观察各物质的溶解情况。
实验现象:试管①中有少量氯化钠未溶,试管②中硝酸钾全部溶解,试管③中有多量氢氧化钙未溶。
实验结论:________
因素2:温度(以硝酸钾为例)
在实验中要改变的因素是:________
要保持不变的因素是:溶质的种类(硝酸钾)
操作步骤:用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入59硝酸钾晶体,将试管①保持在常温下,将试管②加热并保持在40"C,将试管③加热并保持在60"C,振荡,观察各试管中硝酸钾的溶解情况。
实验现象:试管①中有多量硝酸钾未溶,试管②中有少量硝酸钾未溶,试管③中硝酸钾全部溶解。
实验结论:在不同温度下,固体物质(硝酸钾)在水里的溶解度________(填“相等”或“不相等”)。
25.如图是电解水的简易装置和电解水生成气体体积与时间的关系图。试回答下列问题:
(1)若甲试管中生成气体B,则B是________气,b应接电源的________极。
(2)图中现象表明实验是“未开始”“刚开始”还是“已进行一段时间”?________。
(3)如果该实验中产生氧气的体积是8毫升,则生成氢气的体积是________毫升。
(4)该实验可以说明,水在通直流电的条件下,生成了两种不同的气体,请书写其文字表达式:________。
参考答案与解析
一、选择题
1、【答案】 C
【解析】【分析】根据电解水的现象及结论进行分析。
【解答】A.电解水时正极上产生的气体是氧气,能使带火星的木条复燃,叙述正确;
B.电解水时两个电极上都有气泡产生,叙述正确;
C.电解水时产生的氢气体积大于氧气体积,约为2:1,叙述错误;
D.电解水证明水由氢和氧元素组成,叙述正确;
故答案为:C。
2、【答案】 D
【解析】将红砂糖倒入一杯开水中,充分溶解,如果砂糖固体有剩余,说明此时的溶液再也不能溶解砂糖,即这时的砂糖水是饱和溶液,故D正确,而A、B、C错误。
3、【答案】 C
【解析】【分析】物体漂浮在液体表面,物体密度小于液体;物体下沉,则物体的密度大于液体密度。
【解答】甲和乙都在杯子中,和水接触,所以甲乙都有收到浮力。物体受到的浮力等于排开液体体积的重力,所以甲受到的浮力是0.5N,乙受到的重力是0.4N,而小球在甲中漂浮,浮力等于重力,所以甲球的重力为0.5N,质量为50克。小球在甲中漂浮,所以小球的密度小于甲液体的密度。小球在乙中下沉,所以乙的密度小于小球的密度,所以甲液体密度大于乙的密度。
4.【答案】 C
【解析】A、水在通电条件下才可分解, 错误;
B、电解水的最终产物是氢分子和氧分子,错误;
C、图示为化学变化,H原子是化学变化中的最小微粒,正确;
D、O原子能转化为O2分子 不一定是通电条件,错误。
5、【答案】 D
【解析】【分析】(1)用溢水法收集物体排开的水,将溢水杯装满水,然后将物体浸入水中,用其他容器(需先测出其重力)接住溢出的水,然后再测出装有溢出的水的容器的总重力,两者之差就是物体排开水的重力;根据所测数据计算F浮与G排并进行比较.
(2)液体内部的压强与液体深度有关,深度越大,产生的压强越大;
(3)物块完全浸没水中前,排开水的体积增大,溢出去的增多;
(4)由左侧图可知物块的重力,计算出质量;由有图可知物块浸没水中后的重力G′,根据F浮=G-G′计算出浮力,根据阿基米德原理计算出V排,即物体的体积,最后根据密度公式计算出物体的密度.
【解答】A、物体放入水中前,溢水杯应该是满水的,否则小桶内所盛的水将小于物体排开水的体积.所以应该在溢水杯中倒满水;A不符合题意;
B、物块浸没水中后,随着深度的增加,排开水的体积不变,液体的深度不变,故水对容器底部的压强不变;B不符合题意;
C、左侧实验中,在物块完全浸没水中前,随着物块浸入水中深度的增加,排开水的体积增大,溢出去的水增多,故弹簧测力计的示数变大;物块完全浸没水中,排开水的体积不变,弹簧测力计的示数不再变化;C不符合题意;
D、由测力计的示数可知,物体的重力G=2N,物体的质量m=;
物体浸没水中后的浮力F浮=G-G′=2N-1N=1N,
由阿基米德原理F浮=ρ水gV排可得,物体的体积V=V排=F浮/ρ水g==1×10-4m3 ,
物体的密度ρ==2×103m3;D符合题意.
故答案为:D.
6、【答案】 C
【解析】在一定的温度下,向不饱和的NaNO3溶液中,逐渐加入NaNO3晶体,则NaNO3溶液逐渐趋向饱和,即溶质的质量不断增大;当达到饱和以后,其溶液的质量不会变化,故C正确,而A、B、D错误。
7、【答案】 B
【解析】【分析】根据天平的正确使用方法分析;根据取用固体药品的注意事项分析;根据量筒的正确使用分析;根据配制溶液要用玻璃棒搅拌分析。
【解答】天平使用应左物右砝,B中将氯化钠放在了右盘错误;
故答案为:B。
8、【答案】 B
【解析】三个球全部浸没在液体中,因此它们排开液体的体积相同;
根据公式F浮=ρ液gV排可知,液体的密度越大,它受到的浮力越大;液体的密度相等,它们受到的浮力就相等。
因为ρ水>ρ煤油,
即F1=F2>F3。
9、【答案】 C
【解析】【分析】根据向水中不断加氯化钠时溶液密度会增大直到饱和保持不变,从而引起液体中物体所受浮力大小的变化分析。
【解答】不断地向水中加食盐时溶液密度会不断增加,蒸发皿所受浮力会不断增大,所以浸入液面的高度h不断减小,直到氯化钠溶液达到饱和时保持不变;
故答案为:C。
10、【答案】 A
【解析】这艘轮船在卸货前后始终在水面漂浮,因此它受到的浮力等于重力;
因为卸货后轮船的重力减小,所以卸货后轮船受到的浮力变小;
根据公式F浮=ρ液gV排可知,水的密度不变,那么它排开水的体积变小,即会浮起一些。
11、【答案】 A
【解析】(1)当圆柱体没有浸入水中时,它不受浮力,即F=G,这时测力计的示数保持不变;
(2)当圆柱体慢慢浸入水中时,排开水的体积增大,那么它受到的浮力增大;根据公式F=G-F浮可知,弹簧测力计的示数变小;
(3)当圆柱体全部浸没水中时,排开水的体积不变,它们它受到的浮力不变;根据公式F=G-F浮可知,弹簧测力计的示数不变。
因此测力计的示数F和圆柱体下降高度h的关系为:随着高度h的增大,测力计的示数先不变,再增大然后保持不变。
12、【答案】C
【解析】A.粗盐中难溶性杂质的去除的操作步骤是溶解、过滤、蒸发,即步骤是①④⑤,其中去除杂质的关键一步是过滤,故A错误;
B.甲实验各步操作中,溶解时玻璃棒的作用是搅拌,能够加快粗盐的溶解速率;过滤时玻璃棒的作用是引流;蒸发时玻璃棒的作用是搅拌,防止液体飞溅,因此玻璃棒的作用不相同,故B错误;
C.量取的水为42g,那么溶质质量分数= ,会导致配制的溶液浓度偏大,故C正确;
D.乙实验中,若①所用烧杯刚刚用清水洗过,会造成溶剂的质量偏大,则会导致配制的溶液浓度偏小,故D错误。
13、【答案】 D
【解析】【分析】(1)如果溶液中有晶体析出,那么肯定是饱和溶液;如果没有晶体,那么溶液可能饱和,也可能不饱和;
(2)注意丙中有晶体析出;
(3)物质的溶解度的大小与温度有关;
(4)根据公式比较溶质质量分数的大小。
【解答】A.甲溶液恒温蒸发20g水后,仍然没有晶体析出,那么甲肯定是不饱和溶液;丙和丁中,由于已经出现未溶的晶体,所以是饱和溶液,故A错误;
B.丙和乙中溶剂的质量相同,但是丙中溶质的质量小,所以丙的溶液质量小于乙,故B错误;
C.在从甲→丙的过程中,溶液的温度先不变再降低,所以蔗糖的溶解度先不变后减小,故C错误;
D.在甲和乙中,溶质的质量相同,而溶剂的质量减小,根据公式可知,乙的溶质质量分数比甲大,故D正确。
故选D。
14、【答案】 B
【解析】【分析】(1)糖的溶质质量分数越大,糖水的甜度越大;
(2)根据溶解度的概念分析;
(3)根据溶解度与饱和溶液中溶质质量分数关系解答;
(4)根据判断溶液是否饱和的方法分析。
【解答】A.把糖水降温不能增加溶液中糖的溶质质量,不能增大溶质质量分数,自然不能使糖水再甜一点;若糖水原来已经饱和,不会继续溶解糖,此时糖的溶质质量分数不变,即甜度不变,故A错误;
B.饱和糖水的溶质质量分数最大,因此糖水最甜。50℃木糖醇的溶解度是84g,50g的水中最多可以溶解木糖醇42g,故B正确;
C.配制了70℃和50℃最甜糖水各一杯,那么它们都是饱和溶液,两者溶质质量分数之比为 , 故C错误;
D.糖水下面无固体糖出现,那么糖水可能刚好饱和也可能没有饱和,故D错误。
故选B。
15、【答案】 D
【解析】【分析】(1)根据图像确定溶解度,然后根据计算即可;
(2)将不饱和溶液变为饱和溶液的方法:① 加溶质;②改变温度,注意分析是升高温度还是降低温度;
(3)物质的溶解度越大,它的溶质质量分数越大,比较三者物质的溶解度大小即可;
(4)根据图像,确定t3℃和t1℃时a物质的溶解度,然后将它们相减即可。
【解答】A.t1℃时,a、c两种物质的溶解度都是20g,它们饱和溶液的溶质质量分数=, 故A错误;
B.将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质的方法。但是由于c物质的溶解度随温度的升高而减小,因此另一种方法是升温而不是降温,故B错误;
C.a、b两种物质的溶解度都是随温度的降低而减小,因此a、b两种物质在 t2℃ 的饱和溶液降低温度到 t1℃ 时仍然为饱和溶液,但有晶体析出,此时它们的溶质质量分数由t1℃ 时的溶解度决定,即b>a;c物质的溶解度随温度的降低而增大,因此c物质在 t2℃ 的饱和溶液降低温度到 t1℃ 时变成不饱和溶液,那么它的溶质质量分数由 t2℃ 的溶解度决定,因此 t1℃ 时溶液的质量分数a>c,那么三种溶液溶质质量分数的排序是:b>a>c,故C错误;
D.将150ga物质的饱和溶液从t3℃降温至t1℃,可析出:50g-20g=30g,故D正确。
故选D。
填空题
16、【答案】海洋;地表径流
【解析】(1) 地球中的水多数存在于大气层、地面、地底、湖泊、河流及海洋中,其中海洋水所占的比例为最高。
(2)地球上的水循环是指不同的地方上的水,通过吸收太阳的能量,改变状态到地球上另外一个地方。主要通过蒸发、降水、渗透、地表径流和地底流动等方式实现。“南水北调工程”对解决我国“南方水多、北方水少”的现状有所改善,南水北调属于上述水循环中的地表径流环节。
17、【答案】 变大;C
【解析】【分析】(1)容器内的液体质量一定,体积变小,利用密度公式进行定性分析即可判断;
(2)浸没液体中的物体,如果物体的密度大于液体的密度,物体将下沉;如果物体的密度小于液体的密度,物体将上浮;如果物体的密度等于液体的密度,物体将悬浮.据此分析判断.
【解答】(1)当外界气温降低时,容器内的液体质量不变,体积变小,由ρ= 可知密度变大;
(2)当外界气温降低时,液体的密度变大,当液体的密度大于小球的密度时,小球就上浮,按小球上浮的先后顺序,先上浮的小球的密度较小,后上浮的小球的密度较大,所以浮起的三个小球中C球的密度最大.
故答案为:变大;C.
18、【答案】(1)溶剂 (2)烧杯底部观察不到食盐固体颗粒
【解析】(1)溶液由溶质和溶剂组成,所以图中“?”是指溶剂;
(2)不溶解的固体会沉积在烧杯底部,所以烧杯底部观察不到食盐固体颗粒,可以确定食盐固体“完全溶解”。
19、【答案】 (1)t2
(2)甲
(3)20%
【考点】固体溶解度的概念,溶质质量分数的简单计算
【解析】【分析】溶解度,符号S,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。溶液中溶质的质量分数是溶质质量与溶液质量之比。
【解答】(1)由表格中可知,A、B在 t2 ℃时,溶解度都是36.2g;
(2)由表格中的数据可知,物质B的溶解度随着温度的升高而增大,物质C的溶解度随着温度的升高而降低;硝酸铵溶于水吸收热量,溶液温度降低,B物质的溶解度降低,所以试管甲中有物质析出;
(3) t2℃时,A物质的溶解度为36.0g,所以40g溶剂可以溶解A的质量为:所以10gA能够完全溶解在40g水中;其溶质质量分数为;
故答案为:(1) t2;(2)甲;(3)20%。
20、【答案】1.6;0.9×103
【解析】(1)容器底部增大的压力为:△F=△pS=80Pa× 2×10﹣2m2 =1.6N;
那么物体A受到的压力:F=△F=1.6N;
(2)物体A的重力为:G=mg=ρVg= 0.5×103kg/m3 × 4×10﹣4m3 ×10N/kg=2N;
当A浸没时受到的浮力:F浮=G+F=2N+1.6N=3.6N;
那么液体的密度为:。
解答题
21、【答案】 (1)解:因为物体漂浮
所以F浮=G物=ρVg=1.30×103kg/m3×2.50×10-6m3×10N/kg=3.25N
(2)F浮=ρgV排
所以ρ液=F浮/gV排=3.25N/(10N/kg×13/15×250×10-6m3)=1.5×103kg/m3=1.5g/cm3
查表为这种硫酸溶液的溶质质量分数60%
(3)解:物块A全浸,则ρ液=ρ物=1.30g/cm3 , p%=40%
5kg×60%=(5kg+m)×40%
m=2.5kg
【考点】溶质质量分数的简单计算,阿基米德原理,物体的浮沉条件及其应用
【解析】【分析】(1)当物体漂浮时,它受到的浮力等于重力,即 F浮=G物=ρVg ;
(2)已知浮力和V排利用公式计算出硫酸溶液的密度,然后根据表格确定溶液的质量分数;
(3)首先根据浮沉条件确定物块悬浮时溶液的密度,然后根据表格确定溶液的质量分数,最后根据溶质质量相等,利用溶质质量=溶液质量×质量分数列出方程,计算加水的质量即可。
22、【答案】 (1)设400g饱和溶液中溶质氯化钠的质量为x,
;
解得:x=105.88g;
因为54g<105.88g,
所以溶液不不饱和;
(2)①设54g氯化钠饱和溶液的质量为y,
;
解得:y=204g;
那么需要蒸发掉水的质量为:400g-204g=196g;
②需要加入氯化钠的质量为:105.88g-54g=51.88g。
【解析】【分析】(1)相同温度下,同种物质的饱和溶液的溶解度相同,即溶质质量分数相同,据此计算出400g溶液中氯化钠的质量,然后与54g比较大小即可;
(2)①根据溶质质量分数相等,计算出54g氯化钠的饱和溶液的质量,而两个溶液质量的差就是蒸发水的质量;
②用400g饱和氯化钠溶液中溶质质量减去54g即可。
23、【答案】 (1)解:将100g4%的氯化钠溶液中含氯化钠的质量为100g×4%=4g,
含有水的质量为100g-4g=96g。
蒸发10g水后,溶质的质量分数为
(2)增加5g氯化钠后溶质的质量分数为
(3)增加5g氯化钠和5g水后,溶质的质量分数为
24、【答案】在温度保持不变的情况下,不同种类固体物质在水里的溶解度不相等或在温度保持不变时,溶质种类影响固体物质在水中的溶解度;温度;不相等
【解析】因素1实验:通过对以上实验的分析可知:整个过程中除了溶质种类不同以外;其他量均相同;符合单一变量原则;再通过对比发现:试管①中有少量氯化钠未溶,试管②中硝酸钾全部溶解,试管③中有多量氢氧化钙未溶;由此可知:在温度保持不变的情况下,不同种类固体物质在水里的溶解度不相等或在温度保持不变时,溶质种类影响固体物质在水中的溶解度;
因素2实验:探究的变量为温度;不变的量为溶质的种类(硝酸钾);通过对实验现象的分析:试管①保持在常温下,有多量硝酸钾未溶,试管②保持在40℃,有少量硝酸钾未溶,试管③保持在60℃,硝酸钾全部溶解;由此可知:在不同温度下,固体物质(硝酸钾)在水里的溶解度不相等。
【答案】(1)氧;正
(2)已进行一段时间
(3)16
(4)水 氢气+氧气
【解析】(1)通过图可知,甲试管中产生气体少,则B是氧气,b与电源正极相连。
(2)试管中已经有一部分气体存在,故已进行一段时间。
(3)水电解产生氢气和氧气的体积比为2∶1,产生氧气8毫升,则产生氢气16毫升。
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
