化学高中(鲁科版选修3)2.3《配位键和金属键》课件
文档属性
| 名称 | 化学高中(鲁科版选修3)2.3《配位键和金属键》课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-03 13:40:02 | ||
图片预览






文档简介
(共16张PPT)
【三维目标】
1、了解简单配位键的形成实质
2、了解配合物在生物、化学领域的广泛应用
3、理解金属键的含义,能用金属键理论解释金属
的某些特征性质。
4、通过交流讨论,培养探究意识与合作意识
5、介绍化学知识在现代科学中的应用,并学会将
所学知识应用于生活
【学习重点、难点】
配位键、金属键的成键过程和实质
【昨日回眸】
1、B
2、 N—H 三角锥
3、
离子键是阴、阳离子通过静电作用形成的化学键
共价键是原子间通过共用电子对形成的化学键
H
H
︱
—
【思考与交流一】
(1)共价键的特征之一是共价键有饱和性,但NH3为什
么仍能与H+结合生成NH4+,又是怎样结合的呢?写出
NH4+的形成过程,并表示出配位键,总结配位键形成
的条件。
(2)化合物NH3、BF3可以通过配位键形成NH3·BF3。
①在NH3·BF3中,哪个原子提供孤对电子?哪个原子
接受孤对电子?
②还有哪些物质可以提供空轨道,哪些可以提供
孤对电子?
(3)配位键与共价键有什么异同?
一、配位键
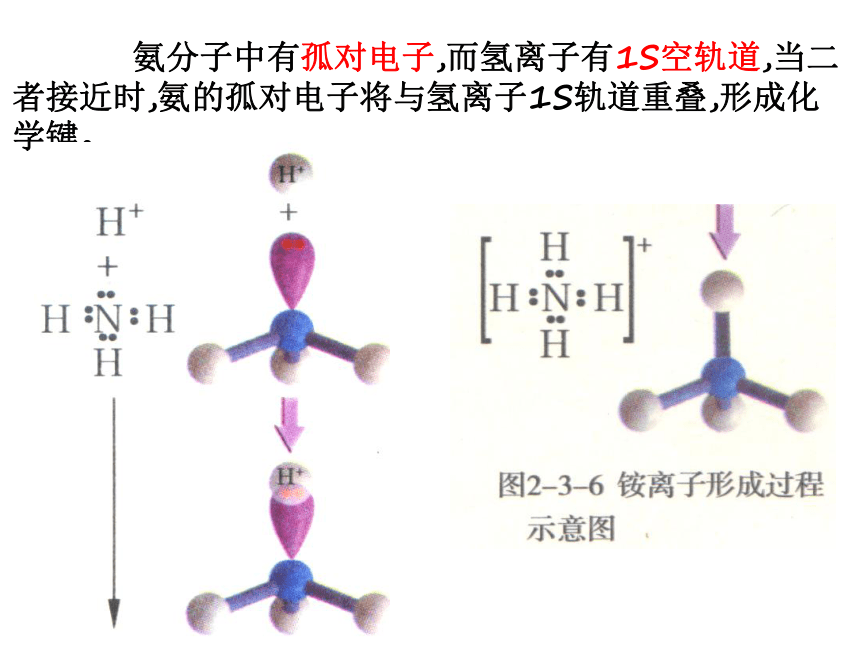
氨分子中有孤对电子,而氢离子有1S空轨道,当二者接近时,氨的孤对电子将与氢离子1S轨道重叠,形成化学键。
【思考与交流一】
(1)共价键的特征之一是共价键有饱和性,但NH3为什
么仍能与H+结合生成NH4+,又是怎样结合的呢?写出
NH4+的形成过程,并表示出配位键,总结配位键形成
的条件。
(2)化合物NH3、BF3可以通过配位键形成NH3·BF3。
①在NH3·BF3中,何种原子提供孤对电子?何种原子
接受孤对电子?
②还有哪些物质可以提供空轨道,哪些可以提供
孤对电子?
(3)配位键与共价键有什么异同?
一、配位键
【思考与交流二】
向盛有5%AgNO3溶液中的试管中逐滴加入2mol/L氨水,直至生成的沉淀恰好全部溶解为止,该过程的现象是什么?分析产物中的化学键类型。
[H3N→Ag←NH3]+OH –
离子键、共价键、配位键
中心离子
有空轨道
▲配位键的存在是配合物与其它物质最本质的区别。
配位体有
孤对电子
四氨合铜络离子的组成:
【思考】
在
中,哪些可以作为中心原子?哪些可以作为配位体?为什么?
中心原子
配位体
Fe3+、Cu2+、Zn2+、Ag+
H2O、NH3、F- 、CN-、CO
身体里的化学
血红蛋白中的配位化合物
Ti
金属样品
二、金属键
【思考与交流三】从微观看金属是由哪些微粒构成的,金属原子怎样形成金属?
金属键: “自由电子”和金属阳离子之间存在强的
相互作用。
特征:
①无方向性、无饱和性;
②金属键中的电子在整个三维空间里运动,属于整块固态金属。
【思考与交流四】
金属具有金属光泽及良好的导电性、导热性和延展性,这些性质与金属键密切相关,如何解释?
化学键 成键
微粒 粒子间的相互作用 键的方向性和饱和性 举例
离子键
共价键
配位键
金属键
阴、阳
离子
原子
原子或离子
与分子或离子
金属阳离子
自由电子
静电
作用
电性
作用
电性
作用
电性
作用
无
无
有
有
HCl、H2等
Fe、 Ag等
NaCl、NaOH等
NH4+ 、
Ag(NH3)2OH等
小结:
【三维目标】
1、了解简单配位键的形成实质
2、了解配合物在生物、化学领域的广泛应用
3、理解金属键的含义,能用金属键理论解释金属
的某些特征性质。
4、通过交流讨论,培养探究意识与合作意识
5、介绍化学知识在现代科学中的应用,并学会将
所学知识应用于生活
【学习重点、难点】
配位键、金属键的成键过程和实质
【昨日回眸】
1、B
2、 N—H 三角锥
3、
离子键是阴、阳离子通过静电作用形成的化学键
共价键是原子间通过共用电子对形成的化学键
H
H
︱
—
【思考与交流一】
(1)共价键的特征之一是共价键有饱和性,但NH3为什
么仍能与H+结合生成NH4+,又是怎样结合的呢?写出
NH4+的形成过程,并表示出配位键,总结配位键形成
的条件。
(2)化合物NH3、BF3可以通过配位键形成NH3·BF3。
①在NH3·BF3中,哪个原子提供孤对电子?哪个原子
接受孤对电子?
②还有哪些物质可以提供空轨道,哪些可以提供
孤对电子?
(3)配位键与共价键有什么异同?
一、配位键
氨分子中有孤对电子,而氢离子有1S空轨道,当二者接近时,氨的孤对电子将与氢离子1S轨道重叠,形成化学键。
【思考与交流一】
(1)共价键的特征之一是共价键有饱和性,但NH3为什
么仍能与H+结合生成NH4+,又是怎样结合的呢?写出
NH4+的形成过程,并表示出配位键,总结配位键形成
的条件。
(2)化合物NH3、BF3可以通过配位键形成NH3·BF3。
①在NH3·BF3中,何种原子提供孤对电子?何种原子
接受孤对电子?
②还有哪些物质可以提供空轨道,哪些可以提供
孤对电子?
(3)配位键与共价键有什么异同?
一、配位键
【思考与交流二】
向盛有5%AgNO3溶液中的试管中逐滴加入2mol/L氨水,直至生成的沉淀恰好全部溶解为止,该过程的现象是什么?分析产物中的化学键类型。
[H3N→Ag←NH3]+OH –
离子键、共价键、配位键
中心离子
有空轨道
▲配位键的存在是配合物与其它物质最本质的区别。
配位体有
孤对电子
四氨合铜络离子的组成:
【思考】
在
中,哪些可以作为中心原子?哪些可以作为配位体?为什么?
中心原子
配位体
Fe3+、Cu2+、Zn2+、Ag+
H2O、NH3、F- 、CN-、CO
身体里的化学
血红蛋白中的配位化合物
Ti
金属样品
二、金属键
【思考与交流三】从微观看金属是由哪些微粒构成的,金属原子怎样形成金属?
金属键: “自由电子”和金属阳离子之间存在强的
相互作用。
特征:
①无方向性、无饱和性;
②金属键中的电子在整个三维空间里运动,属于整块固态金属。
【思考与交流四】
金属具有金属光泽及良好的导电性、导热性和延展性,这些性质与金属键密切相关,如何解释?
化学键 成键
微粒 粒子间的相互作用 键的方向性和饱和性 举例
离子键
共价键
配位键
金属键
阴、阳
离子
原子
原子或离子
与分子或离子
金属阳离子
自由电子
静电
作用
电性
作用
电性
作用
电性
作用
无
无
有
有
HCl、H2等
Fe、 Ag等
NaCl、NaOH等
NH4+ 、
Ag(NH3)2OH等
小结:
