鲁教版(五四制)八年级全一册 第三单元 物质构成的奥秘 复习 课件(共26张PPT)
文档属性
| 名称 | 鲁教版(五四制)八年级全一册 第三单元 物质构成的奥秘 复习 课件(共26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 549.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-29 00:00:00 | ||
图片预览






文档简介
(共26张PPT)
第三单元
物质构成的奥秘 复习课件
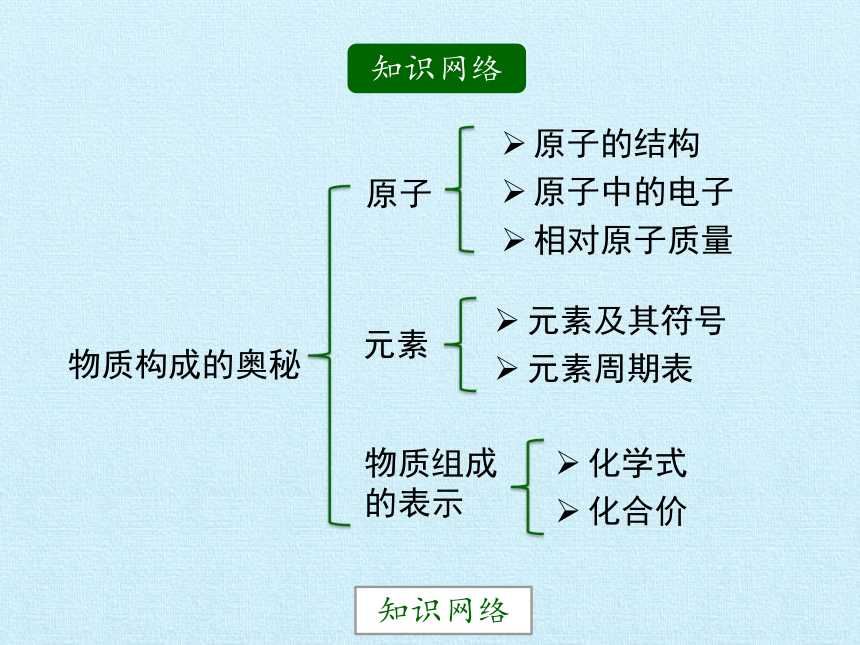
知识网络
知识网络
物质构成的奥秘
原子
原子的结构
原子中的电子
相对原子质量
元素及其符号
元素周期表
元素
物质组成的表示
化学式
化合价
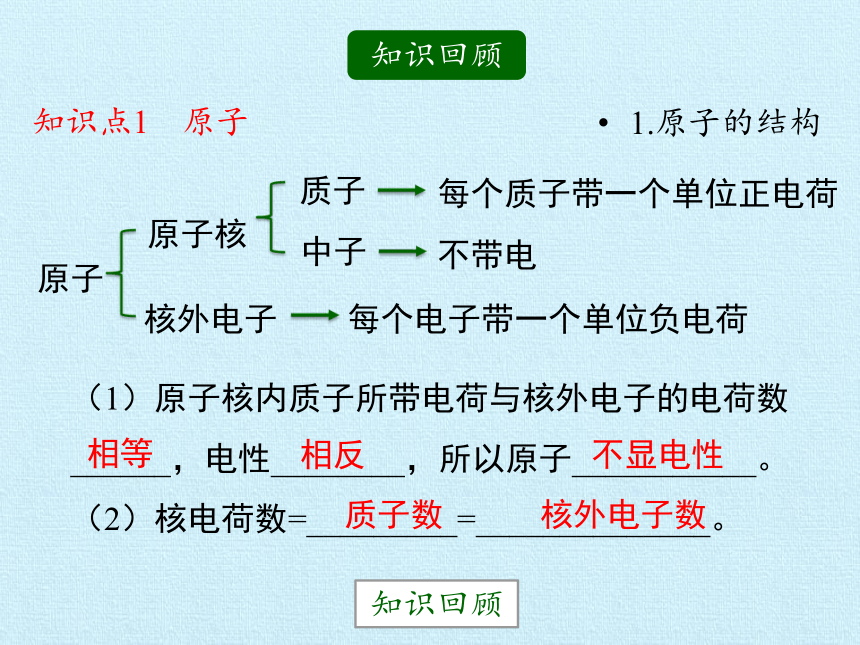
知识回顾
知识回顾
1.原子的结构
原子
原子核
质子
中子
核外电子
每个质子带一个单位正电荷
不带电
每个电子带一个单位负电荷
(1)原子核内质子所带电荷与核外电子的电荷数______,电性________,所以原子___________。
(2)核电荷数=_________=______________。
相等
相反
不显电性
质子数
核外电子数
知识点1 原子
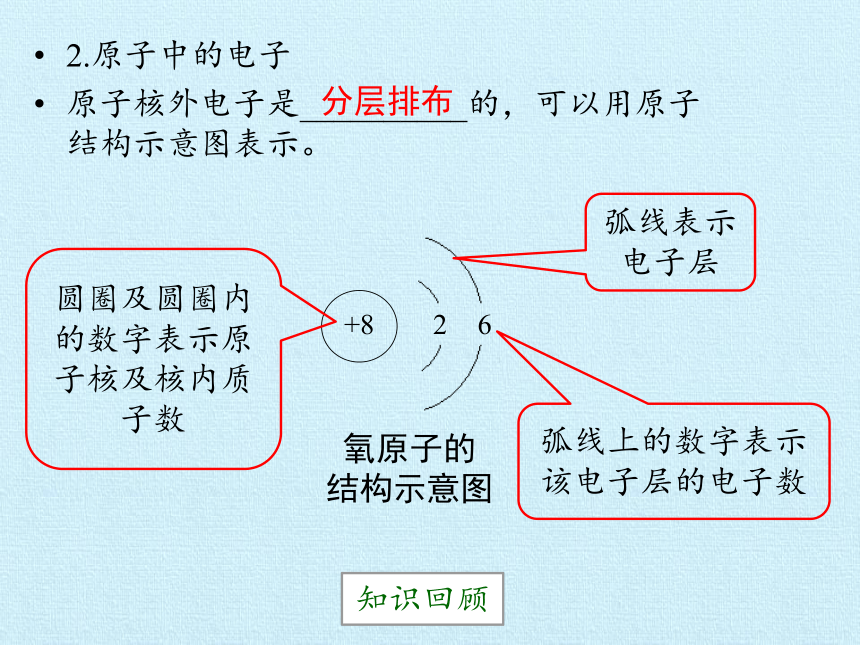
2.原子中的电子
原子核外电子是__________的,可以用原子结构示意图表示。
氧原子的
结构示意图
+8
2
6
弧线表示电子层
弧线上的数字表示该电子层的电子数
圆圈及圆圈内的数字表示原子核及核内质子数
分层排布
知识回顾
(1)金属原子的最外层电子数一般小于4,在化学反应中易________最外层电子,形成________。
(2)非金属原子的最外层电子数一般大于4,在化学反应中易________电子,形成________。
(3)稀有气体原子的最外层电子数一般达到8个电子的_______________(氦除外,为2个电子)。
失去
阳离子
得到
阴离子
相对稳定结构
知识回顾
原子
阳离子
阴离子
得电子
失电子
原子中:质子数 = 电子数(原子不带电)
阳离子中:质子数 > 电子数(带正电)
(4)原子和离子的联系和区别
阴离子中:质子数 < 电子数(带负电)
知识回顾
得电子
失电子
3.相对原子质量
(1)相对原子质量(Ar)=
某种原子的质量
碳12原子质量的1/12
(2)规律:近似相对原子质量=_______+________。
质子数
中子数
注意:相对原子质量不是原子的实际质量,能反映原子实际质量的大小,单位是“1”,习惯不写也不读出。
知识回顾
知识点2 元素
1.元素的概念
元素是______(即核电荷数)相同的一类原子的总称。
质子数
2.元素的化学性质
(1)元素的化学性质与其原子的核外电子排布,特别是______________________有关。
(2)在化学变化时,_____的种类不变,_____也不变。
最外层电子的数目
元素
原子
知识回顾
3.元素符号
(1)书写:“一大二小”。
(2)元素符号的意义
①表示一种______;
②表示这种元素的一个______;
③对于由单个原子构成的单质,还表示这种______。如Fe。
元素
原子
物质
知识回顾
4.元素周期表
(1)原子序数:元素周期表按原子________________的顺序给元素编的号。
(2)布局:7横行形成____个周期,18纵行形成____个族(8、9、10三纵行组成一个族)。
(3)每一个元素占据一格,每一格均包含一种元素的____________________________________________________等内容。
核电荷数递增
原子序数=核电荷数=质子数=核外电子数
原子序数、元素符号、元素名称、相对原子、质量
7
16
知识回顾
知识点3 物质组成的表示
1.化学式
(1)概念:用_____________和数字组合表示物质组成的式子。
(2)意义
化学式不仅能表示某种物质及其组成______,还能表示各元素的原子或离子之间的_____________。
元素符号
元素
数量关系
知识回顾
【探究讨论】
数字在元素符号周围不同的位置代表不同的含义,你能说出下列符号中“2”的意义吗?
①2H
②2H2O
③2Mg2+
知识回顾
(1)概念
化学上用“__________”来体现不同元素的原子相互化合时具有确定的原子个数比的性质。
(2)化合价的表示方法
①元素的化合价标注在元素符号的_________;
②用“+”“-”号表示正负价,用数值表示价位,价位为1的数值__________。
2.化合价
化合价
正上方
不省略
知识回顾
(3)化合价的规律
①在任何化合物里,正负化合价的代数和为_____;
②在化合物里氢通常显____价,氧通常显_____价;
③在金属元素和非金属元素组成的化合物中,金属元素通常显____价,非金属元素通常显____价;
④单质里元素的化合价为____;
⑤许多元素具有_______化合价,同种元素在不同的化合物里可显不同的化合价,如:FeO,Fe2O3中铁元素的化合价分别为+2和+3。
零
+1
-2
正
负
零
可变
知识回顾
(4)化合价的应用
根据:化合物中元素正负化合价的代数和为______。
①根据元素化合价书写化合物的化学式;
②求化合物中某元素的化合价;
③检验化学式的正误。
零
知识回顾
(1)相对分子质量
相对分子质量(符号为Mr)=化学式中各原子的_________________的总和
(2)计算物质组成元素的质量比
(3)计算物质中某元素的质量分数
3.物质组成的定量表示
相对原子质量
知识回顾
例题解析
例题解析
命题角度:考查学生原子的结构的掌握情况。
例1(1)化学变化中的最小粒子是______。
(2)某原子的结构示意图为右图,已知
该粒子在化学反应中易得到2个电子形成
稳定结构,X═_____,该原子得到两个电子后形成的离子符号是_______。若该原子质量为a千克,碳-12原子质量为b千克,该原子相对原子质量为_______。
类型一 原子的结构
原子
16
S2-
12a/b
(3)下列四种微粒中,具有相似的化学性质的是___________。
D
例题解析
【解析】(1)化学变化中的最小粒子是原子。
(2)该粒子在化学反应中易得到2个电子形成稳定结构,即得2个电子形成8电子稳定结构,则原子的最外层应有6个电子;核外电子总数=2+8+6=16,原子中质子数X等于核外电子数16;质子数为16的元素为S,该元素得到两个电子后形成的离子是带两个负电荷的硫离子,根据离子的表示方法可表示为:S2-;若该原子质量为a千克,碳-12原子质量为b千克,该原子相对原子质量为=12a/b。
例题解析
(3)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,可得:
A.②的结构为原子,③的结构为离子,化学性质跟它的原子的最外层电子数目关系非常密切,故A错误;
B.①的结构为原子,③的结构为离子,化学性质跟它的原子的最外层电子数目关系非常密切,故B错误;
C.②、④都为原子结构,最外层电子数不相同,化学性质不同,故C错误;
D.①、④都为原子结构,最外层电子数相同,化学性质相似,故D正确。故选:D。
例题解析
命题角度:考查学生元素及元素周期表的认识。
例2下表为元素周期表中某一周期元素的原子结构示意图.请回答下列问题:
类型二 元素周期表
例题解析
(1)表中磷原子的核电荷数x=_______;
(2)表中具有相对稳定结构的元素是_______;
(3)在化学反应中,每个铝原子失去________个电子形成铝离子;
(4)上述元素在周期表中处于同一周期的原因是__________________________________。
15
氩
3
它们原子的核外电子层数相同
例题解析
【解析】(1)由表中原子结构示意图,再根据“核内质子数=核外电子数”,故x=2+8+5=15;
(2)具有相对稳定结构的元素的最外层电子数应为8,则为氩元素;
(3)由铝元素原子结构示意图知,其最外层电子数为3,故在化学反应中,每个铝原子失去3个电子形成铝离子;
(4)从同周期元素的电子层数相同归纳总结上述元素在周期表中处于同一周期的原因为:原子核外都有3个电子层。
例题解析
0
类型三 化学式与化合价
命题角度:考查学生对化学式与化合价的认识。
例3某物质的化学式为HnMO2n,其相对分子质量是A,则M的相对原子质量是____________,M的化合价是______,当M的化合价不变时,其氧化物化学式为_________,其氧化物的相对分子质量是________。
A-33n
+3n
M2O3n
2A-18n
例题解析
0
例题解析
【解析】某物质的化学式为HnMO2n,其相对分子质量是A,设M的相对原子质量是x,则n+x+16×2n=A,x=A-33n。
氢元素显+1价,氧元素显-2价,
设M元素的化合价是X,根据在化合物中正负化合价代数和为零,可得:(+1)×n+X+(-2)×2n=0,则X=+3n价。
当M的化合价不变时,氧元素显-2价,其氧化物化学式为M2O3n。
其氧化物的相对分子质量是(A-33n)×2+16×3n=2A-18n。
0
谢 谢
第三单元
物质构成的奥秘 复习课件
知识网络
知识网络
物质构成的奥秘
原子
原子的结构
原子中的电子
相对原子质量
元素及其符号
元素周期表
元素
物质组成的表示
化学式
化合价
知识回顾
知识回顾
1.原子的结构
原子
原子核
质子
中子
核外电子
每个质子带一个单位正电荷
不带电
每个电子带一个单位负电荷
(1)原子核内质子所带电荷与核外电子的电荷数______,电性________,所以原子___________。
(2)核电荷数=_________=______________。
相等
相反
不显电性
质子数
核外电子数
知识点1 原子
2.原子中的电子
原子核外电子是__________的,可以用原子结构示意图表示。
氧原子的
结构示意图
+8
2
6
弧线表示电子层
弧线上的数字表示该电子层的电子数
圆圈及圆圈内的数字表示原子核及核内质子数
分层排布
知识回顾
(1)金属原子的最外层电子数一般小于4,在化学反应中易________最外层电子,形成________。
(2)非金属原子的最外层电子数一般大于4,在化学反应中易________电子,形成________。
(3)稀有气体原子的最外层电子数一般达到8个电子的_______________(氦除外,为2个电子)。
失去
阳离子
得到
阴离子
相对稳定结构
知识回顾
原子
阳离子
阴离子
得电子
失电子
原子中:质子数 = 电子数(原子不带电)
阳离子中:质子数 > 电子数(带正电)
(4)原子和离子的联系和区别
阴离子中:质子数 < 电子数(带负电)
知识回顾
得电子
失电子
3.相对原子质量
(1)相对原子质量(Ar)=
某种原子的质量
碳12原子质量的1/12
(2)规律:近似相对原子质量=_______+________。
质子数
中子数
注意:相对原子质量不是原子的实际质量,能反映原子实际质量的大小,单位是“1”,习惯不写也不读出。
知识回顾
知识点2 元素
1.元素的概念
元素是______(即核电荷数)相同的一类原子的总称。
质子数
2.元素的化学性质
(1)元素的化学性质与其原子的核外电子排布,特别是______________________有关。
(2)在化学变化时,_____的种类不变,_____也不变。
最外层电子的数目
元素
原子
知识回顾
3.元素符号
(1)书写:“一大二小”。
(2)元素符号的意义
①表示一种______;
②表示这种元素的一个______;
③对于由单个原子构成的单质,还表示这种______。如Fe。
元素
原子
物质
知识回顾
4.元素周期表
(1)原子序数:元素周期表按原子________________的顺序给元素编的号。
(2)布局:7横行形成____个周期,18纵行形成____个族(8、9、10三纵行组成一个族)。
(3)每一个元素占据一格,每一格均包含一种元素的____________________________________________________等内容。
核电荷数递增
原子序数=核电荷数=质子数=核外电子数
原子序数、元素符号、元素名称、相对原子、质量
7
16
知识回顾
知识点3 物质组成的表示
1.化学式
(1)概念:用_____________和数字组合表示物质组成的式子。
(2)意义
化学式不仅能表示某种物质及其组成______,还能表示各元素的原子或离子之间的_____________。
元素符号
元素
数量关系
知识回顾
【探究讨论】
数字在元素符号周围不同的位置代表不同的含义,你能说出下列符号中“2”的意义吗?
①2H
②2H2O
③2Mg2+
知识回顾
(1)概念
化学上用“__________”来体现不同元素的原子相互化合时具有确定的原子个数比的性质。
(2)化合价的表示方法
①元素的化合价标注在元素符号的_________;
②用“+”“-”号表示正负价,用数值表示价位,价位为1的数值__________。
2.化合价
化合价
正上方
不省略
知识回顾
(3)化合价的规律
①在任何化合物里,正负化合价的代数和为_____;
②在化合物里氢通常显____价,氧通常显_____价;
③在金属元素和非金属元素组成的化合物中,金属元素通常显____价,非金属元素通常显____价;
④单质里元素的化合价为____;
⑤许多元素具有_______化合价,同种元素在不同的化合物里可显不同的化合价,如:FeO,Fe2O3中铁元素的化合价分别为+2和+3。
零
+1
-2
正
负
零
可变
知识回顾
(4)化合价的应用
根据:化合物中元素正负化合价的代数和为______。
①根据元素化合价书写化合物的化学式;
②求化合物中某元素的化合价;
③检验化学式的正误。
零
知识回顾
(1)相对分子质量
相对分子质量(符号为Mr)=化学式中各原子的_________________的总和
(2)计算物质组成元素的质量比
(3)计算物质中某元素的质量分数
3.物质组成的定量表示
相对原子质量
知识回顾
例题解析
例题解析
命题角度:考查学生原子的结构的掌握情况。
例1(1)化学变化中的最小粒子是______。
(2)某原子的结构示意图为右图,已知
该粒子在化学反应中易得到2个电子形成
稳定结构,X═_____,该原子得到两个电子后形成的离子符号是_______。若该原子质量为a千克,碳-12原子质量为b千克,该原子相对原子质量为_______。
类型一 原子的结构
原子
16
S2-
12a/b
(3)下列四种微粒中,具有相似的化学性质的是___________。
D
例题解析
【解析】(1)化学变化中的最小粒子是原子。
(2)该粒子在化学反应中易得到2个电子形成稳定结构,即得2个电子形成8电子稳定结构,则原子的最外层应有6个电子;核外电子总数=2+8+6=16,原子中质子数X等于核外电子数16;质子数为16的元素为S,该元素得到两个电子后形成的离子是带两个负电荷的硫离子,根据离子的表示方法可表示为:S2-;若该原子质量为a千克,碳-12原子质量为b千克,该原子相对原子质量为=12a/b。
例题解析
(3)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,可得:
A.②的结构为原子,③的结构为离子,化学性质跟它的原子的最外层电子数目关系非常密切,故A错误;
B.①的结构为原子,③的结构为离子,化学性质跟它的原子的最外层电子数目关系非常密切,故B错误;
C.②、④都为原子结构,最外层电子数不相同,化学性质不同,故C错误;
D.①、④都为原子结构,最外层电子数相同,化学性质相似,故D正确。故选:D。
例题解析
命题角度:考查学生元素及元素周期表的认识。
例2下表为元素周期表中某一周期元素的原子结构示意图.请回答下列问题:
类型二 元素周期表
例题解析
(1)表中磷原子的核电荷数x=_______;
(2)表中具有相对稳定结构的元素是_______;
(3)在化学反应中,每个铝原子失去________个电子形成铝离子;
(4)上述元素在周期表中处于同一周期的原因是__________________________________。
15
氩
3
它们原子的核外电子层数相同
例题解析
【解析】(1)由表中原子结构示意图,再根据“核内质子数=核外电子数”,故x=2+8+5=15;
(2)具有相对稳定结构的元素的最外层电子数应为8,则为氩元素;
(3)由铝元素原子结构示意图知,其最外层电子数为3,故在化学反应中,每个铝原子失去3个电子形成铝离子;
(4)从同周期元素的电子层数相同归纳总结上述元素在周期表中处于同一周期的原因为:原子核外都有3个电子层。
例题解析
0
类型三 化学式与化合价
命题角度:考查学生对化学式与化合价的认识。
例3某物质的化学式为HnMO2n,其相对分子质量是A,则M的相对原子质量是____________,M的化合价是______,当M的化合价不变时,其氧化物化学式为_________,其氧化物的相对分子质量是________。
A-33n
+3n
M2O3n
2A-18n
例题解析
0
例题解析
【解析】某物质的化学式为HnMO2n,其相对分子质量是A,设M的相对原子质量是x,则n+x+16×2n=A,x=A-33n。
氢元素显+1价,氧元素显-2价,
设M元素的化合价是X,根据在化合物中正负化合价代数和为零,可得:(+1)×n+X+(-2)×2n=0,则X=+3n价。
当M的化合价不变时,氧元素显-2价,其氧化物化学式为M2O3n。
其氧化物的相对分子质量是(A-33n)×2+16×3n=2A-18n。
0
谢 谢
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
