江苏省兴化市板桥高级中学2011-2012学年高一下学期期末考试化学试题
文档属性
| 名称 | 江苏省兴化市板桥高级中学2011-2012学年高一下学期期末考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 222.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-03 22:00:05 | ||
图片预览


文档简介
板桥高级中学2011-2012学年高一下学期期末考试
化学试题
考试时间:75分钟 分值:100分
可能用到的相对的原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27
一.单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3分,共69分)
1.现代生活中出现了 “铁强化酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的铁、钙、硒、氟应理解为 ( )
A.分子 B.元素 C.单质 D.氧化物
2.海洋是一个巨大的宝藏,期待着人们的开发和利用。下列物质不经过化学变化就能从海水中获得的是 ( )
A.单质溴 B.单质镁 C.食盐 D.烧碱
3.下列物质不属于天然高分子化合物的是 ( )
A.淀粉 B.纤维素 C.蚕丝 D.油脂
4.硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是 ( )
A.陶瓷 B.金刚石 C.水晶 D.大理石
5.高纯度的硅及二氧化硅是新型材料,在电子、通讯领域有极广泛的应用。下列元素与硅元素处于同一主族的是 ( )
A.He B.C C.O D.P
6.下列说法正确的是 ( )
A.原子核内含有4个质子 B.32S与33S是同种核素
C.正丁烷与异丁烷互为同系物 D. 互为同分异构体
7.在水溶液中能大量共存的离子组是 ( )
A.Mg2+、NH4+、HCO3—、OH— B.Na+、AlO2—、CO32—、OH—
C.Ca2+、Fe2+、H+、NO3— D.Fe3+、K+、SCN—、SO42—
8.下列物质属于含有共价键的离子化合物的是 ( )
A.C60 B.C6H6 C.KF D.NaOH
9.下列试剂的保存方法错误的是 ( )
A.少量的钠保存在煤油中 B.浓硝酸保存在无色玻璃瓶中
C.新制的氯水保存在棕色玻璃瓶中 D.氢氧化钠溶液保存在具橡皮塞的玻璃瓶中
10.下列说法正确的是 ( )
A.SO2能使KMnO4溶液褪色 B.S在O2中燃烧生成SO3
C.用澄清石灰水可鉴别CO2和SO2 D.SO2通入BaCl2溶液中能产生白色沉淀
11.对于工业合成氨反应:N2+3H22NH3,下列说法错误的是 ( )
A.使用合适的催化剂可以加大反应速率
B.升高温度可以增大反应速率
C.增大N2浓度可以使H2转化率达到100℅
D.增大N2浓度可以增大反应速率
12.下列离子方程式中,正确的是 ( )
A.钠和水反应:Na+2H2O = Na++2OH-+H2↑
B.铜跟稀硝酸反应:3Cu+ 8H++2NO3-=3Cu2++2NO↑+4H2O
C.氯气通入冷的氢氧化钠溶液中 2Cl2+2OH- = 3Cl-+ClO-+H2O
D.向AlCl3溶液中加入过量的氨水溶液:Al3+ + 3OH- = Al(OH)3↓
13.下列有关化学能与热能的说法正确的是 ( )
A.铝热反应属于吸热反应
B.若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应
C.吸热反应是指需要加热才能进行的反应
D.H2与Cl2的反应过程中,分子转化为原子是吸收能量,原子转化为分子是放出能量
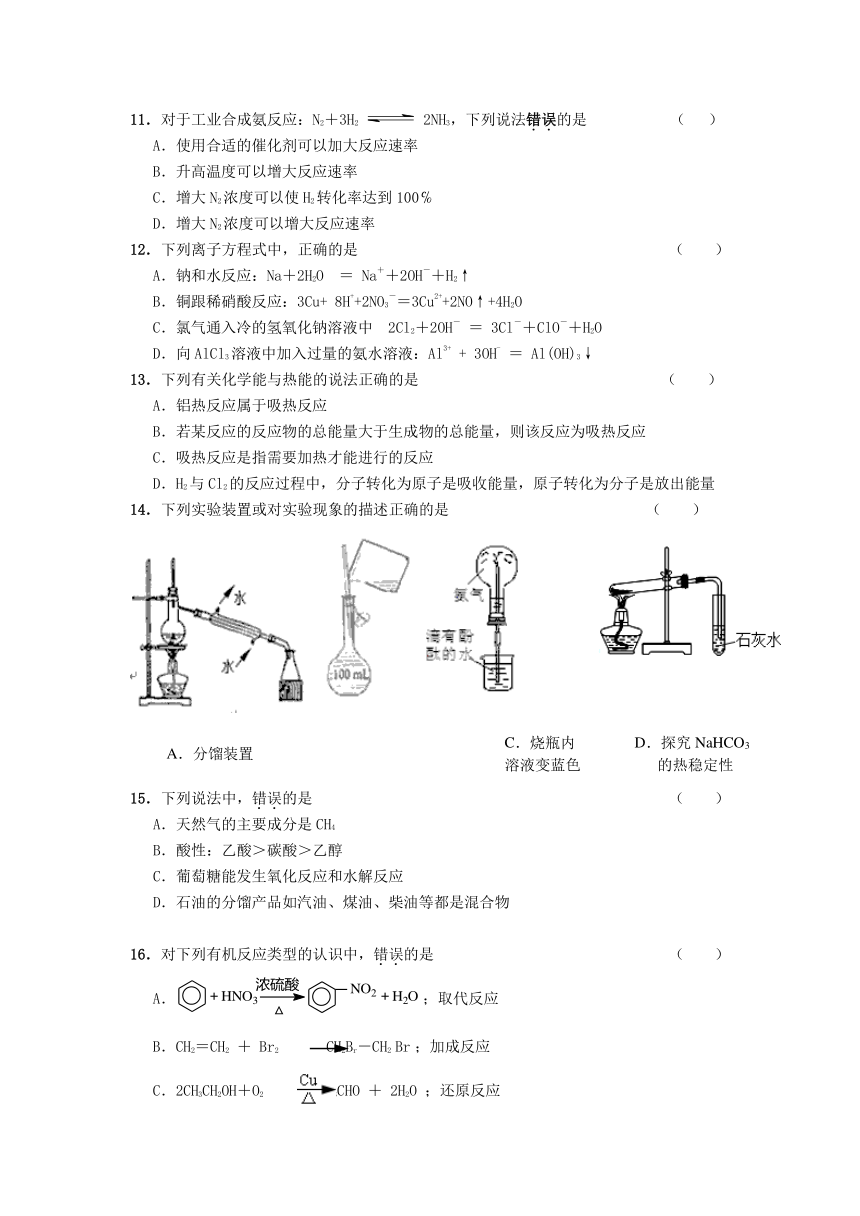
14.下列实验装置或对实验现象的描述正确的是 ( )
15.下列说法中,错误的是 ( )
A.天然气的主要成分是CH4
B.酸性:乙酸>碳酸>乙醇
C.葡萄糖能发生氧化反应和水解反应
D.石油的分馏产品如汽油、煤油、柴油等都是混合物
16.对下列有机反应类型的认识中,错误的是 ( )
A.;取代反应
B.CH2=CH2 + Br2 CH2Br-CH2 Br ;加成反应
C.2CH3CH2OH+O2 2CH3CHO + 2H2O ;还原反应
D. ;酯化反应
17.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:
Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。下列说法正确的是 ( )
A.该反应是非氧化还原反应
B.KNO3是还原剂
C.生成1mol K2FeO4转移的电子数为4 mol
D. K2FeO4不仅具有杀菌消毒作用,而且具有净水作用
18.下列化学用语正确的是 ( )
A.S原子的结构示意图:
B.氯化钠的电子式:
C.乙醇的结构式:
D.碳酸钠的电离方程式:NaHCO3=Na+ + H++CO32-
19.用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.常温常压下,11.2L中含有的分子数为0.5NA
B.2.3g钠与足量水反应,生成Na+离子的数目为0.1 NA
C.0.2 mol·L—1 CaCl2溶液中含有Clˉ离子的数目为0.4 NA
D.2.7g铝与足量氢氧化钠溶液反应转移的电子数NA
20.下列叙述错误的是 ( )
A.可用铝制容器盛装稀硫酸
B.Na2O2可用于呼吸面具中作为氧气的来源
C.Fe2O3常用于制造红色油漆和涂料
D.Si可用于制造太阳能电池
21.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述错误的是 ( )
A.a电极是负极
B.b电极上发生氧化反应
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在
电池内的新型发电装置
22.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是 ( )
A.原子半径:A<B<C<D<E
B.金属性:D>C
C.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
D.化合物AE与CE含有相同类型的化学键
23.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L—1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 ( )
A.60 mL B.45 mL C.30 mL D.15 mL
二、非选择题(本部分3题,共31分)
24.(8分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式 ▲ 。
(2)浓硫酸的作用是 ▲ 与吸水剂。
(3)饱和碳酸钠溶液的主要作用是 ▲ 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防 止 ▲ 。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是▲。
25. (9分)下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
(1)在这些元素中,化学性质最不活泼的是 ▲ (填元素符号)其结构示意图为 ▲。
(2)在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是 ▲ (填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是▲ (填化学式),具有两性的化合物是 ▲ (填化学式)。
(3)元素③的氢化物分别跟元素④、元素⑦的单质反应的化学方程式是 ▲ 、 ▲ 。
26.(14分)工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx ,反应原理如下:
4xNH3 +6 NOx (2x + 3)N2 + 6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:
①装置A中发生反应的化学方程式为 ▲ 。
②装置D中碱石灰的作用是 ▲ 。
(2)工业上也常用Na2CO3溶液吸收法处理NOx 。
已知: NO不能与Na2CO3溶液反应,。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 (II)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是 ▲ (填字母)。
A.1.3 B.1.6 C.1.8
②将1mol NOx 通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3—、NO2—两种离子的物质的量随x变化关系如图所示:
图中线段a表示 ▲ 离子随x值变化的关系;若用溶质质量分数为21.2%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少 ▲ g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为 ▲ 。
(3)氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气共同的优点是 ▲ 。
2011-2012年学年度第一学期期末考试高一化学
参考答案及评分标准
D.探究NaHCO3
的热稳定性
C.烧瓶内
溶液变蓝色
A.分馏装置
化学试题
考试时间:75分钟 分值:100分
可能用到的相对的原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27
一.单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3分,共69分)
1.现代生活中出现了 “铁强化酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的铁、钙、硒、氟应理解为 ( )
A.分子 B.元素 C.单质 D.氧化物
2.海洋是一个巨大的宝藏,期待着人们的开发和利用。下列物质不经过化学变化就能从海水中获得的是 ( )
A.单质溴 B.单质镁 C.食盐 D.烧碱
3.下列物质不属于天然高分子化合物的是 ( )
A.淀粉 B.纤维素 C.蚕丝 D.油脂
4.硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是 ( )
A.陶瓷 B.金刚石 C.水晶 D.大理石
5.高纯度的硅及二氧化硅是新型材料,在电子、通讯领域有极广泛的应用。下列元素与硅元素处于同一主族的是 ( )
A.He B.C C.O D.P
6.下列说法正确的是 ( )
A.原子核内含有4个质子 B.32S与33S是同种核素
C.正丁烷与异丁烷互为同系物 D. 互为同分异构体
7.在水溶液中能大量共存的离子组是 ( )
A.Mg2+、NH4+、HCO3—、OH— B.Na+、AlO2—、CO32—、OH—
C.Ca2+、Fe2+、H+、NO3— D.Fe3+、K+、SCN—、SO42—
8.下列物质属于含有共价键的离子化合物的是 ( )
A.C60 B.C6H6 C.KF D.NaOH
9.下列试剂的保存方法错误的是 ( )
A.少量的钠保存在煤油中 B.浓硝酸保存在无色玻璃瓶中
C.新制的氯水保存在棕色玻璃瓶中 D.氢氧化钠溶液保存在具橡皮塞的玻璃瓶中
10.下列说法正确的是 ( )
A.SO2能使KMnO4溶液褪色 B.S在O2中燃烧生成SO3
C.用澄清石灰水可鉴别CO2和SO2 D.SO2通入BaCl2溶液中能产生白色沉淀
11.对于工业合成氨反应:N2+3H22NH3,下列说法错误的是 ( )
A.使用合适的催化剂可以加大反应速率
B.升高温度可以增大反应速率
C.增大N2浓度可以使H2转化率达到100℅
D.增大N2浓度可以增大反应速率
12.下列离子方程式中,正确的是 ( )
A.钠和水反应:Na+2H2O = Na++2OH-+H2↑
B.铜跟稀硝酸反应:3Cu+ 8H++2NO3-=3Cu2++2NO↑+4H2O
C.氯气通入冷的氢氧化钠溶液中 2Cl2+2OH- = 3Cl-+ClO-+H2O
D.向AlCl3溶液中加入过量的氨水溶液:Al3+ + 3OH- = Al(OH)3↓
13.下列有关化学能与热能的说法正确的是 ( )
A.铝热反应属于吸热反应
B.若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应
C.吸热反应是指需要加热才能进行的反应
D.H2与Cl2的反应过程中,分子转化为原子是吸收能量,原子转化为分子是放出能量
14.下列实验装置或对实验现象的描述正确的是 ( )
15.下列说法中,错误的是 ( )
A.天然气的主要成分是CH4
B.酸性:乙酸>碳酸>乙醇
C.葡萄糖能发生氧化反应和水解反应
D.石油的分馏产品如汽油、煤油、柴油等都是混合物
16.对下列有机反应类型的认识中,错误的是 ( )
A.;取代反应
B.CH2=CH2 + Br2 CH2Br-CH2 Br ;加成反应
C.2CH3CH2OH+O2 2CH3CHO + 2H2O ;还原反应
D. ;酯化反应
17.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:
Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。下列说法正确的是 ( )
A.该反应是非氧化还原反应
B.KNO3是还原剂
C.生成1mol K2FeO4转移的电子数为4 mol
D. K2FeO4不仅具有杀菌消毒作用,而且具有净水作用
18.下列化学用语正确的是 ( )
A.S原子的结构示意图:
B.氯化钠的电子式:
C.乙醇的结构式:
D.碳酸钠的电离方程式:NaHCO3=Na+ + H++CO32-
19.用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.常温常压下,11.2L中含有的分子数为0.5NA
B.2.3g钠与足量水反应,生成Na+离子的数目为0.1 NA
C.0.2 mol·L—1 CaCl2溶液中含有Clˉ离子的数目为0.4 NA
D.2.7g铝与足量氢氧化钠溶液反应转移的电子数NA
20.下列叙述错误的是 ( )
A.可用铝制容器盛装稀硫酸
B.Na2O2可用于呼吸面具中作为氧气的来源
C.Fe2O3常用于制造红色油漆和涂料
D.Si可用于制造太阳能电池
21.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述错误的是 ( )
A.a电极是负极
B.b电极上发生氧化反应
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在
电池内的新型发电装置
22.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是 ( )
A.原子半径:A<B<C<D<E
B.金属性:D>C
C.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
D.化合物AE与CE含有相同类型的化学键
23.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L—1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 ( )
A.60 mL B.45 mL C.30 mL D.15 mL
二、非选择题(本部分3题,共31分)
24.(8分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式 ▲ 。
(2)浓硫酸的作用是 ▲ 与吸水剂。
(3)饱和碳酸钠溶液的主要作用是 ▲ 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防 止 ▲ 。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是▲。
25. (9分)下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
(1)在这些元素中,化学性质最不活泼的是 ▲ (填元素符号)其结构示意图为 ▲。
(2)在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是 ▲ (填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是▲ (填化学式),具有两性的化合物是 ▲ (填化学式)。
(3)元素③的氢化物分别跟元素④、元素⑦的单质反应的化学方程式是 ▲ 、 ▲ 。
26.(14分)工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx ,反应原理如下:
4xNH3 +6 NOx (2x + 3)N2 + 6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:
①装置A中发生反应的化学方程式为 ▲ 。
②装置D中碱石灰的作用是 ▲ 。
(2)工业上也常用Na2CO3溶液吸收法处理NOx 。
已知: NO不能与Na2CO3溶液反应,。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 (II)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是 ▲ (填字母)。
A.1.3 B.1.6 C.1.8
②将1mol NOx 通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3—、NO2—两种离子的物质的量随x变化关系如图所示:
图中线段a表示 ▲ 离子随x值变化的关系;若用溶质质量分数为21.2%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少 ▲ g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为 ▲ 。
(3)氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气共同的优点是 ▲ 。
2011-2012年学年度第一学期期末考试高一化学
参考答案及评分标准
D.探究NaHCO3
的热稳定性
C.烧瓶内
溶液变蓝色
A.分馏装置
同课章节目录
