【2021-2022学年】人教版必修1第二章第三节氧化还原反应同步练习(解析版)
文档属性
| 名称 | 【2021-2022学年】人教版必修1第二章第三节氧化还原反应同步练习(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-30 12:54:11 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
必修1第二章第三节氧化还原反应同步练习
第I卷(选择题)
一、单选题
1.下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
A.NH4Cl+NaOHNaCl+H2O+NH3↑ B.CH4+2O2CO2+2H2O
C.2Al+Fe2O3Al2O3+2Fe D.3Cl2+2Fe2FeCl3
2.已知氧化性:Cl2>Br2>Fe3+>I2。判断下列化学方程式一定不正确的是( )
A.2FeCl3+2KI=2FeCl2+2KCl+I2 B.6FeCl2+3Br2=4FeCl3+2FeBr3
C.FeCl2+Br2=FeBr2+Cl2 D.FeI2+Cl2=FeCl2+I2
3.下列反应中水既不是氧化剂又不是还原剂的氧化还原反应是( )
A.2Na2O2+2H2O=4NaOH+O2↑
B.NaH+H2O=NaOH+H2↑
C.2F2+2H2O=4HF+O2
D.SO3+H2O=H2SO4
4.下列对氧化还原反应的分析中不合理的是( )
A.Mg变成MgO时化合价升高,失去电子,因此Mg在该反应中作氧化剂
B.KMnO4受热分解时,Mn元素被还原,KMnO4既是氧化剂又是还原剂
C.反应CuSO4+2NaOH=Cu(OH)2↓+Na2SO4不属于氧化还原反应
D.在反应2H2O2H2↑+O2↑中,H2O既是还原剂,又是氧化剂
5.已知在碱性溶液中可发生如下反应:2M(OH)3+3Cl2+10OH-=2MO+6Cl-+8H2O,则MO中M的化合价是( )
A.+3 B.+4 C.+5 D.+6
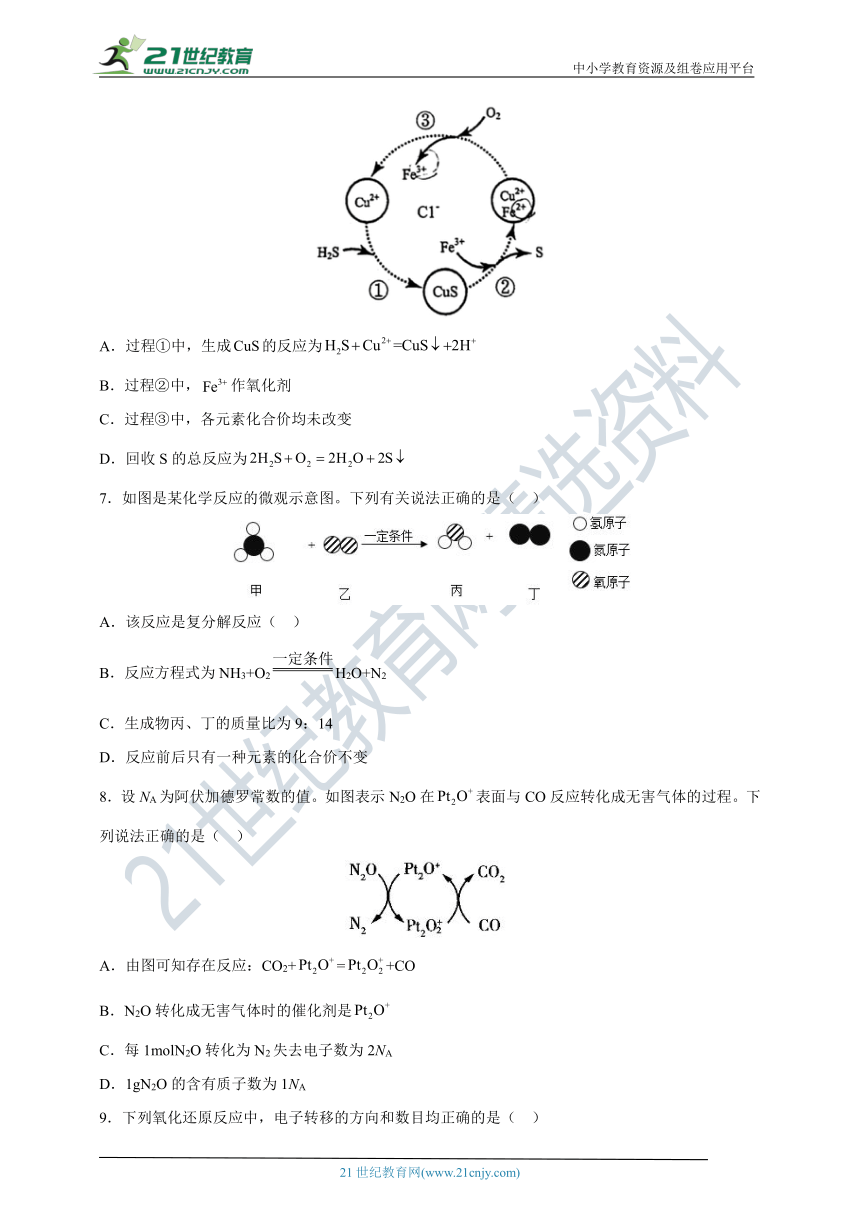
6.硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收,其转化如下图所示(不溶于水)。下列说法中,不正确的是( )
A.过程①中,生成的反应为
B.过程②中,作氧化剂
C.过程③中,各元素化合价均未改变
D.回收S的总反应为
7.如图是某化学反应的微观示意图。下列有关说法正确的是( )
A.该反应是复分解反应( )
B.反应方程式为NH3+O2H2O+N2
C.生成物丙、丁的质量比为9:14
D.反应前后只有一种元素的化合价不变
8.设NA为阿伏加德罗常数的值。如图表示N2O在表面与CO反应转化成无害气体的过程。下列说法正确的是( )
A.由图可知存在反应:CO2+=+CO
B.N2O转化成无害气体时的催化剂是
C.每1molN2O转化为N2失去电子数为2NA
D.1gN2O的含有质子数为1NA
9.下列氧化还原反应中,电子转移的方向和数目均正确的是( )
A. B.
C. D.
10.大蒜是一种调味蔬菜。其贮藏加工部分为其老熟的鳞茎,又称大蒜头。大蒜的储存会用到无水氢化钙或消石灰。氢化钙可作为生氢剂,反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑。下列说法错误的是( )
A.CaH2既是氧化剂,又是还原剂
B.H2既是氧化产物,又是还原产物
C.CaH2是还原剂,H2O是氧化剂
D.氧化产物与还原产物的质量比为1∶1
11.随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总化学方程式为2NO+O2+4CO4CO2+N2
12.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得2KClO3+H2C2O4+H2SO42ClO2↑+K2SO4+2CO2↑+2H2O。据此,下列说法不正确的( )
A.KClO3发生还原反应
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
13.一定条件下硝酸铵受热分解的化学方程式(未配平)为,下列说法正确的是( )
A.配平后H2O的系数为8
B.氧化产物和还原产物的物质的量之比为1∶2
C.N2只是还原产物
D.被氧化与被还原的氮原子数之比为5∶3
14.N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO23CO2+N2O。下列关于N2O的说法正确的是( )
A.上述反应中每生成1molN2O,有3molCO被还原
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只具有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒
15.已知常温下,在溶液中发生如下反应:
①16H++10Z +2XO=2X2++5Z2+8H2O
②2A2++B2=2A3++2B
③2B +Z2=B2+2Z
由此推断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z 可以进行
B.Z元素在反应③中被氧化,在反应①中被还原
C.氧化性由强到弱的顺序是XO、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B 、Z 、X2+
16.下列物质中的硫元素不能表现出氧化性的是( )
A.S B.Na2S C.SO2 D.H2SO4
17.反应3NO2+H2O=2HNO3+NO中,当有6e-转移时,被氧化的物质与被还原的物质的个数比是( )
A.1∶1 B.2∶1 C.1∶2 D.3∶1
18.为测定某尾气中SO2含量,某同学将尾气样品通入200 mL 0.100 mol/L酸性KMnO4溶液(假定样品中其它气体均不参与反应,SO2可被溶液充分吸收),反应的离子方程式为:5SO2+2+2H2O =5+2Mn2++ 4H+。若尾气流速为a L·s-1,平行测定三次,溶液恰好褪色的平均耗时b s,则该尾气样品中SO2含量(单位:g·L-1)是( )
A. B. C. D.
19.高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,工业上采用向KOH溶液中通入Cl2,然后加入Fe(NO3)3溶液发生反应2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+ 3KCl+ 5H2O),下列说法正确的是( )
A.Cl2通入KOH溶液,反应后溶液中n(ClO-):n()=5:1,则参加反应的氧化剂与还原剂的物质的量之比为2:1
B.若2 L2 mol/L的KOH溶液完全反应,能吸收标准状况下Cl2 22.4 L
C.K2FeO4具有强氧化性,其氧化能力比KClO强
D.按上述反应得到3. 96 kg K2FeO4,理论上消耗Cl2为30 mol
20.从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5mol FeS2发生反应,有10mol电子转移
C.产物中的SO离子有一部分是氧化产物
D.FeS2只作还原剂
第II卷(非选择题)
二、填空题
21.化学反应按照不同的分类方法,可以分为化合反应,分解反应、置换反应、复分解反应,也可分为氧化还原反应和非氧化还原反应。有下列反应:
①CO2+C2CO
②Cu2(OH)2CO32CuO+H2O+CO2↑
③2NaOH+Cl2=NaCl+NaClO+H2O
④2CO+O22CO2
⑤3Fe+4H2OFe3O4+4H2
⑥CuO+COCu+CO2
⑦2H2O2H2↑+O2↑
⑧CO2+H2O=H2CO3
(1)其中属于化合反应的是_______(填序号,下同),属于置换反应的是_______。
(2)在化学反应前后元素的化合价没有变化的是_______。
(3)上述反应中,既是分解反应,又是氧化还原反应的是_______。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是_______。
22.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是___________。
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为___________。
(3)根据上述反应可推知___________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方向和数目: 。___________
23.氮族元素包括氮(N),磷(P),砷(As),锑(Sb)和铋(Bi)五种元素,它们位于元素周期表第15纵列,研究氮族元素单质及其化合物的性质对于生产生活具有重要意义。请回答下列问题:
(1)亚硝酸钠()是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。
①亚硝酸钠会与人体中的血红蛋白作用,将二价铁氧化为三价铁,从而使血红蛋白丧失输送氧气的能力而使人体中毒;一旦发生亚硝酸盐中毒,可立即注射美蓝溶液进行解毒治疗,试推断美蓝溶液具有_______(填“氧化”或“还原”)性。
②亚硝酸钠外观极像食盐,工业上检验食盐中是否混有亚硝酸钠的方法是:取样品,加淀粉碘化钾溶液,酸化后溶液_______(描述现象),说明样品中含有亚硝酸钠。
(2)饮用水中的对人类健康会产生危害,为降低的浓度,某饮用水研究人员提出用铝粉将还原为,其化学方程式为。用“双线桥法”表示反应中电子转移的方向和数目:_______。
(3)已知由、、、、、组成的一个氧化还原反应体系中,发生了的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:_____+____+________+_____+_____,_______。
三、计算题
24.叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。
(1)NO和NO2混合气体与NaOH溶液反应可以合成NaNO2,写出该反应的化学方程式___,生成1molNaNO2时转移电子___mol。
(2)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
①该反应中的氧化剂为_______,还原剂为_______(填化学式)。
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克___________________________________________________________________?(写出计算过程,保留一位小数,不考虑固体的体积)。
四、实验题
25.疫情期间,很多自来水厂用二氧化氯(ClO2)消毒,防止水体污染。二氧化氯(ClO2)黄绿色气体,易溶于水,熔点为,沸点为,浓度过高时易发生分解引起爆炸。回答下列问题:
(1)在处理废水时,ClO2可将废水中的氧化成和,ClO2被还原成,写出该反应的离子方程式:___________。
(2)某实验小组设计了如图所示的实验装置用于制备ClO2。
①氮气不参与反应,通入氮气的主要作用有2个,一是可以起到搅拌作用,二是___________。
②装置A用于制备ClO2气体,同时还有生成另种一种无色无味的气体,该反应的离子方程式为___________。
③装置B的作用是___________。
(3)ClO2也可用亚氯酸钠和稀盐酸为原料制备,化学方程式为,该反应的氧化剂与还原剂物质的量之比为:___________。
参考答案
1.B
解析:
A.该反应属于复分解反应,没有化合价变化,不是氧化还原反应,故A不符合题意;
B.该反应不属于四种基本反应类型,且有元素化合价发生变化,属于氧化还原反应,故B符合题意;
C.该反应属于置换反应,是氧化还原反应,故C不符合题意;
D.该反应属于化合反应,是氧化还原反应,故D不符合题意。
综上所述,答案为B。
2.C
解析:
A.根据2FeCl3+2KI=2FeCl2+2KCl+I2可以知道氧化性是Fe3+>I2,符合题干已知条件,所以化学方程式成立,故A正确;
B.根据6FeCl2+3Br2=4FeCl3+2FeBr3可以知道氧化性是Br2>Fe3+,符合题干已知条件,所以化学方程式成立,故B正确;
C.亚铁离子的还原性强于溴离子,但氧化性:Cl2>Br2,所以Br2与氯化亚铁反应只能氧化亚铁离子不能产生氯气,故C错误;
D.根据FeI2+Cl2=FeCl2+I2可以知道氧化性是Cl2>I2,符合题干已知条件,所以化学方程式成立,故D正确;
故选:C。
3.A
解析:
A.2Na2O2+2H2O=4NaOH+O2↑,反应Na2O2中O元素化合价发生变化,水中H、O元素化合价不变,所以水既不是氧化剂也不是还原剂,故A符合题意;
B.该反应中H2O中的H由+1价变为0价,所以水作氧化剂,故B不符合题意;
C.该反应水中O元素化合价由-2价变为0价,所以水作还原剂,故C不符合题意;
D.该反应元素的化合价均不变,不是氧化还原反应,故D不符合题意;
答案选A。
4.A
解析:
A.Mg元素的化合价由0价升至+2价,Mg失电子,作还原剂,故A不合理;
B.KMnO4受热分解成K2MnO4、MnO2和O2,反应中Mn元素的化合价由+7价降至+6和+4价,Mn元素被还原,O元素的化合价由-2价升至0价,KMnO4既是氧化剂又是还原剂,故B合理;
C.反应CuSO4+2NaOH=Cu(OH)2↓+Na2SO4反应前后元素的化合价不改变,不属于氧化还原反应,故C合理;
D.电解水的反应中,H元素的化合价由+1价降至0价,O元素的化合价由-2价升至0价,H2O既是氧化剂又是还原剂,故D合理;
故答案为A。
5.D
解析:
根据方程式两端电荷守恒可知n=2,O元素是-2价,所以R的化合价是+6价,也可以按氧化还原反应中电子得失守恒求,设化合价为+x,则3×2=2×(x-3),得x=6。
答案选D。
6.C
解析:
A.过程①是铜离子和硫化氢反应生成氢离子和硫化铜,离子方程式为,故A正确;
B.过程②中,铁离子和硫化铜反应生成亚铁离子,铁离子化合价降低,因此作氧化剂,故B正确;
C.过程③中,氧气和亚铁离子反应生成铁离子,因此铁元素化合价升高,氧元素化合价降低,故C错误;
D.根据图中信息,因此回收S的总反应为,故D正确。
综上所述,答案为C。
7.D
解析:
A.一种单质与化合物反应生成另一种单质和化合物,符合置换反应的特点,该反应是置换反应,A项错误;
B.根据微观示意图,可以看出反应物为氨气和氧气,生成物为水和氮气,书写化学方程式需要配平,所以该反应的化学方程为4NH3+3O26H2O+2N2,B项错误;
C.根据B中化学方程式可以看出,丙为水,丁为氮气,两种的物质质量比=(6×18):(2×14)=27:7,C项错误;
D.根据B中化学方程式可以看出,氮元素由-3价变为0价,氧元素的化合价由0价变为-2价,氢元素反应前后化合价不变,因此只有一种元素化合价未发生变化,D项正确;
答案选D。
8.B
解析:
A.由图可知,存在反应+CO=CO2+,A错误;
B.由图可知,N2O转化成N2时有的参与,因此催化剂是,B正确;
C.N2O中的N为+1价,N2中的N为0价,每1molN2O转化为N2得电子数为2NA,C错误;
D.1gN2O的物质的量为mol,质子数为×(7×2+8) NA =0.5NA,D错误;
故选B。
9.C
解析:
A.KClO3与HCl反应时,KClO3中Cl元素从+5价降低到Cl2中的0价,HCl中部分-1价Cl元素价态升高到0价,转移电子数为5e-,故A错误;
B.KClO3分解反应中转移电子数为12e-,故B错误;
C.S中部分0价S化合价升高至K2SO3中的+4价,部分由0价降至K2S中的-2价,转移电子数为4e-,故C正确;
D.Br2、SO2和H2O的反应中,Br2得到电子,SO2失去电子,正确的应为,故D错误;
故答案为C。
10.A
解析:
A.用双线桥分析该反应: ;CaH2是还原剂,H2O是氧化剂,故A错误;
B.根据双线桥分析: ,H2既是氧化产物又是还原产物,故B正确;
C.根据化合价变化可知CaH2是还原剂,H2O是氧化剂,故C正确;
D.氧化产物与还原产物的质量之比为1∶1,故D正确;
故答案为A。
11.D
解析:
A.反应过程中NO、O2为氧化剂,N2为还原产物,A错误;
B.汽车尾气中的N2不是污染物,B错误;
C.NO和O2的反应不需要催化剂,C错误;
D.根据题中的图示,可将反应的过程分成如下两步写:2NO+O2=2NO2,2NO2+4CO=N2+4CO2,将两步反应式合并可得总化学方程式为2NO+O2+4CO4CO2+N2,D正确;
答案选D。
12.C
解析:
A.由方程式可知,反应中氯元素的化合价降低被还原,则氯酸钾为氧化剂,发生还原反应,故A正确;
B.由方程式可知,反应中碳元素的化合价升高被氧化,则草酸是反应的还原剂,反应中被氧化,故B正确;
C.由方程式可知,反应中氯元素的化合价降低被还原,反应中碳元素的化合价升高被氧化,则草酸是反应的还原剂,二氧化氯是还原产物,则不能比较草酸和二氧化氯的氧化性强弱,故C错误;
D.二氧化氯具有强氧化性,能起到杀菌消毒的作用,则二氧化氯作水处理剂时,利用了其强氧化性,故D正确;
故选C。
13.D
解析:
由方程式可知,反应中铵根离子中氮元素化合价升高被氧化,硝酸根离子中化合价部分降低被还原,氮气即是氧化产物又是还原产物,由得失电子数目守恒和原子个数守恒可知,硝酸铵受热分解的化学方程式为5NH4NO32HNO3+4N2↑+9H2O。
A.由分析可知,配平后水的系数为9,故A错误;
B.由分析可知,反应中氮气即是氧化产物又是还原产物,由得失电子数目守恒可知,氧化产物和还原产物的物质的量之比为5∶3,故B错误;
C.由分析可知,反应中氮气即是氧化产物又是还原产物,故C错误;
D.由分析可知,被氧化与被还原的氮原子数之比为5∶3,故D正确;
故选D。
14.B
解析:
A. 碳元素化合价由+2价升高为+4价,上述反应中每生成1molN2O,有3molCO被氧化,故A错误;
B. N2O和CO2是22电子分子,等物质的量的N2O和CO2含有相等的电子数,故B正确;
C. N2O中N显+1价,可以升高也可以降低,N2O既具有氧化性,也具有还原性,故C错误;
D. 与人体血红蛋白结合使人体中毒的是NO,故D错误;
故选B。
15.B
解析:
氧化还原反应中,氧化剂的氧化性大于氧化产物,还原剂的还原剂大于还原产物,氧化性:XO 44 >Z2>B2>A3+;还原性:A2+>B->Z->X2+。
A.反应Z2+2A2+=2A3++2Z-中,还原性:A2+>Z-,与已知符合,可以进行,A说法正确;
B.Z元素在反应③中Z的化合价降低,被还原,在反应①中Z的化合价升高,被氧化,B说法错误;
C.分析可知,氧化性由强到弱的顺序是XO、Z2、B2、A3+,C说法正确;
D.还原性由强到弱的顺序是A2+>B->Z->X2+,D说法正确;
答案为B。
16.B
解析:
A.在单质S中元素化合价为0价,可以得到电子变为-2价,也可以失去电子变为+4、+6价,因此S既表现氧化性,又表现还原性,A不符合题意;
B.在Na2S中S为-2价,是S元素的最低化合价,只能失去电子变为较高价态,因此只有还原性,而没有氧化性,B符合题意;
C.在SO2中S为+4价,介于S元素的最低-2价和最高+6价之间,既可以得到电子变为低价态,也可以失去电子变为高价态,因此SO2既可表现氧化性,又可表现还原性,C不符合题意;
D.在H2SO4中S元素化合价为+6价,是S元素的最高化合价,只能得到电子变为低价态,因此只有氧化性,而不具有还原性,D不符合题意;
故合理选项是B。
17.B
解析:
反应3NO2+H2O=2HNO3+NO中,只有N元素化合价发生变化,所以NO2既是氧化剂又是还原剂,+4价升高至+5价时为氧化,+4价降至+2价时被还原,所以被氧化的NO2与被还原的NO2的个数之比为2:1,综上B符合题意;
答案选B。
18.D
解析:
根据题干信息,经过bs溶液恰好褪色,则通过空气的体积为aL·s-1×b s =abL,消耗的酸性KMnO4的物质的量为0.2L×0.1mol/L=0.02mol,根据方程式5SO2~2,则n(SO2)=,则m(SO2)=0.05mol×64g/mol=3.2g,则该空气样品中SO2的含量为;
答案选D。
19.D
解析:
2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+ 3KCl+ 5H2O中,Fe元素的化合价升高、Cl元素的化合价降低,转移的电子数目为6,以此来解答。
A.设ClO-为5mol,为1mol,氯气转化成ClO-、被氧化,转化成KCl被还原,根据电子守恒可知生成KCl的物质的量为:5mol×1+1mol×(5-0)=10mol,则氧化剂与还原剂的物质的量之比为10mol:(5mol+1mol)=5:3,故A错误;
B.氯气和氢氧化钾反应的生成物有KCl、KClO、KClO3,其中K、Cl的物质的量之比为1:1,所以每消耗4molKOH,吸收2mol氯气,标况下2mol氯气的体积为:22.4L/mol×2mol=44.8L,故B错误;
C.由氧化剂的氧化性大于氧化产物的氧化性可知氧化能力KClO比K2FeO4强,故C错误;
D.根据反应Cl2+2OH-=Cl-+ClO-+H2O和2Fe3++3ClO-+10OH-=2FeO+3Cl-+5H2O,可得关系式2K2FeO4~3Cl2,3.96kg K2FeO4的物质的量为20mol,根据关系式可知氯气的物质的量为30mol,故D正确;
答案选D。
20.C
解析:
A.Cu2S为中Cu、S元素化合价降低之产物,因此Cu2S为还原产物,故A错误;
B.反应中Cu元素化合价由+2降低至+1,FeS2中S原子有由-1升高至+6,有由-1降低至-2,其余元素化合价未发生变化,因此每有5mol FeS2发生反应,转移电子为10mol××[6-(-1)]=21mol,故B错误;
C.由B项分析可知,产物中的SO离子有一部分是FeS2中S元素升高而得,因此产物中的SO离子有一部分是氧化产物,故C正确;
D.由B分析可知,FeS2在反应中既作氧化剂也是还原剂,故D错误;
综上所述,说法正确的是C项,故答案为C。
21.
(1) ①④⑧ ⑤
(2)②⑧
(3)⑦
(4)③
解析:
①CO2+C2CO属于化合反应,有元素的化合价变化,属于氧化还原反应,不是离子反应;
②Cu2(OH)2CO32CuO+H2O+CO2↑属于分解反应,反应中无元素发生化合价变化,不属于氧化还原反应,不属于离子反应;
③2NaOH+Cl2=NaCl+NaClO+H2O中有元素的化合价变化,属于氧化还原反应,属于离子反应;
④2CO+O22CO2属于化合反应,有元素的化合价变化,属于氧化还原反应,不属于离子反应;
⑤3Fe+4H2OFe3O4+4H2属于置换反应,有元素的化合价变化,属于氧化还原反应,不属于离子反应;
⑥CuO+COCu+CO2中有元素的化合价变化,属于氧化还原反应,不属于离子反应;
⑦2H2O2H2↑+O2↑属于分解反应,有元素的化合价变化,属于氧化还原反应,不属于离子反应;
⑧CO2+H2O=H2CO3属于化合反应,无元素的化合价变化,不属于氧化还原反应;
(1)其中属于化合反应的是①④⑧,属于置换反应的是⑤;
(2)在化学反应前后元素的化合价没有变化的是②⑧;
(3)上述反应中,既是分解反应,又是氧化还原反应的是⑦;
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是③。
22.
(1)AsH3
(2)Br2
(3)AC
(4)
解析:
(1).KBrO3在反应中得到电子,作氧化剂,则必有作还原剂的另一物质,其应为含有As元素的物质,AsH3中As的化合价为-3价、H3AsO4中As的化合价为+5价,则AsH3为还原剂。
(2)2个KBrO3在反应中得到10个电子生成X,则Br由+5价降低5价而成为0价的Br,从而得出X的化学式为Br2。
(3)上述反应可写成AsH3+KBrO3+H2SO4→H3AsO4+K2SO4+Br2+H2O,KBrO3为氧化剂,H3AsO4为氧化产物,AsH3为还原剂,Br2为还原产物:
A.氧化性:氧化剂>氧化产物,则KBrO3>H3AsO4,正确;
B.由A可知,氧化性:H3AsO4<KBrO3,不正确;
C.还原性:还原剂>还原产物,则AsH3>X(Br2),正确;
D.由C可知,还原性:X(Br2)<AsH3,不正确;
故选AC;
(4)反应中1个KBrO3得到5个电子,1个AsH3失去8个电子,根据得失电子守恒、原子守恒,反应的化学方程式为5AsH3+8KBrO3+4H2SO4=5H3AsO4+4K2SO4+4Br2+4H2O中,用单线桥法标出电子转移的方向和数目:。
23.还原 溶液变蓝 5+2+14=5+2+7
解析:
(1)①亚硝酸钠将二价铁氧化为三价铁,注射美蓝溶液进行解毒治疗,说明美蓝溶液将铁离子变成亚铁离子,美蓝溶液具有还原性;
②亚硝酸钠淀粉碘化钾溶液在酸化后反应生成碘,溶液变蓝色;
(2)反应中铝失去电子,氮元素得到电子, “双线桥法”表示反应中电子转移的方向和数目如下:
(3)已知由、、、、、组成的一个氧化还原反应体系中,发生了反应中的反应过程,说明其元素化合价降低,则根据质量守恒和电子守恒分析,有反应5+2+14=5+2+7。
24.NO+NO2+2NaOH=NaNO2+H2O 1 KNO3 NaN3 63.1g
解析:
结合氧化还原反应电子守恒,物质的量之比1:1的NO和NO2混合气体与NaOH溶液反应,发生氧化还原反应生成NaNO2,NO中氮元素化合价+2价变化为+3价,NO2中 但元素化合价+4价变化为+3价,化合价降低值=化合价升高值=转移电子数,据此计算电子转移总数e-;只有N元素的化合价变化,氧化还原反应中,元素化合价降低的物质做氧化剂,元素化合价升高的物质最还原剂;根据方程式进行计算。
(1)物质的量之比1:1的NO和NO2混合气体与NaOH溶液反应,发生氧化还原反应生成NaNO2,由电子及原子守恒可知该反应的化学方程式NO+NO2+2NaOH=NaNO2+H2O,NO中氮元素化合价+2价变化为+3价,NO2中 但元素化合价+4价变化为+3价,化合价降低值=化合价升高值=转移电子数,生成1molNaNO2时转移电子1mol。故答案为:NO+NO2+2NaOH=NaNO2+H2O;1;
(2)①反应中氮元素化合价-价变化为0价,+5价变化为0价,所以元素化合降低的物质做氧化剂,该反应中的氧化剂为KNO3,元素化合价升高的做还原剂,还原剂为NaN3(填化学式)。故答案为:KNO3;NaN3;
②n(N2)==2.5mol,设该安全气囊反应生成的K2O质量为 x,Na2O质量为x,则: 解得:x=14.7g;y=48.4g,安全气囊中生成的K2O和Na2O的总质量为63.1g,故答案为:63.1g。
25. 稀释ClO2,防止因ClO2浓度过高而发生爆炸 防止倒吸 1∶4
解析:
装置A中,NaClO3和H2O2在酸性条件下反应生成ClO2、O2和H2O,离子方程式为:,ClO2浓度过高时易发生分解引起爆炸,因此通入N2,一是可以起到搅拌作用,二是稀释ClO2,防止因ClO2浓度过高而发生爆炸,装置B是为了防止倒吸,装置C中装有水,ClO2会溶于水中,装置D中装有NaOH溶液,可以吸收尾气,防止污染空气。
(1)ClO2可将废水中的氧化成和,ClO2被还原成,离子方程式为:;
(2)①ClO2浓度过高时易发生分解引起爆炸,因此通入N2,一是可以起到搅拌作用,二是稀释ClO2,防止因ClO2浓度过高而发生爆炸;
②装置A用于制备ClO2气体,NaClO3和H2O2在酸性条件下反应生成ClO2、O2和H2O,该反应的离子方程式为:;
③装置B的作用为防止倒吸;
(3)根据可知,既是氧化剂又是还原剂,5个中的Cl元素,有1个转化为NaCl,化合价降低,作氧化剂,4个转化为,化合价升高,作还原剂,则该反应的氧化剂与还原剂物质的量之比为1∶4。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
必修1第二章第三节氧化还原反应同步练习
第I卷(选择题)
一、单选题
1.下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
A.NH4Cl+NaOHNaCl+H2O+NH3↑ B.CH4+2O2CO2+2H2O
C.2Al+Fe2O3Al2O3+2Fe D.3Cl2+2Fe2FeCl3
2.已知氧化性:Cl2>Br2>Fe3+>I2。判断下列化学方程式一定不正确的是( )
A.2FeCl3+2KI=2FeCl2+2KCl+I2 B.6FeCl2+3Br2=4FeCl3+2FeBr3
C.FeCl2+Br2=FeBr2+Cl2 D.FeI2+Cl2=FeCl2+I2
3.下列反应中水既不是氧化剂又不是还原剂的氧化还原反应是( )
A.2Na2O2+2H2O=4NaOH+O2↑
B.NaH+H2O=NaOH+H2↑
C.2F2+2H2O=4HF+O2
D.SO3+H2O=H2SO4
4.下列对氧化还原反应的分析中不合理的是( )
A.Mg变成MgO时化合价升高,失去电子,因此Mg在该反应中作氧化剂
B.KMnO4受热分解时,Mn元素被还原,KMnO4既是氧化剂又是还原剂
C.反应CuSO4+2NaOH=Cu(OH)2↓+Na2SO4不属于氧化还原反应
D.在反应2H2O2H2↑+O2↑中,H2O既是还原剂,又是氧化剂
5.已知在碱性溶液中可发生如下反应:2M(OH)3+3Cl2+10OH-=2MO+6Cl-+8H2O,则MO中M的化合价是( )
A.+3 B.+4 C.+5 D.+6
6.硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收,其转化如下图所示(不溶于水)。下列说法中,不正确的是( )
A.过程①中,生成的反应为
B.过程②中,作氧化剂
C.过程③中,各元素化合价均未改变
D.回收S的总反应为
7.如图是某化学反应的微观示意图。下列有关说法正确的是( )
A.该反应是复分解反应( )
B.反应方程式为NH3+O2H2O+N2
C.生成物丙、丁的质量比为9:14
D.反应前后只有一种元素的化合价不变
8.设NA为阿伏加德罗常数的值。如图表示N2O在表面与CO反应转化成无害气体的过程。下列说法正确的是( )
A.由图可知存在反应:CO2+=+CO
B.N2O转化成无害气体时的催化剂是
C.每1molN2O转化为N2失去电子数为2NA
D.1gN2O的含有质子数为1NA
9.下列氧化还原反应中,电子转移的方向和数目均正确的是( )
A. B.
C. D.
10.大蒜是一种调味蔬菜。其贮藏加工部分为其老熟的鳞茎,又称大蒜头。大蒜的储存会用到无水氢化钙或消石灰。氢化钙可作为生氢剂,反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑。下列说法错误的是( )
A.CaH2既是氧化剂,又是还原剂
B.H2既是氧化产物,又是还原产物
C.CaH2是还原剂,H2O是氧化剂
D.氧化产物与还原产物的质量比为1∶1
11.随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总化学方程式为2NO+O2+4CO4CO2+N2
12.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得2KClO3+H2C2O4+H2SO42ClO2↑+K2SO4+2CO2↑+2H2O。据此,下列说法不正确的( )
A.KClO3发生还原反应
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
13.一定条件下硝酸铵受热分解的化学方程式(未配平)为,下列说法正确的是( )
A.配平后H2O的系数为8
B.氧化产物和还原产物的物质的量之比为1∶2
C.N2只是还原产物
D.被氧化与被还原的氮原子数之比为5∶3
14.N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO23CO2+N2O。下列关于N2O的说法正确的是( )
A.上述反应中每生成1molN2O,有3molCO被还原
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只具有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒
15.已知常温下,在溶液中发生如下反应:
①16H++10Z +2XO=2X2++5Z2+8H2O
②2A2++B2=2A3++2B
③2B +Z2=B2+2Z
由此推断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z 可以进行
B.Z元素在反应③中被氧化,在反应①中被还原
C.氧化性由强到弱的顺序是XO、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B 、Z 、X2+
16.下列物质中的硫元素不能表现出氧化性的是( )
A.S B.Na2S C.SO2 D.H2SO4
17.反应3NO2+H2O=2HNO3+NO中,当有6e-转移时,被氧化的物质与被还原的物质的个数比是( )
A.1∶1 B.2∶1 C.1∶2 D.3∶1
18.为测定某尾气中SO2含量,某同学将尾气样品通入200 mL 0.100 mol/L酸性KMnO4溶液(假定样品中其它气体均不参与反应,SO2可被溶液充分吸收),反应的离子方程式为:5SO2+2+2H2O =5+2Mn2++ 4H+。若尾气流速为a L·s-1,平行测定三次,溶液恰好褪色的平均耗时b s,则该尾气样品中SO2含量(单位:g·L-1)是( )
A. B. C. D.
19.高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,工业上采用向KOH溶液中通入Cl2,然后加入Fe(NO3)3溶液发生反应2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+ 3KCl+ 5H2O),下列说法正确的是( )
A.Cl2通入KOH溶液,反应后溶液中n(ClO-):n()=5:1,则参加反应的氧化剂与还原剂的物质的量之比为2:1
B.若2 L2 mol/L的KOH溶液完全反应,能吸收标准状况下Cl2 22.4 L
C.K2FeO4具有强氧化性,其氧化能力比KClO强
D.按上述反应得到3. 96 kg K2FeO4,理论上消耗Cl2为30 mol
20.从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5mol FeS2发生反应,有10mol电子转移
C.产物中的SO离子有一部分是氧化产物
D.FeS2只作还原剂
第II卷(非选择题)
二、填空题
21.化学反应按照不同的分类方法,可以分为化合反应,分解反应、置换反应、复分解反应,也可分为氧化还原反应和非氧化还原反应。有下列反应:
①CO2+C2CO
②Cu2(OH)2CO32CuO+H2O+CO2↑
③2NaOH+Cl2=NaCl+NaClO+H2O
④2CO+O22CO2
⑤3Fe+4H2OFe3O4+4H2
⑥CuO+COCu+CO2
⑦2H2O2H2↑+O2↑
⑧CO2+H2O=H2CO3
(1)其中属于化合反应的是_______(填序号,下同),属于置换反应的是_______。
(2)在化学反应前后元素的化合价没有变化的是_______。
(3)上述反应中,既是分解反应,又是氧化还原反应的是_______。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是_______。
22.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是___________。
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为___________。
(3)根据上述反应可推知___________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方向和数目: 。___________
23.氮族元素包括氮(N),磷(P),砷(As),锑(Sb)和铋(Bi)五种元素,它们位于元素周期表第15纵列,研究氮族元素单质及其化合物的性质对于生产生活具有重要意义。请回答下列问题:
(1)亚硝酸钠()是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。
①亚硝酸钠会与人体中的血红蛋白作用,将二价铁氧化为三价铁,从而使血红蛋白丧失输送氧气的能力而使人体中毒;一旦发生亚硝酸盐中毒,可立即注射美蓝溶液进行解毒治疗,试推断美蓝溶液具有_______(填“氧化”或“还原”)性。
②亚硝酸钠外观极像食盐,工业上检验食盐中是否混有亚硝酸钠的方法是:取样品,加淀粉碘化钾溶液,酸化后溶液_______(描述现象),说明样品中含有亚硝酸钠。
(2)饮用水中的对人类健康会产生危害,为降低的浓度,某饮用水研究人员提出用铝粉将还原为,其化学方程式为。用“双线桥法”表示反应中电子转移的方向和数目:_______。
(3)已知由、、、、、组成的一个氧化还原反应体系中,发生了的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:_____+____+________+_____+_____,_______。
三、计算题
24.叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。
(1)NO和NO2混合气体与NaOH溶液反应可以合成NaNO2,写出该反应的化学方程式___,生成1molNaNO2时转移电子___mol。
(2)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
①该反应中的氧化剂为_______,还原剂为_______(填化学式)。
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克___________________________________________________________________?(写出计算过程,保留一位小数,不考虑固体的体积)。
四、实验题
25.疫情期间,很多自来水厂用二氧化氯(ClO2)消毒,防止水体污染。二氧化氯(ClO2)黄绿色气体,易溶于水,熔点为,沸点为,浓度过高时易发生分解引起爆炸。回答下列问题:
(1)在处理废水时,ClO2可将废水中的氧化成和,ClO2被还原成,写出该反应的离子方程式:___________。
(2)某实验小组设计了如图所示的实验装置用于制备ClO2。
①氮气不参与反应,通入氮气的主要作用有2个,一是可以起到搅拌作用,二是___________。
②装置A用于制备ClO2气体,同时还有生成另种一种无色无味的气体,该反应的离子方程式为___________。
③装置B的作用是___________。
(3)ClO2也可用亚氯酸钠和稀盐酸为原料制备,化学方程式为,该反应的氧化剂与还原剂物质的量之比为:___________。
参考答案
1.B
解析:
A.该反应属于复分解反应,没有化合价变化,不是氧化还原反应,故A不符合题意;
B.该反应不属于四种基本反应类型,且有元素化合价发生变化,属于氧化还原反应,故B符合题意;
C.该反应属于置换反应,是氧化还原反应,故C不符合题意;
D.该反应属于化合反应,是氧化还原反应,故D不符合题意。
综上所述,答案为B。
2.C
解析:
A.根据2FeCl3+2KI=2FeCl2+2KCl+I2可以知道氧化性是Fe3+>I2,符合题干已知条件,所以化学方程式成立,故A正确;
B.根据6FeCl2+3Br2=4FeCl3+2FeBr3可以知道氧化性是Br2>Fe3+,符合题干已知条件,所以化学方程式成立,故B正确;
C.亚铁离子的还原性强于溴离子,但氧化性:Cl2>Br2,所以Br2与氯化亚铁反应只能氧化亚铁离子不能产生氯气,故C错误;
D.根据FeI2+Cl2=FeCl2+I2可以知道氧化性是Cl2>I2,符合题干已知条件,所以化学方程式成立,故D正确;
故选:C。
3.A
解析:
A.2Na2O2+2H2O=4NaOH+O2↑,反应Na2O2中O元素化合价发生变化,水中H、O元素化合价不变,所以水既不是氧化剂也不是还原剂,故A符合题意;
B.该反应中H2O中的H由+1价变为0价,所以水作氧化剂,故B不符合题意;
C.该反应水中O元素化合价由-2价变为0价,所以水作还原剂,故C不符合题意;
D.该反应元素的化合价均不变,不是氧化还原反应,故D不符合题意;
答案选A。
4.A
解析:
A.Mg元素的化合价由0价升至+2价,Mg失电子,作还原剂,故A不合理;
B.KMnO4受热分解成K2MnO4、MnO2和O2,反应中Mn元素的化合价由+7价降至+6和+4价,Mn元素被还原,O元素的化合价由-2价升至0价,KMnO4既是氧化剂又是还原剂,故B合理;
C.反应CuSO4+2NaOH=Cu(OH)2↓+Na2SO4反应前后元素的化合价不改变,不属于氧化还原反应,故C合理;
D.电解水的反应中,H元素的化合价由+1价降至0价,O元素的化合价由-2价升至0价,H2O既是氧化剂又是还原剂,故D合理;
故答案为A。
5.D
解析:
根据方程式两端电荷守恒可知n=2,O元素是-2价,所以R的化合价是+6价,也可以按氧化还原反应中电子得失守恒求,设化合价为+x,则3×2=2×(x-3),得x=6。
答案选D。
6.C
解析:
A.过程①是铜离子和硫化氢反应生成氢离子和硫化铜,离子方程式为,故A正确;
B.过程②中,铁离子和硫化铜反应生成亚铁离子,铁离子化合价降低,因此作氧化剂,故B正确;
C.过程③中,氧气和亚铁离子反应生成铁离子,因此铁元素化合价升高,氧元素化合价降低,故C错误;
D.根据图中信息,因此回收S的总反应为,故D正确。
综上所述,答案为C。
7.D
解析:
A.一种单质与化合物反应生成另一种单质和化合物,符合置换反应的特点,该反应是置换反应,A项错误;
B.根据微观示意图,可以看出反应物为氨气和氧气,生成物为水和氮气,书写化学方程式需要配平,所以该反应的化学方程为4NH3+3O26H2O+2N2,B项错误;
C.根据B中化学方程式可以看出,丙为水,丁为氮气,两种的物质质量比=(6×18):(2×14)=27:7,C项错误;
D.根据B中化学方程式可以看出,氮元素由-3价变为0价,氧元素的化合价由0价变为-2价,氢元素反应前后化合价不变,因此只有一种元素化合价未发生变化,D项正确;
答案选D。
8.B
解析:
A.由图可知,存在反应+CO=CO2+,A错误;
B.由图可知,N2O转化成N2时有的参与,因此催化剂是,B正确;
C.N2O中的N为+1价,N2中的N为0价,每1molN2O转化为N2得电子数为2NA,C错误;
D.1gN2O的物质的量为mol,质子数为×(7×2+8) NA =0.5NA,D错误;
故选B。
9.C
解析:
A.KClO3与HCl反应时,KClO3中Cl元素从+5价降低到Cl2中的0价,HCl中部分-1价Cl元素价态升高到0价,转移电子数为5e-,故A错误;
B.KClO3分解反应中转移电子数为12e-,故B错误;
C.S中部分0价S化合价升高至K2SO3中的+4价,部分由0价降至K2S中的-2价,转移电子数为4e-,故C正确;
D.Br2、SO2和H2O的反应中,Br2得到电子,SO2失去电子,正确的应为,故D错误;
故答案为C。
10.A
解析:
A.用双线桥分析该反应: ;CaH2是还原剂,H2O是氧化剂,故A错误;
B.根据双线桥分析: ,H2既是氧化产物又是还原产物,故B正确;
C.根据化合价变化可知CaH2是还原剂,H2O是氧化剂,故C正确;
D.氧化产物与还原产物的质量之比为1∶1,故D正确;
故答案为A。
11.D
解析:
A.反应过程中NO、O2为氧化剂,N2为还原产物,A错误;
B.汽车尾气中的N2不是污染物,B错误;
C.NO和O2的反应不需要催化剂,C错误;
D.根据题中的图示,可将反应的过程分成如下两步写:2NO+O2=2NO2,2NO2+4CO=N2+4CO2,将两步反应式合并可得总化学方程式为2NO+O2+4CO4CO2+N2,D正确;
答案选D。
12.C
解析:
A.由方程式可知,反应中氯元素的化合价降低被还原,则氯酸钾为氧化剂,发生还原反应,故A正确;
B.由方程式可知,反应中碳元素的化合价升高被氧化,则草酸是反应的还原剂,反应中被氧化,故B正确;
C.由方程式可知,反应中氯元素的化合价降低被还原,反应中碳元素的化合价升高被氧化,则草酸是反应的还原剂,二氧化氯是还原产物,则不能比较草酸和二氧化氯的氧化性强弱,故C错误;
D.二氧化氯具有强氧化性,能起到杀菌消毒的作用,则二氧化氯作水处理剂时,利用了其强氧化性,故D正确;
故选C。
13.D
解析:
由方程式可知,反应中铵根离子中氮元素化合价升高被氧化,硝酸根离子中化合价部分降低被还原,氮气即是氧化产物又是还原产物,由得失电子数目守恒和原子个数守恒可知,硝酸铵受热分解的化学方程式为5NH4NO32HNO3+4N2↑+9H2O。
A.由分析可知,配平后水的系数为9,故A错误;
B.由分析可知,反应中氮气即是氧化产物又是还原产物,由得失电子数目守恒可知,氧化产物和还原产物的物质的量之比为5∶3,故B错误;
C.由分析可知,反应中氮气即是氧化产物又是还原产物,故C错误;
D.由分析可知,被氧化与被还原的氮原子数之比为5∶3,故D正确;
故选D。
14.B
解析:
A. 碳元素化合价由+2价升高为+4价,上述反应中每生成1molN2O,有3molCO被氧化,故A错误;
B. N2O和CO2是22电子分子,等物质的量的N2O和CO2含有相等的电子数,故B正确;
C. N2O中N显+1价,可以升高也可以降低,N2O既具有氧化性,也具有还原性,故C错误;
D. 与人体血红蛋白结合使人体中毒的是NO,故D错误;
故选B。
15.B
解析:
氧化还原反应中,氧化剂的氧化性大于氧化产物,还原剂的还原剂大于还原产物,氧化性:XO 44 >Z2>B2>A3+;还原性:A2+>B->Z->X2+。
A.反应Z2+2A2+=2A3++2Z-中,还原性:A2+>Z-,与已知符合,可以进行,A说法正确;
B.Z元素在反应③中Z的化合价降低,被还原,在反应①中Z的化合价升高,被氧化,B说法错误;
C.分析可知,氧化性由强到弱的顺序是XO、Z2、B2、A3+,C说法正确;
D.还原性由强到弱的顺序是A2+>B->Z->X2+,D说法正确;
答案为B。
16.B
解析:
A.在单质S中元素化合价为0价,可以得到电子变为-2价,也可以失去电子变为+4、+6价,因此S既表现氧化性,又表现还原性,A不符合题意;
B.在Na2S中S为-2价,是S元素的最低化合价,只能失去电子变为较高价态,因此只有还原性,而没有氧化性,B符合题意;
C.在SO2中S为+4价,介于S元素的最低-2价和最高+6价之间,既可以得到电子变为低价态,也可以失去电子变为高价态,因此SO2既可表现氧化性,又可表现还原性,C不符合题意;
D.在H2SO4中S元素化合价为+6价,是S元素的最高化合价,只能得到电子变为低价态,因此只有氧化性,而不具有还原性,D不符合题意;
故合理选项是B。
17.B
解析:
反应3NO2+H2O=2HNO3+NO中,只有N元素化合价发生变化,所以NO2既是氧化剂又是还原剂,+4价升高至+5价时为氧化,+4价降至+2价时被还原,所以被氧化的NO2与被还原的NO2的个数之比为2:1,综上B符合题意;
答案选B。
18.D
解析:
根据题干信息,经过bs溶液恰好褪色,则通过空气的体积为aL·s-1×b s =abL,消耗的酸性KMnO4的物质的量为0.2L×0.1mol/L=0.02mol,根据方程式5SO2~2,则n(SO2)=,则m(SO2)=0.05mol×64g/mol=3.2g,则该空气样品中SO2的含量为;
答案选D。
19.D
解析:
2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+ 3KCl+ 5H2O中,Fe元素的化合价升高、Cl元素的化合价降低,转移的电子数目为6,以此来解答。
A.设ClO-为5mol,为1mol,氯气转化成ClO-、被氧化,转化成KCl被还原,根据电子守恒可知生成KCl的物质的量为:5mol×1+1mol×(5-0)=10mol,则氧化剂与还原剂的物质的量之比为10mol:(5mol+1mol)=5:3,故A错误;
B.氯气和氢氧化钾反应的生成物有KCl、KClO、KClO3,其中K、Cl的物质的量之比为1:1,所以每消耗4molKOH,吸收2mol氯气,标况下2mol氯气的体积为:22.4L/mol×2mol=44.8L,故B错误;
C.由氧化剂的氧化性大于氧化产物的氧化性可知氧化能力KClO比K2FeO4强,故C错误;
D.根据反应Cl2+2OH-=Cl-+ClO-+H2O和2Fe3++3ClO-+10OH-=2FeO+3Cl-+5H2O,可得关系式2K2FeO4~3Cl2,3.96kg K2FeO4的物质的量为20mol,根据关系式可知氯气的物质的量为30mol,故D正确;
答案选D。
20.C
解析:
A.Cu2S为中Cu、S元素化合价降低之产物,因此Cu2S为还原产物,故A错误;
B.反应中Cu元素化合价由+2降低至+1,FeS2中S原子有由-1升高至+6,有由-1降低至-2,其余元素化合价未发生变化,因此每有5mol FeS2发生反应,转移电子为10mol××[6-(-1)]=21mol,故B错误;
C.由B项分析可知,产物中的SO离子有一部分是FeS2中S元素升高而得,因此产物中的SO离子有一部分是氧化产物,故C正确;
D.由B分析可知,FeS2在反应中既作氧化剂也是还原剂,故D错误;
综上所述,说法正确的是C项,故答案为C。
21.
(1) ①④⑧ ⑤
(2)②⑧
(3)⑦
(4)③
解析:
①CO2+C2CO属于化合反应,有元素的化合价变化,属于氧化还原反应,不是离子反应;
②Cu2(OH)2CO32CuO+H2O+CO2↑属于分解反应,反应中无元素发生化合价变化,不属于氧化还原反应,不属于离子反应;
③2NaOH+Cl2=NaCl+NaClO+H2O中有元素的化合价变化,属于氧化还原反应,属于离子反应;
④2CO+O22CO2属于化合反应,有元素的化合价变化,属于氧化还原反应,不属于离子反应;
⑤3Fe+4H2OFe3O4+4H2属于置换反应,有元素的化合价变化,属于氧化还原反应,不属于离子反应;
⑥CuO+COCu+CO2中有元素的化合价变化,属于氧化还原反应,不属于离子反应;
⑦2H2O2H2↑+O2↑属于分解反应,有元素的化合价变化,属于氧化还原反应,不属于离子反应;
⑧CO2+H2O=H2CO3属于化合反应,无元素的化合价变化,不属于氧化还原反应;
(1)其中属于化合反应的是①④⑧,属于置换反应的是⑤;
(2)在化学反应前后元素的化合价没有变化的是②⑧;
(3)上述反应中,既是分解反应,又是氧化还原反应的是⑦;
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是③。
22.
(1)AsH3
(2)Br2
(3)AC
(4)
解析:
(1).KBrO3在反应中得到电子,作氧化剂,则必有作还原剂的另一物质,其应为含有As元素的物质,AsH3中As的化合价为-3价、H3AsO4中As的化合价为+5价,则AsH3为还原剂。
(2)2个KBrO3在反应中得到10个电子生成X,则Br由+5价降低5价而成为0价的Br,从而得出X的化学式为Br2。
(3)上述反应可写成AsH3+KBrO3+H2SO4→H3AsO4+K2SO4+Br2+H2O,KBrO3为氧化剂,H3AsO4为氧化产物,AsH3为还原剂,Br2为还原产物:
A.氧化性:氧化剂>氧化产物,则KBrO3>H3AsO4,正确;
B.由A可知,氧化性:H3AsO4<KBrO3,不正确;
C.还原性:还原剂>还原产物,则AsH3>X(Br2),正确;
D.由C可知,还原性:X(Br2)<AsH3,不正确;
故选AC;
(4)反应中1个KBrO3得到5个电子,1个AsH3失去8个电子,根据得失电子守恒、原子守恒,反应的化学方程式为5AsH3+8KBrO3+4H2SO4=5H3AsO4+4K2SO4+4Br2+4H2O中,用单线桥法标出电子转移的方向和数目:。
23.还原 溶液变蓝 5+2+14=5+2+7
解析:
(1)①亚硝酸钠将二价铁氧化为三价铁,注射美蓝溶液进行解毒治疗,说明美蓝溶液将铁离子变成亚铁离子,美蓝溶液具有还原性;
②亚硝酸钠淀粉碘化钾溶液在酸化后反应生成碘,溶液变蓝色;
(2)反应中铝失去电子,氮元素得到电子, “双线桥法”表示反应中电子转移的方向和数目如下:
(3)已知由、、、、、组成的一个氧化还原反应体系中,发生了反应中的反应过程,说明其元素化合价降低,则根据质量守恒和电子守恒分析,有反应5+2+14=5+2+7。
24.NO+NO2+2NaOH=NaNO2+H2O 1 KNO3 NaN3 63.1g
解析:
结合氧化还原反应电子守恒,物质的量之比1:1的NO和NO2混合气体与NaOH溶液反应,发生氧化还原反应生成NaNO2,NO中氮元素化合价+2价变化为+3价,NO2中 但元素化合价+4价变化为+3价,化合价降低值=化合价升高值=转移电子数,据此计算电子转移总数e-;只有N元素的化合价变化,氧化还原反应中,元素化合价降低的物质做氧化剂,元素化合价升高的物质最还原剂;根据方程式进行计算。
(1)物质的量之比1:1的NO和NO2混合气体与NaOH溶液反应,发生氧化还原反应生成NaNO2,由电子及原子守恒可知该反应的化学方程式NO+NO2+2NaOH=NaNO2+H2O,NO中氮元素化合价+2价变化为+3价,NO2中 但元素化合价+4价变化为+3价,化合价降低值=化合价升高值=转移电子数,生成1molNaNO2时转移电子1mol。故答案为:NO+NO2+2NaOH=NaNO2+H2O;1;
(2)①反应中氮元素化合价-价变化为0价,+5价变化为0价,所以元素化合降低的物质做氧化剂,该反应中的氧化剂为KNO3,元素化合价升高的做还原剂,还原剂为NaN3(填化学式)。故答案为:KNO3;NaN3;
②n(N2)==2.5mol,设该安全气囊反应生成的K2O质量为 x,Na2O质量为x,则: 解得:x=14.7g;y=48.4g,安全气囊中生成的K2O和Na2O的总质量为63.1g,故答案为:63.1g。
25. 稀释ClO2,防止因ClO2浓度过高而发生爆炸 防止倒吸 1∶4
解析:
装置A中,NaClO3和H2O2在酸性条件下反应生成ClO2、O2和H2O,离子方程式为:,ClO2浓度过高时易发生分解引起爆炸,因此通入N2,一是可以起到搅拌作用,二是稀释ClO2,防止因ClO2浓度过高而发生爆炸,装置B是为了防止倒吸,装置C中装有水,ClO2会溶于水中,装置D中装有NaOH溶液,可以吸收尾气,防止污染空气。
(1)ClO2可将废水中的氧化成和,ClO2被还原成,离子方程式为:;
(2)①ClO2浓度过高时易发生分解引起爆炸,因此通入N2,一是可以起到搅拌作用,二是稀释ClO2,防止因ClO2浓度过高而发生爆炸;
②装置A用于制备ClO2气体,NaClO3和H2O2在酸性条件下反应生成ClO2、O2和H2O,该反应的离子方程式为:;
③装置B的作用为防止倒吸;
(3)根据可知,既是氧化剂又是还原剂,5个中的Cl元素,有1个转化为NaCl,化合价降低,作氧化剂,4个转化为,化合价升高,作还原剂,则该反应的氧化剂与还原剂物质的量之比为1∶4。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
