人教版九年级化学上册 第五单元 化学方程式 复习课件(共48张PPT)
文档属性
| 名称 | 人教版九年级化学上册 第五单元 化学方程式 复习课件(共48张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-30 15:27:54 | ||
图片预览









文档简介
(共48张PPT)
§第五单元 化学方程式
复 习
质量守恒定律
如何正确书写化学方程式
利用化学方程式得简单计算
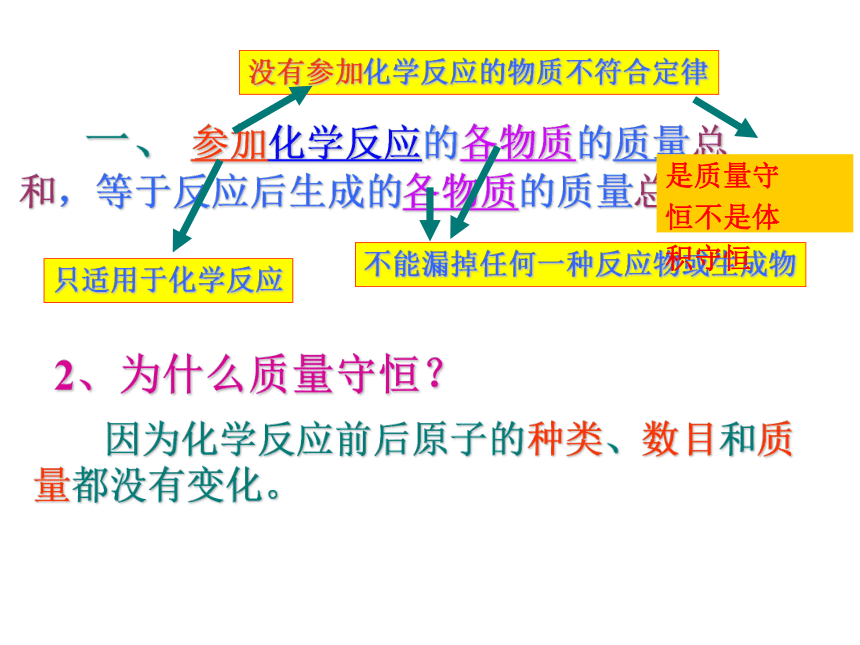
一、 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
没有参加化学反应的物质不符合定律
不能漏掉任何一种反应物或生成物
2、为什么质量守恒?
因为化学反应前后原子的种类、数目和质量都没有变化。
只适用于化学反应
是质量守
恒不是体
积守恒
判断下列说法是否正确:
(1)100克干冰升华变成100克二氧化碳气体符合质量守恒定律
(2)燃烧的镁带和生成的白色粉末质量相等。
(3)3gC在10gO2中充分燃烧,生成13gC02。
(4)2克氢气和8克氧气在点燃的条件下发生化合反应生成10克水
X
X
X
X
典型题三:根据质量守恒定律解释有关问题:
4、镁条在空气中燃烧后,生成物的质量比原来镁条的质量增加。 镁带在空气里燃烧,是 和 发生了___ 反应;
根据质量守恒定律,反应后生成物的质量,一定等于参加反应的 和 的质量总和,所以生成物的质量比 重。
镁
氧气
化学
镁条
氧气
镁条
用质量守恒定律解释:
①铁丝燃烧后质量增加了。
根据质量守恒定律,参加反应的铁与氧气的质量总和等于生成的四氧化三铁的质量,所以铁丝燃烧后质量增加了。
②过氧化氢受热分解后,剩余液体的质量比原来反应物质量轻。
根据质量守恒定律,参加反应的过氧化氢的质量等于生成的水和氧气的质量总和,过氧化氢分解后氧气逸出,所以剩余液体的质量比原来反应物质量轻。
③点石能成金吗?水能变成汽油吗?为什么?
根据质量守恒定律,反应前后元素的种类不变,石头中没有金元素,所以点石不能成金。汽油中含碳元素,而水中不含碳元素,所以水不能变成汽油。
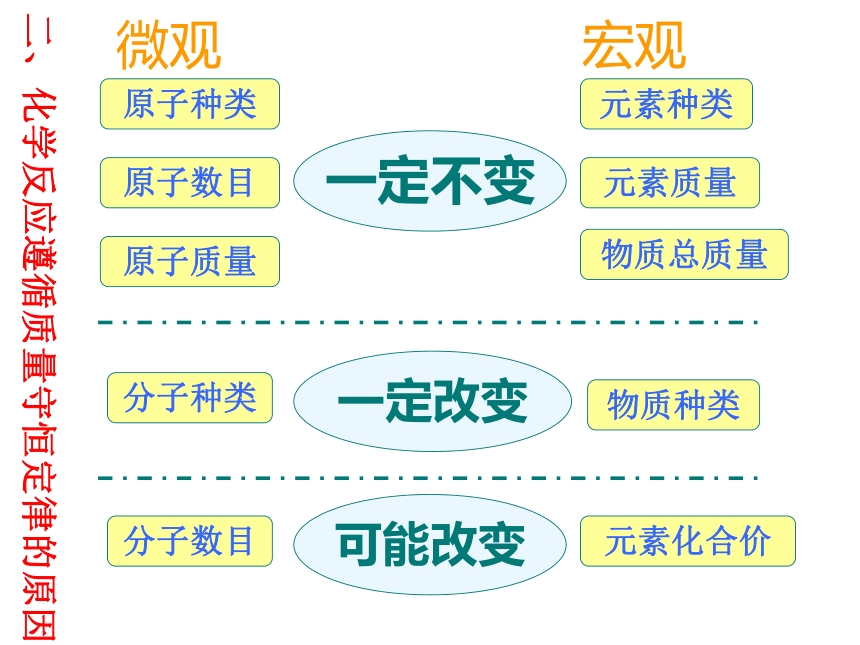
微观
宏观
原子种类
分子数目
元素质量
物质总质量
原子数目
原子质量
元素种类
分子种类
物质种类
元素化合价
一定不变
一定改变
可能改变
二、化学反应遵循质量守恒定律的原因
1.在化学反应前后,肯定没有变化的是( ) ①原子种类 ②分子数目 ③元素种类 ④物质总质量 ⑤物质种类 ⑥原子数目 A.①②③④ B.③④⑥ C.①③④⑥ D.①③④
2.高铁酸钾(K2FeO4)是一种高效多功能水处理剂,它与水反应不可能生成( ) A.氧气 B.碳酸钾 C.氢氧化钾 D.氢氧化铁
3.植物进行光合作用可简单表示为 H2O+CO2→淀粉+O2,由此判断:淀粉中一定含 有 元素,可能含有 元素。
C
B
C、H
O
快速抢答:
1、下列现象不能用质量守恒定律解释的是——
A、纸燃烧化为灰烬,灰烬的质量比纸的质量小
B、镁条燃烧,生成物质量比镁条的质量大
C、10克水受热变为10克水蒸气
D、蜡烛燃烧后质量变小
2、某物质在纯氧气中完全燃烧后生成了二氧化碳和水,则关于该物质的组成的说法正确的是——
A、一定含有碳、氢、氧三种元素。 B、一定含有碳、氧元素。
C 、一定含碳、氢元素。 D、无法确定
3、某化合物X完全燃烧的化学方程式为 X+O2→CO2+H2O﹙未配平﹚则X不可能是——
A、CO B、CH4 C、CH3OH D、C2H5OH
C
C
A
2、推断物质的组成与结构
例1、:某化合物X燃烧的化学方程式
X+3O2===2CO2+3H2O
X的化学式:
C2H6O
例2:在2A+B2=2C的反应中,A的相对原子质量是24,B的相对原子质量是16,则C的相对原子质量是
40
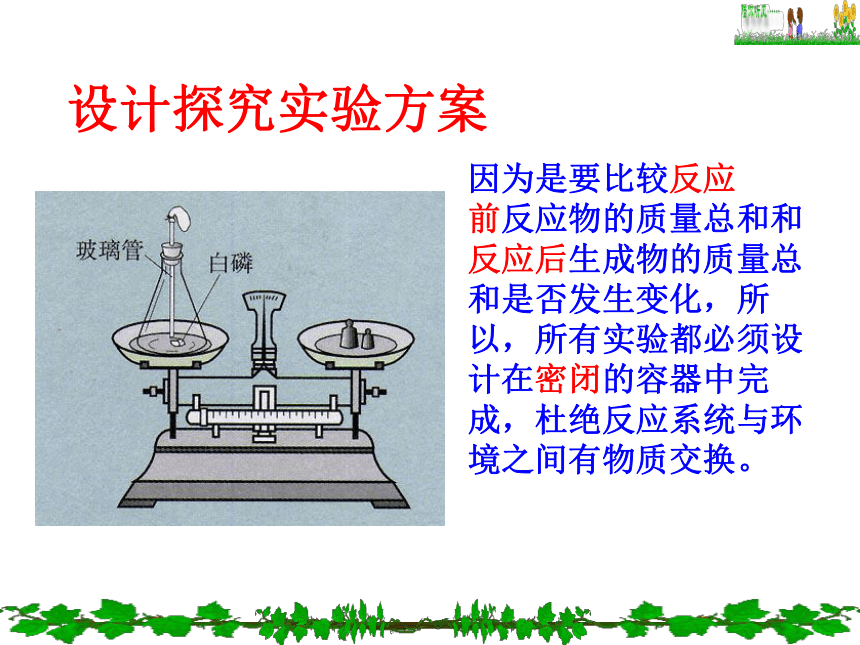
设计探究实验方案
因为是要比较反应
前反应物的质量总和和
反应后生成物的质量总
和是否发生变化,所
以,所有实验都必须设
计在密闭的容器中完
成,杜绝反应系统与环
境之间有物质交换。
快速抢答:
4、根据化学方程式不能获得的信息是——
A、该反应中的反应物和生成物
B、各反应物和生成物的质量比
C、发生反应所需要的条件 D、化学反应的快慢
5、10克A和足量的B混合加热发生反应,10克A完全反应,生成8克C和4克D,则参加反应的A与B的质量比为——
A、1:1 B、2:1 C、4:1 D、5:1
6、化学方程式3Fe + 2O2 点燃 Fe3O4可读作:__
A.铁加氧气等于四氧化三铁
B.三个铁加两个氧气等于一个四氧化三铁
C.铁和氧气点燃后生成四氧化三铁
D.铁加氧气点燃等于四氧化三铁
D
D
C
指出下列化学方程式的错误并改正
(1) Mg + O2 ↑ MgO2
4Fe + 3O2 2Fe2O3
2P2 + 2O5 2P2O5
KMnO4 K2MnO4 + MnO2 + O2
KClO3 KCl + O2 ↑
(6) CuSO4 + NaOH Cu(OH)2 + Na2SO4
点燃
点燃
点燃
△
MnO2
未配平,未标“↑”
未配平,反应条件未注全
未配平,未标“↓”
完成下列化学方程式
1.电解水
2.实验室用双氧水制氧气
3.碳酸钙在高温条件下分解生成氧化钙和二氧化碳
4.甲烷(CH4)燃烧后生成水和二氧化碳
2H2O 2H2↑ + O2↑
2H2O2 2H2O +O2↑
CaCO3 CaO + CO2↑
CH4 +2O2 CO2 + 2H2O
点燃
MnO2
点燃
高温
根据化学方程式计算各物质的质量比
2H2O 2 H2 + O2
18×2 : 2×2 : 32
36: : 4 : 32
KClO3 KCl + O2
2
3
2
MnO2
△
122.5×2 :74.5×2 :32×3
245 : 149 :96
【例题1】加热15.8g高锰酸钾,可以得到多少克氧气?
( 相对原子质量 : Mn 55 K 39 O 16 )
设加热分解15.8g高锰酸钾可以
得到 氧气的质量为x
2KMnO4 K2MnO4+MnO2+O2↑
△
2×158 32
15.8g x
解得 x = 1.6 g
答:加热分解15.8g高锰酸钾可以得到1.6g氧气。
解:
设
方
关
比
答
2×158 15.8g
32 x
X=----------------------------------
15.8g×32
2x158
1、将氯酸钾和二氧化锰的固体混合物30.6克加热至质量不再改变为止,冷却后称量剩余固体物质的质量为21.0克。试问:
(1)生成氧气的质量是多少克?
(2)原混合物中氯酸钾和二氧化锰分别为多少克?
(K:39 Mn:55 O:16)
2.某赤铁矿样品120克,经测定含铁元素49.7克,求该赤铁矿样品中氧化铁的质量分数。(最后结果保留一位小数)
3.小强同学前往当地的石灰石矿区进行调查,他取回了若干快考试样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8克这种石灰石样品,把40稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石中含有的杂质不溶于水,不与盐酸反应)。
1)8g的石灰石样品中含有多少杂质?
(2)样品中碳酸钙的质量分数是多少?
(3)上表中m的数值应为多少?
(4)要得到280kg的氧化钙,需要含碳酸钙质量分数为80%的石灰石多少kg?
2、实验室制取气体
(1)实验室制取氧气
加热高锰酸钾制取氧气:
2KMnO4═K2MnO4+MnO2+O2↑
加热氯酸钾制取氧气:
2KClO3 ═ 2KCl+3O2 ↑
过氧化氢分解制取氧气:
2H2O2 ═ 2H2O+O2 ↑
(2)实验室制取二氧化碳 (提示:制取方法:碳酸钙与盐酸混合反应)
CaCO3+2HCl═CaCl2+H2O+CO2 ↑
△
△
MnO2
MnO2
电解水:
H2O H2 + O2
2
通电
2
小试牛刀:
1、配平下列化学方程式
1、﹙﹚H2O=﹙﹚H2↑+﹙﹚O2↑
2、 ﹙ ﹚AI + ﹙ ﹚ O2= ﹙ ﹚ AI2O3
3、( )Fe2O3+( )C = ( )Fe+ ( )CO2↑
4、﹙ ﹚KCIO3=﹙ ﹚KCI+﹙ ﹚O2↑
2.下列各式中,正确表示铝与稀硫酸反应的化学方程式是
A.Al + H2SO4 ==== AlSO4 + H2↑
B.2Al+ 3H2SO4 ==== Al2(SO4)3 + 3H2↑
C. Al + 2H2SO4 ==== Al(SO4)2 + 2H2↑
D. 2Al + H2SO4 ==== Al2SO4 + H2↑
2
2
1
4
3
2
2
3
4
3
2
2
3
B
3.在2A+B == 2C反应中,已知A的相对分子质量为24,C的相对分子质量为40,则B的相对分子质量为
A. 16 g B. 32 g C. 16 D. 32
4.在 2H2O2 MnO2 2H2O+O2↑ 的反应
中,反应前后肯定发生变化的是
A.元素种类 B.各种原子的数目
C.各元素的化合价 D.物质的质量总和
5.铝在氧气中燃烧生成氧化铝。在这个反应中,铝、氧气、氧化铝的质量比是
A. 27∶32∶102 B. 27∶24∶43
C. 4∶3∶2 D. 108∶96∶204
D
C
D
大显身手:
1、近几年来,科学发现在生物体内存在少量一氧化氮,它有扩张血管和增强记忆力的功能,成为当前生物科学研究的热点。一氧化氮是工业制取硝酸的中间产物,生成一氧化氮的化学方程式为: 4NH3 + 5O2 催化剂 4NO + 6X ,则X的化学式是 。
2、 我国自行设计和制造的长征3号火箭用液氧和液氢作推进剂,点火时发生反应的化学方程式
3、饲养观赏鱼,可以陶冶人的情操,增进人们对生活的热爱。空运观赏鱼,必须密封。为了解决鱼的吸氧问题,可在水中加入过氧化钙(化学式CaO2),过氧化钙与水反应生成的是氢氧化钙和氧气。写出过氧化钙与水反应的化学方程式
H2O
2H2+O2点燃2H2O
2CaO2+2H2O=2Ca﹙OH﹚2+02↑
4、在反应A+B==C+D中,5gA和10gB恰好完全反应,生成8gC;若2.5gA和足量的B反应,可生成D的质量是 。
5、实验室用锌跟足量的稀盐酸(HCl)反应,可以制得氯化锌和氢气。如果用32.5g的锌可制得氢气多少克?﹙Zn:65 、 H:1﹚
3.5g
1g
练习三
植物的光合作用可表示为:
水
+
二氧化碳
光能
叶绿素
淀粉
+
氧气
产生的淀粉中一定含有的元素是( )。
C、H
例题解析
【例2】 在反应2A+5B=2C+4D中,C、D
的相对分子质量之比为9:22。若2.6 gA与
B完全反应后,生成8.8 gD。则在此反应中,B与D的质量比为 ( )
A.4:9 B.8:11
C.10:11 D.31:44
C
例题解析
【例3】某有机物R在足量氧气中完全燃烧后的化学方程式如下:
2R + 13O2 8CO2 +10H2O。
根据质量守定律,R的化学式为 ( )
A.C4H10 B.CH4
C.CH20 D.C2H4O2
点燃
A
例题解析
【例9】纯净的锌片6.5 g恰好和93.7 g稀盐酸完全反应,求反应后所得溶液中溶质质量分数。
例2:有一种含水的过氧化氢样品10g,在二氧化锰的催化作用下,完全分解得到氧气3.2g。
求:生成水的质量?
典型题二:能用质量守恒定律判断物质的元素组成及推断物质的化学式:
2、动物脂肪通过呼吸作用生成二氧化碳和水,反应产生的热量是维持生命活动的能量。则动物脂肪中( )
A.一定含有碳、氢、氧元素
B.一定含有碳、氢元素,可能含有氧元素
C.一定含有二氧化碳和水
D.一定含有碳、氢元素,一定不含氧元素
3、已知化学反应A2+3B2=2C,则C的化学式为____________(用A、B表示)。
B
AB3
典型题四:正确书写化学方程式
7、“珍爱生命,拒绝烧烤”。露天烧烤不仅产生大量有害气体污染环境,而且烧焦的肉类中还含有强烈的致癌物质3,4—苯并芘,其化学式为C20H12,该物质在空气中燃烧,可生成二氧化碳和水,试写出这一反应的化学方程式:
C20H12+23O2 = 20CO2+6H2O
点燃
6.下列现象不能用质量守恒定律解释的是( )。
(A)纸燃烧化为灰烬,灰烬的质量比纸的质量小
(B)镁条燃烧,生成物的质量比镁条的质量大
(C)浓硫酸敞口放置一段时间后质量增大
(D)蜡烛燃烧后质量减小
C
11.2008年北京奥运会使用的“祥云”火炬,内装燃料是液态丙烷。常温下,丙烷气体通过 的方法变为液态,灌装在火炬内。丙烷燃烧的化学方程式为C3H8+xO2===yCO2+zH2O,则x值为 。
5
加压
13.在化学反应A + 2B=3C + D中,6克A与8克B恰好完全反应,生成9克D.若反应生成15克C,则参加反应的B的质量为( )
A.8g B.24g C.12g D.16g
B
18.在一个密闭容器内有X、 Y 、Z、 Q四种物质,在一定条件下充分反应,测得反应前后物质质量如下:
物质 X Y Z Q
反应前质量/g 20 20 20 20
反应后质量/g 20 30 16 14
处理数据后得出的结论正确的是( )
A .反应类型为分解反应 B.反应类型为化合反应
C.生成Z为16g D.反应物为X、Y
B
分析:前后质量比较 不变 +10 -4 -6
21.二氧化碳是常用的灭火剂,但金属镁着火不能用二氧化碳扑救,因为镁可以在二化碳中继续燃烧,生成氧化镁和碳单质.试写出在二氧化碳中燃烧的化学方程式.
22.配平化学方程式
C2H2 + O2 ═ CO2+ H2O
FeS2+ O2 ═ Fe2O3 + SO2
2
2
4
5
点燃
2
4
8
11
点燃
2Mg+CO2═2MgO+C
点燃
27.金属材料在生产、生活中有着广泛的应用。
(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁。用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 。
28.锅炉发生爆炸,可能是由于锅炉内水垢过厚或缺水造成的。为了防止锅炉爆炸,常采用下列措施:
(3)定期清洗锅炉。水垢的主要成分是碳酸钙,写出用稀盐酸清洗水垢的化学方程式:
。
29.如图为自然界中碳循环示意图。
(1)海洋能够吸收二氧化碳,其原因之一是二氧化碳可以跟水反应,请写出该反应的化学方程式: 。
CaCO3+2HCl═ CaCl2+H2O+CO2↑
CO2+H2O═H2CO3
Fe2O3+3CO高温 2Fe+3CO2
30.高级轿车上装有安全气囊,内部储有硝酸铵( )。当汽车高速行驶中受到猛烈撞击时硝酸铵迅速分解,产生大量的氧气、氮气和水,充满气袋,填补在司机与挡风玻璃、方向盘之间,防止司机受伤。
请写出硝酸铵受到猛烈撞击后发生的化学反应方程式:
2NH4NO3 ═ O2↑+2N2 ↑ +4H2O
该反应类型是 。
NH4NO3
撞击
分解反应
第一次 第二次 第三次
氧气的质量(克) 6 13 8
生成二氧化碳的质量(克) 8.25 11 11
33、某同学把3克碳放在不同质量的氧气中充分燃烧,实验数据如下:
(1)以上数据说明,这三次实验中第 次恰好完全反应。
(2)第 次实验碳有剩余,剩余 克。
(3)第 次实验氧气有剩余,剩余 克。
(4)在这三次实验的化学反应过程中,哪几次符合质量守恒定律 。
三
一
0.75
二
5
一、二、三
34、某中学科学小组为了探究一种未知物质M的组成。进行有关探究,在密闭容器中装入物质M、氧气、二氧化碳、水蒸气,在一定的条件下,测得反应前后的质量如下:
(1)认为x的值为 。
(2)如在此过程中生成22克二氧化碳,则同时生成水的质量为 。
(3)未知物质M一定含有的元素有 。
物质 氧气 二氧化碳 水蒸气 M
反应前的质量(克) 100 1 1 46
反应后的质量(克) 4 89 55 x
0克
13.5克
C、H、O
分析前后质量变化:-96 +88 +54 -46
36.石灰石是一种重要的建筑材料,某学校研究性学习小组为了测定某地矿山石灰石碳酸钙的质量分数,取来了一些石灰石样品,并取稀盐酸200克平均分成4份进行实验,结果如下:
(1)哪几次反应中石灰石有剩余?
(2)表中m的数值是 。
(3)试计算这种石灰石矿中碳酸钙的质量分数?
(4)试计算稀盐酸中溶质的质量分数?
实验 1 2 3 4
加入样品的质量(克) 5 10 15 20
生成二氧化碳的质量(克) 1.76 3.52 4.4 m
3、4
4.4
80%
14.6%
4、某物质6克在空气中充分燃烧生成二氧化碳4.4克,水2.7克,则该物质中 ( )
A 一定有C、H、O B 只有C、H
C 一定有C、H,可能有O D无法判断
5、某物质在空气中充分燃烧生成二氧化碳4.4克,水2.7克,则该物质可能是( )
A.CH2O B.CH4 C.C2H60 D.C2H4O2
A
C
20.某3g化合物完全燃烧,生成8.8gCO2和5.4gH2O,则该化合物中( ) A.含有C、H、O三种元素 B.只含有C、H两种元素 C.只含有C、O两种元素 D.无法确定
B
15.蜡烛燃烧前质量是ag,燃烧后质量为bg,生成的二氧化碳质量为cg,水蒸气的质量为dg, 则产物共 g, 参加反应的氧气的质量为 g。
14.在锥形瓶内将30g过氧化氢溶液与2g二氧化锰混合,完全反应后,瓶内剩余物质的总质量为27g,则生成氧气的质量是 g。
c+d
b+c+d-a
5
19.有一种有机物23g在空气中完全燃烧后共生成44g二氧化碳和27g水,该有机物含碳元素的质量是 g,含氢元素的质量是 g,它是由 元素组成的。
12
3
C、H、O
如图所示是测定蜡烛燃烧时的质量变化装置,天平是物理天平,左托盘上蜡烛的上方罩着吸收器。如果实验时,蜡烛正常燃烧,生成的气体顺利通过吸收器,吸收器的药品只在3min内起吸收作用。试回答:
(1)本实验中,蜡烛燃烧时,反应物
是 ,生成物是 ,
反应条件是 。
(2)3min内,天平是否保持平衡? ,
原因是
(3)3min后,会出现什么结果? ,原因是
是否符合质量守恒定律? 。
蜡烛和氧气
二氧化碳和水
点燃
不平衡
生成物中增加了氧元素,并且被吸收器吸收,左盘内物质质量增加。
天平右盘向下倾斜
3min后,吸收器的药物不能再吸收生成物,二氧化碳和水蒸气会逸散
符合
点燃
(1)2Mg+O2===2MgO
点燃
(2)S+O2 ====SO2
点燃
(3)C+O2====CO2
点燃
(4)2C+O2=====2CO
高温
(5)CO2+C=====2CO
点燃
(6)4P+5O2====2P2O5
点燃
(7)3Fe+2O2====Fe3O4
点燃
(8)2H2+O2====2H2O
点燃
(9)2CO+O2=====2CO2
(10)CO2+H2O==H2CO3
常见的化学方程式
一、化合反应
MnO2
2KClO3=====2KCl+3O2↑
△
△
2KMnO4===K2MnO4+MnO2+O2↑
MnO2
2H2O2====2H2O+O2↑
通电
2H2O====2H2↑+O2↑
H2CO3===H2O+CO2↑
二、分解反应
Zn+H2SO4==ZnSO4+H2↑
Mg+H2SO4==MgSO4+H2↑
Fe+H2SO4 ==FeSO4+H2↑
2Al+3H2SO4 ==Al2(SO4)3+3H2↑
Zn+2HCl==ZnCl2+H2↑
Mg+2HCl==MgCl2+H2↑
Fe+2HCl==FeCl2+H2↑
2Al+6HCl==2AlCl3+3H2
高温
C+2CuO=====2Cu+CO2↑
Fe+CuSO4==FeSO4+Cu
CuSO4+Zn==ZnSO4+Cu
Hg(NO3)2+Cu==Cu(NO3)2+Hg
三、置换反应
加热
CuO+CO====Cu+CO2
高温
Fe2O3+3CO====2Fe+3CO2
Fe3O4+4CO====3Fe+4CO2
CaCO3+2HCl==CaCl2+H2O+CO2↑
Na2CO3+2HCl==2NaCl+H2O+CO2↑ Ca(OH)2+CO2===CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
点燃
CH4+2O2=====CO2+2H2O
点燃
C2H5OH+3O2=====2CO2+3H2O
四、其它反应
§第五单元 化学方程式
复 习
质量守恒定律
如何正确书写化学方程式
利用化学方程式得简单计算
一、 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
没有参加化学反应的物质不符合定律
不能漏掉任何一种反应物或生成物
2、为什么质量守恒?
因为化学反应前后原子的种类、数目和质量都没有变化。
只适用于化学反应
是质量守
恒不是体
积守恒
判断下列说法是否正确:
(1)100克干冰升华变成100克二氧化碳气体符合质量守恒定律
(2)燃烧的镁带和生成的白色粉末质量相等。
(3)3gC在10gO2中充分燃烧,生成13gC02。
(4)2克氢气和8克氧气在点燃的条件下发生化合反应生成10克水
X
X
X
X
典型题三:根据质量守恒定律解释有关问题:
4、镁条在空气中燃烧后,生成物的质量比原来镁条的质量增加。 镁带在空气里燃烧,是 和 发生了___ 反应;
根据质量守恒定律,反应后生成物的质量,一定等于参加反应的 和 的质量总和,所以生成物的质量比 重。
镁
氧气
化学
镁条
氧气
镁条
用质量守恒定律解释:
①铁丝燃烧后质量增加了。
根据质量守恒定律,参加反应的铁与氧气的质量总和等于生成的四氧化三铁的质量,所以铁丝燃烧后质量增加了。
②过氧化氢受热分解后,剩余液体的质量比原来反应物质量轻。
根据质量守恒定律,参加反应的过氧化氢的质量等于生成的水和氧气的质量总和,过氧化氢分解后氧气逸出,所以剩余液体的质量比原来反应物质量轻。
③点石能成金吗?水能变成汽油吗?为什么?
根据质量守恒定律,反应前后元素的种类不变,石头中没有金元素,所以点石不能成金。汽油中含碳元素,而水中不含碳元素,所以水不能变成汽油。
微观
宏观
原子种类
分子数目
元素质量
物质总质量
原子数目
原子质量
元素种类
分子种类
物质种类
元素化合价
一定不变
一定改变
可能改变
二、化学反应遵循质量守恒定律的原因
1.在化学反应前后,肯定没有变化的是( ) ①原子种类 ②分子数目 ③元素种类 ④物质总质量 ⑤物质种类 ⑥原子数目 A.①②③④ B.③④⑥ C.①③④⑥ D.①③④
2.高铁酸钾(K2FeO4)是一种高效多功能水处理剂,它与水反应不可能生成( ) A.氧气 B.碳酸钾 C.氢氧化钾 D.氢氧化铁
3.植物进行光合作用可简单表示为 H2O+CO2→淀粉+O2,由此判断:淀粉中一定含 有 元素,可能含有 元素。
C
B
C、H
O
快速抢答:
1、下列现象不能用质量守恒定律解释的是——
A、纸燃烧化为灰烬,灰烬的质量比纸的质量小
B、镁条燃烧,生成物质量比镁条的质量大
C、10克水受热变为10克水蒸气
D、蜡烛燃烧后质量变小
2、某物质在纯氧气中完全燃烧后生成了二氧化碳和水,则关于该物质的组成的说法正确的是——
A、一定含有碳、氢、氧三种元素。 B、一定含有碳、氧元素。
C 、一定含碳、氢元素。 D、无法确定
3、某化合物X完全燃烧的化学方程式为 X+O2→CO2+H2O﹙未配平﹚则X不可能是——
A、CO B、CH4 C、CH3OH D、C2H5OH
C
C
A
2、推断物质的组成与结构
例1、:某化合物X燃烧的化学方程式
X+3O2===2CO2+3H2O
X的化学式:
C2H6O
例2:在2A+B2=2C的反应中,A的相对原子质量是24,B的相对原子质量是16,则C的相对原子质量是
40
设计探究实验方案
因为是要比较反应
前反应物的质量总和和
反应后生成物的质量总
和是否发生变化,所
以,所有实验都必须设
计在密闭的容器中完
成,杜绝反应系统与环
境之间有物质交换。
快速抢答:
4、根据化学方程式不能获得的信息是——
A、该反应中的反应物和生成物
B、各反应物和生成物的质量比
C、发生反应所需要的条件 D、化学反应的快慢
5、10克A和足量的B混合加热发生反应,10克A完全反应,生成8克C和4克D,则参加反应的A与B的质量比为——
A、1:1 B、2:1 C、4:1 D、5:1
6、化学方程式3Fe + 2O2 点燃 Fe3O4可读作:__
A.铁加氧气等于四氧化三铁
B.三个铁加两个氧气等于一个四氧化三铁
C.铁和氧气点燃后生成四氧化三铁
D.铁加氧气点燃等于四氧化三铁
D
D
C
指出下列化学方程式的错误并改正
(1) Mg + O2 ↑ MgO2
4Fe + 3O2 2Fe2O3
2P2 + 2O5 2P2O5
KMnO4 K2MnO4 + MnO2 + O2
KClO3 KCl + O2 ↑
(6) CuSO4 + NaOH Cu(OH)2 + Na2SO4
点燃
点燃
点燃
△
MnO2
未配平,未标“↑”
未配平,反应条件未注全
未配平,未标“↓”
完成下列化学方程式
1.电解水
2.实验室用双氧水制氧气
3.碳酸钙在高温条件下分解生成氧化钙和二氧化碳
4.甲烷(CH4)燃烧后生成水和二氧化碳
2H2O 2H2↑ + O2↑
2H2O2 2H2O +O2↑
CaCO3 CaO + CO2↑
CH4 +2O2 CO2 + 2H2O
点燃
MnO2
点燃
高温
根据化学方程式计算各物质的质量比
2H2O 2 H2 + O2
18×2 : 2×2 : 32
36: : 4 : 32
KClO3 KCl + O2
2
3
2
MnO2
△
122.5×2 :74.5×2 :32×3
245 : 149 :96
【例题1】加热15.8g高锰酸钾,可以得到多少克氧气?
( 相对原子质量 : Mn 55 K 39 O 16 )
设加热分解15.8g高锰酸钾可以
得到 氧气的质量为x
2KMnO4 K2MnO4+MnO2+O2↑
△
2×158 32
15.8g x
解得 x = 1.6 g
答:加热分解15.8g高锰酸钾可以得到1.6g氧气。
解:
设
方
关
比
答
2×158 15.8g
32 x
X=----------------------------------
15.8g×32
2x158
1、将氯酸钾和二氧化锰的固体混合物30.6克加热至质量不再改变为止,冷却后称量剩余固体物质的质量为21.0克。试问:
(1)生成氧气的质量是多少克?
(2)原混合物中氯酸钾和二氧化锰分别为多少克?
(K:39 Mn:55 O:16)
2.某赤铁矿样品120克,经测定含铁元素49.7克,求该赤铁矿样品中氧化铁的质量分数。(最后结果保留一位小数)
3.小强同学前往当地的石灰石矿区进行调查,他取回了若干快考试样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8克这种石灰石样品,把40稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石中含有的杂质不溶于水,不与盐酸反应)。
1)8g的石灰石样品中含有多少杂质?
(2)样品中碳酸钙的质量分数是多少?
(3)上表中m的数值应为多少?
(4)要得到280kg的氧化钙,需要含碳酸钙质量分数为80%的石灰石多少kg?
2、实验室制取气体
(1)实验室制取氧气
加热高锰酸钾制取氧气:
2KMnO4═K2MnO4+MnO2+O2↑
加热氯酸钾制取氧气:
2KClO3 ═ 2KCl+3O2 ↑
过氧化氢分解制取氧气:
2H2O2 ═ 2H2O+O2 ↑
(2)实验室制取二氧化碳 (提示:制取方法:碳酸钙与盐酸混合反应)
CaCO3+2HCl═CaCl2+H2O+CO2 ↑
△
△
MnO2
MnO2
电解水:
H2O H2 + O2
2
通电
2
小试牛刀:
1、配平下列化学方程式
1、﹙﹚H2O=﹙﹚H2↑+﹙﹚O2↑
2、 ﹙ ﹚AI + ﹙ ﹚ O2= ﹙ ﹚ AI2O3
3、( )Fe2O3+( )C = ( )Fe+ ( )CO2↑
4、﹙ ﹚KCIO3=﹙ ﹚KCI+﹙ ﹚O2↑
2.下列各式中,正确表示铝与稀硫酸反应的化学方程式是
A.Al + H2SO4 ==== AlSO4 + H2↑
B.2Al+ 3H2SO4 ==== Al2(SO4)3 + 3H2↑
C. Al + 2H2SO4 ==== Al(SO4)2 + 2H2↑
D. 2Al + H2SO4 ==== Al2SO4 + H2↑
2
2
1
4
3
2
2
3
4
3
2
2
3
B
3.在2A+B == 2C反应中,已知A的相对分子质量为24,C的相对分子质量为40,则B的相对分子质量为
A. 16 g B. 32 g C. 16 D. 32
4.在 2H2O2 MnO2 2H2O+O2↑ 的反应
中,反应前后肯定发生变化的是
A.元素种类 B.各种原子的数目
C.各元素的化合价 D.物质的质量总和
5.铝在氧气中燃烧生成氧化铝。在这个反应中,铝、氧气、氧化铝的质量比是
A. 27∶32∶102 B. 27∶24∶43
C. 4∶3∶2 D. 108∶96∶204
D
C
D
大显身手:
1、近几年来,科学发现在生物体内存在少量一氧化氮,它有扩张血管和增强记忆力的功能,成为当前生物科学研究的热点。一氧化氮是工业制取硝酸的中间产物,生成一氧化氮的化学方程式为: 4NH3 + 5O2 催化剂 4NO + 6X ,则X的化学式是 。
2、 我国自行设计和制造的长征3号火箭用液氧和液氢作推进剂,点火时发生反应的化学方程式
3、饲养观赏鱼,可以陶冶人的情操,增进人们对生活的热爱。空运观赏鱼,必须密封。为了解决鱼的吸氧问题,可在水中加入过氧化钙(化学式CaO2),过氧化钙与水反应生成的是氢氧化钙和氧气。写出过氧化钙与水反应的化学方程式
H2O
2H2+O2点燃2H2O
2CaO2+2H2O=2Ca﹙OH﹚2+02↑
4、在反应A+B==C+D中,5gA和10gB恰好完全反应,生成8gC;若2.5gA和足量的B反应,可生成D的质量是 。
5、实验室用锌跟足量的稀盐酸(HCl)反应,可以制得氯化锌和氢气。如果用32.5g的锌可制得氢气多少克?﹙Zn:65 、 H:1﹚
3.5g
1g
练习三
植物的光合作用可表示为:
水
+
二氧化碳
光能
叶绿素
淀粉
+
氧气
产生的淀粉中一定含有的元素是( )。
C、H
例题解析
【例2】 在反应2A+5B=2C+4D中,C、D
的相对分子质量之比为9:22。若2.6 gA与
B完全反应后,生成8.8 gD。则在此反应中,B与D的质量比为 ( )
A.4:9 B.8:11
C.10:11 D.31:44
C
例题解析
【例3】某有机物R在足量氧气中完全燃烧后的化学方程式如下:
2R + 13O2 8CO2 +10H2O。
根据质量守定律,R的化学式为 ( )
A.C4H10 B.CH4
C.CH20 D.C2H4O2
点燃
A
例题解析
【例9】纯净的锌片6.5 g恰好和93.7 g稀盐酸完全反应,求反应后所得溶液中溶质质量分数。
例2:有一种含水的过氧化氢样品10g,在二氧化锰的催化作用下,完全分解得到氧气3.2g。
求:生成水的质量?
典型题二:能用质量守恒定律判断物质的元素组成及推断物质的化学式:
2、动物脂肪通过呼吸作用生成二氧化碳和水,反应产生的热量是维持生命活动的能量。则动物脂肪中( )
A.一定含有碳、氢、氧元素
B.一定含有碳、氢元素,可能含有氧元素
C.一定含有二氧化碳和水
D.一定含有碳、氢元素,一定不含氧元素
3、已知化学反应A2+3B2=2C,则C的化学式为____________(用A、B表示)。
B
AB3
典型题四:正确书写化学方程式
7、“珍爱生命,拒绝烧烤”。露天烧烤不仅产生大量有害气体污染环境,而且烧焦的肉类中还含有强烈的致癌物质3,4—苯并芘,其化学式为C20H12,该物质在空气中燃烧,可生成二氧化碳和水,试写出这一反应的化学方程式:
C20H12+23O2 = 20CO2+6H2O
点燃
6.下列现象不能用质量守恒定律解释的是( )。
(A)纸燃烧化为灰烬,灰烬的质量比纸的质量小
(B)镁条燃烧,生成物的质量比镁条的质量大
(C)浓硫酸敞口放置一段时间后质量增大
(D)蜡烛燃烧后质量减小
C
11.2008年北京奥运会使用的“祥云”火炬,内装燃料是液态丙烷。常温下,丙烷气体通过 的方法变为液态,灌装在火炬内。丙烷燃烧的化学方程式为C3H8+xO2===yCO2+zH2O,则x值为 。
5
加压
13.在化学反应A + 2B=3C + D中,6克A与8克B恰好完全反应,生成9克D.若反应生成15克C,则参加反应的B的质量为( )
A.8g B.24g C.12g D.16g
B
18.在一个密闭容器内有X、 Y 、Z、 Q四种物质,在一定条件下充分反应,测得反应前后物质质量如下:
物质 X Y Z Q
反应前质量/g 20 20 20 20
反应后质量/g 20 30 16 14
处理数据后得出的结论正确的是( )
A .反应类型为分解反应 B.反应类型为化合反应
C.生成Z为16g D.反应物为X、Y
B
分析:前后质量比较 不变 +10 -4 -6
21.二氧化碳是常用的灭火剂,但金属镁着火不能用二氧化碳扑救,因为镁可以在二化碳中继续燃烧,生成氧化镁和碳单质.试写出在二氧化碳中燃烧的化学方程式.
22.配平化学方程式
C2H2 + O2 ═ CO2+ H2O
FeS2+ O2 ═ Fe2O3 + SO2
2
2
4
5
点燃
2
4
8
11
点燃
2Mg+CO2═2MgO+C
点燃
27.金属材料在生产、生活中有着广泛的应用。
(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁。用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 。
28.锅炉发生爆炸,可能是由于锅炉内水垢过厚或缺水造成的。为了防止锅炉爆炸,常采用下列措施:
(3)定期清洗锅炉。水垢的主要成分是碳酸钙,写出用稀盐酸清洗水垢的化学方程式:
。
29.如图为自然界中碳循环示意图。
(1)海洋能够吸收二氧化碳,其原因之一是二氧化碳可以跟水反应,请写出该反应的化学方程式: 。
CaCO3+2HCl═ CaCl2+H2O+CO2↑
CO2+H2O═H2CO3
Fe2O3+3CO高温 2Fe+3CO2
30.高级轿车上装有安全气囊,内部储有硝酸铵( )。当汽车高速行驶中受到猛烈撞击时硝酸铵迅速分解,产生大量的氧气、氮气和水,充满气袋,填补在司机与挡风玻璃、方向盘之间,防止司机受伤。
请写出硝酸铵受到猛烈撞击后发生的化学反应方程式:
2NH4NO3 ═ O2↑+2N2 ↑ +4H2O
该反应类型是 。
NH4NO3
撞击
分解反应
第一次 第二次 第三次
氧气的质量(克) 6 13 8
生成二氧化碳的质量(克) 8.25 11 11
33、某同学把3克碳放在不同质量的氧气中充分燃烧,实验数据如下:
(1)以上数据说明,这三次实验中第 次恰好完全反应。
(2)第 次实验碳有剩余,剩余 克。
(3)第 次实验氧气有剩余,剩余 克。
(4)在这三次实验的化学反应过程中,哪几次符合质量守恒定律 。
三
一
0.75
二
5
一、二、三
34、某中学科学小组为了探究一种未知物质M的组成。进行有关探究,在密闭容器中装入物质M、氧气、二氧化碳、水蒸气,在一定的条件下,测得反应前后的质量如下:
(1)认为x的值为 。
(2)如在此过程中生成22克二氧化碳,则同时生成水的质量为 。
(3)未知物质M一定含有的元素有 。
物质 氧气 二氧化碳 水蒸气 M
反应前的质量(克) 100 1 1 46
反应后的质量(克) 4 89 55 x
0克
13.5克
C、H、O
分析前后质量变化:-96 +88 +54 -46
36.石灰石是一种重要的建筑材料,某学校研究性学习小组为了测定某地矿山石灰石碳酸钙的质量分数,取来了一些石灰石样品,并取稀盐酸200克平均分成4份进行实验,结果如下:
(1)哪几次反应中石灰石有剩余?
(2)表中m的数值是 。
(3)试计算这种石灰石矿中碳酸钙的质量分数?
(4)试计算稀盐酸中溶质的质量分数?
实验 1 2 3 4
加入样品的质量(克) 5 10 15 20
生成二氧化碳的质量(克) 1.76 3.52 4.4 m
3、4
4.4
80%
14.6%
4、某物质6克在空气中充分燃烧生成二氧化碳4.4克,水2.7克,则该物质中 ( )
A 一定有C、H、O B 只有C、H
C 一定有C、H,可能有O D无法判断
5、某物质在空气中充分燃烧生成二氧化碳4.4克,水2.7克,则该物质可能是( )
A.CH2O B.CH4 C.C2H60 D.C2H4O2
A
C
20.某3g化合物完全燃烧,生成8.8gCO2和5.4gH2O,则该化合物中( ) A.含有C、H、O三种元素 B.只含有C、H两种元素 C.只含有C、O两种元素 D.无法确定
B
15.蜡烛燃烧前质量是ag,燃烧后质量为bg,生成的二氧化碳质量为cg,水蒸气的质量为dg, 则产物共 g, 参加反应的氧气的质量为 g。
14.在锥形瓶内将30g过氧化氢溶液与2g二氧化锰混合,完全反应后,瓶内剩余物质的总质量为27g,则生成氧气的质量是 g。
c+d
b+c+d-a
5
19.有一种有机物23g在空气中完全燃烧后共生成44g二氧化碳和27g水,该有机物含碳元素的质量是 g,含氢元素的质量是 g,它是由 元素组成的。
12
3
C、H、O
如图所示是测定蜡烛燃烧时的质量变化装置,天平是物理天平,左托盘上蜡烛的上方罩着吸收器。如果实验时,蜡烛正常燃烧,生成的气体顺利通过吸收器,吸收器的药品只在3min内起吸收作用。试回答:
(1)本实验中,蜡烛燃烧时,反应物
是 ,生成物是 ,
反应条件是 。
(2)3min内,天平是否保持平衡? ,
原因是
(3)3min后,会出现什么结果? ,原因是
是否符合质量守恒定律? 。
蜡烛和氧气
二氧化碳和水
点燃
不平衡
生成物中增加了氧元素,并且被吸收器吸收,左盘内物质质量增加。
天平右盘向下倾斜
3min后,吸收器的药物不能再吸收生成物,二氧化碳和水蒸气会逸散
符合
点燃
(1)2Mg+O2===2MgO
点燃
(2)S+O2 ====SO2
点燃
(3)C+O2====CO2
点燃
(4)2C+O2=====2CO
高温
(5)CO2+C=====2CO
点燃
(6)4P+5O2====2P2O5
点燃
(7)3Fe+2O2====Fe3O4
点燃
(8)2H2+O2====2H2O
点燃
(9)2CO+O2=====2CO2
(10)CO2+H2O==H2CO3
常见的化学方程式
一、化合反应
MnO2
2KClO3=====2KCl+3O2↑
△
△
2KMnO4===K2MnO4+MnO2+O2↑
MnO2
2H2O2====2H2O+O2↑
通电
2H2O====2H2↑+O2↑
H2CO3===H2O+CO2↑
二、分解反应
Zn+H2SO4==ZnSO4+H2↑
Mg+H2SO4==MgSO4+H2↑
Fe+H2SO4 ==FeSO4+H2↑
2Al+3H2SO4 ==Al2(SO4)3+3H2↑
Zn+2HCl==ZnCl2+H2↑
Mg+2HCl==MgCl2+H2↑
Fe+2HCl==FeCl2+H2↑
2Al+6HCl==2AlCl3+3H2
高温
C+2CuO=====2Cu+CO2↑
Fe+CuSO4==FeSO4+Cu
CuSO4+Zn==ZnSO4+Cu
Hg(NO3)2+Cu==Cu(NO3)2+Hg
三、置换反应
加热
CuO+CO====Cu+CO2
高温
Fe2O3+3CO====2Fe+3CO2
Fe3O4+4CO====3Fe+4CO2
CaCO3+2HCl==CaCl2+H2O+CO2↑
Na2CO3+2HCl==2NaCl+H2O+CO2↑ Ca(OH)2+CO2===CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
点燃
CH4+2O2=====CO2+2H2O
点燃
C2H5OH+3O2=====2CO2+3H2O
四、其它反应
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
