鲁教版(五四制)八年级全一册 3.1 原子的构成 课件(共15张PPT内嵌视频)
文档属性
| 名称 | 鲁教版(五四制)八年级全一册 3.1 原子的构成 课件(共15张PPT内嵌视频) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-30 16:37:44 | ||
图片预览


文档简介
(共15张PPT)
第一节 原子的构成
学习目标
.
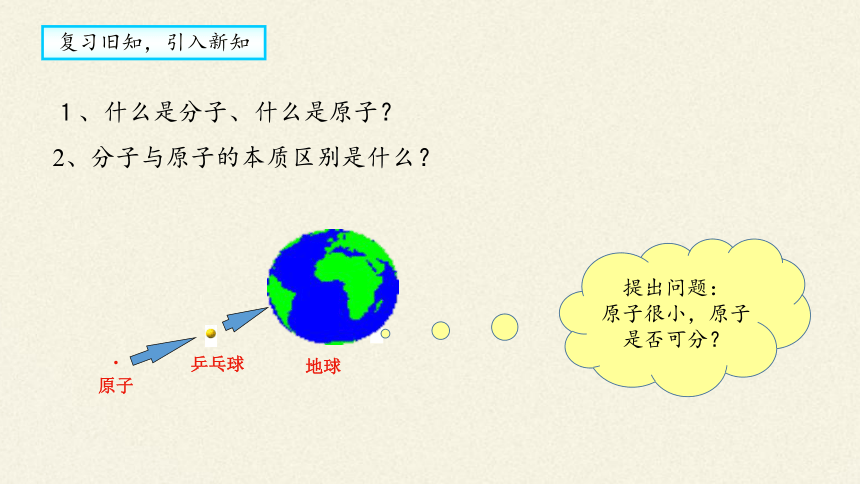
原子
乒乓球
地球
复习旧知,引入新知
1、什么是分子、什么是原子?
2、分子与原子的本质区别是什么?
提出问题:
原子很小,原子是否可分?
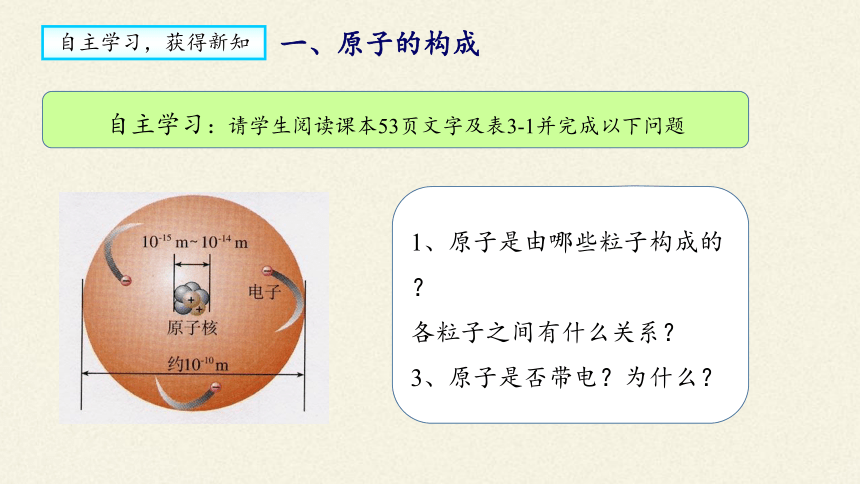
自主学习:请学生阅读课本53页文字及表3-1并完成以下问题
自主学习,获得新知
1、原子是由哪些粒子构成的?
各粒子之间有什么关系?
3、原子是否带电?为什么?
一、原子的构成
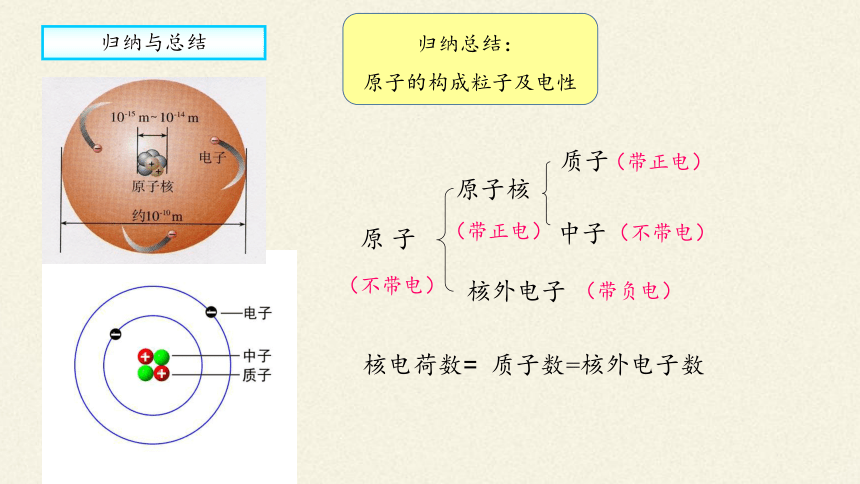
归纳总结:
原子的构成粒子及电性
原 子
核外电子
原子核
质子
中子
(带正电)
(带正电)
(不带电)
(不带电)
质子数=核外电子数
归纳与总结
(带负电)
核电荷数=
1、(2012 北京) 牙膏中的含氟化合物对牙齿有保护作用. 一种氟原子的原子核内有 9 个质子和 10 个中子, 该原子的核电荷数为( )
A. 7 B. 9 C. 10 D. 19
2、(2011 北京) 已知一种碳原子可用于测定文物的年代, 该原子的原子核内含有 6 个质子和 8 个中子, 则核外电子数为( )
A. 2 B. 6 C. 8 D. 14
链接中考,强化训练
B
B
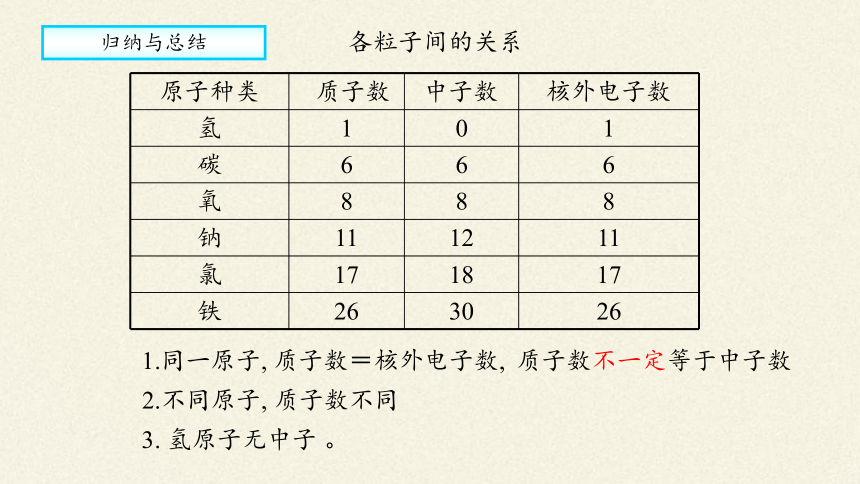
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
铁 26 30 26
3. 氢原子无中子 。
1.同一原子, 质子数=核外电子数,
2.不同原子, 质子数不同
归纳与总结
质子数不一定等于中子数
各粒子间的关系
道尔顿模型(1803)
—“原子不可分”观点
汤姆生模型(1904)
—“西瓜”模型
卢瑟福模型(1911)
— 原子核式结构
原
子
结
构
模
型
的
创
建
和
修
正
思考:看书54页,思考原子核外的电子如何运动?
核外电子运动
二、原子核外电子的排布
自主学习,获得新知
二、原子核外电子的排布
核外电子——分层排布
离核距离:由近 远
电子能量:由低 高
电子层数:
一,二,三,四,五,六,七
归纳与总结
电子层
原子核
O
6
2
+8
该层的电子数
氧原子
原子结构示意图
归纳与总结
第一层最多排2个电子
第二层最多排8个电子
最外层电子数不超过8个
质子数
练习巩固
1、如图为硫原子的结构示意图,请试着说出各部分的意义
2、试着画出氖原子、钠原子、氯原子、钾原子、钙原子的结构示意图
请同学们仔细观察上面18种原子的结构示意图,从原子种类和最外层电子数的关系上你发现了什么规律?
观察思考
稀有气体原子
最外层电子数
以达到最多(2
个或8个)
非金属原子
最外层电子数
一般>=4个
金属原子
最外层电子数
一般<4个
相对稳定结构
易失电子
易得电子
化学性质较活泼
化学性质较稳定
原子 种类 最外层 电子数 是否稳定结构 在化学反应中得失电子 化学
性质
稀有气体原子
金属原子
非金属原子
归纳与总结
原子的最外层电子数决定原子的化学性质
=8
<4
≧4
稳定
不稳定
不稳定
不易得失电子
易失电子
易得电子
稳定
活泼
活泼
谢 谢
第一节 原子的构成
学习目标
.
原子
乒乓球
地球
复习旧知,引入新知
1、什么是分子、什么是原子?
2、分子与原子的本质区别是什么?
提出问题:
原子很小,原子是否可分?
自主学习:请学生阅读课本53页文字及表3-1并完成以下问题
自主学习,获得新知
1、原子是由哪些粒子构成的?
各粒子之间有什么关系?
3、原子是否带电?为什么?
一、原子的构成
归纳总结:
原子的构成粒子及电性
原 子
核外电子
原子核
质子
中子
(带正电)
(带正电)
(不带电)
(不带电)
质子数=核外电子数
归纳与总结
(带负电)
核电荷数=
1、(2012 北京) 牙膏中的含氟化合物对牙齿有保护作用. 一种氟原子的原子核内有 9 个质子和 10 个中子, 该原子的核电荷数为( )
A. 7 B. 9 C. 10 D. 19
2、(2011 北京) 已知一种碳原子可用于测定文物的年代, 该原子的原子核内含有 6 个质子和 8 个中子, 则核外电子数为( )
A. 2 B. 6 C. 8 D. 14
链接中考,强化训练
B
B
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
铁 26 30 26
3. 氢原子无中子 。
1.同一原子, 质子数=核外电子数,
2.不同原子, 质子数不同
归纳与总结
质子数不一定等于中子数
各粒子间的关系
道尔顿模型(1803)
—“原子不可分”观点
汤姆生模型(1904)
—“西瓜”模型
卢瑟福模型(1911)
— 原子核式结构
原
子
结
构
模
型
的
创
建
和
修
正
思考:看书54页,思考原子核外的电子如何运动?
核外电子运动
二、原子核外电子的排布
自主学习,获得新知
二、原子核外电子的排布
核外电子——分层排布
离核距离:由近 远
电子能量:由低 高
电子层数:
一,二,三,四,五,六,七
归纳与总结
电子层
原子核
O
6
2
+8
该层的电子数
氧原子
原子结构示意图
归纳与总结
第一层最多排2个电子
第二层最多排8个电子
最外层电子数不超过8个
质子数
练习巩固
1、如图为硫原子的结构示意图,请试着说出各部分的意义
2、试着画出氖原子、钠原子、氯原子、钾原子、钙原子的结构示意图
请同学们仔细观察上面18种原子的结构示意图,从原子种类和最外层电子数的关系上你发现了什么规律?
观察思考
稀有气体原子
最外层电子数
以达到最多(2
个或8个)
非金属原子
最外层电子数
一般>=4个
金属原子
最外层电子数
一般<4个
相对稳定结构
易失电子
易得电子
化学性质较活泼
化学性质较稳定
原子 种类 最外层 电子数 是否稳定结构 在化学反应中得失电子 化学
性质
稀有气体原子
金属原子
非金属原子
归纳与总结
原子的最外层电子数决定原子的化学性质
=8
<4
≧4
稳定
不稳定
不稳定
不易得失电子
易失电子
易得电子
稳定
活泼
活泼
谢 谢
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
