鲁教版(五四制)八年级全一册 到实验室去:二氧化碳的实验室制取与性质 课件 (共11张PPT)
文档属性
| 名称 | 鲁教版(五四制)八年级全一册 到实验室去:二氧化碳的实验室制取与性质 课件 (共11张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 233.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-30 17:25:15 | ||
图片预览



文档简介
(共11张PPT)
到实验室去:
二氧化碳的实验室制取与性质
内容提要
验证二氧化碳的性质
2
制取与收集二氧化碳
1
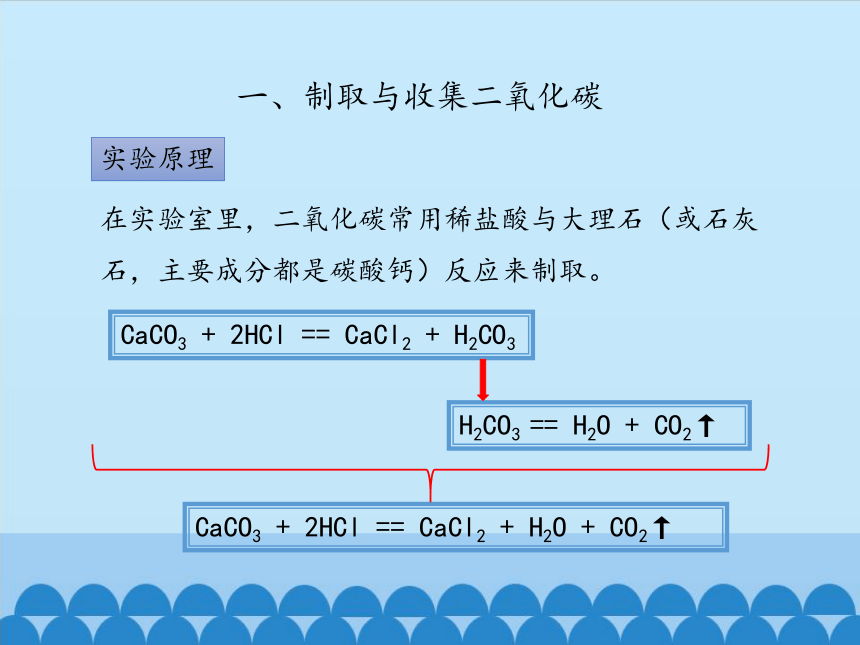
实验原理
一、制取与收集二氧化碳
在实验室里,二氧化碳常用稀盐酸与大理石(或石灰石,主要成分都是碳酸钙)反应来制取。
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
CaCO3 + 2HCl == CaCl2 + H2CO3
H2CO3 == H2O + CO2↑
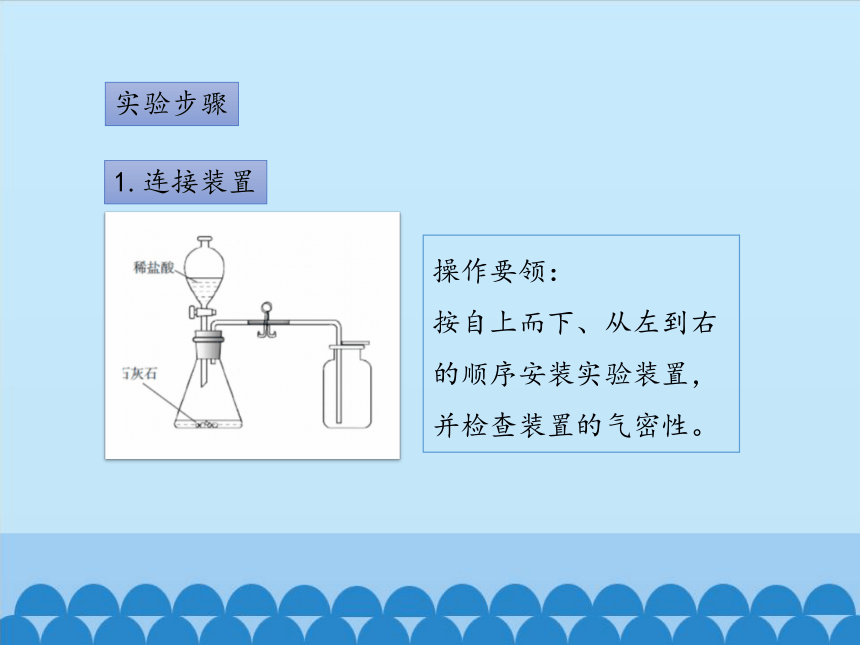
1.连接装置
操作要领:
按自上而下、从左到右的顺序安装实验装置,并检查装置的气密性。
实验步骤
2.盛装药品
向锥形瓶中装入石灰石(或大理石),向分液漏斗中加入稀盐酸。
3.收集气体
打开分液漏斗活塞,待导管口气泡连续、均匀冒出时,收集气体。
操作 现象 结论
向已调节平衡的天平左端烧杯中倾倒二氧化碳气体
(1)二氧化碳的物理性质
实验①:比较二氧化碳和空气的密度
天平向左端倾斜
二氧化碳气体的密度比空气大
二、验证二氧化碳的性质
CO2
操作 现象 结论
向盛有二氧化碳的塑料瓶中加入适量的蒸馏水,迅速拧紧瓶盖,振荡
实验②:二氧化碳的溶解性实验
塑料瓶变瘪
二氧化碳
溶于水
(2)二氧化碳的化学性质
操作 现象 结论
向上述盛有二氧化碳水溶液的塑料瓶中滴加1~2滴紫色石蕊试液,拧紧瓶盖,振荡
实验①:探究二氧化碳能否与水反应
紫色石蕊试液变红
二氧化碳可以和水反应
化学方程式:CO2 + H2O = H2CO3
操作 现象 结论
向盛有二氧化碳的烧杯中倒入适量澄清石灰水,振荡
实验②:探究二氧化碳与澄清石灰水的反应
澄清石灰水变浑浊
二氧化碳可以与澄清石灰水反应
化学方程式:CO2 + Ca(OH)2 == CaCO3 ↓ + H2O
操作 现象 结论
向盛有两支长短不同的燃烧着的蜡烛的烧杯中倾倒二氧化碳气体
实验③:探究二氧化碳能否燃烧及支持燃烧
下面的蜡烛先熄灭,上面的蜡烛后熄灭
CO2密度比空气大,不能燃烧且不支持燃烧
谢 谢
到实验室去:
二氧化碳的实验室制取与性质
内容提要
验证二氧化碳的性质
2
制取与收集二氧化碳
1
实验原理
一、制取与收集二氧化碳
在实验室里,二氧化碳常用稀盐酸与大理石(或石灰石,主要成分都是碳酸钙)反应来制取。
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
CaCO3 + 2HCl == CaCl2 + H2CO3
H2CO3 == H2O + CO2↑
1.连接装置
操作要领:
按自上而下、从左到右的顺序安装实验装置,并检查装置的气密性。
实验步骤
2.盛装药品
向锥形瓶中装入石灰石(或大理石),向分液漏斗中加入稀盐酸。
3.收集气体
打开分液漏斗活塞,待导管口气泡连续、均匀冒出时,收集气体。
操作 现象 结论
向已调节平衡的天平左端烧杯中倾倒二氧化碳气体
(1)二氧化碳的物理性质
实验①:比较二氧化碳和空气的密度
天平向左端倾斜
二氧化碳气体的密度比空气大
二、验证二氧化碳的性质
CO2
操作 现象 结论
向盛有二氧化碳的塑料瓶中加入适量的蒸馏水,迅速拧紧瓶盖,振荡
实验②:二氧化碳的溶解性实验
塑料瓶变瘪
二氧化碳
溶于水
(2)二氧化碳的化学性质
操作 现象 结论
向上述盛有二氧化碳水溶液的塑料瓶中滴加1~2滴紫色石蕊试液,拧紧瓶盖,振荡
实验①:探究二氧化碳能否与水反应
紫色石蕊试液变红
二氧化碳可以和水反应
化学方程式:CO2 + H2O = H2CO3
操作 现象 结论
向盛有二氧化碳的烧杯中倒入适量澄清石灰水,振荡
实验②:探究二氧化碳与澄清石灰水的反应
澄清石灰水变浑浊
二氧化碳可以与澄清石灰水反应
化学方程式:CO2 + Ca(OH)2 == CaCO3 ↓ + H2O
操作 现象 结论
向盛有两支长短不同的燃烧着的蜡烛的烧杯中倾倒二氧化碳气体
实验③:探究二氧化碳能否燃烧及支持燃烧
下面的蜡烛先熄灭,上面的蜡烛后熄灭
CO2密度比空气大,不能燃烧且不支持燃烧
谢 谢
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
