鲁教版(五四制)八年级全一册 3.3 物质组成的表示 课件(共28张PPT)
文档属性
| 名称 | 鲁教版(五四制)八年级全一册 3.3 物质组成的表示 课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 773.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-30 17:28:01 | ||
图片预览







文档简介
(共28张PPT)
物质组成的表示
化学式及其意义
化合价
内容提要
1
2
物质组成的定量表示
3
1.知道化学式的意义,能用化学式表示某些物质的组成;
2.记住常见元素的化合价;
3.初步学会根据化合价书写化学式;
4.知道物质组成的定量表示,能计算物质中某元素的质量分数。
学习目标
一、化学式及其意义
化学式:用元素符号和数字组合表示物质组成的式子。
【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个。
如: 氯化钠 NaCl
铜 Cu
二氧化碳 CO2
氯化钠:由Na+、Cl-构成, Na+、Cl-数目比为1:1
由离子构成的物质,可以用化学式表示该物质的构成。
二氧化碳:由CO2分子构成,分子中C、O原子的个数比为1:2。
由分子构成的物质,可以用分子式表示该物质的构成。
由分子构成的物质,把分子式当作该物质的化学式。
铜:由Cu原子构成。
由原子构成的物质,用元素符号表示该物质的化学式。
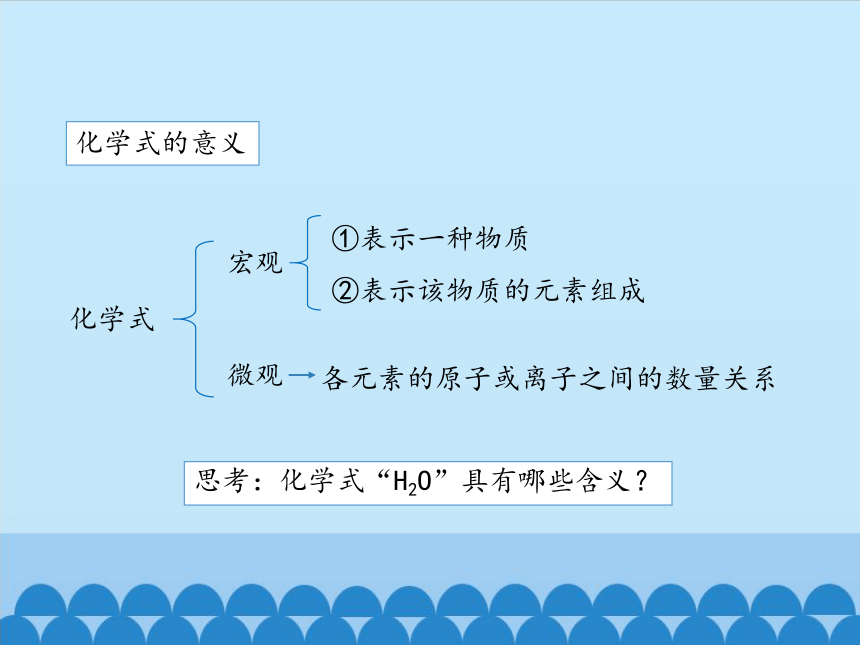
化学式的意义
化学式
宏观
微观
①表示一种物质
②表示该物质的元素组成
各元素的原子或离子之间的数量关系
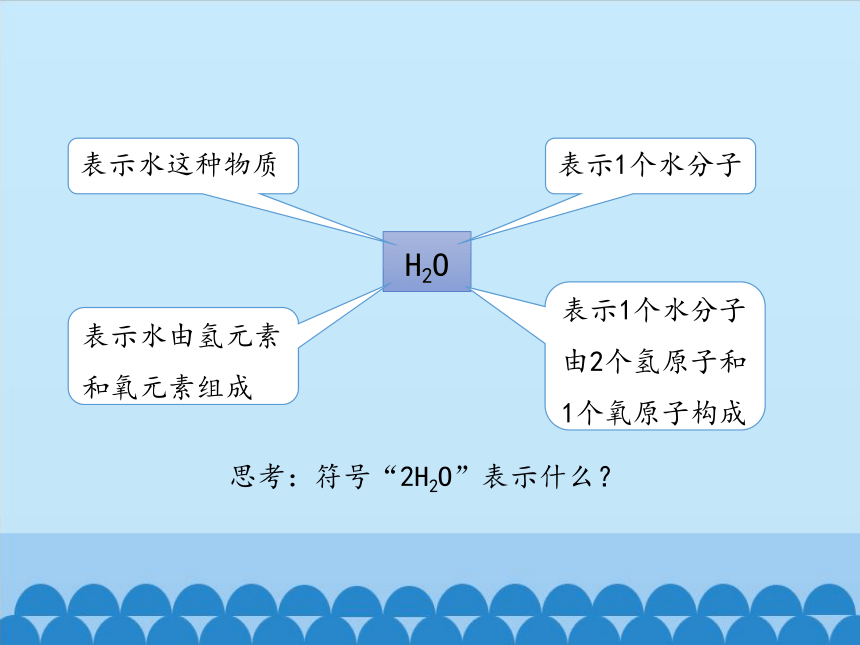
思考:化学式“H2O”具有哪些含义?
H2O
表示水这种物质
表示水由氢元素
和氧元素组成
表示1个水分子
表示1个水分子
由2个氢原子和
1个氧原子构成
思考:符号“2H2O”表示什么?
化学式的书写
1.单质化学式的书写
单质种类 书写方式
稀有气体
金属和固态非金属
非金属气体
元素符号表示,如氦写He
元素符号表示,如铁写Fe
在元素符号右下角写上表示分子中所含原子数的数字,如O2
2.化合物化学式的书写
(1)当组成元素个数比为1时,1省略不写;
(2)氧化物:氧在后,其他元素在前。如CO2;
(3)其他两种元素形成的化合物:金属在前,非金属在后。如NaCl、FeCl3等。
化学式的读法
1.由两种元素组成的化合物,应从右到左读,中间用“化”字连接。如氯化钾(KCl)。
2.部分由两种元素组成的化合物,原子的个数在元素的名称之前读出。如二氧化碳(CO2)。
3.含有原子团的化合物,从右到左,中间用“酸”或“化”字连接,不需读出原子团个数。如碳酸钠((Na2CO3)。
二、化合价
化合物中元素有确定的原子个数比。
O
H
H
原子个数比
1:2 1:3 1:4
化学上用“化合价”来体现不同元素的原子相互化合时具有确定的原子个数比的性质。
H
H
N
H
C
H
H
H
H
化合价的实质
1.在化合物中,元素的化合价由这种元素的原子得到或失去电子的数目决定。如NaCl。
2.有些情况下,不同元素的原子之间相互化合是靠各自提供电子、形成共用电子对来实现的,这种情况下,化合价的数值是形成共用电子对的数目。
原子团:作为一个整体参加反应的原子集团,原子团也叫做根。
注意:①原子团不能单独存在;②带电荷的原子团也是离子。
OH(氢氧根)、NH4(铵根)、CO3(碳酸根)等
根:
离子:
OH-:
NH4+:
NO3-:
CO32-:
SO42-:
PO43-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
磷酸根离子
1.在任何化合物里,正负化合价的代数和为零;
2.在化合物里氢通常显+1价,氧通常显-2价;
3.在金属元素和非金属元素组成的化合物中,金属元素通常显正价,非金属元素通常显负价;
4.单质里元素的化合价为零;
5.许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价,如:FeO,Fe2O3中铁元素的化合价分别为+2和+3。
化合价的有关规律
单质元素全为零,化合物中和为零。
氢一氧二要记住,金正非负记分明。
一价金属钾钠银,二价金属钙镁钡和锌。
一二铜汞二三铁,三铝四硅五价磷。
谈根价,也不难,氢氧根负一铵正一。
酸根所有皆为负,一硝三磷二硫碳。
化合价口诀
离子符号 Na+ Mg2+ Al3+ F- O2-
化合价 Na Mg Al F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法不同:
离子:数字在前,“+”“-”号在后;写在右上角。
化合价:数字在后,“+”“-”号在前;写在正上方。
化合价与离子所带电荷的联系:数字相同,正负号相同。
比较并找规律:离子符号与化合价的比较
根据元素化合价书写化合物的化学式的步骤
写
查
定
标
验
把原子个数标在相应元素符号的右下角,即得化学式
查出所需元素化合价,把化合价标注在元素符号上方
根据化合物中化合价代数和为零,确定原子个数
写出组成该物质的元素符号,正价元素写左边,负价元素写右边
检验各元素正负化合价的代数和是否为零
活动天地
氧化铝的化学式的书写
写
查
定
标
验
元素符号:Al、O;
元素化合价:Al +3,O -2;
原子个数:2个Al原子,3个O原子;
化学式: Al2O3;
化合价的代数和3×2+(-2)×3=0。
三、物质组成的定量表示
相对原子质量(Ar) =
原子的实际质量
碳12原子质量的1/12
相对分子质量(Mr) = 化学式中各原子相对原子质量的总和
化学式反映了组成物质的各元素之间存在的固定的质量关系。
1.计算组成物质的各种元素的质量比。
水(H2O)中元素的质量比
H、O元素的质量比
= (H的相对原子质量×2):(O的相对原子质量×1)
=(1×2):(16×1) =1:8
试一试:计算H2O2、 Cu(OH)2中各元素的质量比。
2.计算物质中某元素的质量分数
试一试:计算SO2中S的质量分数。
水(H2O)中氢元素的质量分数
水中氢元素的质量分数
H的相对原子质量×H的原子个数
H2O的相对分子质量
×100%
=
1×2
18
×100%
=
≈11%
课堂小结
物质组成的表示
化学式
物质组成的定量表示
化合价
概念
意义
简介
书写化学式
质量比
质量分数
课堂练习
1.下列物质的化学式书写不正确的是( )
A.氧化镁 MgO2 B.氧化钠 Na2O
C.硫酸锌 ZnSO4 D.氢氧化铜 Cu(OH)2
2.手机中使用的锂(Li)电池是新型的高能电池,某
种锂电池的总反应可表示为Li + MnO2 === LiMnO2
此反应中锂元素的化合价变化为0→+1,下列对锰
元素的化合价变化判断正确的是( )
A.+4 → +3 B. +2 → +3
C. 0 → +2 D. -4 → -2
A
A
3.治疗手足口病的常用药物是阿昔洛韦(化学式为:C8H11N5O3)。下列有关阿昔洛韦的说法不正确的是( )
A.阿昔洛韦属于有机化合物
B.阿昔洛韦中C、H、N、O三种元素的质量比为8:11:5:3
C.阿昔洛韦的相对分子质量为225
D.该物质的一个分子中含有27个原子
B
4.维生素是人体必备的营养物质,维生素D2的化学式C28H44O。
试计算:
(1)维生素D2的相对分子质量________。
(2)维生素D2中的碳、氢、氧三种元素的质量比____________。
(3)198g维生素D2中含碳元素的质量为______g。
396
84:11:4
168
谢 谢
物质组成的表示
化学式及其意义
化合价
内容提要
1
2
物质组成的定量表示
3
1.知道化学式的意义,能用化学式表示某些物质的组成;
2.记住常见元素的化合价;
3.初步学会根据化合价书写化学式;
4.知道物质组成的定量表示,能计算物质中某元素的质量分数。
学习目标
一、化学式及其意义
化学式:用元素符号和数字组合表示物质组成的式子。
【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个。
如: 氯化钠 NaCl
铜 Cu
二氧化碳 CO2
氯化钠:由Na+、Cl-构成, Na+、Cl-数目比为1:1
由离子构成的物质,可以用化学式表示该物质的构成。
二氧化碳:由CO2分子构成,分子中C、O原子的个数比为1:2。
由分子构成的物质,可以用分子式表示该物质的构成。
由分子构成的物质,把分子式当作该物质的化学式。
铜:由Cu原子构成。
由原子构成的物质,用元素符号表示该物质的化学式。
化学式的意义
化学式
宏观
微观
①表示一种物质
②表示该物质的元素组成
各元素的原子或离子之间的数量关系
思考:化学式“H2O”具有哪些含义?
H2O
表示水这种物质
表示水由氢元素
和氧元素组成
表示1个水分子
表示1个水分子
由2个氢原子和
1个氧原子构成
思考:符号“2H2O”表示什么?
化学式的书写
1.单质化学式的书写
单质种类 书写方式
稀有气体
金属和固态非金属
非金属气体
元素符号表示,如氦写He
元素符号表示,如铁写Fe
在元素符号右下角写上表示分子中所含原子数的数字,如O2
2.化合物化学式的书写
(1)当组成元素个数比为1时,1省略不写;
(2)氧化物:氧在后,其他元素在前。如CO2;
(3)其他两种元素形成的化合物:金属在前,非金属在后。如NaCl、FeCl3等。
化学式的读法
1.由两种元素组成的化合物,应从右到左读,中间用“化”字连接。如氯化钾(KCl)。
2.部分由两种元素组成的化合物,原子的个数在元素的名称之前读出。如二氧化碳(CO2)。
3.含有原子团的化合物,从右到左,中间用“酸”或“化”字连接,不需读出原子团个数。如碳酸钠((Na2CO3)。
二、化合价
化合物中元素有确定的原子个数比。
O
H
H
原子个数比
1:2 1:3 1:4
化学上用“化合价”来体现不同元素的原子相互化合时具有确定的原子个数比的性质。
H
H
N
H
C
H
H
H
H
化合价的实质
1.在化合物中,元素的化合价由这种元素的原子得到或失去电子的数目决定。如NaCl。
2.有些情况下,不同元素的原子之间相互化合是靠各自提供电子、形成共用电子对来实现的,这种情况下,化合价的数值是形成共用电子对的数目。
原子团:作为一个整体参加反应的原子集团,原子团也叫做根。
注意:①原子团不能单独存在;②带电荷的原子团也是离子。
OH(氢氧根)、NH4(铵根)、CO3(碳酸根)等
根:
离子:
OH-:
NH4+:
NO3-:
CO32-:
SO42-:
PO43-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
磷酸根离子
1.在任何化合物里,正负化合价的代数和为零;
2.在化合物里氢通常显+1价,氧通常显-2价;
3.在金属元素和非金属元素组成的化合物中,金属元素通常显正价,非金属元素通常显负价;
4.单质里元素的化合价为零;
5.许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价,如:FeO,Fe2O3中铁元素的化合价分别为+2和+3。
化合价的有关规律
单质元素全为零,化合物中和为零。
氢一氧二要记住,金正非负记分明。
一价金属钾钠银,二价金属钙镁钡和锌。
一二铜汞二三铁,三铝四硅五价磷。
谈根价,也不难,氢氧根负一铵正一。
酸根所有皆为负,一硝三磷二硫碳。
化合价口诀
离子符号 Na+ Mg2+ Al3+ F- O2-
化合价 Na Mg Al F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法不同:
离子:数字在前,“+”“-”号在后;写在右上角。
化合价:数字在后,“+”“-”号在前;写在正上方。
化合价与离子所带电荷的联系:数字相同,正负号相同。
比较并找规律:离子符号与化合价的比较
根据元素化合价书写化合物的化学式的步骤
写
查
定
标
验
把原子个数标在相应元素符号的右下角,即得化学式
查出所需元素化合价,把化合价标注在元素符号上方
根据化合物中化合价代数和为零,确定原子个数
写出组成该物质的元素符号,正价元素写左边,负价元素写右边
检验各元素正负化合价的代数和是否为零
活动天地
氧化铝的化学式的书写
写
查
定
标
验
元素符号:Al、O;
元素化合价:Al +3,O -2;
原子个数:2个Al原子,3个O原子;
化学式: Al2O3;
化合价的代数和3×2+(-2)×3=0。
三、物质组成的定量表示
相对原子质量(Ar) =
原子的实际质量
碳12原子质量的1/12
相对分子质量(Mr) = 化学式中各原子相对原子质量的总和
化学式反映了组成物质的各元素之间存在的固定的质量关系。
1.计算组成物质的各种元素的质量比。
水(H2O)中元素的质量比
H、O元素的质量比
= (H的相对原子质量×2):(O的相对原子质量×1)
=(1×2):(16×1) =1:8
试一试:计算H2O2、 Cu(OH)2中各元素的质量比。
2.计算物质中某元素的质量分数
试一试:计算SO2中S的质量分数。
水(H2O)中氢元素的质量分数
水中氢元素的质量分数
H的相对原子质量×H的原子个数
H2O的相对分子质量
×100%
=
1×2
18
×100%
=
≈11%
课堂小结
物质组成的表示
化学式
物质组成的定量表示
化合价
概念
意义
简介
书写化学式
质量比
质量分数
课堂练习
1.下列物质的化学式书写不正确的是( )
A.氧化镁 MgO2 B.氧化钠 Na2O
C.硫酸锌 ZnSO4 D.氢氧化铜 Cu(OH)2
2.手机中使用的锂(Li)电池是新型的高能电池,某
种锂电池的总反应可表示为Li + MnO2 === LiMnO2
此反应中锂元素的化合价变化为0→+1,下列对锰
元素的化合价变化判断正确的是( )
A.+4 → +3 B. +2 → +3
C. 0 → +2 D. -4 → -2
A
A
3.治疗手足口病的常用药物是阿昔洛韦(化学式为:C8H11N5O3)。下列有关阿昔洛韦的说法不正确的是( )
A.阿昔洛韦属于有机化合物
B.阿昔洛韦中C、H、N、O三种元素的质量比为8:11:5:3
C.阿昔洛韦的相对分子质量为225
D.该物质的一个分子中含有27个原子
B
4.维生素是人体必备的营养物质,维生素D2的化学式C28H44O。
试计算:
(1)维生素D2的相对分子质量________。
(2)维生素D2中的碳、氢、氧三种元素的质量比____________。
(3)198g维生素D2中含碳元素的质量为______g。
396
84:11:4
168
谢 谢
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
