【2021-2022学年】人教版必修1第四章第一节无机非金属材料的主角同步练习(含解析)
文档属性
| 名称 | 【2021-2022学年】人教版必修1第四章第一节无机非金属材料的主角同步练习(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-02 11:57:54 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
必修1第四章第一节无机非金属材料的主角-硅同步练习
第I卷(选择题)
一、单选题
1.2021年5月15日,天问一号探测器成功着陆于火星,在火星上首次留下中国印迹。其中应用了很多化学新材料。下列有关说法不正确的是( )
A.探测器降落伞的材料芳纶(聚酰胺酯)属于高分子合成纤维
B.探测器上太阳能电池板所用的晶体硅与光导纤维成分相同
C.探测器机壳用的SiC增强铝基复合材料重量轻、强度高、刚性好
D.探测器的隔热材料气凝胶(纳米级颗粒构成的充满气体的极轻的固体)属于胶体
2.下列材料中不属于硅酸盐材料的是( )
A.做窗户的普通玻璃
B.浇灌房顶的水泥
C.铺地板的陶瓷瓷砖
D.传输信号的光导纤维
3.中国芯是中国自主研发并生产制造的计算机处理芯片,该芯片中使用的主要材料是( )
A.二氧化硅 B.硅 C.钛铝合金 D.碳化硅
4.雕花玻璃是用下列哪种物质对玻璃进行刻蚀而制成的( )
A.纯碱 B.盐酸 C.烧碱 D.氢氟酸
5.下列物质间的转化不能通过一步反应实现的是( )
A.Na2CO3→NaOH B.Fe→FeCl2 C.NaOH→Fe(OH)3 D.SiO2→H2SiO3
6.化学与生产、生活、科技息息相关,下列叙述错误的是( )
A.华为首款5G手机搭载的智能7nm制程SoC“麒麟980”手机芯片的主要成分是二氧化硅
B.国产飞机C919用到的氮化硅陶瓷是新型无机非金属材料
C.小苏打是面包发酵粉的主要成分之一
D.Na2SiO3可用作黏合剂、木材防火剂的原料,实验室保存NaOH溶液应用橡胶塞
7.下列离子方程式正确的是( )
A.金属钠投入水中:
B.硅酸钠溶液与醋酸溶液混合:
C.向溶液中通入:
D.澄清的石灰水久置后出现白色固体:
8.下列物质中,常温下既能与NaOH溶液反应,又能与盐酸反应的是( )
A.Cu B.Al2O3 C.SiO2 D.Ca(OH)2
9.近年来,我国在无机非金属材料领域的发展受到世界瞩目。下列叙述正确的是( )
A.石墨烯是能导电的新型有机材料
B.氮化硅陶瓷属于传统无机非金属材料
C.陶瓷是以黏土为原料制成的
D.二氧化硅导电性良好
10.我国数千年的文明史给人类留下了无数瑰宝。下列文明的痕迹与硅酸盐有关的是( )
中华文明
瓷器清嘉庆青花赏瓶 青铜器商后母戊鼎 青铜器东汉马踏飞燕 字画唐李白《上阳台帖》
选项 A B C D
11.化学与生活、科技密切相关,下列说法正确的是( )
A.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
B.2020年我国发射的嫦娥5号探月器的太阳能电池板的主要成分是SiO2
C.我国海洋开发走向“深蓝”,“蛟龙号”外壳材料使用的钛合金属于化合物
D.氢氧化钠、氢氧化铝、碳酸钠都是常见的胃酸的中和剂
12.下列离子方程式书写不正确的是( )
A.盛装氢氧化钠溶液的试剂瓶不用玻璃塞的原因:SiO2+2OH-=SiO+H2O
B.氯化铁溶液中通入SO2溶液变为浅绿色:2Fe3++SO2+2H2O=2Fe2+++ 4H+
C.向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++=BaSO4↓
D.少量的Fe粉和稀硝酸反应:Fe+4H++=Fe3++ NO↑+2H2O
13.下列说法不正确的是( )
A.Si与SiO2在常温下都可与NaOH溶液反应
B.C与SiO2之间可以反应制备Si,同时得到CO2
C.Si与SiO2都可以与氢氟酸反应
D.Si→SiO2→H2SiO3不可以通过一步反应实现
14.中华五千年文化博大精深,下列说法错误的是( )
A.“司南之杓(勺),投之于地,其杓指南”,司南中“杓”的主要成分为 Fe3O4
B.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
C.“美人首饰侯王印,尽是沙中浪底来”,“沙中浪底来”指的是金的氧化物
D.“以曾青涂铁,铁赤色如铜”描述的是置换反应
15.二氧化硅与二氧化碳组成相似,结构不同。下列反应原理不同的是( )
A.SiO2+2CSi+2CO↑与NaCl+KKCl+Na
B.SiO2+CaCO3CaSiO3+CO2↑与Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
C.SiO2+2OH-=+H2O与CO2+2OH-=+H2O
D.SiO2+2CSi+2CO↑与SiO2+Na2CO3Na2SiO3+CO2
16.高纯硅广泛应用于信息技术和新能源技术等领域。工业上制备高纯硅的流程如图:( )
下列说法不正确的是( )
A.步骤①、②和③中的反应均为氧化还原反应
B.流程中的H2和HCl可循环利用
C.步骤③中的H2可用焦炭代替
D.由步骤②和③中的反应可知,通过调控反应温度能改变反应进行的方向
17.2021年,我国具有独立知识产权的“龙芯”19岁了。下列对硅单质及其氧化物的有关叙述正确的是( )
A.石英可以用来生产玻璃
B.二氧化硅具有半导体性能,常用于制作光导纤维
C.硅的化学性质不活泼,常温下不与任何物质反应
D.晶体硅是具有金属光泽的灰黑色金属材料
18.某溶液中可能含有OH-、、、、、、Na+、Fe3+、Mg2+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示。下列说法正确的是( )
A.反应最后形成的溶液中的溶质为NaCl
B.原溶液中一定含有的阴离子是:OH-、、、
C.原溶液中一定含有Na2SO4
D.原溶液中含有与的物质的量之比为1∶2
19.现有Fe、Al、Si三种单质的混合物,取一半投入足量的NaOH溶液中,将剩余的一半投入足量的稀硫酸中,若经测量两次实验产生的气体质量相等,则原混合物中Fe、Al、Si三种单质的物质的量之比可能为( )
A.6:4:3 B.1:1:1 C.2:3:4 D.3:7:6
20.有下列变化:①Na2CO3→Na2SiO3,②SiO2→H2SiO3,③Na2SiO3→Na2CO3,④CaO→CaSiO3,其中不能通过一步反应实现的是( )
A.只有① B.②④ C.只有② D.③④
第II卷(非选择题)
二、填空题
21.硅在自然界中主要以二氧化硅和硅酸盐的形式存在。回答下列问题:
(1)Si是良好的半导体材料,试写出硅单质的一种用途:_______。
(2)SiO2是玻璃的主要成分之一,烧碱溶液对玻璃有腐蚀性,写出SiO2与烧碱溶液反应的离子方程式为_______。
(3)Na2SiO3溶液俗称_______,往Na2SiO3溶液中通入足量CO2气体发生的现象是:_______________。
(4)工业上常用焦炭和二氧化硅在高温条件下制备粗硅,该反应的化学方程式为_______________________。
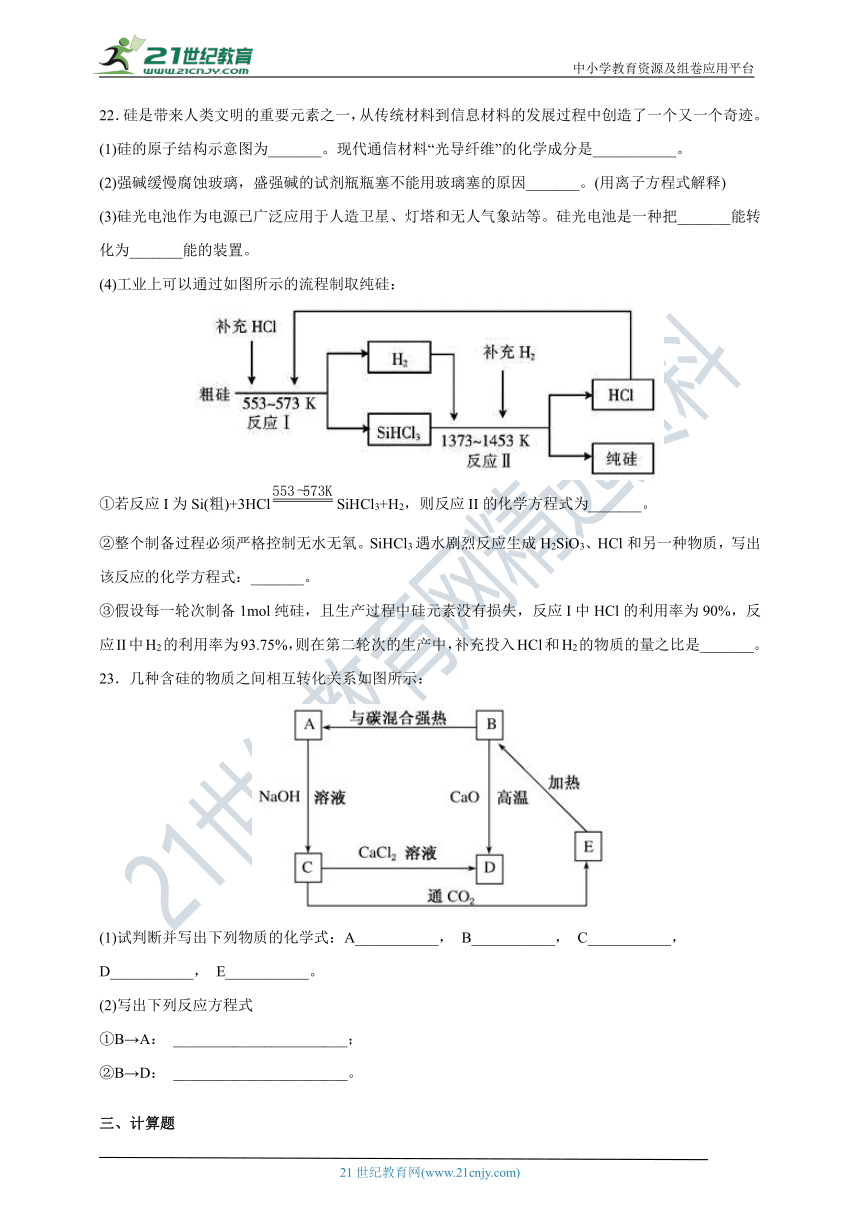
22.硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅的原子结构示意图为_______。现代通信材料“光导纤维”的化学成分是___________。
(2)强碱缓慢腐蚀玻璃,盛强碱的试剂瓶瓶塞不能用玻璃塞的原因_______。(用离子方程式解释)
(3)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等。硅光电池是一种把_______能转化为_______能的装置。
(4)工业上可以通过如图所示的流程制取纯硅:
①若反应I为Si(粗)+3HClSiHCl3+H2,则反应II的化学方程式为_______。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:_______。
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是_______。
23.几种含硅的物质之间相互转化关系如图所示:
(1)试判断并写出下列物质的化学式:A___________, B___________, C___________, D___________, E___________。
(2)写出下列反应方程式
①B→A: _______________________;
②B→D: _______________________。
三、计算题
24.按要求回答问题。
Ⅰ.(1)硅酸盐种类繁多,结构复杂,组成各异,通常用二氧化硅和金属氧化物的组合形式表示其组成,则KAlSi3O8可表示为________________________,Al2Si2O5(OH)4可表示为________________________。
(2)将0.2mol钠和铝的混合物溶于足量的盐酸中,产生3136mL(标准状况下)氢气,则钠和铝的物质的量之比为___________;写出钠与足量盐酸反应的化学方程式__________________________________。
Ⅱ.将3.8 g Na2CO3和NaHCO3的混合物充分加热,混合物质量减少了0.62 g。求:
(1)混合物中NaHCO3的质量___________。
(2)若将等质量的混合物与含有1.46 gHCl的稀盐酸反应,生成气体的的质量为___________。
四、实验题
25.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用过量的碳还原二氧化硅制得粗硅;②粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl=SiHCl3+H2)③SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,已知SiHCl3能与水强烈反应,在空气中易自燃。
请回答:
(1)第一步制取硅的化学方程式___。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃),提纯SiHCl3可采用___的方法。
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):
①装置B中的试剂是________,装置C需水浴加热,目的是______________。
②反应一段时间后,装置D中可观察到有晶体硅生成,装置D不能采用普通玻璃管的原因是___________________________,D中发生的反应的化学方程式是_____________________________。
③为保证实验的成功,操作的关键除题中已告知的之外,你认为最重要的还有:___________________________________,___________________________________。(答出两点)。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是__________________________________________。
a.碘水b.氯水c.NaOH溶液d.KSCN溶液e.Na2SO3溶液.
参考答案
1.B
解析:
A.芳纶是聚酰胺酯,聚酰胺酯属于高分子合成纤维,故A正确;
B.探测器上太阳能电池板所用的晶体硅,光导纤维成分是二氧化硅,两者成份不相同,故B错误;
C.探测器机壳用的SiC增强铝基复合材料重量轻、强度高、刚性好,故C正确;
D.探测器的隔热材料气凝胶(纳米级颗粒构成的充满气体的极轻的固体),符合胶体粒子直径大小且属于混合物,因此该气凝胶属于胶体,故D正确。
综上所述,答案为B。
2.D
解析:
A.硅酸盐材料主要包括:玻璃、水泥、陶瓷,做窗户的普通玻璃属于硅酸盐材料,A不符合;
B.硅酸盐材料主要包括:玻璃、水泥、陶瓷,浇灌房顶的水泥属于硅酸盐材料,B不符合;
C.硅酸盐材料主要包括:玻璃、水泥、陶瓷,铺地板的陶瓷瓷砖属于硅酸盐材料,C不符合;
D. 传输信号的光导纤维的主要成分是SiO2, D符合;
答案选D。
3.B
解析:
硅是常用的半导体材料,计算机处理芯片中使用的主要材料是硅,二氧化硅常用于光导纤维,钛铝合金属于金属材料,碳化硅属于新型无机非金属材料;
答案选B。
4.D
解析:
A.纯碱在高温下和二氧化硅反应生成硅酸钠和二氧化碳,不能用于雕刻玻璃,A不符合;
B.盐酸和二氧化硅不反应,不能用于雕刻玻璃,B不符合;
C.烧碱和二氧化硅反应较慢,不适合雕刻玻璃,C不符合;
D.氢氟酸和二氧化硅反应生成四氟化硅气体和水,能用于雕刻玻璃,D符合;
答案选D。
5.D
解析:
A.Na2CO3和Ba(OH)2反应生成BaCO3和NaOH,能一步实现Na2CO3→NaOH,故A不符合题意;
B.Fe+2HCl=FeCl2+H2↑,能通过一步反应实现Fe→FeCl2,故B不符合题意;
C.NaOH和FeCl3反应生成Fe(OH)3,能通过一步反应实现NaOH→Fe(OH)3,故C不符合题意;
D.二氧化硅是酸性氧化物,但不溶于水,不能通过一步反应实现SiO2→H2SiO3,故D符合题意;故答案选D。
6.A
解析:
A.手机芯片的主要成分是硅,故A错误;
B.氮化硅陶瓷是新型无机非金属材料,故B正确;
C.小苏打是碳酸氢钠,小苏打是面包发酵粉的主要成分之一,故C正确;
D.Na2SiO3可用作黏合剂、木材防火剂的原料,实验室保存NaOH溶液时,防止玻璃塞与NaOH溶液反应生成Na2SiO3而黏住瓶塞,因此用橡胶塞,故D正确。
综上所述,答案为A。
7.D
解析:
A.没有配平,金属钠投入水中:,A错误;
B.醋酸难电离,硅酸钠溶液与醋酸溶液混合:,B错误;
C.碳酸的酸性弱于盐酸,向溶液中通入不反应,C错误;
D.澄清的石灰水久置后出现白色固体,是因为氢氧化钙吸收二氧化碳生成碳酸钙:,D正确;
答案选D。
8.B
解析:
A.Cu是不活泼金属,既不能与NaOH溶液反应,又不能与盐酸,故A错误;
B.Al2O3具有两性,既能与NaOH溶液反应,又能与盐酸,故B正确;
C.SiO2只能与NaOH溶液反应,不能与盐酸,故C错误;
D.Ca(OH)2属于碱,只能与盐酸反应,故D错误;
故答案为B。
9.C
解析:
A.石墨烯无机非金属材料,故A错误;
B.氮化硅陶瓷属于新型无机非金属材料,故B错误;
C.陶瓷是以黏土为原料制成的传统的硅酸盐产品,故C正确;
D.硅可以导电是良好的半导体材料,故D错误;
故答案为C。
10.A
解析:
瓷器与硅酸盐材料相关,青铜鼎、马踏飞燕为青铜材料,纸主要成分为纤维素,与硅酸盐无关。
故选A。
11.A
解析:
A.油性漆中含有有机物,挥发后对人体有伤害,水性漆则不会,A正确;
B.太阳能电池板的主要成分是Si,B错误;
C.钛合金是金属材料,属于混合物,C错误;
D.NaOH是强碱,具有强烈的腐蚀性,Na2CO3溶液碱性较强,不能用作胃酸中和剂,D错误;
故选A。
12.C
解析:
A.盛装氢氧化钠溶液的试剂瓶不用玻璃塞是由于玻璃的主要成分SiO2是酸性氧化物,能够与碱NaOH发生反应产生Na2SiO3、H2O,该反应的离子方程式为:SiO2+2OH-=+H2O,A正确;
B.FeCl3电离产生的Fe3+具有氧化性,会与具有还原性的SO2在溶液中发生氧化还原反应,使棕黄色的Fe3+变为浅绿色的Fe2+,该反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2+++ 4H+,B正确;
C.向(NH4)2SO4溶液中加入适量Ba(OH)2,二者反应产生BaSO4沉淀和弱碱NH3·H2O,该反应的离子方程式为:Ba2++2OH-+2+=BaSO4↓+2NH3·H2O,C错误;
D.少量的Fe粉和稀硝酸反应产生Fe3+、NO、H2O,根据原子守恒、电子守恒、电荷守恒,可得该反应的离子方程式为:Fe+4H++=Fe3++ NO↑+2H2O,D正确;
故合理选项是C。
13.B
解析:
A.硅与氢氧化钠反应生成硅酸钠与氢气、二氧化硅与氢氧化钠反应生成硅酸钠与水,所以Si与SiO2在常温下都可与NaOH溶液反应,故A正确;
B.C与SiO2在高温下反应生成硅与一氧化碳,所以可用C与SiO2之间可以反应制备Si,故B错误;
C.Si与氢氟酸反应生成四氟化硅和氢气,SiO2能与氢氟酸反应SiO2+4HF=SiF4↑+2H2O,所以Si与SiO2都可以与氢氟酸反应,故C正确;
D.硅和氧气反应生成二氧化硅,二氧化硅不溶于水也不与水反应,不能通过一步反应实现,而是二氧化硅先与强碱反应生成硅酸盐,然后与酸反应生成硅酸,故D正确;
故选B。
14.C
解析:
A.四氧化三铁具有磁性,司南中“杓”的主要成分为Fe3O4,故A正确;
B.瓷器属于硅酸盐产品,其主要原料为黏土,故B正确;
C.金性质稳定,可以在自然界中存在,“沙中浪底来”指的是金单质,故C错误;
D.“以曾青涂铁,铁赤色如铜”发生铁置换铜的反应,因此描述的是置换反应,故D正确;
故选C。
15.B
解析:
A.都是高温下同主族元素单质间的置换反应,生成气体使反应趋于完全,原理相同,故A不符合题意;
B.前者是高温下的固体反应,生成的二氧化碳气体使反应趋于完全,后者是溶液中的强酸制弱酸的复分解反应,原理不同,故B符合题意;
C.二者都是酸性氧化物与碱的反应,原理相同,故C不符合题意;
D.前者是氧化还原反应,后者是非氧化还原反应,但本质上两个反应都是高温固相反应,生成气体使反应趋于完全,原理相同,故D不符合题意;
故答案为:B
16.C
解析:
石英砂(主要成分为SiO2),与碳在2000°C条件下反应生成粗硅和一氧化碳,粗硅与氯化氢在300°C条件下反应生成SiHCl3和氢气, SiHCl3与氢气在1100°C条件下反应生成高纯硅和氯化氢,达到制备高纯硅的目的,据此分析解题。
A.①反应方程式为:SiO2+2CSi+2CO↑,②反应方程式为:2Si+6HCl2SiHCl3+3H2,③反应方程式为:SiHCl3+ H2Si+3HCl,均有化合价的变化,A正确;
B.根据流程和节约成本可知,流程中HCl和H2可以循环利用,B正确;
C.步骤③中的H2用焦炭代替会产生杂质,C错误;
D.②反应方程式为:2Si+6HCl2SiHCl3+3H2,③反应方程式为:SiHCl3+ H2Si+3HCl,D正确;
答案选C。
17.A
解析:
A.制取玻璃的原料有石灰石、纯碱、石英,因此石英可以用来生产玻璃,A正确;
B.二氧化硅是非金属性氧化物,不具有半导体性能,但其能够使光线全反射,因此常用于制作光导纤维,B错误;
C.硅的化学性质不活泼,但在常温下能与NaOH溶液、氢氟酸发生反应,C错误;
D.Si是非金属元素,晶体硅是具有金属光泽的灰黑色非金属材料,D错误;
故合理选项是A。
18.B
解析:
由图象分析可知,开始无沉淀生成说明加入的盐酸和溶液中的碱反应,说明溶液中一定含OH-离子,则与氢氧根离子不能共存的Fe3+、Mg2+、Al3+在溶液中不存在;随后反应生成沉淀逐渐增大,说明是、和氢离子反应生成氢氧化铝沉淀和硅酸沉淀;继续加入盐酸沉淀量不变,消耗盐酸的离子只能是离子,反应完后继续加入盐酸,沉淀逐渐减小,至不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定是否存在,但根据溶液的电中性可知,溶液中一定含有Na+离子;
A. 因为溶液中硫酸根不能确定是否存在,则反应后最终溶液中的溶质除了有NaC1,还可能有硫酸钠,故A错误;
B. BC段是碳酸根与盐酸反应,结合分析可知,原溶液中一定含有的阴离子是:OH-、、、,故B正确;
C. 原溶液中一定含有的离子是Na+、OH-、SiO、AlO、CO,可能含有SO,故C错误;
D. 依据图像可知和碳酸根离子反应的盐酸为2体积,反应的离子方程式为+2H+=CO2↑+H2O,氢氧化铝溶解消耗的盐酸体积为4体积,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,则原溶液中含有与的物质的量之比为n():n()=(2×):(4×)=3:4,故D错误;
答案选B。
19.A
解析:
取一半固体投入足量的NaOH溶液中,Al、Si与氢氧化钠反应放出氢气;将剩余的一半投入足量的稀硫酸中,Fe、Al与稀硫酸反应放出氢气,测量两次实验产生的气体质量相等,说明Fe与硫酸反应放出的氢气和Si与氢氧化钠反应放出氢气一样多,根据 、 ,Fe、Si的物质的量比一定为2:1,故A正确。
20.C
解析:
碳酸钠与二氧化硅在高温下反应能生成硅酸钠,②二氧化硅不溶于水,不与水反应,所以不能一步转化为硅酸,至少得两步才能完成这个转化:先与碱性物质反应生成硅酸盐,再与酸反应生成硅酸,③因为碳酸的酸性比硅酸强,所以向硅酸钠溶液中通入少量二氧化碳后可生成碳酸钠和硅酸,④氧化钙是碱性氧化物,可以与酸性氧化物二氧化硅在高温下反应生成硅酸钙。综上所述,只有②不能一步实现,所以选C。
21.
(1)做计算机的芯片或太阳能电池
(2)SiO2+2OH-=SiO+H2O
(3) 水玻璃 有白色不溶物生成
(4)2C+SiO2Si+2CO ↑
解析:
(1)硅原子的质子数为14,原子质子数=核外电子数=14,所以硅的原子示意图为,现代通信材料“光导纤维”的化学成分是SiO2,故答案为:,SiO2;
(2)玻璃的成分之一是SiO2可以与氢氧化钠反应生成具有粘性的硅酸钠和水,其离子方程式为SiO2+2OH- = SiO+H2O,
故答案为:SiO2+2OH- = SiO+H2O;
(3)光电池是一种把光能转化为电能的装置,故答案为:光,电;
(4) ①由流程图可知反应是SiHCl和H2反应生成纯硅和HCl,因此方程式为:SiHCl3+H2Si(纯)+3HCl,故答案为:SiHCl3+H2Si(纯)+3HCl;
②写出方程式中已知物质:SiHCl3+3H2O - H2SiO3+3HCl,由原子守恒可知另一种物质为H2,故方程式为SiHCl3+3H2O = H2SiO3+3HCl+H2↑,故答案为:SiHCl3+3H2O = H2SiO3+3HCl+H2↑;
③据题中条件,结合反应:Si(粗)+3HClSiHCl3+H2,:SiHCl3+H2Si(纯)+3HCl可知,循环生产只能产生3molHCl,但HCl的利用率90%,因此需要增加HCl,循环生产只能产生1mol H2,但H2的利用率为93.75%,因此需要增加H2,所以补充投入HCl和H2的物质的量之比是:=5∶1,故答案为:5∶1。
23.Si SiO2 Na2SiO3 CaSiO3 H2SiO3 SiO2+2CSi+2CO↑ SiO2+CaOCaSiO3
解析:
A、B、C、D、E都含硅的物质,A能和碱反应可能为二氧化硅或硅单质,B能和碳单质反应生成A,所以A为Si,B为SiO2,B能和氧化钙反应生成D为CaSiO3,A和氢氧化钠反应生成C为Na2SiO3,Na2SiO3与氯化钙反应生成硅酸钙,Na2SiO3溶液中通入二氧化碳生成E为H2SiO3,H2SiO3受热分解得二氧化硅,符合各物质转化关系;据此解答。
(1)由上述分析可知,A为Si,B为SiO2,C为Na2SiO3,D为CaSiO3,E为H2SiO3;答案为Si,SiO2,Na2SiO3,CaSiO3,H2SiO3。
(2)①B→A的反应为碳还原二氧化硅得硅,反应的方程式为SiO2+2CSi+2CO↑;答案为SiO2+2CSi+2CO↑。
B→D的反应为二氧化硅与氧化钙在高温条件下得硅酸钙,反应的方程式为SiO2+CaOCaSiO3;答案为SiO2+CaOCaSiO3。
24.K2O Al2O3 6SiO2 Al2O3 2SiO2 2H2O 4:1 2Na +2HCl =2NaCl +H2↑ 1.68 g 0.968 g
解析:
Ⅰ.(1)硅酸盐的化学式可表示为:活泼金属氧化物 金属氧化物 非金属氧化物 水,书写时满足原子守恒;则KAlSi3O8可表示为K2O Al2O3 6SiO2;Al2Si2O5(OH)4可表示为Al2O3 2SiO2 2H2O;
(2)设金属钠有xmol,金属铝有ymol,产生氢气的量为 =0.14mol;物质的量守恒:x+y=0.2,电子得失守恒:x+3y=0.14×2,解之,x=0.16mol,y=0.04mol;所以钠和铝的物质的量之比为4:1;钠与足量盐酸反应生成氯化钠和氢气,化学方程式为:2Na +2HCl =2NaCl +H2↑;
Ⅱ.(1)碳酸氢钠不稳定,受热分解,而碳酸钠较稳定;设混合物中碳酸氢钠有xg,
2NaHCO3= Na2CO3+CO2+H2O 固体质量减小
2×84 62
x 0.62
列方程,求出x=1.68g,既混合物中NaHCO3的质量1.68g,碳酸钠质量为2.12g;
(2)若将等质量的混合物与含有1.46 gHCl的稀盐酸反应,即Na2CO3和NaHCO3各有1.9g,物质的量分别为:=0.018mol,=0.023mol,1.46 gHCl的稀盐酸溶质的量为0.04mol;混合物中加入盐酸先发生Na2CO3+HCl=NaHCO3+NaCl反应,消耗盐酸的量n=0.018mol,剩余盐酸n=0.04-0.018=0.022mol;碳酸钠完全反应后,再发生NaHCO3+HCl=NaCl+CO2+H2O反应,总的n(NaHCO3)=0.018+0.023=0.041mol,已过量,按照盐酸计算二氧化碳的量n=0.022mol,生成气体的的质量为0.022×44=0.968g。
25. 蒸馏 浓硫酸 使SiHCl3气化 温度太高,普通玻璃管易熔化 检查实验装置的气密性 排尽装置中的空气 bd
解析:
(1)第①步制备粗硅的化学反应方程式为,故答案为:;
(2)可以利用沸点的不同提纯SiHCl3,操作为蒸馏,故答案为:蒸馏;
(3)①装置B中的试剂是浓硫酸,装置C需水浴加热,目的是使SiHCl3气化,故答案为:浓硫酸;使SiHCl3气化;
②SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,装置D不能采用普通玻璃管,温度太高,普通玻璃管易熔化,装置D中发生反应的化学方程式为:,故答案为:温度太高,普通玻璃管易熔化;;
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及排尽装置中的空气,故答案为:检查实验装置的气密性或控制好反应温度或排尽装置中的空气(任意两点);
④铁和稀盐酸反应生成亚铁离子,亚铁离子有还原性,被氯水氧化生成铁离子,铁离子遇硫氰化钾溶液变红色,所以可以用氯水和硫氰化钾溶液检验铁的存在,答案选bd,故答案为bd。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
必修1第四章第一节无机非金属材料的主角-硅同步练习
第I卷(选择题)
一、单选题
1.2021年5月15日,天问一号探测器成功着陆于火星,在火星上首次留下中国印迹。其中应用了很多化学新材料。下列有关说法不正确的是( )
A.探测器降落伞的材料芳纶(聚酰胺酯)属于高分子合成纤维
B.探测器上太阳能电池板所用的晶体硅与光导纤维成分相同
C.探测器机壳用的SiC增强铝基复合材料重量轻、强度高、刚性好
D.探测器的隔热材料气凝胶(纳米级颗粒构成的充满气体的极轻的固体)属于胶体
2.下列材料中不属于硅酸盐材料的是( )
A.做窗户的普通玻璃
B.浇灌房顶的水泥
C.铺地板的陶瓷瓷砖
D.传输信号的光导纤维
3.中国芯是中国自主研发并生产制造的计算机处理芯片,该芯片中使用的主要材料是( )
A.二氧化硅 B.硅 C.钛铝合金 D.碳化硅
4.雕花玻璃是用下列哪种物质对玻璃进行刻蚀而制成的( )
A.纯碱 B.盐酸 C.烧碱 D.氢氟酸
5.下列物质间的转化不能通过一步反应实现的是( )
A.Na2CO3→NaOH B.Fe→FeCl2 C.NaOH→Fe(OH)3 D.SiO2→H2SiO3
6.化学与生产、生活、科技息息相关,下列叙述错误的是( )
A.华为首款5G手机搭载的智能7nm制程SoC“麒麟980”手机芯片的主要成分是二氧化硅
B.国产飞机C919用到的氮化硅陶瓷是新型无机非金属材料
C.小苏打是面包发酵粉的主要成分之一
D.Na2SiO3可用作黏合剂、木材防火剂的原料,实验室保存NaOH溶液应用橡胶塞
7.下列离子方程式正确的是( )
A.金属钠投入水中:
B.硅酸钠溶液与醋酸溶液混合:
C.向溶液中通入:
D.澄清的石灰水久置后出现白色固体:
8.下列物质中,常温下既能与NaOH溶液反应,又能与盐酸反应的是( )
A.Cu B.Al2O3 C.SiO2 D.Ca(OH)2
9.近年来,我国在无机非金属材料领域的发展受到世界瞩目。下列叙述正确的是( )
A.石墨烯是能导电的新型有机材料
B.氮化硅陶瓷属于传统无机非金属材料
C.陶瓷是以黏土为原料制成的
D.二氧化硅导电性良好
10.我国数千年的文明史给人类留下了无数瑰宝。下列文明的痕迹与硅酸盐有关的是( )
中华文明
瓷器清嘉庆青花赏瓶 青铜器商后母戊鼎 青铜器东汉马踏飞燕 字画唐李白《上阳台帖》
选项 A B C D
11.化学与生活、科技密切相关,下列说法正确的是( )
A.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
B.2020年我国发射的嫦娥5号探月器的太阳能电池板的主要成分是SiO2
C.我国海洋开发走向“深蓝”,“蛟龙号”外壳材料使用的钛合金属于化合物
D.氢氧化钠、氢氧化铝、碳酸钠都是常见的胃酸的中和剂
12.下列离子方程式书写不正确的是( )
A.盛装氢氧化钠溶液的试剂瓶不用玻璃塞的原因:SiO2+2OH-=SiO+H2O
B.氯化铁溶液中通入SO2溶液变为浅绿色:2Fe3++SO2+2H2O=2Fe2+++ 4H+
C.向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++=BaSO4↓
D.少量的Fe粉和稀硝酸反应:Fe+4H++=Fe3++ NO↑+2H2O
13.下列说法不正确的是( )
A.Si与SiO2在常温下都可与NaOH溶液反应
B.C与SiO2之间可以反应制备Si,同时得到CO2
C.Si与SiO2都可以与氢氟酸反应
D.Si→SiO2→H2SiO3不可以通过一步反应实现
14.中华五千年文化博大精深,下列说法错误的是( )
A.“司南之杓(勺),投之于地,其杓指南”,司南中“杓”的主要成分为 Fe3O4
B.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
C.“美人首饰侯王印,尽是沙中浪底来”,“沙中浪底来”指的是金的氧化物
D.“以曾青涂铁,铁赤色如铜”描述的是置换反应
15.二氧化硅与二氧化碳组成相似,结构不同。下列反应原理不同的是( )
A.SiO2+2CSi+2CO↑与NaCl+KKCl+Na
B.SiO2+CaCO3CaSiO3+CO2↑与Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
C.SiO2+2OH-=+H2O与CO2+2OH-=+H2O
D.SiO2+2CSi+2CO↑与SiO2+Na2CO3Na2SiO3+CO2
16.高纯硅广泛应用于信息技术和新能源技术等领域。工业上制备高纯硅的流程如图:( )
下列说法不正确的是( )
A.步骤①、②和③中的反应均为氧化还原反应
B.流程中的H2和HCl可循环利用
C.步骤③中的H2可用焦炭代替
D.由步骤②和③中的反应可知,通过调控反应温度能改变反应进行的方向
17.2021年,我国具有独立知识产权的“龙芯”19岁了。下列对硅单质及其氧化物的有关叙述正确的是( )
A.石英可以用来生产玻璃
B.二氧化硅具有半导体性能,常用于制作光导纤维
C.硅的化学性质不活泼,常温下不与任何物质反应
D.晶体硅是具有金属光泽的灰黑色金属材料
18.某溶液中可能含有OH-、、、、、、Na+、Fe3+、Mg2+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示。下列说法正确的是( )
A.反应最后形成的溶液中的溶质为NaCl
B.原溶液中一定含有的阴离子是:OH-、、、
C.原溶液中一定含有Na2SO4
D.原溶液中含有与的物质的量之比为1∶2
19.现有Fe、Al、Si三种单质的混合物,取一半投入足量的NaOH溶液中,将剩余的一半投入足量的稀硫酸中,若经测量两次实验产生的气体质量相等,则原混合物中Fe、Al、Si三种单质的物质的量之比可能为( )
A.6:4:3 B.1:1:1 C.2:3:4 D.3:7:6
20.有下列变化:①Na2CO3→Na2SiO3,②SiO2→H2SiO3,③Na2SiO3→Na2CO3,④CaO→CaSiO3,其中不能通过一步反应实现的是( )
A.只有① B.②④ C.只有② D.③④
第II卷(非选择题)
二、填空题
21.硅在自然界中主要以二氧化硅和硅酸盐的形式存在。回答下列问题:
(1)Si是良好的半导体材料,试写出硅单质的一种用途:_______。
(2)SiO2是玻璃的主要成分之一,烧碱溶液对玻璃有腐蚀性,写出SiO2与烧碱溶液反应的离子方程式为_______。
(3)Na2SiO3溶液俗称_______,往Na2SiO3溶液中通入足量CO2气体发生的现象是:_______________。
(4)工业上常用焦炭和二氧化硅在高温条件下制备粗硅,该反应的化学方程式为_______________________。
22.硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅的原子结构示意图为_______。现代通信材料“光导纤维”的化学成分是___________。
(2)强碱缓慢腐蚀玻璃,盛强碱的试剂瓶瓶塞不能用玻璃塞的原因_______。(用离子方程式解释)
(3)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等。硅光电池是一种把_______能转化为_______能的装置。
(4)工业上可以通过如图所示的流程制取纯硅:
①若反应I为Si(粗)+3HClSiHCl3+H2,则反应II的化学方程式为_______。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:_______。
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是_______。
23.几种含硅的物质之间相互转化关系如图所示:
(1)试判断并写出下列物质的化学式:A___________, B___________, C___________, D___________, E___________。
(2)写出下列反应方程式
①B→A: _______________________;
②B→D: _______________________。
三、计算题
24.按要求回答问题。
Ⅰ.(1)硅酸盐种类繁多,结构复杂,组成各异,通常用二氧化硅和金属氧化物的组合形式表示其组成,则KAlSi3O8可表示为________________________,Al2Si2O5(OH)4可表示为________________________。
(2)将0.2mol钠和铝的混合物溶于足量的盐酸中,产生3136mL(标准状况下)氢气,则钠和铝的物质的量之比为___________;写出钠与足量盐酸反应的化学方程式__________________________________。
Ⅱ.将3.8 g Na2CO3和NaHCO3的混合物充分加热,混合物质量减少了0.62 g。求:
(1)混合物中NaHCO3的质量___________。
(2)若将等质量的混合物与含有1.46 gHCl的稀盐酸反应,生成气体的的质量为___________。
四、实验题
25.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用过量的碳还原二氧化硅制得粗硅;②粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl=SiHCl3+H2)③SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,已知SiHCl3能与水强烈反应,在空气中易自燃。
请回答:
(1)第一步制取硅的化学方程式___。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃),提纯SiHCl3可采用___的方法。
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):
①装置B中的试剂是________,装置C需水浴加热,目的是______________。
②反应一段时间后,装置D中可观察到有晶体硅生成,装置D不能采用普通玻璃管的原因是___________________________,D中发生的反应的化学方程式是_____________________________。
③为保证实验的成功,操作的关键除题中已告知的之外,你认为最重要的还有:___________________________________,___________________________________。(答出两点)。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是__________________________________________。
a.碘水b.氯水c.NaOH溶液d.KSCN溶液e.Na2SO3溶液.
参考答案
1.B
解析:
A.芳纶是聚酰胺酯,聚酰胺酯属于高分子合成纤维,故A正确;
B.探测器上太阳能电池板所用的晶体硅,光导纤维成分是二氧化硅,两者成份不相同,故B错误;
C.探测器机壳用的SiC增强铝基复合材料重量轻、强度高、刚性好,故C正确;
D.探测器的隔热材料气凝胶(纳米级颗粒构成的充满气体的极轻的固体),符合胶体粒子直径大小且属于混合物,因此该气凝胶属于胶体,故D正确。
综上所述,答案为B。
2.D
解析:
A.硅酸盐材料主要包括:玻璃、水泥、陶瓷,做窗户的普通玻璃属于硅酸盐材料,A不符合;
B.硅酸盐材料主要包括:玻璃、水泥、陶瓷,浇灌房顶的水泥属于硅酸盐材料,B不符合;
C.硅酸盐材料主要包括:玻璃、水泥、陶瓷,铺地板的陶瓷瓷砖属于硅酸盐材料,C不符合;
D. 传输信号的光导纤维的主要成分是SiO2, D符合;
答案选D。
3.B
解析:
硅是常用的半导体材料,计算机处理芯片中使用的主要材料是硅,二氧化硅常用于光导纤维,钛铝合金属于金属材料,碳化硅属于新型无机非金属材料;
答案选B。
4.D
解析:
A.纯碱在高温下和二氧化硅反应生成硅酸钠和二氧化碳,不能用于雕刻玻璃,A不符合;
B.盐酸和二氧化硅不反应,不能用于雕刻玻璃,B不符合;
C.烧碱和二氧化硅反应较慢,不适合雕刻玻璃,C不符合;
D.氢氟酸和二氧化硅反应生成四氟化硅气体和水,能用于雕刻玻璃,D符合;
答案选D。
5.D
解析:
A.Na2CO3和Ba(OH)2反应生成BaCO3和NaOH,能一步实现Na2CO3→NaOH,故A不符合题意;
B.Fe+2HCl=FeCl2+H2↑,能通过一步反应实现Fe→FeCl2,故B不符合题意;
C.NaOH和FeCl3反应生成Fe(OH)3,能通过一步反应实现NaOH→Fe(OH)3,故C不符合题意;
D.二氧化硅是酸性氧化物,但不溶于水,不能通过一步反应实现SiO2→H2SiO3,故D符合题意;故答案选D。
6.A
解析:
A.手机芯片的主要成分是硅,故A错误;
B.氮化硅陶瓷是新型无机非金属材料,故B正确;
C.小苏打是碳酸氢钠,小苏打是面包发酵粉的主要成分之一,故C正确;
D.Na2SiO3可用作黏合剂、木材防火剂的原料,实验室保存NaOH溶液时,防止玻璃塞与NaOH溶液反应生成Na2SiO3而黏住瓶塞,因此用橡胶塞,故D正确。
综上所述,答案为A。
7.D
解析:
A.没有配平,金属钠投入水中:,A错误;
B.醋酸难电离,硅酸钠溶液与醋酸溶液混合:,B错误;
C.碳酸的酸性弱于盐酸,向溶液中通入不反应,C错误;
D.澄清的石灰水久置后出现白色固体,是因为氢氧化钙吸收二氧化碳生成碳酸钙:,D正确;
答案选D。
8.B
解析:
A.Cu是不活泼金属,既不能与NaOH溶液反应,又不能与盐酸,故A错误;
B.Al2O3具有两性,既能与NaOH溶液反应,又能与盐酸,故B正确;
C.SiO2只能与NaOH溶液反应,不能与盐酸,故C错误;
D.Ca(OH)2属于碱,只能与盐酸反应,故D错误;
故答案为B。
9.C
解析:
A.石墨烯无机非金属材料,故A错误;
B.氮化硅陶瓷属于新型无机非金属材料,故B错误;
C.陶瓷是以黏土为原料制成的传统的硅酸盐产品,故C正确;
D.硅可以导电是良好的半导体材料,故D错误;
故答案为C。
10.A
解析:
瓷器与硅酸盐材料相关,青铜鼎、马踏飞燕为青铜材料,纸主要成分为纤维素,与硅酸盐无关。
故选A。
11.A
解析:
A.油性漆中含有有机物,挥发后对人体有伤害,水性漆则不会,A正确;
B.太阳能电池板的主要成分是Si,B错误;
C.钛合金是金属材料,属于混合物,C错误;
D.NaOH是强碱,具有强烈的腐蚀性,Na2CO3溶液碱性较强,不能用作胃酸中和剂,D错误;
故选A。
12.C
解析:
A.盛装氢氧化钠溶液的试剂瓶不用玻璃塞是由于玻璃的主要成分SiO2是酸性氧化物,能够与碱NaOH发生反应产生Na2SiO3、H2O,该反应的离子方程式为:SiO2+2OH-=+H2O,A正确;
B.FeCl3电离产生的Fe3+具有氧化性,会与具有还原性的SO2在溶液中发生氧化还原反应,使棕黄色的Fe3+变为浅绿色的Fe2+,该反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2+++ 4H+,B正确;
C.向(NH4)2SO4溶液中加入适量Ba(OH)2,二者反应产生BaSO4沉淀和弱碱NH3·H2O,该反应的离子方程式为:Ba2++2OH-+2+=BaSO4↓+2NH3·H2O,C错误;
D.少量的Fe粉和稀硝酸反应产生Fe3+、NO、H2O,根据原子守恒、电子守恒、电荷守恒,可得该反应的离子方程式为:Fe+4H++=Fe3++ NO↑+2H2O,D正确;
故合理选项是C。
13.B
解析:
A.硅与氢氧化钠反应生成硅酸钠与氢气、二氧化硅与氢氧化钠反应生成硅酸钠与水,所以Si与SiO2在常温下都可与NaOH溶液反应,故A正确;
B.C与SiO2在高温下反应生成硅与一氧化碳,所以可用C与SiO2之间可以反应制备Si,故B错误;
C.Si与氢氟酸反应生成四氟化硅和氢气,SiO2能与氢氟酸反应SiO2+4HF=SiF4↑+2H2O,所以Si与SiO2都可以与氢氟酸反应,故C正确;
D.硅和氧气反应生成二氧化硅,二氧化硅不溶于水也不与水反应,不能通过一步反应实现,而是二氧化硅先与强碱反应生成硅酸盐,然后与酸反应生成硅酸,故D正确;
故选B。
14.C
解析:
A.四氧化三铁具有磁性,司南中“杓”的主要成分为Fe3O4,故A正确;
B.瓷器属于硅酸盐产品,其主要原料为黏土,故B正确;
C.金性质稳定,可以在自然界中存在,“沙中浪底来”指的是金单质,故C错误;
D.“以曾青涂铁,铁赤色如铜”发生铁置换铜的反应,因此描述的是置换反应,故D正确;
故选C。
15.B
解析:
A.都是高温下同主族元素单质间的置换反应,生成气体使反应趋于完全,原理相同,故A不符合题意;
B.前者是高温下的固体反应,生成的二氧化碳气体使反应趋于完全,后者是溶液中的强酸制弱酸的复分解反应,原理不同,故B符合题意;
C.二者都是酸性氧化物与碱的反应,原理相同,故C不符合题意;
D.前者是氧化还原反应,后者是非氧化还原反应,但本质上两个反应都是高温固相反应,生成气体使反应趋于完全,原理相同,故D不符合题意;
故答案为:B
16.C
解析:
石英砂(主要成分为SiO2),与碳在2000°C条件下反应生成粗硅和一氧化碳,粗硅与氯化氢在300°C条件下反应生成SiHCl3和氢气, SiHCl3与氢气在1100°C条件下反应生成高纯硅和氯化氢,达到制备高纯硅的目的,据此分析解题。
A.①反应方程式为:SiO2+2CSi+2CO↑,②反应方程式为:2Si+6HCl2SiHCl3+3H2,③反应方程式为:SiHCl3+ H2Si+3HCl,均有化合价的变化,A正确;
B.根据流程和节约成本可知,流程中HCl和H2可以循环利用,B正确;
C.步骤③中的H2用焦炭代替会产生杂质,C错误;
D.②反应方程式为:2Si+6HCl2SiHCl3+3H2,③反应方程式为:SiHCl3+ H2Si+3HCl,D正确;
答案选C。
17.A
解析:
A.制取玻璃的原料有石灰石、纯碱、石英,因此石英可以用来生产玻璃,A正确;
B.二氧化硅是非金属性氧化物,不具有半导体性能,但其能够使光线全反射,因此常用于制作光导纤维,B错误;
C.硅的化学性质不活泼,但在常温下能与NaOH溶液、氢氟酸发生反应,C错误;
D.Si是非金属元素,晶体硅是具有金属光泽的灰黑色非金属材料,D错误;
故合理选项是A。
18.B
解析:
由图象分析可知,开始无沉淀生成说明加入的盐酸和溶液中的碱反应,说明溶液中一定含OH-离子,则与氢氧根离子不能共存的Fe3+、Mg2+、Al3+在溶液中不存在;随后反应生成沉淀逐渐增大,说明是、和氢离子反应生成氢氧化铝沉淀和硅酸沉淀;继续加入盐酸沉淀量不变,消耗盐酸的离子只能是离子,反应完后继续加入盐酸,沉淀逐渐减小,至不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定是否存在,但根据溶液的电中性可知,溶液中一定含有Na+离子;
A. 因为溶液中硫酸根不能确定是否存在,则反应后最终溶液中的溶质除了有NaC1,还可能有硫酸钠,故A错误;
B. BC段是碳酸根与盐酸反应,结合分析可知,原溶液中一定含有的阴离子是:OH-、、、,故B正确;
C. 原溶液中一定含有的离子是Na+、OH-、SiO、AlO、CO,可能含有SO,故C错误;
D. 依据图像可知和碳酸根离子反应的盐酸为2体积,反应的离子方程式为+2H+=CO2↑+H2O,氢氧化铝溶解消耗的盐酸体积为4体积,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,则原溶液中含有与的物质的量之比为n():n()=(2×):(4×)=3:4,故D错误;
答案选B。
19.A
解析:
取一半固体投入足量的NaOH溶液中,Al、Si与氢氧化钠反应放出氢气;将剩余的一半投入足量的稀硫酸中,Fe、Al与稀硫酸反应放出氢气,测量两次实验产生的气体质量相等,说明Fe与硫酸反应放出的氢气和Si与氢氧化钠反应放出氢气一样多,根据 、 ,Fe、Si的物质的量比一定为2:1,故A正确。
20.C
解析:
碳酸钠与二氧化硅在高温下反应能生成硅酸钠,②二氧化硅不溶于水,不与水反应,所以不能一步转化为硅酸,至少得两步才能完成这个转化:先与碱性物质反应生成硅酸盐,再与酸反应生成硅酸,③因为碳酸的酸性比硅酸强,所以向硅酸钠溶液中通入少量二氧化碳后可生成碳酸钠和硅酸,④氧化钙是碱性氧化物,可以与酸性氧化物二氧化硅在高温下反应生成硅酸钙。综上所述,只有②不能一步实现,所以选C。
21.
(1)做计算机的芯片或太阳能电池
(2)SiO2+2OH-=SiO+H2O
(3) 水玻璃 有白色不溶物生成
(4)2C+SiO2Si+2CO ↑
解析:
(1)硅原子的质子数为14,原子质子数=核外电子数=14,所以硅的原子示意图为,现代通信材料“光导纤维”的化学成分是SiO2,故答案为:,SiO2;
(2)玻璃的成分之一是SiO2可以与氢氧化钠反应生成具有粘性的硅酸钠和水,其离子方程式为SiO2+2OH- = SiO+H2O,
故答案为:SiO2+2OH- = SiO+H2O;
(3)光电池是一种把光能转化为电能的装置,故答案为:光,电;
(4) ①由流程图可知反应是SiHCl和H2反应生成纯硅和HCl,因此方程式为:SiHCl3+H2Si(纯)+3HCl,故答案为:SiHCl3+H2Si(纯)+3HCl;
②写出方程式中已知物质:SiHCl3+3H2O - H2SiO3+3HCl,由原子守恒可知另一种物质为H2,故方程式为SiHCl3+3H2O = H2SiO3+3HCl+H2↑,故答案为:SiHCl3+3H2O = H2SiO3+3HCl+H2↑;
③据题中条件,结合反应:Si(粗)+3HClSiHCl3+H2,:SiHCl3+H2Si(纯)+3HCl可知,循环生产只能产生3molHCl,但HCl的利用率90%,因此需要增加HCl,循环生产只能产生1mol H2,但H2的利用率为93.75%,因此需要增加H2,所以补充投入HCl和H2的物质的量之比是:=5∶1,故答案为:5∶1。
23.Si SiO2 Na2SiO3 CaSiO3 H2SiO3 SiO2+2CSi+2CO↑ SiO2+CaOCaSiO3
解析:
A、B、C、D、E都含硅的物质,A能和碱反应可能为二氧化硅或硅单质,B能和碳单质反应生成A,所以A为Si,B为SiO2,B能和氧化钙反应生成D为CaSiO3,A和氢氧化钠反应生成C为Na2SiO3,Na2SiO3与氯化钙反应生成硅酸钙,Na2SiO3溶液中通入二氧化碳生成E为H2SiO3,H2SiO3受热分解得二氧化硅,符合各物质转化关系;据此解答。
(1)由上述分析可知,A为Si,B为SiO2,C为Na2SiO3,D为CaSiO3,E为H2SiO3;答案为Si,SiO2,Na2SiO3,CaSiO3,H2SiO3。
(2)①B→A的反应为碳还原二氧化硅得硅,反应的方程式为SiO2+2CSi+2CO↑;答案为SiO2+2CSi+2CO↑。
B→D的反应为二氧化硅与氧化钙在高温条件下得硅酸钙,反应的方程式为SiO2+CaOCaSiO3;答案为SiO2+CaOCaSiO3。
24.K2O Al2O3 6SiO2 Al2O3 2SiO2 2H2O 4:1 2Na +2HCl =2NaCl +H2↑ 1.68 g 0.968 g
解析:
Ⅰ.(1)硅酸盐的化学式可表示为:活泼金属氧化物 金属氧化物 非金属氧化物 水,书写时满足原子守恒;则KAlSi3O8可表示为K2O Al2O3 6SiO2;Al2Si2O5(OH)4可表示为Al2O3 2SiO2 2H2O;
(2)设金属钠有xmol,金属铝有ymol,产生氢气的量为 =0.14mol;物质的量守恒:x+y=0.2,电子得失守恒:x+3y=0.14×2,解之,x=0.16mol,y=0.04mol;所以钠和铝的物质的量之比为4:1;钠与足量盐酸反应生成氯化钠和氢气,化学方程式为:2Na +2HCl =2NaCl +H2↑;
Ⅱ.(1)碳酸氢钠不稳定,受热分解,而碳酸钠较稳定;设混合物中碳酸氢钠有xg,
2NaHCO3= Na2CO3+CO2+H2O 固体质量减小
2×84 62
x 0.62
列方程,求出x=1.68g,既混合物中NaHCO3的质量1.68g,碳酸钠质量为2.12g;
(2)若将等质量的混合物与含有1.46 gHCl的稀盐酸反应,即Na2CO3和NaHCO3各有1.9g,物质的量分别为:=0.018mol,=0.023mol,1.46 gHCl的稀盐酸溶质的量为0.04mol;混合物中加入盐酸先发生Na2CO3+HCl=NaHCO3+NaCl反应,消耗盐酸的量n=0.018mol,剩余盐酸n=0.04-0.018=0.022mol;碳酸钠完全反应后,再发生NaHCO3+HCl=NaCl+CO2+H2O反应,总的n(NaHCO3)=0.018+0.023=0.041mol,已过量,按照盐酸计算二氧化碳的量n=0.022mol,生成气体的的质量为0.022×44=0.968g。
25. 蒸馏 浓硫酸 使SiHCl3气化 温度太高,普通玻璃管易熔化 检查实验装置的气密性 排尽装置中的空气 bd
解析:
(1)第①步制备粗硅的化学反应方程式为,故答案为:;
(2)可以利用沸点的不同提纯SiHCl3,操作为蒸馏,故答案为:蒸馏;
(3)①装置B中的试剂是浓硫酸,装置C需水浴加热,目的是使SiHCl3气化,故答案为:浓硫酸;使SiHCl3气化;
②SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,装置D不能采用普通玻璃管,温度太高,普通玻璃管易熔化,装置D中发生反应的化学方程式为:,故答案为:温度太高,普通玻璃管易熔化;;
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及排尽装置中的空气,故答案为:检查实验装置的气密性或控制好反应温度或排尽装置中的空气(任意两点);
④铁和稀盐酸反应生成亚铁离子,亚铁离子有还原性,被氯水氧化生成铁离子,铁离子遇硫氰化钾溶液变红色,所以可以用氯水和硫氰化钾溶液检验铁的存在,答案选bd,故答案为bd。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
