【化学】:专题4 第二单元 第3课时 硝酸的性质(苏教版必修1)
文档属性
| 名称 | 【化学】:专题4 第二单元 第3课时 硝酸的性质(苏教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-08 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
第3课时 硝酸的性质
1、掌握硝酸的物理性质和化学性质;掌握硝酸制法的反应原理,并了解主要生产过程。
2、培养学生观察、动手实验、分析和解决问题、演绎推理和自学能力。
3、激发学生学习化学的兴趣,培养学生严肃认真、实事求是的实验习惯和科学态度。
氮肥
硝化纤维塑料
染 料
硝酸的用途
打开一瓶浓硝酸的瓶盖,闻其气味,观察其挥发现象。
[归纳]
硝酸是无色、有刺激气味的液体,易溶于水,沸点低(83℃),易挥发。常用硝酸密度为 1.503g/cm3, 浓度为69%,15.6mol/L。
硝酸的物理性质
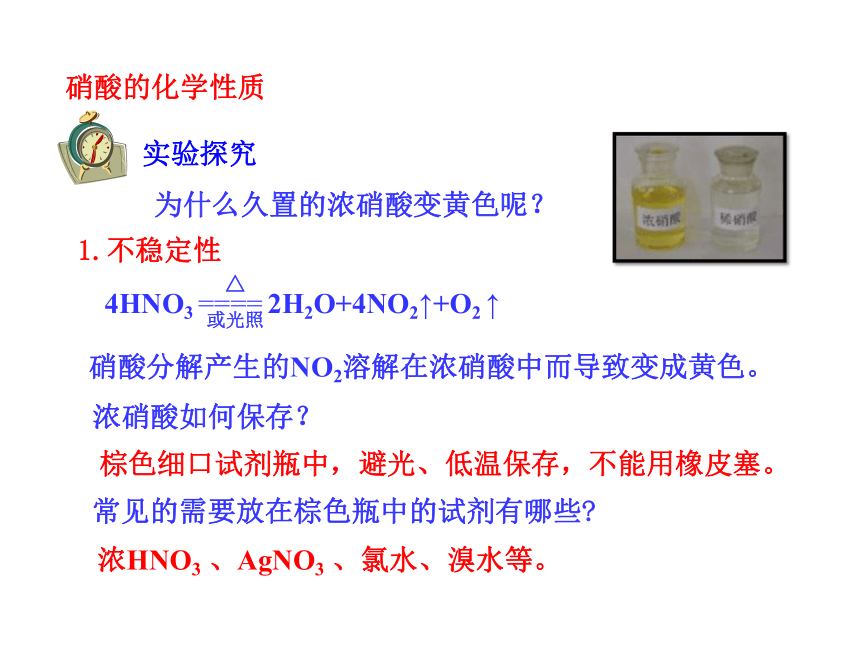
实验探究
为什么久置的浓硝酸变黄色呢?
1.不稳定性
4HNO3 ==== 2H2O+4NO2↑+O2 ↑
△
或光照
硝酸分解产生的NO2溶解在浓硝酸中而导致变成黄色。
浓硝酸如何保存?
棕色细口试剂瓶中,避光、低温保存,不能用橡皮塞。
常见的需要放在棕色瓶中的试剂有哪些
浓HNO3 、AgNO3 、氯水、溴水等。
硝酸的化学性质
2.强氧化性
a.与金属反应
实验探究
现象:
铜片溶解,常温下反应剧烈;
有红棕色的气体产生;
溶液变蓝。
结论:
Cu+4HNO3(浓) ==== Cu(NO3)2+2NO2↑+2H2O
实验探究
反应缓慢,铜片溶解;
有无色的气体产生,气体接触空气时立即变成红棕色;
溶液由无色变为蓝色。
现象:
结论:
3Cu+8HNO3(稀) ==== 3Cu(NO3)2+2NO↑+4H2O
3Cu+8H+ + 2NO3 - ==== 3Cu2++2NO↑+4H2O
Fe+HNO3(浓) 常温时生成致密的氧化膜(钝化)
Al+HNO3(浓) 常温时生成致密的氧化膜(钝化)
应用:钝化使金属的化学活动性大大降低,耐腐蚀性大大增强。因此在常温下可以用铝槽车装运浓硝酸和浓硫酸。
[归纳]
①几乎和所有金属(除金、铂等少数金属外)
②铁、铝遇冷浓HNO3发生钝化。
③Cu等较不活泼的金属与浓硝酸反应得到NO2,与稀HNO3反应得NO,可以以此反应制NO2和NO气体。
④与金属反应硝酸既起氧化剂的作用,又起酸的作用。
⑤与任何金属反应均不生成H2,说明呈现氧化性的不是H+而是HNO3,但由于H+的量决定HNO3的量,所以硝酸发生化学反应时要特别关注H+的浓度
⑥Mg、Zn、Fe等较活泼的金属与稀HNO3反应根据稀HNO3的浓度不同可得NO、N2O、 N2、NH4NO3等不同产物。
⑦硝酸与变价金属(如Fe)反应,根据硝酸的量的多少分别得到低价、高价或两种价态共存的混合物。
b.与某些非金属的反应
C + HNO3(浓)==== CO2↑+ NO2↑+ H2O
化合价升高 4
化合价降低 1×4
0
+5
+4
+4
4
4
2
[归纳]
B
C
P
S
I2
+ HNO3(浓)
H3BO3
CO2
H3PO4
H2SO4
HIO3
+ NO2
+ HNO3(稀)
+ NO
c.与还原性化合物的反应
如与含S2- 、SO32- 、Fe2+ 、I﹣等的化合物反应。
3FeO + 10HNO3(稀)==== 3Fe(NO3)3 + NO↑ + 5H2O
3H2S + 2HNO3(稀) ==== 3S↓ + 2NO↑ + 4H2O
3FeO + 12HNO3(浓)==== 3Fe(NO3)3 + 3NO2↑ + 6H2O
3H2S + 6HNO3(浓) ==== 3S↓ + 6NO2↑ + 6H2O
浓HNO3和浓HCl(体积比1:3)混合物,能
使一些不溶于硝酸的金属如Au、Pt等溶解。
玻尔是丹麦著名的物理学家,曾获得诺贝尔
奖。二战中,玻尔被迫离开将要被德国占领的祖国。为了表示重返祖国的决心,他将诺贝尔金质奖章溶解在王水里,装于玻璃瓶中,然后将它放在柜面上。后来,纳粹分子窜进玻尔的住宅,那瓶溶有奖章的溶液就在敌人的眼皮底下。战争结束后,玻尔又从溶液中还原提取出金,并重新铸成奖章。新铸成的奖章显得更加灿烂夺目,因为它凝聚着玻尔对祖国无限的热爱和无穷智慧。
王 水
3.酸的通性
a.与指示剂作用
稀硝酸与石蕊试液,变红,加热不褪色,浓硝酸与石蕊试液,变红,加热褪色
b.与活泼金属反应不产生H2。
c.与碱和碱性氧化物反应:比较与CuO、FeO(会被氧化)的反应。
d.与盐反应:比较与Na2CO3、Na2SO3(会被氧化)的反应
跟铜反应 常温时,跟铁、铝反应 跟碳反应 跟铂、金反应
条件 还原产物
稀硫酸 \ \ 置换出H2 不反应 \
浓硫酸 加热 SO2 钝化 加热反应 \
稀硝酸 \ NO 还原为NO 不反应 \
浓硝酸 \ NO2 钝化 加热反应 \
硫酸和硝酸的氧化性规律
能与多数金属单质反应,一般放出NO。
能与多数金属和非金属单质反应,一般放出NO2。
与金属活动性处于H之前的金属反应,置换出H2。
加热下能与多数金属和非金属单质反应,放出SO2。
(1)氨在催化剂的作用下与氧气发生反应,生成一氧化氮:
工业上制备硝酸的过程如下,试写出各步反应的化学方程式:
2NO + O2 ==== 2NO2
3NO2 + H2O ==== 2HNO3 + NO
4NH3 + 5O2 ==== 4NO + 6H2O
催化剂
(2)一氧化氮进一步被氧气氧化成二氧化氮:
(3)用水吸收二氧化氮生成硝酸:
3.硝酸的工业制备
1、某溶液能与Al作用产生H2,则该溶液可能大量共存
的离子组合是( )
A、Na+ 、NO3- 、Fe2+ 、K+
B、Cl- 、Na+ 、Fe2+ 、K+
C、K+ 、I- 、NO3- 、H+
D、NO3- 、 Na+ 、NH4+ 、HCO3-
B
2、制等质量的Cu(NO3)2,消耗HNO3最少的是( )
A、Cu和浓HNO3反应
B、Cu和稀HNO3反应
C、Cu2O和浓HNO3反应
D、Cu2(OH)2CO3和稀HNO3 反应
D
3、将铜粉放入稀H2SO4中,加热无明显现象发生,当加入
下列一种物质后,铜粉的质量减少,溶液呈蓝色,同时
有气体逸出,该物质是( )
A、Fe2(SO4)3 B、Na2SO4 C、KNO3 D、FeSO4
C
4、工业上拟用Cu与适量的硝酸来制备Cu(NO3)2 ,下面是三位同学提出的三个方案:
请问:那一种方案最好 为什么
甲:铜
浓硝酸
乙: 铜
稀硝酸
丙: 铜
空气
△
硝酸
Cu(NO3)2
Cu(NO3)2
Cu(NO3)2
CuO
丙,硝酸的利用率最高,且不会产生氮氧化物之类的污染性气体。
5、足量的Cu中加入少量的浓硝酸,可能会发生什么反应
一开始是铜与浓硝酸反应:
Cu + 4HNO3(浓) ==== Cu(NO3)2 + 2NO2↑ + 2H2O
随着反应进行, 硝酸由浓变稀,则发生:
3Cu+8HNO3(稀) ====3Cu(NO3)2+2NO↑+4H2O
硝酸的化学性质
不稳定性
酸的通性
硝酸的物理性质
强氧化性
硝酸的用途
硫酸与硝酸的氧化性规律
硝酸的工业制法
与金属的反应
与非金属的反应
与还原性化合物的反应
第3课时 硝酸的性质
1、掌握硝酸的物理性质和化学性质;掌握硝酸制法的反应原理,并了解主要生产过程。
2、培养学生观察、动手实验、分析和解决问题、演绎推理和自学能力。
3、激发学生学习化学的兴趣,培养学生严肃认真、实事求是的实验习惯和科学态度。
氮肥
硝化纤维塑料
染 料
硝酸的用途
打开一瓶浓硝酸的瓶盖,闻其气味,观察其挥发现象。
[归纳]
硝酸是无色、有刺激气味的液体,易溶于水,沸点低(83℃),易挥发。常用硝酸密度为 1.503g/cm3, 浓度为69%,15.6mol/L。
硝酸的物理性质
实验探究
为什么久置的浓硝酸变黄色呢?
1.不稳定性
4HNO3 ==== 2H2O+4NO2↑+O2 ↑
△
或光照
硝酸分解产生的NO2溶解在浓硝酸中而导致变成黄色。
浓硝酸如何保存?
棕色细口试剂瓶中,避光、低温保存,不能用橡皮塞。
常见的需要放在棕色瓶中的试剂有哪些
浓HNO3 、AgNO3 、氯水、溴水等。
硝酸的化学性质
2.强氧化性
a.与金属反应
实验探究
现象:
铜片溶解,常温下反应剧烈;
有红棕色的气体产生;
溶液变蓝。
结论:
Cu+4HNO3(浓) ==== Cu(NO3)2+2NO2↑+2H2O
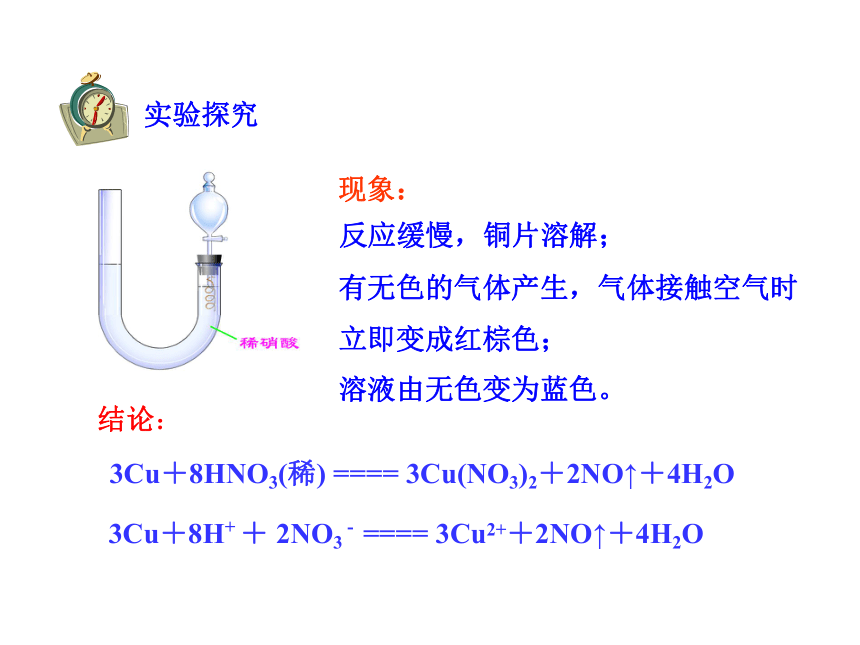
实验探究
反应缓慢,铜片溶解;
有无色的气体产生,气体接触空气时立即变成红棕色;
溶液由无色变为蓝色。
现象:
结论:
3Cu+8HNO3(稀) ==== 3Cu(NO3)2+2NO↑+4H2O
3Cu+8H+ + 2NO3 - ==== 3Cu2++2NO↑+4H2O
Fe+HNO3(浓) 常温时生成致密的氧化膜(钝化)
Al+HNO3(浓) 常温时生成致密的氧化膜(钝化)
应用:钝化使金属的化学活动性大大降低,耐腐蚀性大大增强。因此在常温下可以用铝槽车装运浓硝酸和浓硫酸。
[归纳]
①几乎和所有金属(除金、铂等少数金属外)
②铁、铝遇冷浓HNO3发生钝化。
③Cu等较不活泼的金属与浓硝酸反应得到NO2,与稀HNO3反应得NO,可以以此反应制NO2和NO气体。
④与金属反应硝酸既起氧化剂的作用,又起酸的作用。
⑤与任何金属反应均不生成H2,说明呈现氧化性的不是H+而是HNO3,但由于H+的量决定HNO3的量,所以硝酸发生化学反应时要特别关注H+的浓度
⑥Mg、Zn、Fe等较活泼的金属与稀HNO3反应根据稀HNO3的浓度不同可得NO、N2O、 N2、NH4NO3等不同产物。
⑦硝酸与变价金属(如Fe)反应,根据硝酸的量的多少分别得到低价、高价或两种价态共存的混合物。
b.与某些非金属的反应
C + HNO3(浓)==== CO2↑+ NO2↑+ H2O
化合价升高 4
化合价降低 1×4
0
+5
+4
+4
4
4
2
[归纳]
B
C
P
S
I2
+ HNO3(浓)
H3BO3
CO2
H3PO4
H2SO4
HIO3
+ NO2
+ HNO3(稀)
+ NO
c.与还原性化合物的反应
如与含S2- 、SO32- 、Fe2+ 、I﹣等的化合物反应。
3FeO + 10HNO3(稀)==== 3Fe(NO3)3 + NO↑ + 5H2O
3H2S + 2HNO3(稀) ==== 3S↓ + 2NO↑ + 4H2O
3FeO + 12HNO3(浓)==== 3Fe(NO3)3 + 3NO2↑ + 6H2O
3H2S + 6HNO3(浓) ==== 3S↓ + 6NO2↑ + 6H2O
浓HNO3和浓HCl(体积比1:3)混合物,能
使一些不溶于硝酸的金属如Au、Pt等溶解。
玻尔是丹麦著名的物理学家,曾获得诺贝尔
奖。二战中,玻尔被迫离开将要被德国占领的祖国。为了表示重返祖国的决心,他将诺贝尔金质奖章溶解在王水里,装于玻璃瓶中,然后将它放在柜面上。后来,纳粹分子窜进玻尔的住宅,那瓶溶有奖章的溶液就在敌人的眼皮底下。战争结束后,玻尔又从溶液中还原提取出金,并重新铸成奖章。新铸成的奖章显得更加灿烂夺目,因为它凝聚着玻尔对祖国无限的热爱和无穷智慧。
王 水
3.酸的通性
a.与指示剂作用
稀硝酸与石蕊试液,变红,加热不褪色,浓硝酸与石蕊试液,变红,加热褪色
b.与活泼金属反应不产生H2。
c.与碱和碱性氧化物反应:比较与CuO、FeO(会被氧化)的反应。
d.与盐反应:比较与Na2CO3、Na2SO3(会被氧化)的反应
跟铜反应 常温时,跟铁、铝反应 跟碳反应 跟铂、金反应
条件 还原产物
稀硫酸 \ \ 置换出H2 不反应 \
浓硫酸 加热 SO2 钝化 加热反应 \
稀硝酸 \ NO 还原为NO 不反应 \
浓硝酸 \ NO2 钝化 加热反应 \
硫酸和硝酸的氧化性规律
能与多数金属单质反应,一般放出NO。
能与多数金属和非金属单质反应,一般放出NO2。
与金属活动性处于H之前的金属反应,置换出H2。
加热下能与多数金属和非金属单质反应,放出SO2。
(1)氨在催化剂的作用下与氧气发生反应,生成一氧化氮:
工业上制备硝酸的过程如下,试写出各步反应的化学方程式:
2NO + O2 ==== 2NO2
3NO2 + H2O ==== 2HNO3 + NO
4NH3 + 5O2 ==== 4NO + 6H2O
催化剂
(2)一氧化氮进一步被氧气氧化成二氧化氮:
(3)用水吸收二氧化氮生成硝酸:
3.硝酸的工业制备
1、某溶液能与Al作用产生H2,则该溶液可能大量共存
的离子组合是( )
A、Na+ 、NO3- 、Fe2+ 、K+
B、Cl- 、Na+ 、Fe2+ 、K+
C、K+ 、I- 、NO3- 、H+
D、NO3- 、 Na+ 、NH4+ 、HCO3-
B
2、制等质量的Cu(NO3)2,消耗HNO3最少的是( )
A、Cu和浓HNO3反应
B、Cu和稀HNO3反应
C、Cu2O和浓HNO3反应
D、Cu2(OH)2CO3和稀HNO3 反应
D
3、将铜粉放入稀H2SO4中,加热无明显现象发生,当加入
下列一种物质后,铜粉的质量减少,溶液呈蓝色,同时
有气体逸出,该物质是( )
A、Fe2(SO4)3 B、Na2SO4 C、KNO3 D、FeSO4
C
4、工业上拟用Cu与适量的硝酸来制备Cu(NO3)2 ,下面是三位同学提出的三个方案:
请问:那一种方案最好 为什么
甲:铜
浓硝酸
乙: 铜
稀硝酸
丙: 铜
空气
△
硝酸
Cu(NO3)2
Cu(NO3)2
Cu(NO3)2
CuO
丙,硝酸的利用率最高,且不会产生氮氧化物之类的污染性气体。
5、足量的Cu中加入少量的浓硝酸,可能会发生什么反应
一开始是铜与浓硝酸反应:
Cu + 4HNO3(浓) ==== Cu(NO3)2 + 2NO2↑ + 2H2O
随着反应进行, 硝酸由浓变稀,则发生:
3Cu+8HNO3(稀) ====3Cu(NO3)2+2NO↑+4H2O
硝酸的化学性质
不稳定性
酸的通性
硝酸的物理性质
强氧化性
硝酸的用途
硫酸与硝酸的氧化性规律
硝酸的工业制法
与金属的反应
与非金属的反应
与还原性化合物的反应
