【化学】:专题2 第一单元第2课时 氧化还原反应(苏教版必修1)
文档属性
| 名称 | 【化学】:专题2 第一单元第2课时 氧化还原反应(苏教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-08 00:00:00 | ||
图片预览








文档简介
(共30张PPT)
第2课时 氧化还原反应
1.今有下列三组物质,每组中都有一种物质跟其他三种属于不同的种类。将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内。三组物质分别为:
(1)O2、F2、S、N2
(2)Fe、Na、Al、Si
(3)NO、CO2、SO2、P2O5
组别 被选出的物质 挑选依据
第(1)组
第(2)组
第(3)组
S
Si
P2O5
通常情况下,S是固体,其余均为气体。
只有Si是非金属单质,其余是金属单质。
均为非金属氧化物,但P2O5为固体,其余的通常情况下为气体。
2、同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)生石灰可做干燥剂的理由是什么?(用化学方程式表示)
化合物、金属氧化物、固态物质等
CaO + H2O ==== Ca(OH)2
(3)生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。
(4)小纸袋中的物质能否长期持续的做干燥剂?为什么?
与酸的反应:CaO + 2HCl ==== CaCl2 + H2O;
与酸性氧化物反应:CaO + CO2 ==== CaCO3
不能,因为生石灰全部变为Ca(OH)2后,就不能持续起到干燥作用。
(5)在你所认识的化学物质中,还有哪些可以用作干燥剂?列举一例。
浓硫酸、无水CaCl2、P2O5 、碱石灰等
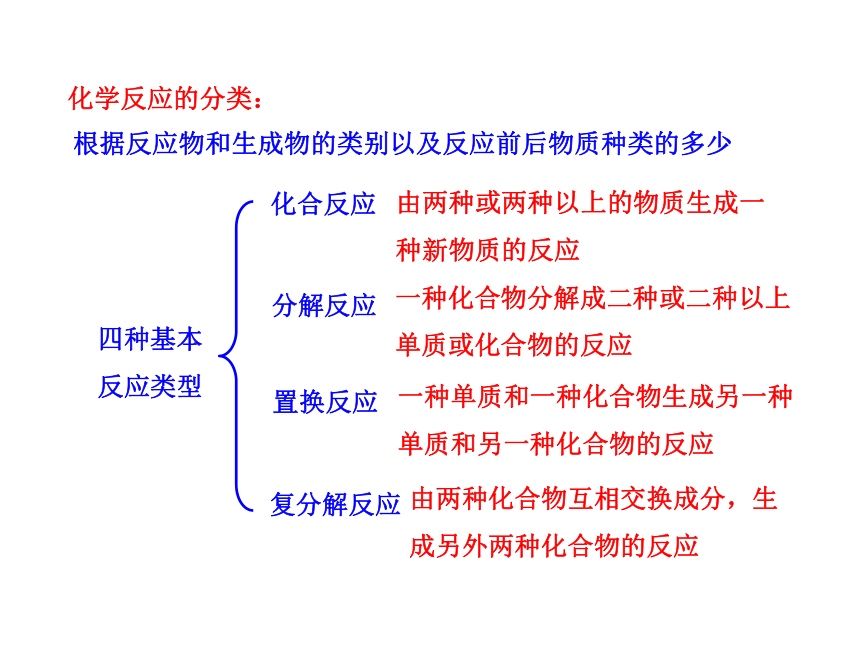
化学反应的分类:
根据反应物和生成物的类别以及反应前后物质种类的多少
四种基本反应类型
化合反应
分解反应
置换反应
复分解反应
由两种或两种以上的物质生成一种新物质的反应
一种化合物分解成二种或二种以上单质或化合物的反应
一种单质和一种化合物生成另一种单质和另一种化合物的反应
由两种化合物互相交换成分,生成另外两种化合物的反应
请同学们根据要求写出相应的化学方程式
化合反应
单质+单质→
→单质+化合物
化合物+化合物→
分解反应
→单质+单质
单质+化合物→
→化合物+化合物
置换反应
非金属→金属
金属→金属
金属→非金属
非金属→非金属
复分解反应
酸+碱
酸+盐
碱+盐
盐+盐
酸+碱性氧化物
碱+酸性氧化物
根据有无化合价的变化
氧化还原反应
非氧化还原反应
一、氧化还原反应的判断
1、定义
有元素化合价变化的反应称为氧化还原反应。
2、判断方法
观察反应前后元素的化合价是否发生改变。
常见元素及原子团的化合价:
+1:H、Li、Na、K、Ag、NH4+
+2:Ca、Mg、Zn、Ba
+3:Al +4:Si +5:P
-1:F、Cl、Br、I、NO3- 、OH-
-2:O、SO42-、CO32-、SO32-
-3:PO43-
Fe: +2 +3 Cu:+2 +1 C: +2 +4
S:-2 +4 6 N:-3 +1 +2 +3 +4 +5
标出下列物质中指定元素的化合价:
CO CO2 CaCO3 CH4 NaHCO3
NH3 N2O NO NO2 HNO2 NH4NO3
FeCl3 Ca(ClO)2 KClO3 HClO4
H2O H2O2
H2S SO2 SO3 FeSO4
PCl3 P2O5 PH3
MnCl2 MnO2 K2MnO4 KMnO4
[练习]判断下列反应是否属于氧化还原反应:
[结论]有单质参加的化合反应属于氧化还原反应。
[结论]有单质参加的分解反应属于氧化还原反应。
↑
[结论]所有置换反应均属于氧化还原反应。
[结论]所有复分解反应均属于非氧化还原反应。
氧化还原反应和四大基本反应类型的关系
氧化还原反应
置 换
化 合
分 解
复分解
二、氧化还原反应的相关概念
1、氧化剂
在氧化还原反应中,化合价降低的反应物。
2、还原剂
在氧化还原反应中,化合价升高的反应物。
3、氧化产物
在氧化还原反应中,还原剂对应的生成物。
4、还原产物
在氧化还原反应中,氧化剂对应的生成物。
举例
Cu+4HNO3====Cu(NO3)2+2NO2↑+2H2O
0
+5
+2
+4
还原剂
氧化剂
氧化产物
还原产物
练习:判断下列反应是否属于氧化还原反应,如果是,请指出氧化剂、还原剂、氧化产物和还原产物。
练习:判断下列反应是否属于氧化还原反应,如果是,请指出氧化剂、还原剂、氧化产物和还原产物。
CO2+H2O====H2CO3 ( )
H2+Cl2====2HCl ( )
Cu2(OH)2CO3====2CuO+CO2↑+H2O ( )
2AgNO3====2Ag+2NO2↑+O2↑ ( )
光照
△
△
×
√
×
√
【练习1】下列描述正确的是( )
A、氧化还原反应是既得氧又失氧的反应
B、判断一个反应是否为氧化还原反应的依据是是否有化合价的升降
C、氧化和还原是独立存在的,一个反应是氧化反应,就不可能是还原反应。
D、氧化和还原是同时存在的,发生氧化反应的同时必然会发生还原反应。
B、D
①2H2 + O2 ==== 2H2O
②Zn + H2SO4 ==== ZnSO4 +H2↑
③2HgO ==== 2Hg + O2↑
④H2O2 + SO2 ==== H2SO4
⑤C + CO2 ==== 2CO
⑥BaCl2 + H2SO4 ==== BaSO4↓+2HCl
⑦2KClO3 ==== 2KCl + 3O2↑
⑧NH4NO3 ==== N2O↑ + 2H2O
⑨CaCO3 ==== CaO + CO2↑
⑩CaO + H2O ====Ca(OH)2
点燃
高温
MnO2
△
高温
【练习2】
上述反应中属于化合反应的:
分解反应的:
置换反应的:
复分解反应的:
氧化还原反应的:
非氧化还原反应的:
①④⑤⑩
③⑦⑧⑨
②
⑥
①②③④⑤⑦⑧
⑥⑨⑩
第2课时 氧化还原反应
1.今有下列三组物质,每组中都有一种物质跟其他三种属于不同的种类。将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内。三组物质分别为:
(1)O2、F2、S、N2
(2)Fe、Na、Al、Si
(3)NO、CO2、SO2、P2O5
组别 被选出的物质 挑选依据
第(1)组
第(2)组
第(3)组
S
Si
P2O5
通常情况下,S是固体,其余均为气体。
只有Si是非金属单质,其余是金属单质。
均为非金属氧化物,但P2O5为固体,其余的通常情况下为气体。
2、同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)生石灰可做干燥剂的理由是什么?(用化学方程式表示)
化合物、金属氧化物、固态物质等
CaO + H2O ==== Ca(OH)2
(3)生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。
(4)小纸袋中的物质能否长期持续的做干燥剂?为什么?
与酸的反应:CaO + 2HCl ==== CaCl2 + H2O;
与酸性氧化物反应:CaO + CO2 ==== CaCO3
不能,因为生石灰全部变为Ca(OH)2后,就不能持续起到干燥作用。
(5)在你所认识的化学物质中,还有哪些可以用作干燥剂?列举一例。
浓硫酸、无水CaCl2、P2O5 、碱石灰等
化学反应的分类:
根据反应物和生成物的类别以及反应前后物质种类的多少
四种基本反应类型
化合反应
分解反应
置换反应
复分解反应
由两种或两种以上的物质生成一种新物质的反应
一种化合物分解成二种或二种以上单质或化合物的反应
一种单质和一种化合物生成另一种单质和另一种化合物的反应
由两种化合物互相交换成分,生成另外两种化合物的反应
请同学们根据要求写出相应的化学方程式
化合反应
单质+单质→
→单质+化合物
化合物+化合物→
分解反应
→单质+单质
单质+化合物→
→化合物+化合物
置换反应
非金属→金属
金属→金属
金属→非金属
非金属→非金属
复分解反应
酸+碱
酸+盐
碱+盐
盐+盐
酸+碱性氧化物
碱+酸性氧化物
根据有无化合价的变化
氧化还原反应
非氧化还原反应
一、氧化还原反应的判断
1、定义
有元素化合价变化的反应称为氧化还原反应。
2、判断方法
观察反应前后元素的化合价是否发生改变。
常见元素及原子团的化合价:
+1:H、Li、Na、K、Ag、NH4+
+2:Ca、Mg、Zn、Ba
+3:Al +4:Si +5:P
-1:F、Cl、Br、I、NO3- 、OH-
-2:O、SO42-、CO32-、SO32-
-3:PO43-
Fe: +2 +3 Cu:+2 +1 C: +2 +4
S:-2 +4 6 N:-3 +1 +2 +3 +4 +5
标出下列物质中指定元素的化合价:
CO CO2 CaCO3 CH4 NaHCO3
NH3 N2O NO NO2 HNO2 NH4NO3
FeCl3 Ca(ClO)2 KClO3 HClO4
H2O H2O2
H2S SO2 SO3 FeSO4
PCl3 P2O5 PH3
MnCl2 MnO2 K2MnO4 KMnO4
[练习]判断下列反应是否属于氧化还原反应:
[结论]有单质参加的化合反应属于氧化还原反应。
[结论]有单质参加的分解反应属于氧化还原反应。
↑
[结论]所有置换反应均属于氧化还原反应。
[结论]所有复分解反应均属于非氧化还原反应。
氧化还原反应和四大基本反应类型的关系
氧化还原反应
置 换
化 合
分 解
复分解
二、氧化还原反应的相关概念
1、氧化剂
在氧化还原反应中,化合价降低的反应物。
2、还原剂
在氧化还原反应中,化合价升高的反应物。
3、氧化产物
在氧化还原反应中,还原剂对应的生成物。
4、还原产物
在氧化还原反应中,氧化剂对应的生成物。
举例
Cu+4HNO3====Cu(NO3)2+2NO2↑+2H2O
0
+5
+2
+4
还原剂
氧化剂
氧化产物
还原产物
练习:判断下列反应是否属于氧化还原反应,如果是,请指出氧化剂、还原剂、氧化产物和还原产物。
练习:判断下列反应是否属于氧化还原反应,如果是,请指出氧化剂、还原剂、氧化产物和还原产物。
CO2+H2O====H2CO3 ( )
H2+Cl2====2HCl ( )
Cu2(OH)2CO3====2CuO+CO2↑+H2O ( )
2AgNO3====2Ag+2NO2↑+O2↑ ( )
光照
△
△
×
√
×
√
【练习1】下列描述正确的是( )
A、氧化还原反应是既得氧又失氧的反应
B、判断一个反应是否为氧化还原反应的依据是是否有化合价的升降
C、氧化和还原是独立存在的,一个反应是氧化反应,就不可能是还原反应。
D、氧化和还原是同时存在的,发生氧化反应的同时必然会发生还原反应。
B、D
①2H2 + O2 ==== 2H2O
②Zn + H2SO4 ==== ZnSO4 +H2↑
③2HgO ==== 2Hg + O2↑
④H2O2 + SO2 ==== H2SO4
⑤C + CO2 ==== 2CO
⑥BaCl2 + H2SO4 ==== BaSO4↓+2HCl
⑦2KClO3 ==== 2KCl + 3O2↑
⑧NH4NO3 ==== N2O↑ + 2H2O
⑨CaCO3 ==== CaO + CO2↑
⑩CaO + H2O ====Ca(OH)2
点燃
高温
MnO2
△
高温
【练习2】
上述反应中属于化合反应的:
分解反应的:
置换反应的:
复分解反应的:
氧化还原反应的:
非氧化还原反应的:
①④⑤⑩
③⑦⑧⑨
②
⑥
①②③④⑤⑦⑧
⑥⑨⑩
